Статья опубликована на с. 33-40
Первичный гипотиреоз — клинический синдром, появляющийся при частичной или полной недостаточности тиреоидных гормонов в связи с поражением ткани щитовидной железы (ЩЖ). Статистические данные свидетельствуют о его высокой распространенности среди населения: 0,5–1 % в общей популяции, 0,025 % среди новорожденных и 4 % среди пожилых, более часто у женщин. В Украине зарегистрировано около 90 тыс. больных (в 1999 г. — 53 тыс.). То есть распространенность гипотиреоза растет из года в год, что свидетельствует о важности применения эффективных средств борьбы с данной патологией [1–3].
Первичный гипотиреоз может быть врожденным и приобретенным. Врожденные формы заболевания обычно связаны с аплазией и дисплазией ЩЖ, а также врожденными энзимопатиями, при которых нарушается биосинтез тиреоидных гормонов. Приобретенные формы болезни наиболее часто развиваются вследствие аутоиммунного тиреоидита (АИТ), после оперативного удаления ЩЖ (резекция ЩЖ, тиреоидэктомия) либо лечения ее радиоактивным йодом (131I) [3, 4].
Важно отметить наличие субклинических и манифестных форм первичного гипотиреоза. При субклиническом течении гипотиреоза симптомы выражены слабо, а манифестные формы маскируются под те или иные смежные группы болезней (табл. 1). В любом случае для правильной постановки диагноза пациент должен быть тщательно опрошен и обследован [3, 5].
/33.jpg)
Основой лечения первичного гипотиреоза является назначение заместительной терапии L-тироксином. Заместительная гормонотерапия позволяет в значительной степени уменьшить выраженность патологических нарушений, характерных для гипотиреоза, таких как окислительный стресс, гиперлипидемия, гиперактивность иммунной системы, эндотелиальная дисфункция, неврологические нарушения и др. И все же степень коррекции не является достаточной, поскольку часто не достигает нормальных значений. Поэтому для повышения эффективности лечения назначают дополнительные лекарственные средства, среди которых важное место занимает α-липоевая кислота. В тех клинических исследованиях, которые включены в настоящий обзор, было продемонстрировано, что лишь при совместном назначении L-тироксина и α-липоевой кислоты удавалось достичь нормализации синдромов, сопровождающих первичный гипотиреоз, или значительного улучшения.
Альфа-липоевая кислота является сильным антиоксидантом, работающим как в водо-, так и в жирорастворимой среде. Это позволяет ей проявлять свои эффекты во всех клетках и тканях организма, включая внутриклеточные структуры. Интересно, что антиоксидантные свойства проявляет и восстановленная, и окисленная форма α-липоевой кислоты (рис. 1).
При этом восстановленная форма α-липоевой кислоты переводит в активное (восстановленное) состояние другие антиоксиданты, такие как витамин С, витамин Е, глутатион, кофермент Q10. Из-за этого α-липоевую кислоту называют «дирижером», облегчающим оптимальное взаимодействие между другими антиоксидантами. Обе формы α-липоевой кислоты — восстановленная и окисленная — проявляют также собственное антиоксидантное действие: нейтрализуют активные формы кислорода и хелатируют металлы, опосредующие образование активных форм кислорода [7–9].
Одним из следствий антиоксидантных эффектов α-липоевой кислоты является ее способность проявлять радиопротекторное действие [6, 10].
В большом количестве исследований было продемонстрировано метаболическое действие α-липоевой кислоты, суть которого сводится к стимуляции углеводного и липидного обмена.
В частности, α-липоевая кислота уменьшает выраженность инсулинорезистентности за счет облегчения поступления в клетки глюкозы — эффект, связанный с усилением встраивания в клеточные мембраны глюкозных транспортеров GLUT1 и GLUT4. Кроме того, α-липоевая кислота стимулирует окисление глюкозы за счет усиления гликолиза, поскольку является кофактором пируватдегидрогеназного комплекса, обеспечивающего окислительное декарбоксилирование пирувата до ацетил-КоА [11–14].
В дополнение к этому α-липоевая кислота способна уменьшать содержание триглицеридов за счет ингибирования экспрессии липогенных генов в печени, снижения печеночной секреции триглицеридов и усиления расщепления липопротеинов, богатых триглицеридами. Также α-липоевая кислота способна снижать содержание общего холестерина и липопротеинов низкой плотности (ЛПНП) за счет снижения активности ГМГ-КоА-редуктазы, увеличения активности липопротеинлипазы, инициирования в печени синтеза рецепторов к ЛПНП, увеличения синтеза аполипопротеина А. Благодаря активации АМФ-активируемой протеинкиназы α-липоевая кислота усиливает β-окисление жирных кислот в митохондриях [15, 16].
Интереснейшей находкой стали результаты экспериментального исследования Y. Bao и соавт. [35], в котором оценивалось влияние α-липоевой кислоты на содержание в крови гормонов ЩЖ и липидов. Проведенное исследование показало, что α-липоевая кислота повышала содержание в плазме крови трийодтиронина. Поскольку это новейшие данные 2015 г., представляется интересным в будущих исследованиях оценить способность α-липоевой кислоты влиять на уровень тиреоидных гормонов при гипотиреозе.
Учитывая медицинскую актуальность первичного гипотиреоза и многокомпонентность фармакологического действия α-липоевой кислоты, мы посвятили настоящий обзор результатам исследований, в которых α-липоевая кислота была назначена для терапии данной патологии.
Окислительный стресс
В случае избыточной продукции тиреоидных гормонов развитие окислительного стресса является вполне ожидаемым, поскольку их функция сводится к стимуляции обмена веществ. В частности, тиреоидные гормоны усиливают митохондриальное дыхание, что приводит к повышению продукции активных форм кислорода. При гипотиреозе некоторым исследователям казалось, что развитие окислительного стресса невозможно вследствие развития гипометаболического состояния. Однако результаты новых исследований опровергли это предположение. G. Baskol и соавт. [17, 18] оценили состояние оксидантной-антиоксидантной системы у 33 пациентов с первичным гипотиреозом. В результате было обнаружено увеличение содержания малонового диальдегида (МДА), оксида азота (NO) и снижение активности фермента параоксоназы‑1 (PON1; антиоксидантный фермент в липопротеинах высокой плотности (ЛПВП), который гидролизует перекись липидов в окисленных липопротеинах). Зафиксированные изменения были расценены как формирование прооксидантного окружения у больных с гипотиреозом. H. Erdamar и соавт. [19] провели аналогичную оценку у 20 пациентов с гипотиреозом вследствие АИТ. По итогам исследования было выявлено повышение содержания МДА, нитрита и повышение активности миелопероксидазы. Авторы также сделали заключение о развитии окислительного стресса у больных с гипотиреозом, причем более выраженного, чем в группе пациентов с гипертиреозом.
Следовательно, назначение α-липоевой кислоты при гипотиреозе является обоснованным, учитывая выраженные антиоксидантные свойства данного лекарственного средства.
Данные клинических исследований
В исследование А.А. Басова и соавт. [20] были включены 40 пациентов с первичным гипотиреозом, из которых половина в дополнение к стандартной терапии получала парентерально α-липоевую кислоту в курсовой дозе не менее 3000 мг. Контрольную группу составили 25 здоровых добровольцев. О выраженности перекисного окисления липидов судили по содержанию ТБК-активных продуктов в эритроцитах (с тиобарбитуровой кислотой связывается в основном МДА — один из основных конечных продуктов перекисного окисления липидов). О состоянии антиоксидантной системы судили по содержанию тиоловых групп в гемолизате эритроцитов. С целью интегральной оценки окислительного стресса рассчитывали коэффициент окислительной модификации биомолекул эритроцитов (КОМБэр), учитывающий как ТБК-активные продукты, так и тиоловые группы. Все перечисленные показатели оценивали в первые сутки нахождения больных в стационаре и на 10-й день после проведенного лечения.
В результате было выяснено, что исходно (до лечения) у больных с гипотиреозом наблюдалось повышение содержания ТБК-активных продуктов в среднем на 30,8 %, снижение количества тиоловых групп в среднем на 21,2 %, повышение КОМБэр в среднем в 13,1 раза по сравнению с контролем (p < 0,05). Эти данные свидетельствуют о развитии окислительного стресса у больных с первичным гипотиреозом.
Спустя 10 дней лечения в группе, получавшей только стандартную терапию (n = 20), и в группе, получавшей стандартную терапию и α-липоевую кислоту (n = 20), наблюдалась нормализация содержания ТБК-активных продуктов и тиоловых групп по сравнению с контролем (p > 0,05). Однако интегральный показатель КОМБэр в группе со стандартной терапией не достигал нормальных значений, продолжая превышать показатели контрольной группы в 5,8 раза (p < 0,05). Это указывает на то, что стандартная терапия не смогла полностью устранить окислительный стресс у больных с первичным гипотиреозом. Назначение в дополнение к стандартной терапии α-липоевой кислоты возвращало КОМБэр к значениям контрольной группы (p > 0,05), что указывало на полное нивелирование окислительного стресса (рис. 2).
/35.jpg)
В работе В.И. Панькива и соавт. [21] было обследовано 45 больных первичным (идиопатическим) гипотиреозом. Всем пациентам в дополнение к стандартной терапии назначали α-липоевую кислоту (Эспа-Липон) внутривенно капельно в дозе 600 мг/сутки в течение 10 дней, а затем курс лечения был продолжен пероральным приемом данного препарата в дозе 600 мг/сут в течение одного месяца. Авторы исследования отмечают, что до лечения у больных было отмечено увеличение содержания МДА в эритроцитах и угнетение ферментов антиоксидантной защиты. После проведенной терапии было отмечено достоверное уменьшение содержания МДА и рост активности супероксиддисмутазы и каталазы.
В другое исследование [22] было включено 40 пациентов с субклиническим гипотиреозом. Из них половина больных не получала никакого лечения, а вторая половина получала α-липоевую кислоту. В результате было выяснено, что спустя 3 недели лечения в группе, получавшей α-липоевую кислоту (n = 20), наблюдалось достоверное уменьшение содержания ТБК-активных продуктов по сравнению с состоянием до лечения (p < 0,05).
В исследовании А.С. Аметова и соавт. [23] у больных с компенсированным и декомпенсированным гипотиреозом было выявлено значительное усиление процессов свободнорадикального окисления (СРО). У больных с декомпенсированным гипотиреозом интенсивность процессов СРО была в 2,26 раза выше, чем аналогичный показатель у больных с компенсированным гипотиреозом (р < 0,05). В исследованиях in vitro и ex vivo были получены данные, подтверждающие антиоксидантные свойства α-липоевой кислоты, снижавшей быструю вспышку хемилюминесценции на 46–70 % в обеих группах больных гипотиреозом.
Таким образом, в ходе исследований было установлено, что в организме больных с гипотиреозом наблюдается развитие окислительного стресса, который эффективно корригируется с помощью α-липоевой кислоты. Назначение α-липоевой кислоты в дополнение к базовой терапии L-тироксином повышает эффективность проводимого лечения и позволяет более эффективно бороться с перекисным окислением липидов, а также повышает антиоксидантный статус, что приводит к нивелированию окислительного стресса и улучшению состояния пациентов с гипотиреозом.
Гиперлипидемия
Тиреоидные гормоны стимулируют обмен веществ, в том числе катаболизм липидов. При недостатке тиреоидных гормонов в организме возникает состояние гипометаболизма, включая ограничение липолиза. Как следствие, в плазме крови повышается содержание триглицеридов, общего холестерина, ЛПНП, липопротеинов очень низкой плотности (ЛПОНП), ЛПВП, аполипопротеина А. Развивается состояние, называемое метаболическим синдромом, которое влечет за собой повышение атерогенного риска и вероятности развития сердечно-сосудистых осложнений [24, 25].
С учетом способности α-липоевой кислоты стимулировать липидный обмен представляется обоснованным ее назначение больным с гипотиреозом.
Данные клинических исследований
В исследование Е.В. Большовой [26] было включено 38 детей (средний возраст 14,8 ± 0,5 года) с врожденным гипотиреозом. Из них 12 пациентам был назначен только L-тироксин, а остальным 26 пациентам в дополнение к гормональной терапии была назначена α-липоевая кислота (Эспа-Липон) перорально в дозе 600 мг/сут. Длительность курса лечения составила 3 месяца.
В ходе исследования было установлено, что на фоне монотерапии L-тироксином в крови больных детей достоверно снижалось содержание триглицеридов и холестерина ЛПНП (p < 0,05). При совместном назначении L-тироксина и α-липоевой кислоты было отмечено достоверное снижение большего числа показателей: триглицеридов, общего холестерина, холестерина ЛПНП и коэффициента атерогенности (p < 0,05; табл. 2).
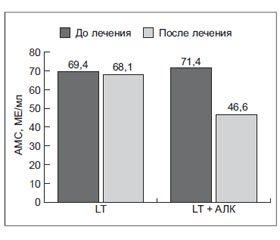
В работе Д.В. Кириенко и соавт. [27] у пациентов с первичным гипотиреозом вследствие АИТ на фоне монотерапии L-тироксином (n = 20) не было отмечено достоверного снижения общего холестерина спустя 3 месяца лечения. В этих же условиях совместное назначение L-тироксина и α-липоевой кислоты (Эспа-Липон 600 мг/сут перорально, курс лечения 3 месяца) приводило к достоверному снижению данного показателя по сравнению с состоянием до лечения (p < 0,05; рис. 3).
В работе В.И. Панькива и соавт. [21] у больных с первичным (идиопатическим) гипотиреозом (n = 45) назначение α-липоевой кислоты (Эспа-Липон 600 мг/сут парентерально в течение 10 дней, затем 600 мг/сут перорально в течение одного месяца) приводило к достоверному снижению содержания триглицеридов, общего холестерина и холестерина ЛПНП (p < 0,05).
Таким образом, результаты выполненных исследований свидетельствуют о развитии в организме пациентов с гипотиреозом гиперлипидемии, которая более эффективно корригируется при совместном назначении L-тироксина и α-липоевой кислоты по сравнению с монотерапией L-тироксином.
Гиперреактивность иммунной системы
Патогенетической основой АИТ является развитие иммунологической реакции, при которой цитотоксические Т-лимфоциты распознают определенные участки в молекуле тиреопероксидазы (фермент, ответственный за синтез тиреоидных гормонов) как чужеродные. В результате развивается аутоиммунный процесс, приводящий к замещению эпителиальной ткани ЩЖ фиброзной тканью с одновременным развитием гипотиреоза [28, 29].
Данные клинических исследований
В работе Д.В. Кириенко и соавт. [27] у пациентов с первичным гипотиреозом вследствие АИТ был оценен уровень антител к микросомальной фракции (антитела к тиреопероксидазе) на фоне монотерапии L-тироксином (n = 20) и при совместном назначении L-тироксина и α-липоевой кислоты (n = 20) в течение трех месяцев (Эспа-Липон 600 мг/сут перорально). В результате было выяснено, что достоверное снижение уровня антител наблюдалось только в группе, получавшей сочетанную терапию (p < 0,05; рис. 4).
Следовательно, назначение α-липоевой кислоты в дополнение к заместительной гормонотерапии L-тироксином при АИТ с первичным гипотиреозом приводит к снижению иммунологической реактивности, что, по-видимому, приводит к замедлению прогрессирования гипотиреоза. Механизмы этого эффекта α-липоевой кислоты требуют дальнейшего исследования.
Эндотелиальная дисфункция
Во многих исследованиях было продемонстрировано, что у пациентов с гипотиреозом развивается эндотелиальная дисфункция. Ее наличие увеличивает риск развития атеросклероза и, как следствие, вероятность появления сердечно-сосудистых осложнений [30, 31].
Данные клинических исследований
В исследование G.D.X. и соавт. [22] было включено 40 пациентов с субклиническим гипотиреозом. Из них 20 пациентов не получали никакого лечения, а остальные 20 больных получали α-липоевую кислоту в течение 3 недель. Контрольную группу составили 18 здоровых пациентов. О выраженности эндотелиальной дисфункции судили по потокопосредованной эндотелийзависимой артериальной дилатации (FMD). В ходе исследования было выяснено, что исходно (до лечения) у всех больных гипотиреозом наблюдалось снижение показателя FMD: в среднем его величина составила 3,97 %, в то время как в контрольной группе — 5,64 % (p < 0,001). На фоне проведенного лечения α-липоевой кислотой наблюдалось достоверное увеличение FMD до 4,82 % по сравнению с состоянием до лечения (p < 0,01). При этом в группе, не получавшей никакого лечения, FMD достоверно не менялась (p > 0,05).
Таким образом, результаты выполненных исследований свидетельствуют о развитии у пациентов с гипотиреозом эндотелиальной дисфункции, выраженность которой снижается при назначении препаратов α-липоевой кислоты.
Неврологические нарушения
В работе Е.Л. Товажнянской [32] были обследованы пациенты (281 чел.) с первичным гипотиреозом, развившимся вследствие АИТ или субтотальной/тотальной резекции ЩЖ по поводу диффузного токсического зоба. Было выяснено, что основными формами неврологического дефицита у больных являются энцефалопатия (25,1 %), энцефалополиневропатия (69,8 %), энцефаломиелополиневропатия (22,2 %) и нервно-мышечные синдромы (49,4 %).
Энцефалопатия (изолированная или в сочетании с другими неврологическими нарушениями) характеризовалась развитием синдрома вегетативной дистонии. В эмоционально-психопатологической сфере это проявлялось астенией, неврастенией, депрессией. Вегетативная регуляция вначале характеризовалась симпатикотонией, с последующим истощением симпатической нервной системы и развитием относительной парасимпатикотонии. Дополнительно при энцефалопатии были отмечены цефалгический, гипертензионный, вестибулоатактический и диссомнический синдромы.
Патология периферической нервной системы проявлялась в виде полиневропатий, туннельных невропатий и мононевропатий черепно-мозговых нервов.
Для миелопатии были характерны признаки двусторонней пирамидной недостаточности по центральному типу, редко присутствовали элементы сфинктерных нарушений.
Основными нервно-мышечными синдромами были гипотиреоидная миопатия с превалированием гипертрофических форм, гипотиреоидная псевдомиотония и патологическая мышечная утомляемость.
По состоянию на сегодняшний день накоплены обширные данные по способности α-липоевой кислоты уменьшать выраженность неврологических нарушений при сахарном диабете [33, 34]. С учетом этого было вполне обоснованным клиническое применение α-липоевой кислоты для борьбы с неврологическими нарушениями при первичном гипотиреозе.
Данные клинических исследований
В исследование Д.В. Кириенко и соавт. [27] было включено 40 пациентов с первичным гипотиреозом вследствие АИТ. По окончании курса лечения у больных, принимавших сочетанную терапию L-тироксином и α-липоевой кислотой, было отмечено достоверное увеличение психомоторной активности, о чем свидетельствовали результаты теста на цифровую последовательность, теста на возможность следовать линии и теста на цифровые символы (p < 0,05; табл. 3). В группе больных, принимавших только L-тироксин, достоверные отличия получены не были (p > 0,05).
/38.jpg)
При оценке состояния вегетативной нервной системы (ВНС) с помощью функциональных проб (тест на глубокое дыхание, проба Вальсальвы, индекс 30 : 15, ортотест) у больных, принимавших сочетанную терапию L-тироксином и α-липоевой кислотой, было выявлено снижение активности симпатической и парасимпатической нервной системы (p < 0,05), что авторы расценили как улучшение функциональной активности ВНС. Это было подтверждено также с помощью вариационной пульсометрии (p < 0,05). В группе больных, принимавших только L-тироксин, достоверные отличия получены не были (p > 0,05).
В работе В.И. Панькива и соавт. [21] у больных с первичным (идиопатическим) гипотиреозом (n = 45) назначение α-липоевой кислоты (Эспа-Липон 600 мг/сут) в дополнение к стандартной терапии в течение шести недель приводило к значительному улучшению показателей тестов, характеризующих парасимпатический контроль ритма сердца. Авторы сделали вывод о том, что полученные результаты могут свидетельствовать об увеличении скорости проведения в висцеральных парасимпатических и симпатических волокнах.
Таким образом, в исследованиях было продемонстрировано, что течение гипотиреоза сопровождается развитием комплекса неврологических нарушений, которые уменьшаются за счет включения α-липоевой кислоты в проводимое лечение L-тироксином.
Заключение
Назначение α-липоевой кислоты в дополнение к стандартной терапии у пациентов с первичным гипотиреозом различного генеза позволяет более эффективно бороться с окислительным стрессом, гиперлипидемией, гиперреактивностью иммунной системы, эндотелиальной дисфункцией и неврологическими нарушениями, т.е. нивелировать повреждающее действие дефицита тиреоидных гормонов на патогенетическом уровне и улучшать состояние пациентов — на клиническом. Об этом красноречиво свидетельствуют результаты проведенных исследований применения α-липоевой кислоты у пациентов с гипотиреозом различных возрастных групп. Эффективная дозировка α-липоевой кислоты составляет 600 мг/сут, курс лечения должен продолжаться не менее 1–3 месяцев.
Список литературы
1. Большова Е.В. Ранняя диагностика и лечение врожденного гипотиреоза // Здоров’я України. — 2012. — № 4. — С. 25.
2. Синдром гіпотиреозу. Симпозіум № 82. — http://www.mif-ua.com
3. Паньків В.І. Практична тиреоїдологія. — Донецьк: Видавець Заславський О.Ю., 2011. — 224 с.
4. Пасєчко Н.В. Вплив субклінічного гіпотиреозу на репродуктивну функцію жінки та ефективність його корекції / Н.В. Пасєчко, С.В. Гнат, І.І. Свистун, Л.В. Наумова // Міжнародний ендокринологічний журнал. — 2015. — № 1. — С. 98-101.
5. Свириденко Н.Ю., Косьянова Н.А. Субклинический гипотиреоз // Лечащий врач. — 2006. — № 10. — С. 58-61.
6. Эффективность использования альфа-липоевой кислоты при диабетической нейропатии / В.И. Панькив // Международный эндокринологический журнал. — 2015. — № 2 (66). — С. 59-65.
7. Thomas E., Levy T.E. Alpha Lipoic Acid. — 2013. — http://www.peakenergy.com
8. Gomes M.B., Negrato C.A. Alpha-lipoic acid as a pleiotropic compound with potential therapeutic use in diabetes and other chronic diseases // Diabetol. Metab. Syndr. — 2014. — Vol. 6, № 1.
9. Szeląg M., Mikulski D., Molski M. Quantum-chemical investigation of the structure and the antioxidant properties of α-lipoic acid and its metabolites // Journal of Molecular Modeling. — 2012. — Vol. 18, № 7. — P. 2907-2916.
10. Alpha-Lipoic acid attenuates x-irradiation-induced oxidative stress in mice / Manda K., Ueno M., Moritake T., Anzai K. // Cell Biol. Toxicol. — 2007. — Vol. 23, № 2. — P. 129-137.
11. Bilska A., Włodek L. Lipoic acid — the drug of the future? // Pharmacol. Rep. — 2005. — Vol. 57, № 5. — P. 570-577.
12. Evans J.L., Goldfine I.D. Alpha-lipoic acid: a multifunctional antioxidant that improves insulin sensitivity in patients with type 2 diabetes // Diabetes Technol. Ther. — 2000. — Vol. 2, № 3. — P. 401-413.
13. Alpha-lipoic acid in liver metabolism and disease / Bustamante J., Lodge J.K., Marcocci L. et al. // Free Radic. Biol. Med. — 1998. — Vol. 24, № 6. — P. 1023-1039.
14. Alpha-Lipoic acid treatment decreases serum lactate and pyruvate concentrations and improves glucose effectiveness in lean and obese patients with type 2 diabetes / Konrad T., Vicini P., Kusterer K. et al. // Diabetes Care. — 1999. — Vol. 22, № 2. — P. 280-287.
15. Amelioration of lipid abnormalities by α-lipoic acid through antioxidative and anti-inflammatory effects / Zhang Y., Han P., Wu N. et al. // Obesity (Silver Spring). — 2011. — Vol. 19, № 8. — P. 1647-1653.
16. Effect of Alpha-lipoic Acid Supplementation on Serum Lipid Profile in Women with Rheumatoid Arthritis / Mirtaheri E., Gargari B.P., Kolahi S. et al. // Nutrition and Food Sciences Research. — 2014. — Vol. 1, № 1. — P. 11-18.
17. Golbidi S., Laher I. Antioxidant therapy in human endocrine disorders // Med. Sci. Monit. — 2010. — Vol. 16, № 1. — P. 9-24.
18. Oxidative stress and enzymatic antioxidant status in patients with hypothyroidism before and after treatment / Baskol G., Atmaca H., Tanriverdi F. et al. // Exp. Clin. Endocrinol. Diabetes. — 2007. — Vol. 115, № 8. — P. 522-526.
19. The effect of hypothyroidism, hyperthyroidism, and their treatment on parameters of oxidative stress and antioxidant status / Erdamar H., Demirci H., Yaman H. et al. // Clin. Chem. Lab. Med. — 2008. — Vol. 46, № 7. — P. 1004-1010.
20. Басов А.А., Мелконян К.И., Сторожук А.П. Влияние препаратов липоевой кислоты на показатели прооксидантно-антиоксидантной системы крови при сахарном диабете и гипотиреозе // Современные проблемы науки и образования. — 2013. — № 6. — http://www.science-education.ru
21. Паньків В.І., Гаврилюк В.М. Досвід використання Еспа-Ліпону при лікуванні хворих на гіпотиреоз. — Чернівці: Буковинська державна медична академія (материал предоставлен фармацевтической компанией).
22. Взаємозв’язок між структурно-функціональними порушеннями щитоподібної залози і компонентами метаболічного синдрому / Паньків В.І., Гаврилюк В.М., Непорадна Л.Д. та ін. // Міжнародний ендокринологічний журнал. — 2011. — № 6 (38). — С. 39-43.
23. Про- и антиоксидантная система у больных гипотиреозом и ее изменения под влиянием препаратов липоевой кислоты / Аметов А.С., Павлюченко И.И., Басов А.А., Белоножкина Е.С. // Проблемы эндокринологии. — 2007. — № 2. — С. 49-54.
24. Hypothyroidism on Lipid Metabolism / J. Coria M., V. Carmona Y., B. Oliveros L., S. Giménez M. // Hypothyroidism — Influences and Treatments, Dr. Drahomira Springer (Ed.). — 2012. — http://www.intechopen.com
25. Guidelines for the Management of Dyslipidemia and Thyroid Dysfunction. A Clinical Practice Guideline / Jayakumar R.V. et al. // http://www.apiindia.org
26. Большова О.В., Музь В.А., Малиновська Т.М. Застосування альфа-ліпоєвої кислоти в комплексному лікуванні порушень ліпідного обміну у дітей та підлітків, хворих на вроджений гіпотиреоз // Ліки України. — 2011. — № 10. — С. 84-88.
27. Кирієнко Д.В., Пєшко А.О., Щербак О.В. Терапевтична ефективність альфа-ліпоєвої кислоти (Еспа-Ліпону) при аутоімунному тиреоїдиті з гіпотиреозом // Ліки. — 2002. — № 3-4. — С. 112-115.
28. Schott M., Scherbaum W.A. Autoimmune Thyroid Disease // Dtsch. Arztebl. — 2006. — Vol. 103, № 45. — P. 3023-3032.
29. Evaluation of conformational epitopes on thyroid peroxidase by antipeptide antibody binding and mutagenesis / Gora M., Gardas A, Wiktorowicz W. et al. // Clinical and Experimental Immunology. — 2004. — Vol. 136, № 1. — P. 137-144.
30. Treating hypothyroidism improves endothelial function / Papaioannou G.I., Lagasse M., Mather J.F., Thompson P.D. // Metabolism. — 2004. — Vol. 53, № 3. — P. 278-279.
31. Hypothyroidism is associated with signs of endothelial dysfunction despite 1-year replacement therapy with levothyroxine / Clausen P., Mersebach H., Nielsen B. et al. // Clin. Endocrinol. (Oxf). — 2009. — Vol. 70, № 6. — P. 932-937.
32. Товажнянская Е.Л. Неврологические осложнения первичного гипотиреоза различного генеза // Международный медицинский журнал. — 2013. — № 1. — С. 15-19.
33. Oral treatment with alpha-lipoic acid improves symptomatic diabetic polyneuropathy: the SYDNEY2 trial / Ziegler D., Ametov A., Barinov A. et al. // Diabetes Care. — 2006. — Vol. 29, № 11. — P. 2365-2370.
34. Poh Z.X., Goh K.P. A current update on the use of alpha lipoic acid in the management of type 2 diabetes mellitus // Endocr. Metab. Immune Disord. Drug Targets. — 2009. — Vol. 9, № 4. — P. 392-398.
35. Effects of Dietary L-carnosine and Alpha-lipoic Acid on Growth Performance, Blood Thyroid Hormones and Lipid Profiles in Finishing Pigs / Bao Y., Gao C., Hao W. et al. // Asian-Australas J. Anim. Sci. — 2015. — Vol. 28, № 10. — P. 1465-1470.
36. Inhibitory Effects of α-Lipoic Acid on Oxidative Stress-Induced Adipogenesis in Orbital Fibroblasts From Patients With Graves Ophthalmopathy / Hwang S., Byun J.W., Yoon J.S., Lee E.J. // Medicine (Baltimore). — 2016. — Vol. 95, № 2. — Numb. of publ. e2497.
37. Alpha lipoic acid attenuates radiation-induced thyroid injury in rats / Jung J.H., Jung J., Kim S.K. et al. // PLoS One. — 2014. — Vol. 9, № 11. — Numb. of publ. 112253.
38. Alpha lipoic acid inhibits proliferation and epithelial mesenchymal transition of thyroid cancer cells / Jeon M.J., Kim W.G., Lim S. et al. // Mol. Cell Endocrinol. — 2016. — Vol. 419. — P. 113-123.
39. Alpha-lipoic acid induces sodium iodide symporter expression in TPC‑1 thyroid cancer cell line / Choi H.J., Kim T.Y., Ruiz-Llorente S. et al. // Nucl. Med. Biol. — 2012. — Vol. 39, № 8. — P. 1275-1280.
40. Moon H.S. Chemopreventive Effects of Alpha Lipoic Acid on Obesity-Related Cancers // Ann. Nutr. Metab. — 2016. — Vol. 68, № 2. — P. 137-144.
/35.jpg)
/37.jpg)
/37_2.jpg)

/33.jpg)
/34.jpg)
/36.jpg)
/38.jpg)