Статтю опубліковано на с. 80-84
Цукровий діабет (ЦД) — вагома проблема світової охорони здоров’я через його глобальну поширеність та асоційовані судинні ускладнення. За даними Міжнародної діабетичної федерації, кількість дорослих хворих на ЦД у 2015 р. досягла 415 млн (до 2040 р. прогнозується збільшення до 642 млн, при цьому ЦД і пов’язана з ним коморбідна патологія стали причиною 5 млн смертей [1].
Важливим завданням є розробка нових способів профілактики і лікування ЦД, спрямованих на зниження ризику розвитку і прогресування мікро- і макросудинних ускладнень. ЦД характеризується поліметаболічними порушеннями, що охоплюють всі ланки обміну речовин. Порушення утилізації основних енергосубстратів супроводжується зниженням ефективності енергетичного обміну, зменшенням запасів макроергічних сполук, посиленням вільнорадикальних процесів [2].
Одним із коректорів метаболічних порушень є мельдоній — структурний аналог попередника карнітину γ-бутиробетаїну. Карнітин виконує функцію переносника активованих жирних кислот (ЖК) через мембрану всередину мітохондрії, де відбувається процес їх окиснення [3]. Мельдоній як конкурентний інгібітор ферменту γ-бутиробетаїн гідроксилази обмежує швидкість біосинтезу карнітину з γ-бутиробетаїном. При цьому в цитозолі знижується рівень карнітину, в мітохондрії надходить менше ЖК, що призводить до зменшення окиснення ЖК і перемикання обміну речовин на економніше використання кисню шляхом надходження енергії з вуглеводів [4].
Накопичення γ-бутиробетаїну сприяє підвищенню біодоступності оксиду азоту (NO) — ендотеліального фактора вазодилатації з подальшою нормалізацією функціонального стану ендотелію і, відповідно, нормалізацією судинного тонусу [5]. Механізм підвищення рівня NO на фоні застосування мельдонію пов’язують зі стимуляцією біосинтезу NO і зменшенням його інактивації вільними радикалами. Також мельдоній підвищує активність найважливіших ферментів у циклі аеробного окиснення глюкози (гексокінази і піруватдегідрогенази), запобігає ацидозу за рахунок зменшення утворення лактату. Оптимізація процесів енергетичного обміну, разом із запобіганням вільнорадикальному ушкодженню мембран мітохондрій, сприяє поєднанню окиснення з фосфорилюванням і підвищенням синтезу АТФ.
Зважаючи на сприятливі властивості мельдонію (виражені протиішемічний, антиоксидантний, антигіперглікемічний ефекти), його застосування в комплексній терапії ЦД 2-го типу є доцільним.
Здатність знижувати споживання кисню в усьому організмі («метаболічний тренінг», або прекондиціювання тканин), посилювати окиснення глюкози, запобігати накопиченню недоокислених вільних ЖК і розвитку лактоацидозу, а також зменшувати дисфункцію ендотелію відкриває перспективи для його ширшого застосування в клінічній практиці, особливо при ЦД [2].
Мета дослідження — вивчення ефективності Вазонату (мельдонію) у хворих на цукровий діабет 2-го типу, що може розширити спектр показань до застосування препарату в практиці лікарів-ендокринологів, а також виявити вплив препарату у складі комбінованої терапії на показники вуглеводного, ліпідного, пуринового обміну, функціональний стан нирок, морфофункціональні параметри серця у порівняльному 12-тижневому дослідженні.
Матеріали та методи
Обстежено 55 хворих на ЦД 2-го типу. Пацієнти були розподілені на дві групи. Основна (перша) група представлена 30 пацієнтами з ЦД 2-го типу (10 чоловіків і 20 жінок), середній вік 59,2 ± 1,6 року. Пацієнтам цієї групи на додаток до базисної терапії ЦД (антигіперглікемічні препарати) призначали мельдоній (Вазонат, АТ «Олайнфарм», Латвія) в дозі 1000 мг/добу, перорально (по 500 мг двічі на добу в першій половині дня) впродовж 12 тижнів. Для дослідження був вибраний препарат Вазонат, зважаючи на його переваги порівняно з іншими препаратами мельдонію (європейська якість субстанції і виробництво згідно з нормами GMP як гарантія ефективності та безпеки, доведена біоеквівалентність і біодоступність, оптимальне співвідношення «ціна/якість»).
До другої (контрольної) групи увійшло 25 хворих на ЦД 2-го типу (8 чоловіків і 17 жінок, середній вік 60,4 ± 1,9 року), які отримували тільки базисну терапію ЦД. Тривалість ЦД становила 9,2 ± 0,7 року, рівень глікованого гемоглобіну (HbA1c) — 8,1 ± 0,4 %. Групи були порівнянні за статтю, віком, протидіабетичною терапією.
Цукрознижувальна терапія проводилася згідно з Уніфікованим клінічним протоколом первинної і вторинної (спеціалізованої) медичної допомоги «Цукровий діабет 2-го типу», затвердженим наказом МОЗ України від 21.12.2012 р. № 1118. Пацієнти отримували препарати метформіну (середня доза 1935 мг/добу) і сульфонілсечовини (глімепірид у середній дозі 2,8 мг/добу). Доза вказаних препаратів не змінювалася в процесі 12-тижневого спостереження за хворими.
Обстеження проводили до і після завершення курсу лікування. Пацієнти під час лікування заповнювали щоденники самоконтролю, в яких відзначали рівень глікемії, артеріального тиску (АТ), оцінку загального стану.
Критерії виключення: стенокардія напруження ІV ФК, тяжка артеріальна гіпертензія, застійна серцева недостатність, порушення ритму серця, тяжкі порушення функції печінки і нирок, гіперчутливість до досліджуваного препарату, застосування засобів, що мають вазодилатаційні та ноотропні властивості.
На першому візиті оцінювали клінічний стан, морфофункціональні параметри серцево-судинної системи (ЕКГ, ехокардіографія), функцію нирок, проводили біохімічне дослідження крові (креатинін, загальний холестерин, ліпопротеїни високої і низької щільності, тригліцериди, сечова кислота), розраховували індекс атерогенності, визначали вміст глюкози в крові натще, HbA1c, постпрандіальну глікемію, мікроальбумінурію (МАУ). За відсутності критеріїв виключення хворим призначалося лікування.
На другому візиті, через 4 тижні від початку лікування, оцінювалася ефективність лікування, наявність або відсутність побічних ефектів і ускладнень терапії. За необхідності здійснювали її корекцію. Після закінчення 12 тижнів лікування усім хворим було проведено завершальне обстеження в обсязі першого візиту.
Початково і через 12 тижнів терапії всім хворим проводили фізикальне обстеження, що включало оцінку загального стану, вимірювання АТ на обох руках у положенні пацієнта сидячи за стандартною методикою, антропометрію. Оцінку морфофункціонального стану серця проводили за допомогою ехокардіографії за загальноприйнятою методикою на апараті Siеmens Sonoline G50 (Німеччина) з допплерівським датчиком. Дослідження містило оцінку лінійних розмірів порожнин серця (передньозадній розмір лівого передсердя, кінцево-систолічний і кінцево-діастолічний розміри лівого шлуночка (КСР і КДР ЛШ)), товщини міжшлуночкової перегородки (МШП) і задньої стінки ЛШ (ЗСЛШ). Масу міокарда лівого шлуночка (ММЛШ) розраховували за формулою:
ММЛШ = 1,04 — [(КДР + МШП + ЗСЛШ)3 — КДР3] — 13,6.
Крім того, визначали індекс ММЛШ (ІММЛШ) за співвідношенням до поверхні тіла, оцінювали систолічну і діастолічну функцію ЛШ.
Вивчення функціонального стану нирок включало визначення креатиніну сироватки крові, швидкості клубочкової фільтрації (ШКФ) розрахунковим методом за формулою CKD-EPI, екскреції альбуміну з сечею (МАУ) методом імуноферментного аналізу.
Обробку результатів дослідження проводили методами параметричної і непараметричної статистики. Дані наведені у вигляді (M ± m), де M — середнє значення; m — помилка середнього. Для оцінки вірогідності відмінностей між показниками застосовували t-критерій Стьюдента, точний метод Фішера. Вірогідними вважали відмінності при p < 0,05.
Результати
Більш виражені позитивні зміни в клінічному стані пацієнтів були виявлені у хворих основної групи на фоні додаткового прийому Вазонату.
В обох порівнювальних групах після закінчення курсу терапії відзначалося зростання показника фракції викиду лівого шлуночка (ФВ ЛШ). При цьому краща динаміка цього параметра спостерігалася у хворих, які додатково приймали Вазонат. Через 12 тижнів ФВ ЛШ у цій групі збільшилася на 10,0 % проти 6,3 % у контрольній групі. У двох групах після закінчення дослідження відзначалося невірогідне зменшення порожнинних розмірів серця (КДР ЛШ, КСР ЛШ). Відмінностей між групами за цими показниками не спостерігалося.
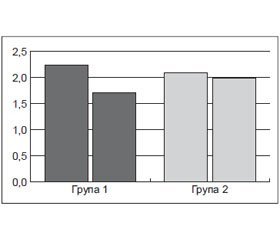
При оцінці впливу 12-тижневої терапії із Вазонатом у складі встановлено, що рівень креатиніну сироватки крові вірогідно змінився тільки у хворих основної групи (табл. 1; рис. 1). Рівень креатиніну зменшився з 104,2 ± 4,8 мкмоль/л до 92,3 ± 4,1 мкмоль/л (р < 0,05). При цьому в групі хворих, які отримували Вазонат, на 19,5 % зменшилася кількість пацієнтів із підвищеним рівнем сироваткового креатиніну, тоді як у контрольній групі їх кількість за час спостереження практично не змінилася.
ШКФ в основній групі пацієнтів вірогідно збільшилася на 14,3 % порівняно з 5,1 % у контрольній (р < 0,05). Звертає на себе увагу, що рівень МАУ в першій групі хворих статистично значимо знизився на 13,1 % проти 2,9 % у другій групі (табл. 1; рис. 2).
Включення Вазонату в схему лікування ЦД статистично вірогідно поліпшило функціональний стан нирок: ШКФ збільшилася з 61,1 ± 2,3 мл/хв/1,73 м2 до 71,2 ± 2,4 мл/хв/1,73 м2 після закінчення 12-тижневого лікування, тоді як у контрольній групі ШКФ не змінилася (рис. 1). Відмінність між ∆% в обох порівнювальних групах була статистично значимою (p < 0,05).
Збільшення середнього значення ШКФ на фоні додаткового прийому Вазонату спостерігалося за рахунок зростання кліренсу креатиніну у пацієнтів з початково зниженою ШКФ (< 60 мл/хв/1,73 м2), внаслідок чого їх кількість у цій групі зменшилася на 27,2 %.
Через 12 тижнів спостереження в обох групах відзначалося зниження середніх значень МАУ. Однак призначення Вазонату до базисного лікування супроводжувалося вірогідним антипротеїнуричним ефектом (–13,1 % vs –2,9 %; р < 0,05).
Отримані результати свідчать про навність у мельдонію нефропротективних властивостей, що має важливе значення для пацієнтів з ЦД 2-го типу як фактор зниження серцево-судинного ризику.
Проведений кореляційний аналіз виявив залежність поліпшення функції нирок паралельно з покращенням показників кардіогемодинаміки. Відзначається вірогідна залежність між поліпшенням систолічної функції ЛШ і ШКФ (r = 0,48; р < 0,05) у групі хворих, які
отримували Вазонат. Нами виявлений взаємозв’язок між поліпшенням діастолічної функції ЛШ на фоні прийому Вазонату і покращенням функціонального стану нирок.
Також виявлений сприятливий вплив терапії з включенням Вазонату на метаболічні показники, що характеризують вуглеводний і ліпідний обмін. На 12-й тиждень дослідження показник HbA1c у пацієнтів, які отримували мельдоній, знизився на 11,9 % порівняно з аналогічним показником у контрольній групі (на 2,6 %). Відмінності між групами виявилися статистично вірогідними (р < 0,05).
Позитивний вплив Вазонату у складі комбінованого лікування хворих на ЦД на ліпідний профіль передусім полягав у зниженні рівня тригліцеридів (ТГ) і ЛПНЩ. Відзначається вірогідне зменшення рівня ТГ крові у пацієнтів основної групи на 23,2 % (р < 0,05) і ЛПНЩ — на 18,5 % (р < 0,05). У контрольній групі ці показники знизилися лише на 4,8 і 6,2 % відповідно (рис. 3, 4). Зміни інших показників ліпідного спектра були невірогідними як в основній, так і в контрольній групі. Показники пуринового і електролітного обміну (калій) значимо не змінювалися.
Безпека застосування Вазонату підтверджується відсутністю у хворих побічних явищ і несприятливих змін основних біохімічних показників.
Обговорення
За даними проведених раніше досліджень, застосування мельдонію у пацієнтів із субкомпенсованим і компенсованим ЦД на додаток до метформіну або препарату сульфонілсечовини впродовж 12 тижнів сприяло вірогідному зниженню показника глюкози на 11,85 %, HbA1c — на 9,14 % [6]. Виявлено, що у пацієнтів на фоні застосування мельдонію впродовж 12 тижнів вірогідно знижувався рівень не лише HbA1c, але й ТГ [7]. Нами також підтверджено вірогідне зниження рівня HbA1c і ТГ після лікування в осіб обох статей.
Вплив мельдонію на перебіг діабетичної нефропатії практично не вивчався. В одному з досліджень вказувалося, що мельдоній на фоні базисної терапії призводить до поліпшення морфологічної структури та скорочувальної функції міокарда за рахунок комплексної дії на метаболічні процеси і обмін оксиду азоту [8].
Автори вважають, що встановлена нефропротективна дія мельдонію може бути пов’язана як зі зменшенням вираженості серцевої недостатності при його застосуванні, так і з прямим сприятливим впливом на метаболізм нефроцитів [7].
Виявлений нефропротективний ефект мельдонію при ЦД 2-го типу особливо важливий, адже наявність МАУ збільшує смертність від серцево-судинних захворювань у декілька разів.
Висновки
На фоні тривалого застосування мельдонію (Вазонат) в комбінації з основною терапією виявлено зниження рівня HbA1c, що свідчить про поліпшення стану вуглеводного обміну.
12-тижнева терапія мельдонієм у складі комбінованої терапії ЦД 2-го типу статистично значуще покращує показники функціонального стану нирок, на що вказує значне зниження МАУ, креатиніну і збільшення ШКФ в основній групі пацієнтів.
Включення в схему лікування Вазонату у хворих на ЦД 2-го типу покращує морфофункціональні параметри серця, має додаткову нефропротекторну дію, знижує середні значення ТГ і ЛПНЩ, а також рівень HbA1c порівняно з базисною терапією.
Вазонат, що поєднує кардіопротективні властивості та цукрознижуючий ефект, є особливо вдалим вибором для комплексної терапії пацієнтів з порушеннями метаболізму глюкози, діабетичною нефропатією і серцевою недостатністю.
Беручи до уваги цукрознижувальний ефект і сприятливий вплив на ліпідний обмін, прояви діабетичної нефропатії, Вазонат рекомендовано включати до засобів комплексного лікування хворих на ЦД, особливо в осіб із високим ризиком серцево-судинних захворювань. Додатковим фактором на користь Вазонату є його добра переносимість і тривалий досвід застосування як протиішемічного засобу.
Рекомендується така схема призначення Вазонату при ЦД 2-го типу: таблетки по 500 мг двічі на добу в першій половині дня впродовж 12 тижнів.
Список литературы
1. International Diabetes Federation. Diabetes Atlas, 7th edition, Brussels. — Belgium: International Diabetes Federation, 2015. — 143 р.
2. Корпачев В.В., Корпачева-Зиныч О.В., Гурина Н.М. и др. Оценка антигипоксической эффективности мельдония при нарушениях микроциркуляторного русла у больных сахарным диабетом 2-го типа // Український медичний часопис. — 2015. — № 4(108). — С. 63-65.
3. Klusa V., Beitnere U., Pupure J., Isajevs S., Rumaks J., Svirskis S., Dzirkale Z., Kalvinsh I. Mildronate and its neuroregulatory mechanisms: targeting the mitochondria, neuroinflammation, and protein expression // Medicina (Kaunas). — 2013. — Vol. 49(7). — P. 301-309.
4. Pupure J., Isajevs S., Skapare E., Rumaks J., Svirskis S., Svirina D., Kalvinsh I., Klusa V. Neuroprotective properties of mildronate, a mitochondria-targeted small molecule // Neurosci. Lett. — 2010. — Vol. 470(2). — P. 100-105.
5. Klusa V., Muceniece R., Isajevs S., Isajeva D., Beitnere U., Mandrika I., Pupure J., Rumaks J., Jansone B., Kalvinsh I., Vinters H.V. Mildronate enhances learning/memory and changes hippocampal protein expression in trained rats // Pharmacol. Biochem. Behav. — 2013. — Vol. 106. — P. 68-76.
6. Лобанова М.В., Полетаева Л.В., Романюк С.С. Влияние милдроната на уровень глюкозы крови и гликированного гемоглобина у больных сахарным диабетом типа 2 // Вестник Российского государственного медицинского университета. — 2008. — № 2(61). — С. 37-41.
7. Стаценко М.Е., Туркина С.В., Беленкова С.В. Возможности применения милдроната у больных хронической сердечной недостаточностью с сахарным диабетом 2 типа и автономной кардиальной нейропатией // Российский кардиологический журнал. — 2009. — № 3(77). — С. 69-75.
8. Топчий И.И., Денисенко В.П., Смолкин М.Г. Роль мельдония в комплексном лечении больных с диабетической нефропатией и артериальной гипертензией // Український терапевтичний журнал. — 2014. — № 2. — С. 45-50.
/83.jpg)

/82_3.jpg)
/82.jpg)