Международный эндокринологический журнал 4 (76) 2016
Вернуться к номеру
Клинико-гормональная характеристика больных с гигантскими образованиями хиазмально-селлярной области
Авторы: Алимова К.Б., Урманова Ю.М. - Ташкентский педиатрический медицинский институт, Республиканский специализированный научно-практический медицинский центр эндокринологии Республики Узбекистан, г. Ташкент, Республика Узбекистан
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
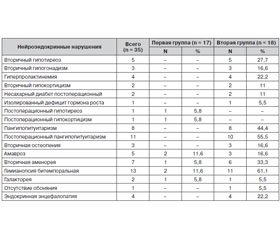
Мета дослідження: вивчити клініко-гормональну характеристику пацієнтів з гігантськими утвореннями хіазмально-селярної ділянки. Матеріал і методи. За період з 2015 по 2016 р. обстежено 35 дорослих хворих з макроаденомами гіпофіза, із них 48,6 % чоловіків. Середній вік чоловіків становив 37,12 року, жінок — 38,15 року. Тривалість захворювання перебувала в межах від 2 місяців до 25 років. Результати. Розподіл хворих за топографо-анатомічною класифікацією сторони росту аденоми гіпофіза показав, що найчастіше спостерігалися аденоми гіпофіза з тотальним варіантом росту (51,4 %). У хворих з гігантськими аденомами гіпофіза найчастіше спостерігались пангіпопітуїтаризм (44,4 %), а також бітемпоральна геміанопсія (61,1 %) і вторинна аменорея (33,3 %). Такі порушення, як вторинна остеопенія, ендокринна енцефалопатія, затримка фізичного і статевого розвитку, були виявлені тільки в цій групі хворих. Крім того, вірогідне зниження середніх значень базальних рівнів тропних гормонів гіпофіза (соматотропний гормон (СТГ), лютеїнізуючий гормон (ЛГ), фолікулостимулюючий гормон (ФСГ), адренокортикотропний гормон) було зафіксоване у пацієнтів з гігантськими аденомами гіпофіза. Висновки. У хворих з гігантськими аденомами гіпофіза в першу чергу відзначається зниження рівня СТГ, ФСГ і ЛГ. Найбільш виражені нейроендокринні та офтальмологічні порушення трапляються у хворих з гігантськими аденомами гіпофіза.
Цель исследования: изучить клинико-гормональную характеристику пациентов с гигантскими образованиями хиазмально-селлярной области. Материал и методы. За период с 2015 по 2016 г. обследовано 35 взрослых больных с макроаденомами гипофиза, из них 48,6 % мужчин. Средний возраст мужчин составил 37,12 года, женщин — 38,15 года. Давность заболевания колебалась в пределах от 2 месяцев до 25 лет. Результаты. Распределение больных по топографо-анатомической классификации стороны роста аденомы гипофиза показало, что наиболее часто наблюдались аденомы гипофиза с тотальным вариантом роста (51,4 %). У больных с гигантскими аденомами гипофиза наиболее часто встречались пангипопитуитаризм (44,4 %), а также битемпоральная гемианопсия (61,1 %) и вторичная аменорея (33,3 %). Такие нарушения, как вторичная остеопения, эндокринная энцефалопатия, задержка физического и полового развития, были выявлены только в этой группе больных. Кроме того, достоверное снижение средних значений базальных уровней тропных гормонов гипофиза (соматотропный гормон (СТГ), лютеинизирующий гормон (ЛГ), фолликулостимулирующий гормон (ФСГ), адренокортикотропный гормон) было зафиксировано у пациентов с гигантскими аденомами гипофиза. Выводы. У больных с гигантскими аденомами гипофиза в первую очередь отмечается снижение уровня СТГ, ФСГ, ЛГ. Наиболее выраженные нейроэндокринные и офтальмологические нарушения встречаются у больных с гигантскими аденомами гипофиза.
Objective: to study the clinical and hormonal characteristics of patients with giant masses of sellar-chiasmatic area. Material and methods. During the period from 2015 to 2016, we have examined 35 adult patients with pituitary macroadenomas, including 48.6 % of men. The average age of men was 37.12 years, women — 38.15 years. The disease duration ranged from 2 months to 25 years. Results. Distribution of patients according to topographic and anatomical classification of pituitary adenoma side growth showed that pituitary adenomas with total growth were (51.4 %) most frequent. Patients with giant pituitary adenomas most often had panhypopituitarism (44.4 %), as well as bitemporal hemianopsia (61.1 %) and secondary amenorrhea (33.3 %). Such disorders, as a secondary osteopenia, endocrine encephalopathy, delayed physical and sexual development, had been identified only in this group of patients. In addition, a significant decrease in the mean values of basal levels of tropic pituitary hormones (growth hormone (GH), luteinizing hormone (LH), follicle stimulating hormone (FSH), adrenocorticotropic hormone) was observed in patients with giant pituitary adenomas. Conclusions. Patients with giant pituitary adenomas have primarily a decrease in GH, FSH, LH levels. The most significant neuroendocrine and ophthalmic disorders occur in patients with giant pituitary adenomas.
гігантські аденоми гіпофіза, клініка, ускладнення.
гигантские аденомы гипофиза, клиника, осложнения.
giant pituitary adenomas, clinical pattern, complications.
Статья опубликована на с. 104-107
Введение
Материал и методы
Результаты
Обсуждение результатов
Выводы
1. Al-Shriam M. The 2004 World Health Organization classification of pituitary tumors. What is new? // Acta neuropathol. — 2006. — Vol. 111. — P. 1-7.
2. Komninos J., Vlassopoulou V., Protopapa D. et al. Tumors metastatic to the pituitary gland: case report and literature review // J. Clin. Endocrinol. Metab. — 2004. — Vol. 89(2). — P. 574-580.
3. Mortini P., Losa M., Barzaghi R. Results of transsphenoidal surgery in a large series of patients with pituitary adenoma // Neurosurgery. — 2005. — Vol. 56. — P. 1222-1233.
4. Sara M., Claudio F., Marco L. et al. Time course of hypothalamic-pituitary deficiency in adults receiving cranial radiotherapy for primary extrasellar brain tumors // Radiother. Oncol. — 2011. — Vol. 99(1). — P. 23-28.
5. Tomlinson J.W., Holden N., Hills R.K., Wheatley K. Association between premature mortality and hypopituitarism. West Midlands Prospective Hypopituitary Study Group // Lancet. — 2001. — Vol. 357(9254). — P. 425-431.
6. Ezzat S., Asa S.L., Couldwell W.T. et al. The prevalence of pituitary adenomas: a systematic review // Cancer. — 2004. — Vol. 101(3). — P. 613-619.
7. Colao A., Pivonello R., Di S.C., Savastano S., Grasso L.F., Lombardi G. Medical therapy of pituitary adenomas: effects on tumor shrinkage // Rev. Endocr. Metab. Disord. — 2009. — Vol. 10(2). — P. 111-123.
8. Chanson P., Salenave S. Diagnosis and treatment of pituitary adenomas // Minerva Endocrinol. — 2004. — Vol. 29(4). — P. 241-245.
9. Fatemi N., Dusick J.R., de Paiva Neto M.A., Kelly D.F. The endonasal microscopic approach for pituitary adenomas and other parasellar tumors: a 10-year experience // Neurosurgery. — 2008. — Vol. 63(4 Suppl. 2). — P. 244-256.
10. Charalampaki P., Ayyad A., Kockro R.A., Perneczky A. Surgical complications after endoscopic transsphenoidal pituitary surgery // J. Clin. Neurosci. — 2009. — Vol. 16(6). — P. 786-789.

/105.jpg)
/106.jpg)