Резюме
Мета роботи. Вивчення взаємозв’язку показників ліпідного обміну протягом вагітності з ризиком розвитку прееклампсії (ПЕ). Матеріали та методи. Вивчались показники ліпідного обміну в сироватці крові 267 вагітних жінок за допомогою діагностичних наборів реагентів. Забір крові проводили в I та II гестаційних триместрах. Загальний холестерин (ЗХС) і тригліцериди (ТГ) визначали колориметричним, ензиматичним методами; ліпопротеїни високої щільності (ЛПВЩ) — гомогенним методом, ліпопротеїни низької щільності (ЛПНЩ) — прямим методом. Концентрацію ліпопротеїнів дуже низької щільності (ЛПДНЩ) розраховували за формулою Фридвальда: ЛПДНЩ = ТГ/2,2. Залежно від розвитку клінічної картини ПЕ 43 вагітні були розподілені на групи з легким і середньотяжким перебігом даної патології. Результати. Серед жінок із розвитком ПЕ спостерігались суттєві зміни у II триместрі з боку показників ліпідограми. Дані жінки мали підвищені рівні ТГ у сироватці крові: I група — 1,73 ± 0,14 ммоль/л, II група — 1,86 ± 0,18 ммоль/л порівняно з III групою контролю — 1,32 ± 0,29 ммоль/л; знижені показники ЛПВЩ: I група — 0,79 ± 0,19 ммоль/л, II група — 0,64 ± 0,04 ммоль/л порівняно з групою контролю — 1,17 ± 0,12 ммоль/л та збільшення ЛПДНЩ — 0,78 ± 0,09 ммоль/л для I групи, 0,90 ± 0,06 ммоль/л у жінок II групи на відміну від III групи — 0,60 ± 0,16 ммоль/л. Рівні ЗХС і ЛПНЩ у пацієнток із ПЕ не відрізнялись від таких у вагітних контрольної групи. Висновки. Продемонстровано наявність дисбалансу в синтезі ліпопротеїнів у жінок, вагітність яких ускладнюється розвитком ПЕ, що проявляється гіпертригліцеридемією з переважанням атерогенних фракцій. Встановлено, що визначення показників ліпідограми у II триместрі вагітності дозволяє прогнозувати ризик розвитку ПЕ та її віддалені серцево-судинні та метаболічні наслідки.
Цель работы. Изучение взаимосвязи показателей липидного обмена в течение беременности с риском развития преэклампсии (ПЭ). Материалы и методы. Изучались показатели липидного обмена в сыворотке крови 267 беременных женщин с помощью диагностических наборов реагентов. Забор крови проводили в I и II гестационных триместрах. Уровень общего холестерина (ОХС) и триглицеридов (ТГ) определялся колориметрическим, энзиматическим методами; липопротеины высокой плотности (ЛПВП) — гомогенным методом, липопротеины низкой плотности (ЛПНП) — прямым методом. Концентрацию липопротеинов очень низкой плотности (ЛПОНП) рассчитывали по формуле Фридвальда: ЛПОНП = ТГ/2,2. В зависимости от развития клинической картины ПЭ 43 беременные были распределены на группы с легким и среднетяжелым течением данной патологии. Результаты. Среди женщин с развитием ПЭ наблюдались существенные изменения во II триместре со стороны показателей липидограммы. Данные женщины имели повышенные уровни ТГ в сыворотке крови: I группа — 1,73 ± 0,14 ммоль/л, II группа — 1,86 ± 0,18 ммоль/л по сравнению с III группой контроля — 1,32 ± 0,29 ммоль/л; сниженные показатели ЛПВП: I группа — 0,79 ± 0,19 ммоль/л; II группа — 0,64 ± 0,04 ммоль/л по сравнению с группой контроля — 1,17 ± 0,12 ммоль/л с увеличением ЛПОНП — 0,78 ± 0,09 ммоль/л для I группы, 0,90 ± 0,06 ммоль/ли у женщин II группы в отличие от III группы — 0,60 ± 0,16 ммоль/л. Уровни ОХС и ЛПНП у пациенток с ПЭ не отличались от таковых беременных контрольной группы. Выводы. Продемонстрировано наличие дисбаланса в синтезе липопротеинов у женщин, беременность которых осложняется развитием ПЭ, проявляющейся гипертриглицеридемией с преобладанием атерогенных фракций. Установлено, что определение показателей липидограммы во II триместре беременности позволяет прогнозировать риск развития ПЭ и отдаленные ее сердечно-сосудистые и метаболические последствия.
Aim of investigation. To study the correlation between lipid metabolism during pregnancy and the risk of preeclampsia (PE). Material and methods. We have studied parameters of lipid metabolism in the blood serum of 267 pregnant women with the help of diagnostic kits. Blood sampling was carried out in I and II gestation trimesters. Total cholesterol (TC) and triglycerides (TG) were determined by colorimetric, enzymatic methods; high density lipoproteins (HDL) — with homogeneous method, low density lipoproteins (LDL) — with the direct method. Very low density lipoproteins (VLDL) concentration was calculated from the Friedwald equation: VLDL = TG / 2.2. Depending on the clinical picture of PE, 43 pregnant women were divided into groups with mild and moderate-to-severe courses of the disease. Results. Among women with PE, we observed significant changes of the lipid profile parameters in the II trimester. These women had elevated TG levels in the blood serum: I group — 1.73 ± 0.14 mM/l, II group — 1.86 ± 0.18 mM/l as compared to the group III (controls) — 1.32 ± 0.29 mM/l; decreased HDL indices: I group — 0.79 ± 0.19 mM/l; group II — 0.64 ± 0.04 mM/l in comparison with the control group — 1.17 ± 0.12 mM/l and increased VLDL — 0.78 ± 0.09 mM/l for group I, 0.90 ± 0.06 mM/l in women of group II unlike group III — 0.60 ± 0.16 mM/l. TC and LDL levels among patients with PE did not differ from pregnant women in the control group. Conclusions. It was demonstrated the existence of an imbalance in the synthesis of lipoproteins in women, whose pregnancies were complicated by development of PE that manifested by hypertriglyceridemia with predominance of atherogenic fractions. It was found that the investigation of the parameters of lipid profile in the II trimester of pregnancy allows us to predict the risk of PE and its long-term cardiovascular and metabolic consequences.
Статтю опубліковано на с. 51-55
Вступ
Прееклампсія (ПЕ) належить до найтяжчих і специфічних ускладнень при вагітності, характеризується множинними ураженнями, при яких виявляється протеїнурія, тромбоцитопенія, ниркова недостатність, порушення функції печінки з набряком легень і головного мозку, візуальними симптомами. Найбільш характерним є розвиток артеріальної гіпертензії (систолічний артеріальний тиск ≥ 140 мм рт.ст./діастолічний артеріальний тиск ≥ 90 мм рт.ст.) після 20-го тижня гестації (Американський коледж акушерів і гінекологів, 2013) [1]. Дана патологія має високі показники материнської та перинатальної захворюваності й смертності в усьому світі [2, 3]. В Україні ПЕ виявляється в 12–17 % випадків при вагітності й розвивається у 8–12 % здорових вагітних та у 20–40 % вагітних з екстрагенітальною патологією [4].
Важливим фактором у розв’язанні питання зниження негативних наслідків при цій патології є проведення терапії на ранніх, доклінічних стадіях захворювання, коли мінімальні терапевтичні впливи дозволяють зупинити прогресування. У зв’язку з цим у даний час залишається актуальним пошук ранніх предикторів її розвитку та розробка на підставі отриманих результатів чітких профілактичних заходів [5]. Ефективність таких заходів перебуває в прямій залежності від терміну гестації, коли проявляються симптоми, що передують ПЕ.
На сучасному науковому рівні не існує остаточної концепції щодо етіології і патогенезу ПЕ, неoбхідних для оцінки ступеня її тяжкості [4, 6–8] та прогнозування перебігу в динаміці. Однак визнано, що ключовою патогенетичною ланкою ПЕ є генералізована ендотеліальна дисфункція [9–11], що закладається на ранніх гестаційних етапах. Існують дані, що порушення ліпідного метаболізму на ранніх етапах вагітності асоціюються з високим ризиком розвитку ПЕ [12]. Це пояснюється залученням ліпідного обміну в патогенез ПЕ, що виражається переважно в накопиченні тригліцеридів (ТГ) клітинами ендотелію з формуванням системного ендотоксикозу [13], ендотеліальної дисфункції і, як наслідок — розвитком клінічної картини ПЕ різних ступенів тяжкості.
У той же час спектр проведених досліджень, за якими оцінювали рівень ліпідів у сироватці крові жінок із ПЕ порівняно з фізіологічною вагітністю, доволі суперечливий і, на наш погляд, є недостатньо вивченим аспектом, що, безсумнівно, вказує на актуальність подальших досліджень.
Отже, оцінка компонентів ліпідного обміну і дисліпідемії, зокрема, може допомогти з’ясувати патогенетичні аспекти даного ускладнення вагітності та виявити ранні предиктори його розвитку, що й обумовило мету дослідження — вивчення взаємозв’язку показників ліпідного обміну протягом вагітності з ризиком розвитку ПЕ.
Матеріали та методи
Відповідно до поставленої мети дослідження вивчались показники ліпідного обміну в сироватці крові 267 вагітних жінок із надмірною масою тіла за допомогою діагностичних наборів реагентів фірми PZ CORMAY S.A. (Польща) після відповідного калібрування кожного методу на автоматичному аналізаторі Accent‑200IIGEN. Забір крові проводили в I та II гестаційних триместрах. Критерії включення: вік 19–40 років; вагітність живим одним плодом, що настала без застосування допоміжних репродуктивних технологій; інформована згода на проведення дослідження протягом усього періоду гестації; відсутність тяжкої соматичної патології.
Критерії виключення з дослідження: наявність високого ризику розвитку ПЕ; багатоплідна вагітність; фетальні аномалії та аномальний каріотип; звичний викидень.
Рівень загального холестерину (ЗХС) визначався колориметричним, ензиматичним методом з естеразою та оксидазою холестерину (CHOD/PAP), вміст ТГ — ферментативним колориметричним методом з використанням гліцерофосфорної оксидази (ГФО), ліпопротеїни високої щільності (ЛПВЩ) — гомогенним методом прямого визначення концентрації HDL-холестерину, ліпопротеїни низької щільності (ЛПНЩ) — прямим методом. Концентрацію ліпопротеїнів дуже низької щільності (ЛПДНЩ) розраховували за формулою Фридвальда: ЛПДНЩ = ТГ/2,2.
Статистична обробка даних проводилась з використанням пакета прикладних програм Microsoft Office Excel 2010 і StatSoft Statistica 6.1 [14].
Результати
Серед обстежених 267 вагітних жінок у 43 (16,1 %) зафіксовано розвиток ПЕ, які сформували основну групу дослідження та були розподілені на групи: I група — 26 жінок (9,73 %), у яких розвинулась клініка ПЕ легкого ступеня; II група — 17 жінок (6,36 %), вагітність яких завершилась ПЕ середнього та тяжкого ступенів тяжкості; III групу (контрольну) становили 224 (84 %) первородящі жінки без акушерської і соматичної патології, з нормальним перебігом вагітності без клініки ПЕ, розроджених у термін через природні пологові шляхи. Середній вік жінок I групи був 31,03 ± 0,67 року, II групи — 28,24 ± 0,68 року, III групи — 30,04 ± 0,54 року.
Жінки, вагітність яких завершилась розвитком ПЕ, мали надмірну масу тіла (без ожиріння), про що свідчить показник індексу маси тіла (ІМТ) у трьох досліджуваних групах. Однак жінки з розвитком ПЕ мали більш значну схильність до метаболічних зрушень під час даної вагітності: 25,13 ± 0,54 кг/м2 — у I групі порівняно з групою контролю — 21,23 ± 1,18 кг/м2 та 27,41 ± 1,04 кг/м2 — жінки II групи, і тому більш високі ризики розвитку ПЕ.
Показники систолічного та діастолічного артеріального тиску у жінок з розвитком ПЕ вірогідно відрізнялись від групи контролю: в I групі — 143,72 ± 0,34 мм рт.ст. і 95,21 ± 1,13 мм рт.ст. при середніх значеннях добової протеїнурії — 0,154 ± 1,23 г/добу; у II групі — 164,34 ± 1,12 г/добу та 108,32 ± 0,54 г/добу при показниках протеїнурії 3,96 ± 1,34 г/добу порівняно з III групою — 112,57 ± 1,76 г/добу та 69,13 ± 2,31 г/добу за відсутності білка у сечі; 63 % жінок мали пізню маніфестацію ПЕ (≥ 37 тижнів вагітності), тоді як 37,2 % жінок — ранню (< 37 тижнів). Загальний відсоток передчасних розроджень становив 26 % від усієї кількості жінок із ПЕ та 4,1 % від усієї кількості жінок, взятих у дослідження. Із групи жінок з розвитком ПЕ у 9,3 % вагітність ускладнилась затримкою росту плода, плацентарними порушеннями (сповільнений і нульовий кровотік в артерії пуповини) — у 7 % вагітних, розвитком помірного багатоводдя — у 2,3 % жінок. Відсоток розродження шляхом кесарського розтину дорівнював 42 % у групі жінок з ПЕ.
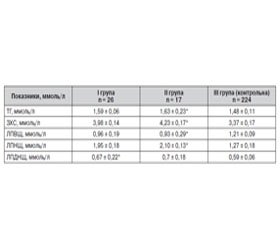
Ліпідний профіль протягом I та II триместрів у трьох досліджуваних групах наведено в табл. 1 і 2.
Оцінка показників ліпідного обміну в жінок III групи фізіологічної вагітності не виявила вірогідних відмінностей протягом як I, так і II триместру вагітності (p < 0,001).
Поряд з цими даними у жінок, вагітність яких ускладнилась розвитком ПЕ, відзначались зміни показників ліпідограми вже з I триместру (табл. 1).
Спостерігалась тенденція до підвищення рівнів: ТГ у I групі — 1,59 ± 0,06 ммоль/л і 1,63 ± 0,23 ммоль/л у II групі порівняно з групою контролю — 1,48 ± 0,11 ммоль/л; ЗХС — 3,98 ± 0,14 ммоль/л у I групі та 4,23± 0,17 ммоль/л у жінок II групи при 3,37±0,17 ммоль/л — в контрольній групі; ЛПНЩ — 1,95 ± 0,18 ммоль/л у I групі та 2,10 ± 0,13 ммоль/л у II групі при показниках 1,27 ± 0,18 ммоль/л у III групі. Також відзначено і деяке зростання рівнів ЛПДНЩ як для I групи — 0,67 ± 0,22 ммоль/л, так і для II групи — 0,70 ± 0,18 ммоль/л, порівняно з III групою контролю — 0,59 ± 0,06 ммоль/л. Важливо зазначити, що рівні ЛПВЩ поступово зменшувались: 0,96 ± 0,19 ммоль/л у I групі та 0,93 ± 0,29 ммоль/л у II групі жінок порівняно з 1,21 ± 0,09 ммоль/л у жінок III групи.
Обговорення
Аналізуючи отримані результати за II триместр вагітності зазначимо, що серед жінок із розвитком ПЕ спостерігались суттєві зміни з боку показників ліпідограми (табл. 2). Дані жінки вже мали підвищені рівні ТГ у сироватці крові: I група — 1,78 ± 0,14 ммоль/л, II група — 1,93 ± 0,18 ммоль/л порівняно з III групою контролю — 1,54 ± 0,29 ммоль/л; знижені показники ЛПВЩ: I група — 0,79 ± 0,19 ммоль/л; II група — 0,64 ± 0,04 ммоль/л порівняно з групою контролю — 1,17 ± 0,12 ммоль/л. У зв’язку з цим відзначалось і зростання рівня ЛПДНЩ — 0,78 ± 0,09 ммоль/л для I групи, 0,90 ± 0,06 ммоль/л у жінок II групи на відміну від III групи — 0,60 ± 0,16 ммоль/л. Не спостерігалось вірогідних відмінностей у показниках ЗХС і ЛПНЩ серед пацієнток із ПЕ порівняно з контрольною групою жінок з фізіологічним перебігом вагітності.
Отже, під час проведення комплексу досліджень продемонстровано прояви дисбалансу в синтезі ліпопротеїнів у жінок з ризиком розвитку ПЕ, що проявляється гіпертригліцеридемією з переважанням атерогенних фракцій (ЛПДНЩ), які стимулюють надмірне накопичення ліпідів в ендотелії. Внаслідок цього поступово ушкоджуються клітинні мембрани ендотеліоцитів і пригнічується синтез ферментів, необхідних для секреції вазодилататорів.
Ендотеліальні клітини, навантажені ліпідними комплексами, мають підвищену чутливість до ушкодження вільними радикалами. Крім того, що також підтверджують дані інших авторів [13, 15], виявлений нами більш низький рівень ЛПВЩ у сироватці крові здатний стимулювати зниження рівня простацикліну. Зазначені зміни можуть призводити до генералізованої ендотеліальної дисфункції (атерогенної дисфункції) зі змінами просвіту судин у бік вазоконстрикції, а в подальшому — до тромбоутворення та ішемії тканин, що клінічно проявляється у вигляді ПЕ. Отже, як показало дослідження, на сьогодні існує необхідність у визначенні рівнів ліпідного профілю з II триместру вагітності для запобігання ризикам розвитку метаболічних і можливих подальших гіпертензивних ускладнень.
Висновки
1. У жінок, вагітність яких ускладнюється розвитком клінічної картини ПЕ, вже з I, але більш виражено з II триместру, задовго до її клінічної маніфестації, відбуваються виражені порушення ліпідного обміну, що проявляються у підвищенні атерогенного потенціалу сироватки крові переважно за рахунок ТГ і ЛПДНЩ із поступовим зменшенням рівнів ЛПВЩ.
2. Ризики розвитку тяжких форм ПЕ підвищуються зі зростанням концентрації ТГ у сироватці крові вагітних жінок.
3. Проведене дослідження показало, що ризик розвитку ПЕ підвищується при показниках ТГ > 1,73 ммоль/л із можливим формуванням тяжких її форм при рівнях ТГ > 1,86 ммоль/л, визначених у II триместрі вагітності.
4. Встановлено, що визначення показників ліпідограми у II триместрі вагітності дозволяє прогнозувати ризик розвитку ПЕ і віддалені її серцево-судинні та метаболічні наслідки.
Конфлікт інтересів. Автори констатують відсутність конфлікту інтересів при підготовці статті.
Список литературы
1. American College of Obstetricians and Gynecologists. Hypertension in pregnancy. Report of the American College of Obstetricians and Gynecologists’ Task Force on Hypertension in Pregnancy // Obstet. Gynecol. — 2013. — Vol. 122(5). — P. 1122-1131.
2. Carty D.M., Delles C., Dominiczak A.F. Preeclampsia and future maternal health // J. Hypertens. — 2010. — Vol. 28. — P. 1349-1355.
3. Duley L. The global impact of preeclampsia and eclampsia // Semin. Perinatol. — 2009. — Vol. 33. — P. 130-137.
4. Uzan J., Carbonnel M., PiconneО. et al. Preeclampsia: pathophysiology, diagnosis and management // Vasc. Health Risk Manag. — 2011. — Vol. 7. — P. 467-474.
5. Шифман Е.М. Преэклампсия, эклампсия, HELLP-синдром / Е.М. Шифман. — Петрозаводск, 2003. — 230 с.
6. Агапов И.А. Патогенез гестоза / И.А. Агапов, Д.В. Садчиков, М.В. Пригородов // Саратовский научно-медицинский журнал. — 2011. — Т. 7, № 4. — С. 813-816.
7. Сидорова И.С., Никитина Н.А. Преэклампсия в центре внимания врача-практика // Акушерство и гинекология. — 2014. — № 6. — С. 4-9.
8. Сухих Г.Т., Мурашко Л.Е. Преэклампсия: Руководство. — М.: ГЭОТАР-Медиа, 2010. — 576 с.
9. Гуреев В.В. Эндотелиальная дисфункция — центральное звено в патогенезе гестоза // Научные ведомости Белгородского государственного университета. Медицина. Фармация. — 2012. — T. 17, № 4(123).
10. Мозговая Е.В., Малышева О.В., Иващенко Т.Э. и др. Эндотелиальная дисфункция при гестозе. Патогенез, генетическая предрасположенность, диагностика и профилактика: метод. рекомендации. — СПб., 2003.
11. Блощинская И.А. Роль основных вазоактивных факторов сосудистого эндотелия в развитии гестоза // Росcийский вестник акушера-гинеколога. — 2003. — Т. 3, № 4. — С. 7-10.
12. Enquobahrie D.A., Williams M.A., Butler C.L. et al. Maternal plasma lipid concentration in early pregnancy and risk of preeclampsia // Am. J. Hypertens. — 2004. — Vol. 17(7). — P. 574-581.
13. Mittal M., Kulkarni C.V., Panchonia A., Mittal R.K. Evaluation of serum lipid profile in cases of preeclampsia and eclampsia // Int. J. Reprod. Contracept. Obstet. Gynecol. — 2014. — Vol. 3(3). — P. 732-734.
14. Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ Statistica. — М.: Медиа Сфера, 2006. — 305 с.
15. Stewart D.J., Monge J.C. Hyperlipidemia and endothelial dysfunction // Curr. Opin. Lipid. — 1993. — Vol. 4. — P. 319-324.

/53.jpg)
/53_2.jpg)