Резюме
Вступ. Цукровий діабет (ЦД) 1-го типу призводить до розвитку та несприятливого клінічного перебігу хронічних запальних захворювань, у тому числі і лор-органів. Мета дослідження: вивчити видовий склад і популяційний рівень мікрофлори вмісту порожнини товстої кишки хворих на ЦД 1-го типу залежно від тяжкості його клінічного перебігу. Матеріали і методи. Бактеріологічним і мікологічним методами проведено обстеження вмісту порожнини товстої кишки у 50 хворих на ЦД 1-го типу віком від 15 до 60 років, середнього і тяжкого ступенів клінічного перебігу, а також у 30 практично здорових людей такого ж віку, які вважали себе здоровими і не хворіли на будь-яку патологію протягом останніх 6 місяців. З 50 хворих у 39 діагностований ЦД тяжкої форми, а в 11 — клінічний перебіг середнього ступеня тяжкості. Результати. При середньому і тяжкому перебігу ЦД 1-го типу у вмісті порожнини товстої кишки формується дефіцит автохтонних, найважливіших за представництвом у товстокишковому мікробіоценозі анаеробних бактерій роду Bifidobacterium, Lactobacillus, Peptostreptococcus, Enterococcus. На такому тлі настає контамінація порожнини товстої кишки патогенними (E.coli Hly+, ентеропатогенні кишкові палички) та умовно-патогенними (Enterobacter, Citrobacter, Serratia, Proteus) ентеробактеріями, а також умовно-патогенними бактеріями роду Bacteroides, Clostridium, P.niger, Staphylococcus і дріжджоподібними грибами роду Candida, шо досягають високого популяційного рівня. Висновки. У мікробіоценозі порожнини товстої кишки хворих на ЦД 1-го типу суттєво зростає рівень ентеротоксигенних і ентеротоксичних (61,38 %) та умовно-патогенних бактерій (71,24 %). Зміна видового складу, індексу домінування Бергера — Паркера, індексу постійності призводить до зміни ролі кожного компонента мікробіоценозу порожнини товстої кишки хворих на ЦД 1-го типу як із середнім, так і більшою мірою з тяжким ступенем перебігу. У хворих на ЦД 1-го типу середнього та тяжкого перебігу в порожнині товстої кишки відзначається виражений (р < 0,05–0,001) дефіцит облігатних бактерій роду Bifidobacterium — на 50,04 %, Lactobacillus — на 34,82 %, Peptostreptococcus — на 16,0 %, Enterococcus — на 11,68 %. З поглибленням тяжкості клінічного перебігу посилюється дефіцит та прогнозується чітка картина зниження ролі біфідо- та лактобактерій у товстокишковому мікробіоценозі. Отримані дані є підставою для вивчення ефективності пробіотиків у комплексному лікуванні хворих на ЦД 1-го типу до, після та через 3 місяці після лікування на основі аналізу видового складу і популяційного рівня мікрофлори вмісту порожнини товстої кишки, а також для розробки лікувальної тактики гнійних синуїтів у пацієнтів з ЦД 1-го типу із включенням у схеми комплексного лікування пробіотиків.
Введение. Сахарный диабет (СД) 1-го типа приводит к развитию и неблагоприятному клиническому течению хронических воспалительных заболеваний, в том числе и лор-органов. Цель исследования: изучить видовой состав и популяционный уровень микрофлоры содержимого полости толстой кишки больных СД 1-го типа в зависимости от тяжести его клинического течения. Материалы и методы. Бактериологическим и микологическим методами проведено обследование содержимого полости толстой кишки у 50 больных СД 1-го типа в возрасте от 15 до 60 лет, средней и тяжелой степеней клинического течения, а также у 30 практически здоровых людей такого же возраста, которые считали себя здоровыми и не болели любой патологией в течение последних 6 месяцев. Из 50 больных у 39 диагностирован СД тяжелой формы, а у 11 — клиника средней степени тяжести. Результаты. При среднем и тяжелом течении СД 1-го типа в содержании полости толстой кишки формируется дефицит автохтонных, важнейших по представительству в толстокишечном микробиоценозе анаэробных бактерий рода Bifidobacterium, Lactobacillus, Peptostreptococcus, Enterococcus. На таком фоне наступает контаминация полости толстой кишки патогенными (E.coli Hly+, энтеропатогенные кишечные палочки) и условно-патогенными (Enterobacter, Citrobacter, Serratia, Proteus) энтеробактериями, а также условно-патогенными бактериями рода Bacteroides, Clostridium, P.niger, Staphylococcus и дрожжеподобными грибами рода Candida, которые достигают высокого популяционного уровня. Выводы. В микробиоценозе полости толстой кишки больных СД 1-го типа существенно возрастает уровень энтеротоксигенных и энтеротоксических (61,38 %) и условно-патогенных бактерий (71,24 %). Изменение видового состава, индекса доминирования Бергера — Паркера, индекса постоянства приводит к изменению роли каждого компонента микробиоценоза полости толстой кишки больных СД 1-го типа как со средней, так и, в большей степени, с тяжелой степенью течения. У больных СД 1-го типа среднего и тяжелого течения в полости толстой кишки отмечается выраженный (р < 0,05–0,001) дефицит облигатных бактерий рода Bifidobacterium — на 50,04 %, Lactobacillus — на 34,82 %, Peptostreptococcus — на 16,0 %, Enterococcus — на 11,68 %. С углублением тяжести клинического течения усиливается дефицит и прогнозируется четкая картина снижения роли бифидо- и лактобактерий в толстокишечном микробиоценозе. Полученные данные являются основанием для изучения эффективности пробиотиков в комплексном лечении больных СД 1-го типа до, после и через 3 месяца после лечения на основе анализа видового состава и популяционного уровня микрофлоры содержимого полости толстой кишки, а также для разработки лечебной тактики гнойных синуитов у пациентов с СД 1-го типа с включением в схемы комплексного лечения пробиотиков.
Background. Type 1 diabetes mellitus (DM) results in the development and unfavorable clinical course of chronic inflammatory diseases, including those of ENT organs. Aim of the study — to explore the species composition and population level of the large intestine microflora in patients with type 1 DM depending on the severity of its clinical course. Materials and methods. By means of bacteriological and mycological methods, we have examined the content of the large intestine cavity in 50 patients aged 15 to 60 years with moderate and severe DM type 1, as well as in 30 apparently healthy individuals of the same age, who considered themselves to be healthy and were not affected by any diseases during the previous six months. The severe form of DM was diagnosed in 39 of 50 patients, and the clinical course of moderate severity — in 11 patients. Results. In moderate and severe course of type 1 DM, the deficiency of autochtonous bacteria of the genus Bifidobacterium, Lactobacillus, Peptostreptococcus, Enterococcus is formed in the content of the large intestine cavity, they are the most important by their representation in the large intestine microbiocenosis. Against this background, there is a contamination of the large intestine cavity with pathogenic (E.coli Hly+, EPEC) and opportunistic (Enterobacter, Citrobacter, Serratia, Proteus) enterobacteria, as well as opportunistic bacteria of the genus Bacteroides, Clostridium, P.niger, Staphylococcus, and yeast-like fungi of the Candida genus reaching a high population level. Conclusions. In the microbiocenosis of the large intestine cavity of patients with type 1 DM, there is a significant increase in the level of enterotoxigenic and enterotoxic (61.38 %) and opportunistic bacteria (71.24 %). A change of the species composition, Berger-Parker dominance index, constancy index results in the changes in a role of each component of the large intestine microbiocenosis of patients with type 1 DM both of a moderate and, to a greater extent, of severe course. In the large intestine cavity of patients with moderate and severe DM type 1, there is a significant (p < 0.05–0.001) deficiency of obligate bacteria of Bifidobacterium genus — 50.04 %, Lactobacillus — 34.82 %, Peptostreptococcus — 16.0 %, Enterococcus — 11.68 %. The more severe the clinical course, the more pronounced the deficiency, and a clear pattern of a decreased role of Bifidobacterium and Lactobacterium in the large intestine microbiocenosis is prognosticated. The findings are the reason to study the efficacy of probiotics in a comprehensive treatment of patients with type 1 DM before, after and 3 months after the treatment on the basis of the analysis of the species composition and population level of the large intestine microflora, as well as to work out the therapeutic modality for purulent sinusitis in patients with type 1 DM with inclusion of probiotics into the schemes of a comprehensive treatment.
Статтю опубліковано на с. 61-66
Вступ
Дисбіоз кишечника — це клініко-лабораторний синдром, в основі якого є зміни якісного і кількісного складу мікрофлори кишечника з розвитком метаболічних та імунологічних зрушень, які на тлі цукрового діабету (ЦД) 1-го типу призводять до виникнення, розвитку та несприятливого клінічного перебігу більшості захворювань, у тому числі і лор-органів [2, 5, 6].
Слизова оболонка верхніх дихальних шляхів є першим захисним бар’єром між навколишнім і внутрішнім середовищем людини. Її стан разом з функціональною спроможністю слизової оболонки товстої кишки визначають ризик виникнення захворювань як лор-органів, так і організму загалом. Чинники місцевого імунітету та стан мікробіоти товстого кишечника при запальних захворюваннях верхніх дихальних шляхів на тлі ЦД 1-го типу вивчені недостатньо [1].
Значна частина мікрофлори тіла людини (понад 60 %) заселяє різні відділи шлунково-кишкового тракту [9]. Товста кишка є основним резервуаром мікробіоти людини в цілому та травного тракту зокрема. Склад нормальної мікрофлори товстої кишки надзвичайно складний (17 родин, 45 родів і понад 400 видів мікроорганізмів). Разом із тим стабільність видового складу і її фізіологічних функцій підтримується складними механізмами симбіозу з мікроорганізмом, який сформувався у процесі тривалої адаптації спільного існування у формі єдиної екологічної системи [4, 10].
Кишечний мікробіоценоз людини характеризується своїм унікальним видовим складом та кількісним представництвом і змінюється при різноманітних патологічних станах, пов’язаних з імуносупресією (ЦД, онкозахворювання, променева терапія, прийом антибіотиків і препаратів стероїдних гормонів, імуносупресивних препаратів, трансплантація, оперативні втручання та хронічні гнійні запальні процеси), що призводить до дисбіозу кишечника [2, 4, 6].
У будь-якому біоценозі, у тому числі у товстій кишці, домінують представники автохтонної облігатної мікрофлори, якій відведена провідна роль у підтримці симбіотичних відношень між організмом людини та мікрофлорою, а також у регуляції міжмікробних відношень, ця мікрофлора є ключовою складовою мікробіоценозу [6–8, 10].
Головна мікрофлора товстої кишки включає у себе облігатні анаеробні бактерії родів Bifidobacterium, Bacteroides, Lactobacillus, Propionibacterium, Peptostreptococcus, а також факультативнi анаеробні та аеробні бактерії роду Escherichia, Enterococcus. До додаткової мікрофлори товстої кишки відносять анаеробні бактерії роду Peptococcus, Clostridium, Eubacterium, Fusobacterium, факультативні анаеробні та аеробні бактерії роду Staphylococcus, Citrobacter, Proteus, Enterobacter, Pantotea, Edwardsiella, Klebsiella, інші ентеробактерії [7].
Мікрофлора товстої кишки виконує понад 22 важливих функції [2, 5, 6]. При зниженні у кишковому біоценозі рівня бактерій роду Bifidobacterium і Lactobacillus та їх біологічної активності порушуються процеси всмоктування поживних речовин, засвоєння мікроелементів та екзогенних вітамінів, знижується активність ряду ферментів і біологічно активних речовин, суттєво знижується колонізаційна резистентність слизових оболонок шлунково-кишкового тракту, що сприяє розвитку інфекційно-запальних захворювань [2, 3, 7, 8].
У хворих на ЦД 1-го типу спостерігається значне зниження реактивності організму, що також призводить до тяжкого перебігу хронічних захворювань, зокрема хронічних гнійних синуїтів [11]. Вплив ЦД 1-го типу на перебіг патологічних процесів обумовлений глибокими порушеннями майже всіх видів обміну речовин і пригніченням імунологічного захисту організму [16].
Лікування більшості оториноларингологічних захворювань з використанням маніпуляцій супроводжується відчуттям болю різної інтенсивності. Негативні емоції на больовий синдром особливо небезпечні за наявності супутніх захворювань, зокрема ЦД 1-го типу [15]. При цьому порушуються практично всі види обміну речовин, характерним є ураження більшості органів і систем організму, що в подальшому призводить до виникнення тяжких ускладнень і високої летальності хворих [12–14]. Порушення регенераторної функції тканин, послаблення фагоцитарної активності макрофагів і лейкоцитів та зниження захисного бар’єру слизових оболонок сприяють посиленню адгезії мікроорганізмів та формуванню хронічних вогнищ інфекції, зокрема в піднебінних мигдаликах і приносових пазухах [11].
Перераховане вище свідчить про необхідність вивчення якісного та кількісного складу мікрофлори товстої кишки хворих на ЦД 1-го типу з метою вдосконалення діагностики та лікувальної тактики не тільки основного, а також супутніх захворювань (запальних процесів лор-органів) [3, 8].
Мета дослідження: вивчити видовий склад і популяційний рівень мікрофлори вмісту порожнини товстої кишки хворих на цукровий діабет 1-го типу залежно від тяжкості його клінічного перебігу.
Матеріал і методи
Бактеріологічним і мікологічним методами проведено обстеження вмісту порожнини товстої кишки у 50 хворих на ЦД 1-го типу віком від 15 до 60 років, середнього і тяжкого ступенів клінічного перебігу, а також у 30 практично здорових людей такого ж віку, які вважали себе здоровими і не хворіли на будь-яку патологію протягом останніх 6 місяців. Із 50 хворих у 39 діагностований ЦД тяжкої форми, а в 11 — клінічний перебіг середнього ступеня тяжкості.
Проби вмісту порожнини товстої кишки (приблизно 3–5 г) із стерильної емальованої тарілки набирали із середніх порцій стерильним (автоклавованим) дерев’яним шпателем у стерильні, ретельно вимиті пеніцилінові флакончики. Забраний матеріал невідкладно направляли для бактеріологічного і мікологічного дослідження у лабораторію клінічної імунології і мікробіології кафедри клінічної імунології, алергології та ендокринології Буковинського державного медичного університету. Результати враховували тільки в тих випадках, коли термін від взяття свіжого матеріалу до його бактеріологічного дослідження не перевищував дві години.
Вміст товстої кишки у стерильних умовах зважували на стерильному вощеному папері, відбирали 0,01 г у стерильну пробірку і додавали до нього 9,9 мл стерильного фізіологічного розчину натрію хлориду, одержуючи розведення матеріалу 1 : 10 (10–1). Із цієї суміші вмісту товстої кишки готували ряд послідовних серійних десятикратних розведень від 10–2 до 10–11 у стерильному ізотонічному розчині натрію хлориду. Відразу ж із кожного розведення відбирали стерильною мікропіпеткою 0,01 мл зависі мікробів, наносили на сектори твердого оптимального для кожного роду/виду мікроба поживного середовища і рівномірно розподіляли матеріал стерильним шпателем на поверхні середовища.
Посіви виставляли для росту і розмноження мікроорганізмів. Факультативні анаеробні та аеробні мікроорганізми інкубували у термостаті (температура 37 °C) протягом 24–48 годин. Облігатні анаеробні бактерії вирощували у стаціонарному анаеростаті СО2 incubator T‑125 фірми ASSAB (Швеція) протягом 5–7 діб. Після цього підраховували типові і не зовсім типові підозрілі колонії для кожного роду/виду мікроорганізмів. Із колоній одержували чисті культури облігатних та факультативних анаеробних і аеробних мікроорганізмів. Для встановлення належності бактерій до відповідного роду або виду визначали їх основні властивості. Ці властивості стосуються мікроскопічної морфології, тинкторіальних особливостей, характеру колоній і культивування, процесів обміну речовин (біохімічної характеристики). При ідентифікації бактерій використовували «Визначник бактерій Берджі» (1997) та «Зміни в таксономії і номенклатурі бактерій» (2004).
Враховуючи те, що число бактерій та дріжджоподібних грибів роду Candida на одиницю маси (грам) вмісту порожнини товстої кишки досягає мільйонів, мільярдів мікробних одиниць, для зручності викладу матеріалу і математично-статистичного опрацювання використовували десяткові логарифми кількісного показника вирощених колоній мікроорганізмів (lg КУО/г.)
Ентеробактерії вирощували на селективних середовищах Ендо, Левіна, Плоскірєва, стафілококи — на кров’яному м’ясо-пептонному агарі (КМПА) та середовищі Чапмена — Бериса, жовтково-сольовому МПА за Чистовичем, молочно-сольовому МПА; ентерококи — на жовчно-кров’яному МПА Беленького; дріжджоподібні гриби роду Candida — на твердому середовищі Сабуро та рисовому середовищі Левиної; анаероби — на кров’яному агарі Цейслера, кров’яному агарі для бактероїдів; лактобактерії — на середовищі Ленцнера; біфідобактерії — на середовищі Блаурока на печінковому відварі і на модифікованому середовищі Блаурока із додаванням до середовища азиду натрію (100 мг/л).
Одержані результати вивчення якісного і кількісного складу мікрофлори вмісту порожнини товстої кишки піддавалися математично-статистичному аналізу за допомогою стандартного пакета прикладних програм для медико-бiологiчних досліджень на персональному комп’ютері із застосуванням Microsoft office для Windows XP.
Результати
Ступінь тяжкості перебігу ЦД 1-го типу залежить не тільки від порушень вуглеводного обміну, а також від ступеня порушень функцій інших органів і систем — імунної, нервової, кардіоваскулярної та ін. Обстежених хворих розподілили на дві групи: з середньотяжкою (11 хворих) і тяжкою (39 хворих) формами перебігу.
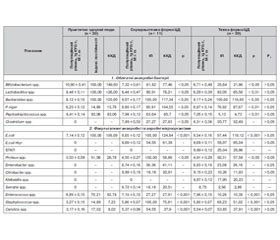
При перебігу середньої тяжкості ЦД 1-го типу у вмісті порожнини товстої кишки формується дефіцит автохтонних, найважливіших за представництвом у товстокишковому мікробіоценозі анаеробних бактерій роду Bifidobacterium — на 37,84 %, Lactobacillus — на 30,86 %, Peptostreptococcus — на 5,39 %, Enterococcus — на 12,39 %. При цьому зростає популяційний рівень умовно-патогенних бактерій роду Bacteroides — на 11,70 %, P.niger — на 42,70 %, E.coli — на 35,15 %, Proteus — на 28,90 %, Staphylococcus — на 79,20 %, дріжджоподібних грибів роду Candida. У порожнині товстої кишки хворих на ЦД 1-го типу із середньою формою тяжкості бактерії роду Clostridium, патогенні (E.coli Hly+) та умовно-патогенні (Enterobacter, Citrobacter, Serratia) досягають високого популяційного рівня.
Зміна якісного складу мікробіоти будь-якого біотопу завжди супроводжується змінами кількісного складу представників товстокишкового мікробіоценозу.
Мікробіота вмісту порожнини товстої кишки хворих на ЦД 1-го типу тяжкого ступеня перебігу характеризується більш глибокими порушеннями видового складу, які стосуються елімінації, у частини хворих, бактерій роду Bifidobacterium (74,36 %), Lactobacillus (17,45 %), Peptostreptococcus (69,34 %), E.coli (2,56 %), Enterococcus (59,45 %).
На такому тлі настає контамінація порожнини товстої кишки патогенними (E.coli Hly+, ентеропатогенні кишкові палички (ЕПКП)), умовно-патогенними (Enterobacter, Citrobacter, Serratia, Proteus) ентеробактеріями, а також умовно-патогенними бактеріями роду Clostridium, Staphylococcus і дріжджоподібними грибами роду Candida. Значно зростає кількість умовно-патогенних бактерій роду Bacteroides — на 12,43 %, P.niger — на 43,98 %, E.coli — на 33,61 %, Proteus — на 39,09 %, Staphylococcus — на 77,37 % і дріжджоподібних грибів роду Candida — на 74,76 %.
Результати вивчення видового складу і популяційного рівня мікробіоти вмісту порожнини товстої кишки хворих на ЦД 1-го типу залежно від тяжкості клінічного перебігу наведені в табл. 1.
Обговорення
Середній ступінь тяжкості ЦД 1-го типу супроводжується контамінацією порожнини товстої кишки хворих патогенними (E.coli Hly+, ЕПКП) та умовно-патогенними (бактерії роду Enterobacter, Citrobacter, Serratia, Proteus) ентеробактеріями, бактеріями роду Clostridium, Staphylococcus, P.niger, що змінює видовий склад мікробіоти біотопу. Домінантними мікроорганізмами у вмісті порожнини товстої кишки хворих на ЦД 1-го типу середнього ступеня тяжкості стають бактерії роду Bacteroides, Eсherichia, Proteus, Staphylococcus, Lactobacillus, Peptococcus, Bifidobacterium, Peptostreptococcus, ентеротоксигенні ешерихії і дріжджоподібні гриби роду Candida на відміну від резидентних бактерій.
Зміна видового складу, індексу домінування Бергера — Паркера, індексу постійності, коефіцієнта кількісного домінування і коефіцієнта значущості призводить до зміни ролі кожного компонента мікробіоценозу порожнини товстої кишки хворих на ЦД 1-го типу як із середнім, так і більшою мірою з тяжким ступенем перебігу.
Зниження функціональної ролі у мікробіоценозі біотопу та у мікроекологічній системі Bifidobacterium, Lactobacillus, Peptostreptococcus, Bacteroides, Enterococcus призвело до суттєвого зростання у мікробіоценозі порожнини товстої кишки хворого на ЦД 1-го типу із середньою формою тяжкості перебігу умовно-патогенних P.niger — у 7,59 раза, E.coli — на 17,67 %, Proteus — у 2,20 раза, Staphylococcus — у 10,49 раза і дріжджоподібних грибів роду Candida — у 4,73 раза. Значну роль у товстокишковому мікробіоценозі таких хворих відіграють патогенні (61,38 %) та умовно-патогенні (71,24 %) ентеробактерії та клостридії.
У хворих на ЦД 1-го типу із тяжкою формою перебігу у порожнині товстої кишки відзначається виражений (р < 0,05–0,001) дефіцит автохтонних облігатних бактерій роду Bifidobacterium — на 50,04 %, Lactobacillus — на 34,82 %, Peptostreptococcus — на 16,0 %, Enterococcus — на 11,68 %. Бактерії, які контамінували порожнину товстої кишки хворих на ЦД 1-го типу із тяжким перебігом: патогенні (E.coli, ентеропатогенні ешерихії), умовно-патогенні (Enterobacter, Citrobacter, Klebsiella, Serratia, Proteus) ентеробактерії, а також умовно-патогенні бактерії роду Clostridium, Staphylococcus і дріжджоподібні гриби роду Candida.
Висновки
1. Зміна видового складу, індексу домінування Бергера — Паркера, індексу постійності, коефіцієнта кількісного домінування і коефіцієнта значущості призводить до зміни ролі кожного компонента мікробіоценозу порожнини товстої кишки хворих на ЦД 1-го типу як із середнім, так і більшою мірою з тяжким перебігом.
2. У мікробіоценозі порожнини товстої кишки хворих на ЦД 1-го типу із середньою та тяжкою формою перебігу суттєво зростає рівень ентеротоксигенних і ентеротоксичних (61,38 %) та умовно-патогенних бактерій (71,24 %): P.niger — у 7,59 раза, E.coli — на 17,67 %, Proteus — у 2,20 раза, Staphylococcus — у 10,49 раза і дріжджоподібних грибів роду Candida — у 4,73 раза.
3. У хворих на ЦД 1-го типу середнього та тяжкого перебігу в порожнині товстої кишки відзначається виражений (р < 0,05–0,001) дефіцит облігатних бактерій роду Bifidobacterium — на 50,04 %, Lactobacillus — на 34,82 %, Peptostreptococcus — на 16,0 %, Enterococcus — на 11,68 %. З поглибленням тяжкості клінічного перебігу посилюється дефіцит та прогнозується чітка картина зниження ролі біфідо- та лактобактерій у товстокишковому мікробіоценозі.
Перспективи подальших досліджень: вивчити ефективність пробіотиків у комплексному лікуванні хворих на ЦД 1-го типу до, після та через 3 місяці після лікування на основі аналізу видового складу і популяційного рівня мікрофлори вмісту порожнини товстої кишки. Розробити лікувальну тактику гнійних синуїтів у пацієнтів з ЦД 1-го типу із включенням у схеми комплексного лікування пробіотиків.
Конфлікт інтересів. Автори констатують відсутність конфлікту інтересів при підготовці статті.
Список литературы
1. Мазур О.О. Стан мікробіоти порожнини товстого кишечника у хворих на цукровий діабет 1-го типу залежно від віку та тривалості захворювання / О.О. Мазур, О.Г. Плаксивий, Н.В. Пашковська, І.О. Білоока // Міжнародний ендокринологічний журнал. — 2016. — № 3(75). — С. 19-24.
2. Гавриленко О.М. Мікробіоценоз піднебінних мигдаликів у дітей, хворих на цукровий діабет 1 типу, з наявністю хронічного тонзиліту / О.М. Гавриленко, А.А. Лайко, О.М. Головня // Журнал вушних, носових і горлових хвороб. — 2014. — № 5. — С. 49-54.
3. Conlon M., Bird A. The impact of diet and lifestyle on gut microbiota and human health // Nutrients. — 2014. — Vol. 7. — P. 17-44.
4. Mejía-León M.E., de la Barca C. Diet, microbiota and immune system in type 1 diabetes development and evolution // Nutrients. — 2015. — Vol. 7(11). — P. 9171-9184.
5. Gülden E., Wong F.S., Wen L. The gut microbiota and Type 1 Diabetes // Clin. Immunol. — 2015. — Vol. 159(2). — P. 143-153.
6. He C., Shan Y., Song W. Targeting gut microbiota as a possible therapy for diabetes // Nutr. Res. — 2015. — Vol. 35(5). — P. 361-367.
7. Wen L., Ley R.E., Volchkov P.Y. et al. Innate immunity and intestinal microbiota in the development of type 1 diabetes // Nature. — 2008. — Vol. 455. — P. 1109-1113.
8. Vaarala O. Is the origin of type 1 diabetes in the gut? // Immunol. Cell Biol. — 2012. — Vol. 90. — P. 271-276.
9. Vaarala O., Atkinson M.A., Neu J. The «perfect storm» for type 1 diabetes: The complex interplay between intestinal microbiota, gut permeability, and mucosal immunity // Diabetes. — 2008. — Vol. 57. — P. 2555-2562.
10. Virtanen S.M., Nevalainen J., Kronberg-Kippilä C. et al. Food consumption and advanced β cell autoimmunity in young children with HLA-conferred susceptibility to type 1 diabetes: A nested case-control design // Am. J. Clin. Nutr. — 2012. — Vol. 95. — P. 471-478.
11. Davis-Richardson A., Triplett E. A model for the role of gut bacteria in the development of autoimmunity for type 1 diabetes // Diabetologia. — 2015. — Vol. 58. — P. 1386-1393.
12. Giongo A., Gano K.A., Crabb D.B. et al. Toward defining the autoimmune microbiome for type 1 diabetes // ISME J. — 2011. — Vol. 5. — P. 82-91.
13. De Goffau M.C., Luopajärvi K., Knip M. et al. Fecal microbiota composition differs between children with β-cell autoimmunity and those without // Diabetes. — 2013. — Vol. 62. — P. 1238-1244.
14. Alkanani A.K., Hara N., Gottlieb P.A. et al. Alterations in intestinal microbiota correlate with susceptibility to type 1 diabetes // Diabetes. — 2015. — Vol. 64. — P. 3510-3520.
15. Murri M., Leiva I., Gomez-Zumaquero J.M. et al. Gut microbiota in children with type 1 diabetes differs from that in healthy children: A case-control study // BMC Med. — 2013. — Vol. 11. — doi: 10.1186/1741-7015-11-46.
16. Skyler J.S. Toward primary prevention of type 1 diabetes // JAMA. — 2015. — Vol. 313. — P. 1520-1521.

/64.jpg)