Международный эндокринологический журнал 5 (77) 2016
Вернуться к номеру
Особливості формування окисного стресу у хворих на цукровий діабет 2-го типу залежно від тривалості захворювання та статі
Авторы: Мокрій В.Я., Зябліцев С.В., Кришталь М.В. - Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
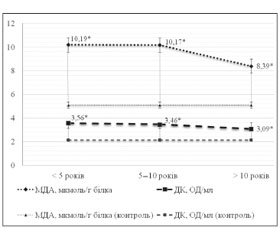
Вступ. Захворюваність на цукровий діабет (ЦД) 2-го типу невпинно зростає як в Україні, так і в усьому світі. Тяжкість даної патології визначається кількістю ускладнень, в основі яких лежать процеси перекисного окислення ліпідів (ПОЛ). Метою даного дослідження стало визначення етапів формування окисного стресу за показниками ПОЛ та активності антиоксидантних систем (АОС) у хворих на цукровий діабет (ЦД) 2-го типу залежно від тривалості захворювання та статі. Матеріали і методи. Вивчена інтенсивність процесів ПОЛ та активність АОС у 88 хворих на ЦД 2-го типу та в 50 осіб, які не його не мали, залежно від тривалості захворювання та статі. Результати. Отримані нами дані свідчать, що максимальна інтенсифікація ПОЛ (вміст у крові дієнових кон’югат та малонового діальдегіду) відбувається в перші 5 років з моменту діагностування ЦД 2-го типу. Активність АОС (активність супероксиддисмутази й каталази та рівень у крові α-токоферолу) також досягає максимальних значень у перші 5 років хвороби, а в період 5–10 та більше 10 років вірогідно знижується при достатньо високій інтенсивності ПОЛ. Висновки. У жінок, які хворіли понад 10 років, відзначається значуще зниження утворення малонового діальдегіду порівняно з чоловіками, тоді як динаміка активності АОС суттєво не відрізнялась залежно від статі хворих.
Введение. Заболеваемость сахарным диабетом (СД) 2-го типа неуклонно растет как в Украине, так и во всем мире. Тяжесть данной патологии определяется количеством осложнений, в основе которых лежат процессы перекисного окисления липидов (ПОЛ). Цель исследования — изучить интенсивность процессов ПОЛ и активность антиоксидантных систем (АОС) у 88 больных с СД 2-го типа и 50 человек, которые им не болеют, в зависимости от длительности заболевания и пола. Результаты. Полученные нами данные свидетельствуют, что максимальная интенсификация ПОЛ (содержание в крови диеновых конъюгат и малонового диальдегида) происходит в первые 5 лет с момента диагностирования СД 2-го типа. Активность АОС (активность супероксиддисмутазы и каталазы, а также уровень в крови α-токоферола) также достигает максимальных значений в первые 5 лет болезни, а в период 5–10 и более 10 лет достоверно снижается при достаточно высокой интенсивности ПОЛ. Выводы. У женщин, которые болели более 10 лет, отмечено значимое снижение образования малонового диальдегида по сравнению с мужчинами, тогда как динамика активности АОС существенно не отличалась в зависимости от пола больных.
Background. The incidence of type 2 diabetes is increasing in Ukraine and worldwide. The severity of this disease is determined by the number of complications, with lipid peroxidation (LPO) underlying. The aim of the study was to study the intensification of LPO and antioxidant systems (AOS) in 88 patients with type 2 diabetes mellitus (T2DM) and 50 people without the disease, depending on the duration of the illness and gander. Results. Our data indicate that the maximum intensification of LPO (blood levels of conjugated dienes and malondialdehyde) occurs within the first 5 years after diagnosis of T2DM. AOS activity (blood activity of superoxide dismutase and catalase and alfa-tocopherol blood level) reaches maximum values within the first 5 years of disease, and in 5–10 and more than 10 years significantly reduced at rather high intensity of LPO. Conclusions. Women with disease duration more than 10 years had significant reduction in the formation of malondialdehyde as compared to men, while dynamics of AOC activity did not significantly differ depending on the gender.
цукровий діабет 2-го типу, перекисне окислення ліпідів, тривалість захворювання, стать.
сахарный диабет 2-го типа, перекисное окисление липидов, длительность заболевания, пол.
type 2 diabetes mellitus, lipid peroxidation, disease duration, gender.
Статтю опубліковано на с. 67-71
Вступ
Матеріал і методи
Результати дослідження
/68.jpg)
Обговорення результатів дослідження
/69_2.jpg)
Висновки
1. Global status report on noncommunicable diseases 2014. Geneva, World Health Organization, 2014 — Р. 14. — Режим доступу: http://apps.who.int/iris/bitstream/10665/148114/1/9789241564854_eng.pdf
2. Паньків В.І. Шляхи удосконалення тактики надання допомоги хворим на цукровий діабет в амбулаторних умовах (фармакоепідеміологічний підхід) / В.І. Паньків // Здоров’я України ХХІ сторіччя. — 2015. — № 1. — С. 23-24.
3. Соколова Л.К. Сахарный диабет 2-го типа. Роль семейного врача / Л.К. Соколова // Укр. мед. часопис. — 2012. — № 1(87). — С. 70-73.
4. Попова Т.Н. Интенсивность свободнорадикальных процессов в печени крыс при сахарном диабете 2 типа и введении эпифамина / Т.Н. Попова, А.А. Агарков, А.Н. Веревкин // Экспериментальные статьи. — 2013. — № 4(19). — С. 129-134.
5. Ishonina O.G. Comparative characteristics of antioxidant status in women with diabetes type 2 of different age groups / O.G. Ishonina, Z.I. Mikashinovich, E.V. Olempieva, T.D. Kovalenko // Adv. Gerontol. — 2011. — № 24(4) — Р. 645-649.
6. Бардымова Т.П. Перекисное окисление липидов, антиоксидантная система у больных сахарным диабетом ІІ типа // Т.П. Бардымова, Л.И. Колесникова, В.А. Петрова // Бюллетень ВСНЦ СО РАМН. — 2005. — № 6(44). — С. 50-54.
7. Сорокина Ю.А. Коэффициенты окислительного стресса как способ персонифицирования фармакотерапии в дебюте СД 2 типа / Ю.А. Сорокина, Л.В. Ловцова // Universum: Медицина и фармакология: Эл. научн. журн. — 2015. — № 1(14). — Режим доступу: http://7universum.com/ru/med/archive/item/1868
8. Балаболкин М.И. Лечение сахарного диабета и его осложнений // М.И. Балаболкин, Е.М. Клебанова, В.М. Креминская. — М.: Медицина, 2005. — 325 с.
9. Балаболкин М.И. Роль гликирования белков, окислительного стресса в патогенезе сосудистых осложнений при сахарном диабете / М.И. Балаболкин // Сахарный диабет. — 2002. — № 4. — С. 5-16.
10. Занозина О.В. «Порочный круг» взаимосвязи перекисного окисления липидов и окислительной модификации белков у больных сахарным диабетом 2 типа / О.В. Занозина, Ю.А. Сорокина, Н.Н. Боровков, Т.Г. Щербатюк // Медицинский альманах. — 2013. — № 6. — С. 167-170.
11. Ланкин В.З. Особенности модификации липопротеинов низкой плотности в развитии атеросклероза и сахарного диабета типа 2 / В.З. Ланкин, А.К. Тихазе, Е.М. Кумскова // Кардиологический вестник. — 2008. — T. 3, № 1. — С. 60-67.
12. Занозина О.В. Роль окислительного стресса в развитии и прогрессировании поздних осложнений сахарного диабета 2-го типа. Возможности антиоксидантной терапии / О.В. Занозина // Международный эндокринологический журнал. — 2010. — № 7(31) — С. 127-136.
13. Tappia P.S. Oxidative stress and redox regulation of phospholipase D in myocardial disease / P.S. Tappia, M.R. Dent, N.S. Dhalla // Free Radic. Biol. Med. — 2006. — Vol. 41. — P. 349-361.
14. Гаврилов В.Б. Спектрофотометрическое определение содержания гидроперекисей липидов в плазме крови / В.Б. Гаврилов, М.И. Мишкорудная // Лаб. дело. — 1983. — № 3. — С. 33-36.
15. Гончаренко М.С. Метод оценки перекисного окисления липидов / М.С. Гончаренко, А.М. Латинова // Лаб. дело. — 1985. — № 1. — С. 60-61.

/68_2.jpg)
/69.jpg)