Международный эндокринологический журнал 5 (77) 2016
Вернуться к номеру
Вплив призначення вітаміну D на рівень антитіл до тиреоїдної пероксидази у хворих на гіпотиреоз автоімунного генезу
Авторы: Паньків І.В. - ВДНЗ України «Буковинський державний медичний університет», м. Чернівці, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
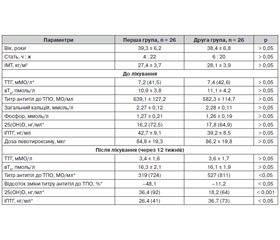
Незважаючи на вивчення взаємозв’язків між дефіцитом і недостатністю вітаміну D з автоімунною тиреоїдною патологією, вплив додаткового призначення препаратів цього вітаміну при такій патології не з’ясований. Метою дослідження було вивчення впливу вітаміну D на вміст антитіл до тиреоїдної пероксидази (ТПО) у хворих на вперше виявлений гіпотиреоз на ґрунті автоімунного тиреоїдиту (АІТ). Матеріали та методи. Під спостереженням перебували 52 пацієнти із вперше виявленим гіпотиреозом на ґрунті АІТ, які були рандомізовані на дві групи. Хворі першої групи додатково отримували холекальциферол у дозі 2000 МО/добу (14 000 МО/тижд) і препарати кальцію в дозі 1000 мг/добу протягом 12 тижнів. Хворим другої групи було призначено на тлі левотироксину лише препарати кальцію в дозі 1000 мг/добу протягом 12 тижнів. Позитивним результатом лікування вважали зниження титру антитіл до ТПО принаймні на 25 %. Результати. У 94,2 % хворих на гіпотиреоз установлено дефіцит і недостатність вітаміну D. У хворих на гіпотиреоз відзначається вірогідна негативна кореляція між рівнем 25(ОН)D і титром антитіл до ТПО (r = –0,172; р = 0,046). Додаткове призначення вітаміну D призвело до вірогідного зниження рівня антитіл до ТПО (–48,1 %) у хворих на гіпотиреоз. Загалом зменшення рівня антитіл до ТПО на 25 % і більше досягнуто в 73,1 % хворих. Призначення препарату вітаміну D сприяло вірогідному підвищенню вмісту 25(OH)D у сироватці крові з відповідним зниженням концентрації інтактного паратгормону у хворих на гіпотиреоз на ґрунті АІТ. Висновки. Установлено позитивний вплив додаткового призначення вітаміну D на рівень антитіл до ТПО у хворих на гіпотиреоз автоімунного генезу.
Несмотря на изучение взаимосвязей между дефицитом и недостаточностью витамина D с аутоиммунной тиреоидной патологией, влияние дополнительного назначения препаратов этого витамина при такой патологии не выяснен. Целью исследования было изучение влияния витамина D на содержание антител к тиреоидной пероксидазе (ТПО) у больных с впервые выявленным гипотиреозом на почве аутоиммунного тиреоидита (АИТ). Материалы и методы. Под наблюдением находились 52 пациента с впервые выявленным гипотиреозом вследствие АИТ, которые были рандомизированы на две группы. Больные первой группы дополнительно получали холекальциферол в дозе 2000 МЕ/сут (14 000 МЕ/нед) и препараты кальция в дозе 1000 мг/сут в течение 12 недель. Больным второй группы были назначены на фоне левотироксина лишь препараты кальция в дозе 1000 мг/сут в течение 12 недель. Положительным результатом лечения считали снижение титра антител к ТПО по крайней мере на 25 %. Результаты. У 94,2 % больных гипотиреозом установлен дефицит витамина D. У больных гипотиреозом установлена достоверная отрицательная корреляция между уровнем 25(ОН)D и титром антител к ТПО (r = –0,172; р = 0,046). Дополнительное назначение витамина D привело к достоверному снижению уровня антител к ТПО (–48,1 %) у больных гипотиреозом. В целом уменьшение уровня антител к ТПО на 25 % и больше достигнуто у 73,1 % больных. Назначение препарата витамина D привело к достоверному повышению содержания 25(OH)D в сыворотке крови с соответствующим снижением концентрации интактного паратгормона у больных гипотиреозом на почве АИТ. Выводы. Установлено положительное влияние дополнительного назначения витамина D на уровень антител к ТПО у больных гипотиреозом аутоиммунного генеза.
In spite of studying the relationship between the deficiency and the lack of vitamin D in autoimmune thyroid disorders, the effect of additional administration of the preparations of this vitamin has not been clear in such pathology. The aim of study was to investigate the effect of vitamin D on the content of thyroid peroxidase antibodies (TPO) in patients with newly diagnosed hypothyroidism on the background of autoimmune thyroiditis (AIT). Materials and methods. The study included 52 patients with newly diagnosed hypothyroidism on the background of AIT, who were randomized into two groups. Patients of the first group additionally received cholecalciferol 2000 IU/day (14 000 IU/week) and calcium preparations in a dose of 1000 mg/day for 12 weeks. Patients of the second group were administered only calcium preparations at a dose of 1000 mg/day for 12 weeks in addition to levothyroxine. A positive result of treatment was considered a reduction of antibodies to TPO of at least 25 %. Results. 94.2 % of patients with hypothyroidism had the deficiency and the lack of vitamin D. In patients with hypothyroidism, there was a significant negative correlation between the levels of 25(OH)D and the titer of antibodies to TPO (r = –0.172; p = 0.046). Vitamin D supplementation resulted in a significant decrease of the level of antibodies to TPO (–48.1 %) in patients with hypothyroidism. In general, lowering the level of antibodies to TPO by 25 % or more has been achieved in 73.1 % of patients. Administration of vitamin D contributed to a significant increase of the content of 25(OH)D in the blood serum with a corresponding reduction in the concentration of intact parathyroid hormone in patients with hypothyroidism resulted from AIT. Conclusions. The positive effect of supplemental vitamin D has been established in terms of the level of antibodies to TPO in patients with autoimmune hypothyroidism.
гіпотиреоз, автоімунний тиреоїдит, вітамін D.
гипотиреоз, аутоиммунный тиреоидит, витамин D.
hypothyroidism, autoimmune thyroiditis, vitamin D.
Статтю опубліковано на с. 78-82
Вступ
Матеріали та методи
Результати дослідження
Обговорення результатів
Висновки
1. Reichrath J., Zouboulis C., Vogt T., Holick M. Targeting the vitamin D endocrine system (VDES) for the management of inflammatory and malignant skin diseases: An historical view and outlook // Rev. Endocr. Metab. Disord. — 2016. — Vol. 17. Epub ahead of print.
2. Muscogiuri G., Mitri J., Mathieu C. et al. Mechanisms in endocrinology: vitamin D as a potential contributor in endocrine health and disease // Eur. J. Endocrinol. — 2014. — Vol. 171. — P. 101-110.
3. Rosen C.J., Adams J.S., Bikle D.D. et al. The nonskeletal effects of vitamin D: an Endocrine Society scientific statement // Endocr. Rev. — 2012. — Vol. 33. — P. 456-492.
4. Dutta D., Mondal S.A., Choudhuri S. et al. Vitamin-D supplementation in prediabetes reduced progression to type 2 diabetes and was associated with decreased insulin resistance and systemic inflammation: An open label randomized prospective study from Eastern India // Diabetes Res. Clin. Pract. — 2014. — Vol. 103. — P. 18-23.
5. D’Aurizio F., Villalta D., Metus P. et al. Is vitamin D a player or not in the pathophysiology of autoimmune thyroid diseases? // Autoimmun. Rev. — 2015. — Vol. 14(5). — P. 363-369.
6. Tamer G., Arik S., Tamer I., Coksert D. Relative Vitamin D insufficiency in Hashimoto’s thyroiditis // Thyroid. — 2011. — Vol. 21. — P. 891-896.
7. Kivity S., Agmon-Levin N., Zisappl M. et al. Vitamin D and autoimmune thyroid diseases // Cell. Mol. Immunol. — 2011. — Vol. 8. — P. 243-247.
8. Ma J., Wu D., Li C. et al. Lower serum 25-hydroxyvitamin D level is associated with 3 types of autoimmune thyroid diseases // Medicine (Baltimore). — 2015. — Vol. 94(39). — P. 1639.
9. Caturegli P., De Remigis A., Rose N.R. Hashimoto thyroiditis: clinical and diagnostic criteria // Autoimmun. Rev. — 2014. — Vol. 13(4–5). — P. 391-397.
10. Kienreich K., Tomaschitz A., Verheyen N. et al. Vitamin D and cardiovascular disease // Nutrients. — 2013. — Vol. 5(8). — P. 3005-3021.
11. Wang J., Li S., Chen G. et al. Meta-analysis of the association between vitamin D and autoimmune thyroid disease // Nutrients. — 2015. — Vol. 7. — P. 2485-2498.
12. Choi Y.M., Kim W.G., Kim T.Y. et al. Low levels of serum Vitamin D3 are associated with autoimmune thyroid disease in pre-menopausal women // Thyroid. — 2014. — Vol. 24. — P. 655-661.
13. Chailurkit L.O., Aekplakorn W., Ongphiphadhanakul B. High Vitamin D status in younger individuals is associated with low circulating thyrotropin // Thyroid. — 2013. — Vol. 23. — P. 25-30.
14. Zhang Q., Wang Z., Sun M. et al. Association of high Vitamin D status with low circulating thyroid-stimulating hormone independent of thyroid hormone levels in middle-aged and elderly males // Int. J. Endocrinol. — 2014. — 631819.
15. Effraimidis G., Badenhoop K., Tijssen J.G., Wiersinga W.M. Vitamin D deficiency is not associated with early stages of thyroid autoimmunity // Eur. J. Endocrinol. — 2012. — Vol. 167. — P. 43-48.
16. Zhang H., Liang L., Xie Z. Low Vitamin D status is associated with increased thyrotropin-receptor antibody titer in Graves disease // Endocr. Pract. — 2015. — Vol. 21. — P. 258-263.
17. Goswami R., Marwaha R.K., Gupta N. et al. Prevalence of Vitamin D deficiency and its relationship with thyroid autoimmunity in Asian Indians: A community-based survey // Br. J. Nutr. — 2009. — Vol. 102. — P. 382-386.

/80.jpg)