Резюме
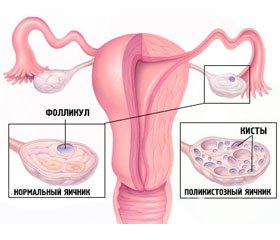
Синдром полікістозних яєчників (СПКЯ) — найчастіша форма ендокринопатії, що зустрічається в 5–10 % жінок репродуктивного віку і становить до 80 % від усіх форм гіперандрогенії. Мета дослідження — вивчити функціональний стан осі «гіпофіз — гонади» у жінок із СПКЯ. Матеріал і методи. Під спостереженням амбулаторно в період з вересня 2015 до липня 2016 року обстежено 120 пацієнток фертильного віку із СПКЯ. Пацієнтки були розподілені на групу з первинним безпліддям (94 випадки) і групу хворих із вторинним безпліддям (26 випадків). Середній вік хворих становив 25,5 ± 4,3 року. Тривалість захворювання перебувала в межах від 7 місяців до 9 років. 20 здорових жінок відповідного віку становили групу контролю. Усім хворим виконувався комплекс досліджень, що містив загальноклінічні, біохімічні (глюкоза крові, тест толерантності до глюкози), гормональні, ультразвукове дослідження матки та яєчників (трансабдомінально і трансвагінально) на 14-й день циклу з фолікулометрією в динаміці, а також магнітно-резонансна томографія турецького сідла і анкетування пацієнтів. Результати. У групі пацієнток із первинним безпліддям відзначалося вірогідне зниження рівнів як гіпофізарних, так і оваріальних гормонів на тлі гіперандрогенії та гіперпролактинемії. Порівняно з групою контролю на 14-й день циклу були вірогідно знижені рівні лютеїнізуючого, фолікулостимулюючого гормонів, а також естрадіолу, прогестерону, тоді як показники вільного тестостерону, дегідроепіандростерону були підвищені. У другій групі пацієнток також було виявлено вірогідне зниження рівнів гіпофізарних гормонів на тлі гіперандрогенії і гіперпролактинемії, тоді як оваріальна функція перебувала в межах норми. Порівняно з групою контролю на 14-й день циклу були вірогідно знижені рівні лютеїнізуючого, фолікулостимулюючого гормонів, при цьому показники вільного тестостерону, дегідроепіандростерону й антимюллерова гормона були підвищені. Нейровізуалізація гіпофіза в пацієнток із СПКЯ виявила у багатьох випадках гіперплазію гіпофіза, а також синдром порожнього турецького сідла та мікроаденоми гіпофіза. Висновки. У групі пацієнток із первинним безпліддям відзначалося вірогідне зниження рівнів як гіпофізарних, так і оваріальних гормонів на тлі гіперандрогенії і гіперпролактинемії. У групі пацієнток із вторинним безпліддям також виявлено вірогідне зниження показників гіпофізарних гормонів на тлі гіперандрогенії і гіперпролактинемії, однак оваріальна функція перебувала в межах норми. В обох групах хворих відзначалася гіпогонадотропінемія, що поєднувалася з помірною гіперпролактинемією і гіперандрогенією.
Синдром поликистозных яичников (СПКЯ) является наиболее частой формой эндокринопатии, встречается у 5–10 % женщин репродуктивного возраста и составляет 80 % от всех форм гиперандрогении. Цель исследования — изучить функциональное состояние оси «гипофиз — гонады» у женщин с СПКЯ. Материал и методы. Под наблюдением амбулаторно в период с сентября 2015 по июль 2016 года было обследовано 120 пациенток фертильного возраста с СПКЯ. Пациентки были разделены на группу с первичным бесплодием (94 случая) и группу больных с вторичным бесплодием (26 случаев). Средний возраст больных составил 25,5 ± 4,3 года. Давность заболевания колебалась в пределах от 7 месяцев до 9 лет. 20 здоровых женщин соответствующего возраста составили группу контроля. Всем больным выполнялся комплекс исследований, включавший общеклинические, биохимические (глюкоза крови, тест толерантности к глюкозе), гормональные, ультразвуковое исследование матки и яичников (трансабдоминально и трансвагинально) на 14-й день цикла с фолликулометрией в динамике, а также магнитно-резонансная томография турецкого седла и анкетирование пациентов. Результаты. В группе пациенток с первичным бесплодием отмечалось достоверное снижение уровней как гипофизарных, так и овариальных гормонов на фоне гиперандрогении и гиперпролактинемии. По сравнению с группой контроля на 14-й день цикла были достоверно снижены уровни лютеинизирующего, фолликулостимулирующего гормонов, а также эстрадиола, прогестерона, в то время как показатели свободного тестостерона, дегидроэпиандростерона были повышены. Во второй группе пациенток также было выявлено достоверное снижение уровней гипофизарных гормонов на фоне гиперандрогении и гиперпролактинемии, в то время как овариальная функция была в пределах нормы. По сравнению с группой контроля на 14-й день цикла были достоверно снижены уровни лютеинизирующего, фолликулостимулирующего гормонов, при этом показатели свободного тестостерона, дегидроэпиандростерона и антимюллерова гормона были повышены. Нейровизуализация гипофиза у пациенток с СПКЯ выявила во многих случаях гиперплазию гипофиза, а также синдром пустого турецкого седла и микроаденомы гипофиза. Выводы. В группе пациенток с первичным бесплодием отмечалось достоверное снижение уровней как гипофизарных, так и овариальных гормонов на фоне гиперандрогении и гиперпролактинемии. В группе пациенток с вторичным бесплодием также выявлено достоверное снижение показателей гипофизарных гормонов на фоне гиперандрогении и гиперпролактинемии, однако овариальная функция была в пределах нормы. В обеих группах больных имела место гипогонадотропинемия, сочетающаяся с умеренной гиперпролактинемией и гиперандрогенией.
Background. The polycystic ovary syndrome (PCOS) is the most frequent form of endocrine pathology and occurs in 5–10 % women of reproductive age and makes up 80 %, and according to some data, even 90 % of all forms of hyperandrogenism. The information about pathogenesis of PCOS is contradictory. The main step of the SPCO pathogenesis is hyperproduction of LH of by the hypophysis, revealed in 40–80 % patients. According to one of numerous theories, an increase secretion results in the increase of LH by the hypothalamus of the gonadotropin-releasing hormone (GRH), secreted in the discrete mode under control sexual steroid hormones, monoamines and opioid peptides. The aim of the investigation is to study the functional status of hypophysis — gonads axis for women with SPCO. Material and methods. In the department of neuroendocrinology of the Center of Endocrinology of Health Ministry of the Republic of Uzbekistan in a period from September 2015 till July 2016 120 outpatients of fertile age with PCOS were inspected. Mean age of patients was 25.5 ± 4.3 years. The duration of the disease hesitated from 7 months to 9 years. 20 healthy women of corresponding age made a control group. The complex of researches, including clinical, biochemical (glycemia, glucose tolerance test), hormonal (LH, FSH, prolactin, estradiol, progesterone, dehydroepiandrostendion (ДGEA), 17-oxyprogesterone, аntimuller hormone (АМH), insulin) was performed in all patients, ultrasonic examination of uterus and ovaries (transabdominal and transvaginal) on the 14th day of cycle with folliculometria in dynamics, and also magnetically-resonant tomography of hypophysis and questionnaire of patients were carried out. Results. Patients were divided into two groups: with primary sterility (94 cases) and with secondary sterility (26 cases). In the first group of patients with primary sterility the reliable decline of both pituitary and ovarian hormones was determined on a background of hyperandrogenemia and hyperprolactinemia. So, as compared to the group of control on the 14th day of cycle LH, FSH, and estradiol, progesterone, while free testosterone, DGEA were enhanced as compared to control data. In the second group of patients the reliable decline of pituitary hormones was also educed on a background of hyperandrogenemia and hyperprolactinemia while an ovarian function was within the normal limits. So, as compared to the group of control on the 14th day of cycle the LH, FSH, here free testosterone, DGEA and АМH levels were enhanced as compared to control data. The neuroimaging of hypophysis in patients with PCOS educed hyperplasia (adenomatosis) of hypophysis in 49 from 120 (40.8 %), that can be explained by ovarian insufficiency in these patients. On the second place by incidence there was the syndrome of the empty sella (26 cases, 21.6 %), and on the third — the microadenoma of hypophysis in 16 persons (13.3 %). Conclusions. In the first group of patients with primary sterility the reliable decline of both pituitary and ovarian hormones was marked on a background of hyperandrogenemia and hyperprolactinemia. In the second group of patients the significant decline of pituitary hormones was also educed on a background of hyperanrogenemia and hyperprolactinemia, while an ovarian function was within the normal limits. In both groups of patients hypogonadotropinemia occurred combined with moderate hyperprolactinemia and hyperandrogenemia. Thus, the most expressed violations of the system of pituitary — ovarian function were found out in the first group of patients with PCOS with primary sterility, at that the significant decline of the functional status of pituitary — gonads axis was marked, namely decline of LH, FSH, estradiol and progesterone levels on the 14th day of menstrual cycle, that was confirmed by ultrasouns examination of uterus and ovaries by impoverishment of follicle vehicle of ovaries, anovulation signs. Thus, the most expressed violations of the system of pituitary-ovarial function were found out in the first group of patients with PCOS with primary sterility, at that the significant decline of the functional state of hypophysis-gonads was marked, namely decline of LH, FSH, estradiol and progesterone levels that was confirmed by ultrasound investigation of uterus and ovaries.
Статтю опубліковано на с. 71-76
Введение
Синдром поликистозных яичников (СПКЯ) является наиболее частой формой эндокринопатии, встречается у 5–10 % женщин репродуктивного возраста и составляет 80 %, а по некоторым данным — даже 90 % от всех форм гиперандрогении [1, 2]. Центральным звеном патогенеза СПКЯ является гиперпродукция лютеинизирующего гормона (ЛГ) гипофизом, выявляемая у 40–80 % больных [3]. По одной из многочисленных теорий [7], к повышению уровня ЛГ приводит усиленная секреция гипоталамусом гонадотропин-рилизинг гормона, секретирующегося в дискретном режиме под контролем половых стероидных гормонов, моноаминов и опиоидных пептидов. Определенное значение в развитии СПКЯ отводится овариальным факторам, например гиперпродукции яичниками ингибина, избирательно тормозящего секрецию фолликулостимулирующего гормона (ФСГ) гипофизом [9, 10].
Известно, что при СПКЯ отмечается резистентность к инсулину, результатом которой является гиперинсулинемия [11, 12]. Тека-клетки яичников имеют рецепторы к инсулину, кроме того, инсулин повышает образование инсулиноподобного фактора роста 1 (ИФР‑1), усиливающего синтез андрогенов в клетках теки и интерстициальной ткани яичников [13]. Инсулин, кроме того, снижает уровень стероидсвязывающего глобулина и, следовательно, повышает уровень свободного, биологически активного тестостерона [14]. Роль жировой ткани в метаболизме половых гормонов известна, и доказано, что стромальные клетки жировой ткани обладают ароматазной активностью. Это способствует образованию эстрогенов из андрогенов, а именно — превращению андростендиона в эстрон. Действие этих ферментов усиливается под влиянием инсулина и ИФР‑1, подобно тому, как это происходит в яичниках [15, 16].
Несмотря на сложность строения репродуктивной системы, основной формой ее нарушения является ановуляция. Клиническими формами проявления нарушения функции репродуктивной системы являются ановуляторное бесплодие и нарушение менструального цикла — от аменореи до ациклических маточных кровотечений.
Для лечения бесплодия у женщин с СПКЯ используют различные методы индукции овуляции. Однако индукция овуляции у женщин с СПКЯ менее эффективна, чем при других формах ановуляторного бесплодия, и относительно часто осложняется развитием синдрома гиперстимуляции яичников. Использование аналогов соматостатина в терапии СПКЯ приводит к снижению уровня ИФР‑1, инсулина и андрогенов в крови, повышению секреции ИФР‑1, а применение октреотида на фоне стимуляции овуляции гонадотропинами приводит к снижению частоты развития СГЯ [11].
Исходя из действительно существующих проблем, необходимо отметить, что СПКЯ как медико-социальная проблема продолжает оставаться малоизученной. На сегодняшний день нет точного понимания механизмов развития репродуктивных нарушений, особенно у женщин фертильного возраста. До конца не изучена роль ИФР‑1, соматотропного гормона, их значимость при развитии как СПКЯ, так и его репродуктивных осложнений. Неизвестно также, может ли уровень соматотропного гормона, ИФР‑1 в сыворотке крови быть диагностическим маркером ожирения, его активности.
Цель исследования: изучить функциональное состояние оси «гипофиз — гонады» у женщин с СПКЯ.
Материал и методы
Под нашим наблюдением амбулаторно в отделе нейроэндокринологии РСНПМЦ эндокринологии МЗ РУз в период с сентября 2015 по июль 2016 года было обследовано 120 пациенток фертильного возраста с СПКЯ. Средний возраст больных составил 25,5 ± 4,3 года. Давность заболевания колебалась в пределах от 7 месяцев до 9 лет. 20 здоровых женщин аналогичного возраста составили группу контроля.
Всем больным выполнялся комплекс исследований, включавший общеклинические (общий анализ крови и мочи), биохимические (глюкоза крови, тест толерантности к глюкозе), гормональные (определение уровня ЛГ, ФСГ, пролактина, эстрадиола, прогестерона, свободного тестостерона, дегидроэпиандростендиона (ДГЭА), 17-оксипрогестерона (17-ОКС), антимюллерова гормона (АМГ), инсулина), ультразвуковое исследование матки и яичников (трансабдоминально и трансвагинально) на 14-й день цикла с фолликулометрией в динамике, а также магнитно-резонансная томография (МРТ) турецкого седла и анкетирование пациентов.
Полученные данные обрабатывали с помощью компьютерных программ Microsoft Excel и Statistica 6. Достоверность различий количественных показателей (n > 12) определяли по методу Вилкоксона для несвязанных диапазонов, для определения достоверности малых выборок (n < 12) использовали непараметрический критерий рандомизации компонент Фишера для независимых выборок, для качественных значений применяли точный критерий Фишера — Ирвина. Различия между группами считали статистически значимыми при р < 0,05. Вычислялись средние значения (М) и стандартные отклонения средних (m).
Результаты исследования
Пациентки были разделены на две группы: первую — с первичным бесплодием (94 случая), вторую — с вторичным бесплодием (26 случаев). В табл. 1 приведена частота различных нейроэндокринных нарушений по группам больных.
Для более углубленного анализа нами выполнены исследования средних значений базальных уровней гормонов плазмы крови (на 14-й день цикла), что представлено в табл. 2 и 3.
Как видно из табл. 2, в первой группе пациенток отмечалось достоверное снижение уровней как гипофизарных, так и овариальных гормонов на фоне гиперандрогении и гиперпролактинемии. Так, по сравнению с группой контроля на 14-й день цикла были достоверно снижены уровни ЛГ, ФСГ, а также эстрадиола, прогестерона, в то же время показатели свободного тестостерона и ДГЭА были повышены.
Во второй группе пациенток также было выявлено достоверное снижение уровней гипофизарных гормонов на фоне гиперандрогении и гиперпролактинемии, в то время как овариальная функция находилась в пределах нормы. Так, по сравнению с группой контроля на 14-й день цикла были достоверно снижены показатели ЛГ, ФСГ, при этом уровни свободного тестостерона, ДГЭА и АМГ были повышены.
В табл. 4 приведена характеристика данных МРТ гипофиза у обследованных больных.
Нейровизуализация гипофиза у пациенток с СПКЯ выявила во многих случаях гиперплазию (аденоматоз) гипофиза — у 49 из 120 (40,8 %), что можно объяснить яичниковой недостаточностью у этих больных. На втором месте по частоте встречаемости — СПТС (синдром пустого турецкого седла; 26 случаев (21,6 %)) и на третьем — микроаденома гипофиза (16 случаев (13,3 %)).
Обсуждение результатов
Как показали проведенные нами исследования, у женщин, страдающих различной степенью ожирения, имеющих явные репродуктивные отклонения — от дисменореи вплоть до бесплодия, выявлены нарушения гонадотропной функции гипофиза в виде недостаточной секреции ЛГ и ФСГ.
Известно, что согласно современной теории нейроэндокринного контроля репродуктивной функции в норме менструальная функция и в целом гонадальная функция обеспечиваются пульсирующей секрецией гонадотропинов. Таким образом, частота и амплитуда импульсов секреции гонадотропинов существенно меняются в зависимости от фазы менструального цикла. Кроме этого, другим конт–ролером уровня гонадотропинов является уровень эстрадиола, т.е. по мере нарастания концентраций эстрадиола отмечается снижение амплитуды импульсов гонадотропинов до 3–4 мМЕ/мл, которая восстанавливается после овуляции. По данным других авторов [7, 11], у женщин с дисменорей и СПКЯ при определении уровней ЛГ и ФСГ 2 раза в течение 28 дней установлено, что в предполагаемой первой фазе цикла средние показатели ЛГ и ФСГ были значительно ниже нормы. Во второй фазе цикла (на 21-й день) их уровни продолжали оставаться ниже нормальных показателей.
В литературе широко обсуждается вопрос о роли пролактина и гиперпролактинемии в регуляции фертильности в целом, а также при СПКЯ. У обследованных нами женщин с ожирением и репродуктивными нарушениями уровень пролактина имел тенденцию к увеличению в обеих группах.
Таким образом, наиболее выраженные нарушения системы гипофизарно-овариальной функции были обнаружены в первой группе пациенток с СПКЯ с первичным бесплодием, у которых отмечалось достоверное снижение функционального состояния системы «гипофиз — гонады», а именно снижение уровней ЛГ, ФСГ, эстрадиола и прогестерона плазмы крови на 14-й день менструального цикла, что подтверждалось обеднением фолликулярного аппарата яичников и ановуляцией. Секреция гонадотропинов гипофиза не имела пульсирующего характера и постоянно находилась на минимальных уровнях у женщин с нарушениями в репродуктивной сфере, страдающих ожирением, а уровни пролактина имели тенденцию к повышению.
Выводы
В группе пациенток с первичным бесплодием отмечалось достоверное снижение как гипофизарных, так и овариальных гормонов на фоне гиперандрогении и гиперпролактинемии. В группе пациенток с вторичным бесплодием также выявлено достоверное снижение гипофизарных гормонов на фоне гиперандрогении и гиперпролактинемии, однако овариальная функция была в пределах нормы. В обеих группах больных имела место гипогонадотропинемия, сочетающаяся с умеренной гиперпролактинемией и гиперандрогенией.
Конфликт интересов. Авторы констатируют отсутствие конфликта интересов при подготовке статьи.
Список литературы
1. Дедов И.И., Мельниченко Г.А. Синдром поликистозных яичников. — М.: Мед. информ. агентство, 2007. — 361 с.
2. Андреева E.H., Семичева Т.В., Веснина А.Ф. и др. Молекулярно-генетические аспекты синдрома поликистозных яичников // Пробл. репродукции. — 2007. — № 6. — С. 29-35.
3. Блинова И.В., Чернуха Г.Е., Карпов Ю.А. и др. Особенности функционального состояния эндотелия у женщин с синдромом поликистозных яичников // Кардиология. — 2008. — Т. 48, № 1. — С. 57-61.
4. Урманова Ю.М., Саидназирханова М.С. Нарушение секреции соматотропного гормона у женщин с синдромом поликистозных яичников в сравнении с больными с неактивными аденомами гипофиза // Международный эндокринологический журнал. — 2016. — № 3(75). — С. 56-63.
5. Шереметьева Е.В., Карпова Е.А., Деркач Д.А. и др. Консервативная терапия (стимуляция овуляции) синдрома поликистозных яичников // Лечащий врач. — 2010. — № 4. — С. 27-34.
6. Azziz R. Diagnosis of Polycystic Ovarian Syndrome: The Rotterdam Criteria Are Premature. // Journal of Clinical Endocrinology and Metabolism. — 2006. — Vol. 91(3). — P. 781-5. — doi: 10.1210/jc.2005-2153. PMID16418211.
7. Bozdag G., Mumusoglu S., Zengin D. et al. The prevalence and phenotypic features of polycystic ovary syndrome: a systematic review and meta-analysis // Hum. Reprod. — 2016, Sep 22. [Epub ahead of print]
8. Carmina E. Diagnosis of polycystic ovary syndrome: from NIH criteria to ESHRE-ASRM guidelines // Minerva gynecologica. — 2004. — Vol. 56(1). — P. 1-6. [PMID14973405]
9. Hart R., Hickey M., Franks S. Definitions, prevalence and symptoms of polycystic ovaries and polycystic ovary syndrome // Best Practice and Research Clinical Obstetrics and Gynaeco–logy. — 2004. — Vol. 18(5). — P. 671-83. — doi: 10.1016/j.bpobgyn.2004.05.001. [PMID15380140]
10. Ehrmann D.A. Polycystic ovary syndrome // N. Engl. J. Med. — 2005. — Vol. 352. — P. 1223-36. [PMID15788499]
11. Nafiye Y., Sevtap K., Muammer D. The effect of serum and intrafollicular insulin resistance parameters and homocysteine levels of nonobese, nonhyperandrogenemic polycystic ovary syndrome patients on in vitro fertilization outcome // Fertil. Steril. — 2010. — Vol. 93(6). — P. 1864-1869. — doi: 10.1016/j.fertnstert.2008.12.024. [PMID19171332]
12. Noroozzadeh M., Tehrani F.R., Mobarakabadi S.S. et al. Sexual function and hormonal profiles in women with and without polycystic ovary syndrome: a population-based study // Int. J. Impot. Res. — 2016. — Sep 22. — doi: 10.1038/ijir.2016.35. [Epub ahead of print]
13. Fruzzetti F., Bersi C., Parrini D. Effect of long-term naltrexone treatment on endocrine profile, clinical features, and insulin sensitivity in obese women with polycystic ovary syndrome // Fertil. Steril. — 2002. — Vol. 77(5). — P. 936-44. [PMID12009347]
14. Fulghesu A.M., Ciampelli M. Role of opioid tone in the pathophysiology of hyperinsulinemia and insulin resistance in polycystic ovarian disease // Metab. Clin. Exp. — 2008. — Vol. 47(2). — P. 158-162. [PMID9472963]
15. Unfer V., Carlomagno G., Dante G. Effects of myoinositol in women with PCOS: a systematic review of randomized controlled trials // Gynecol. Endocrinol. — 2012. — Vol. 28(7). — P. 509-515.
16. Song D.K., Sung Y.A., Lee H. The Role of Serum MicroRNA‑6767-5p as a Biomarker for the Diagnosis of Polycystic Ovary Syndrome // PLoS One. — 2016. — Vol. 11(9). — doi: 10.1371/journal.pone.0163756.
17. Tan X., Li S., Chang Y. et al. Effect of metformin treatment during pregnancy on women with PCOS: a systematic review and meta-analysis // Clin. Invest. Med. — 2016. — Vol. 39(4). — Р. 120-131.

/71-76/73-1.jpg)
/71-76/73-2.jpg)
/71-76/74-1.jpg)