Статья опубликована на с. 11-21
Одной из огромнейших проблем человечества сегодня является прогрессирующая пандемия сахарного диабета (СД), которая, согласно данным Всемирной федерации диабета (IDF), отмечается во всех странах мира [29]. В настоящее время, по данным IDF, СД болеет 415 млн человек, т.е. каждый одиннадцатый человек нашей планеты, а по прогнозам эпидемиологов, в 2040 году СД будут страдать 642 млн, т.е. каждый десятый человек. 10.22141/2224-0721.7.79.2016.86414 При этом отмечается одновременное значительное повышение заболеваемости СД как 1-го типа (СД‑1), так и 2-го (СД‑2). С 1990 года частота возникновения СД‑1 у детей в Европе ежегодно увеличивается на 3–5 % [39]. Число детей (0–14 лет), больных СД‑1, в 2015 году составляло 542 000, а впервые выявленных пациентов с СД 1-го типа — 86 000 человек. В 2015 году от СД погибло в мире 5,1 млн человек, т.е. каждые 6 с умирал один больной.
Неутешительные данные о частоте СД имеются и в Украине. Согласно официальным данным, число больных СД в нашей стране в 2015 году составляло 1 223 607 человек, в том числе детей (0–14 лет), больных СД‑1, — 5990 человек. В 2015 году было зарегистрировано 1017 новых случаев заболевания СД‑1 детей в возрасте 0–14 лет [1]. Следовательно, в нашей стране больных СД‑1 — 12 человек на 1000 нормогликемических.
В связи с указанной пандемией общество несет колоссальные затраты на лечение больных СД. Так, согласно данным IDF, в 2015 году на лечение инсулином и сахароснижающими препаратами, другими лекарствами, а также сопроводительное обеспечение больных СД и его осложнениями в мире было затрачено 673 биллиона USD, а в 2040 году планируется израсходовать 800 биллионов USD.
Поэтому в настоящее время медико-социальная проблема, касающаяся профилактики, лечения и диагностики СД, приобретает особенно важное значение. Настоящая работа посвящена новейшему перспективному направлению в иммунодиабетологии, а именно доклинической асимптомной диагностике СД‑1 с помощью недавно открытых аутоантител к панкреатическим островкам Лангерганса (ОЛ), дающей возможность предсказать возникновение заболевания еще у здорового человека.
Согласно современным представлениям СД‑1 является хроническим аутоиммунным заболеванием, возникающим в результате комплексного взаимодействия генетической предрасположенности и факторов внешней среды, при котором происходит постепенное селективное органоспецифическое снижение числа и функции инсулинпродуцирующих бета-клеток в поджелудочной железе [12]. Когда масса разрушенных или функционально угнетенных бета-клеток достигает 80–90 %, возникает инсулиновая недостаточность, приводящая к нарушению гомеостаза глюкозы в организме (гипергликемии) и появлению клинических симптомов, характерных для манифестации СД‑1, т.е. у человека развивается классическая триада (полидипсия, полиурия и полифагия), а также происходит прогрессивная потеря массы тела [16]. СД‑1 может возникать в любом возрасте, но в основном — в раннем детском (ювенильный СД‑1), хотя нередки случаи дебюта заболевания и в более поздние годы (взрослый СД‑1) [19, 28].
Недавно СД‑1 был также охарактеризован как наиболее распространенное хроническое педиатрическое заболевание, при котором происходит аутоиммунный процесс, разрушающий бета-клетки и приводящий к потере секреции инсулина [34, 61].
Характерной особенностью этиологии и патогенеза СД‑1 является довольно длительная (длящаяся иногда годами) асимптомная фаза развития, т.е. скрытый, доклинический период от начала возникновения аутоиммунного процесса в ОЛ, сопровождаемого деструкцией и дисфункцией бета-клеток, до периода клинического проявления заболевания.
До недавнего времени отсутствовали достоверные методы выявления аутоиммунного процесса в ОЛ поджелудочной железы в доклиническую стадию патогенеза СД‑1 у человека. Наши знания об этом основывались преимущественно на данных, полученных в опытах на моделях лабораторных животных со спонтанным или трансгенным аутоиммунным СД‑1, нередко с использованием аутопсии. Вместе с тем исследования, проведенные на экспериментальных животных, при всей их научной ценности не могут быть полностью экстраполированы на заболевания у людей в связи с уникальной видовой специфичностью их иммунной системы, особенностью клинического течения, неодинаковой длительностью жизни и социальными факторами [23, 44].
Знаменательным событием в изучении патогенеза и диагностики СД‑1, особенно скрытой асимптомной доклинической стадии его развития, стало открытие в конце прошлого столетия аутоантител к антигенам ОЛ поджелудочной железы у человека. Благодаря этому появились надежные уникальные иммунологические биомаркеры, дающие возможность прижизненного, нетравматического выявления аутоиммунного процесса в ОЛ, приводящего к гибели бета-клеток, что дало возможность предсказать развитие СД‑1 у еще практически здорового человека задолго (от месяцев до многих лет) до появления у него дисгликемии, а затем и стабильной гипергликемии, т.е. развития клинической манифестации заболевания [2, 3, 30].
По мнению Ezio Bonifacio (2015) — одного из пионеров изучения патогенеза СД‑1, использование ОАА как биомаркеров для диагностики различных стадий патогенеза СД‑1 дает возможность: специфического установления аутоиммунной деструкции бета-клеток, начиная с младенцев; точного диагностирования асимптомной фазы развития СД‑1; степени прогрессирования заболевания. На основании этого автор высказал гипотезу, что СД‑1 является патологией, в основе которой лежит поражение клеток-мишеней, а не системное заболевание [17, 19].
Впервые аутоантитела к антигенам цитоплазмы ОЛ (ICA) в сыворотке больных СД‑1 и их родственников первой линии были обнаружены G.F. Bottаzo et al. [20]. В настоящее время описаны и успешно используются в клинической практике для высокочувствительного специфического определения четыре классических сывороточных аутоантитела антигенов бета-клеток — IAA, GADA, IA‑2A и ZnT8А и одно ОАА против цитоплазмы клеток ОЛ (ICA).
IAA — аутоантитела к инсулину (insulin autoantibodies) — впервые были выделены J.F. Рalmer et al. в 1983 году из сыворотки плазмы крови (ПК) у больных СД‑1, еще не леченных инсулином. IAA обнаруживаются в ПК самыми первыми по сравнению с другими ОАА, т.е. до года после рождения ребенка. Они варьируют по аффинности и специфичности. При низкой аффинности, обычно связанной с атипичным эпитопом, но не с проинсулином, появляющимся после двухлетнего возраста, редко ассоциируются с прогрессированием диабета. В противоположность этому при высокой аффинности IAA распознают общий эпитоп, представленный как на инсулине, так и на проинсулине, обычно появляющемся в возрасте около двух лет. Одновременно обнаруживаются при повышенном титре других ОАА и развитии СД‑1 [17, 19, 47, 48, 60].
GADA — аутоантитела к декарбоксилазе глютаминовой кислоты (glutamic acid decarboxylase antibodies) — были открыты S. Baekkescov et al. в 1982–1990 годах. Антиген GAD является ферментом, который катализирует глютаминовую кислоту в гамма-аминомасляную кислоту — важную аутокринную и паракринную сигнальную молекулу и фактор, обеспечивающий жизнедеятельность ОЛ, участвующий в регуляции глюкозой секреции инсулина. GADA относят к биомаркерам аутоиммунной деструкции бета-клеток и широко используют для прогнозирования возникновения СД‑1 у детей и взрослых [48, 54, 55].
IA‑2A — аутоантитела к протеину‑2 тирозинфосфатазы (IA‑2A antibodies или антиген‑2 инсулиномы) — описаны в 1993–1994 годах [21, 36, 43]. IA‑2A является фрагментом антигена GAD с молекулярной массой 64 кДА, состоящего из трех различных молекул декарбоксилазы глютаминовой кислоты и двух протеинов тирозинфосфатазы‑2 (ICA‑512) и фагрина (IA‑2βA) [31]. IA‑2A считается одним из главных высокоспецифических маркеров снижения функции бета-клеток при прогрессировании диабета. IA‑2A наиболее часто используются для диагностики асимптомной фазы СД‑1 [19, 22, 60].
ZnT8А — аутоантитела к транспортеру потока ZnT8 (Zn transporter 8 antibodies), впервые идентифицированы J.M. Wenzlau et al. (2007) [53]. ZnT8 является протеином мембран секреторных гранул бета-клеток и участвует в регуляции механизмов секреции инсулина. Показано, что уровень ZnT8 хорошо ассоциируется с уровнем GADA и IA‑2A, особенно у пациентов с впервые выявленным СД‑1 [51, 52], а также при СД‑1 у взрослых [33]. Считается, что обнаружение ZnT8А указывает на быстрое прогрессирование СД‑1 [17].
Появление стандартизированных методов определения различных ОАА (ICA, IAA, GADA, IA‑2A и ZnT8A) и выпуск многими фирмами стандартных наборов реактивов для их определения у человека, контролируемый специально созданным инспектирующим органом (DASP) — обществом иммунологов при IDF, располагающим большой сетью лабораторий в различных странах мира, стимулировали создание ряда многолетних проспективных международных и национальных программ по изучению возможности использования ОАА с диагностической целью. Одновременно появилась отсутствующая ранее возможность более глубокого изучения иммунных механизмов, происходящих в организме человека, предшествующих развитию клинического дебюта СД‑1. К таким приоритетным программам прежде всего следует отнести: BABYDIAB (Baby Diabetes), BABYDIET (Baby Diets), DAISY (Diabetes Autoimmunity Study in the Young), DIPP (Diabetes Prediction and Prevention Study), TEDDY (The Environmental Determinations in the Young), DPT‑1 (Diabetes Prevention Trial-Type1), TRIGR (Trial to Reduce IDDY in Genetically in Risk) и другие аналогичные программы. В 2015 году создана специальная платформа GPPAD (Global Platform for the Prevention of Autoimmune Diabetes), объединяющая несколько известных программ (TEDDY, TIGR, FINDIA и BABYDIET), с целью увеличения количества обследуемых детей в Великобритании и Германии и получения более полных данных о сероконверсии различных ОАА у детей начиная с рождения и возникновения у них СД‑1 [59].
В октябре 1998 года впервые в нашей стране в ГУ «Институт эндокринологии и обмена веществ имени В.П. Комиссаренко НАМН Украины» была создана отечественная проспективная многолетняя программа «Иммунитет в доклиническую стадию развития сахарного диабета 1-го типа (ИДСД)» [2, 3, 11], которая выполняется и в настоящее время.
Весьма важным вопросом при исследовании ОАА являются способы их определения. В настоящее время существует три основных метода определения титра ОАА в сыворотке ПК человека: радиоиммунологический, электрохемилюминесцентный и иммуноферментный ELISA. Наиболее высокочувствительным и специфичным из них считается радиоиммунологический, но он наиболее дорогой и для его использования требуются специальные условия [17]. Хемилюминесцентный также довольно чувствительный, но редко используемый, так как он наиболее специфичен только для определения IAA и GADA [37, 57].
Иммуноферментный метод ELISA является самым распространенным и наиболее дешевым для определения ОАА, но до последнего времени считался менее чувствительным, чем радиоиммунологический. Однако после недавней его модификации и создания нового трехскринингового метода (RSR) в результате исследований, проведенных очень большой группой педиатров (400 врачей) из разных клиник и с огромным количеством обследуемых (22 000 детей), было установлено, что модифицированный метод ELISA не уступает радиоиммунологическому, причем его можно использовать даже при небольшом количестве капиллярной крови детей [42].
Методы определения ОАА в клинической практике в настоящее время используются в основном в трех целях: для диагностики асимптомной доклинической стадии и предсказания возникновения СД‑1; установления наличия сохранившейся активности функционирующих ОЛ при уже развившемся начальном СД‑1; более точной дифференциации взрослого СД‑1 (LADA) и СД‑2.
Как уже указывалось, к выдающимся достижениям последних десятилетий следует прежде всего отнести открытие аутоантител к островкам Лангерганса поджелудочной железы, которое расширило возможности диагностики СД‑1 и изучения доклинической стадии его патогенеза, т.е. появление новых способов прижизненного нетравматического установления доклинической стадии развития СД‑1. Благодаря этому стала возможной предикция риска развития СД‑1 у еще здорового человека задолго (от месяцев до многих лет) до возникновения клинических симптомов заболевания [19, 62, 63]. Однако при этом, естественно, возникает вопрос, какие же из пяти ныне используемых ОАА или их сочетаний обладают наиболее высокой диагностической ценностью для предсказания риска развития клинически диагностируемого СД‑1 у человека?
Прежде всего следует отметить, что при исследовании титра сывороточных ОАА у детей начиная с рождения был выявлен чрезвычайно важный факт — очень раннее появление в ПК позитивных аутоантител (сероконверсия). Пик сероконверсии приходится на период между первым и третьим годами. До шести месяцев ОАА у младенцев обнаруживаются очень редко. У многих детей (особенно с генотипом HLA-DR/DQ), у которых развивается СД‑1, аутоиммунная агрессия подтверждена последующим определением четырех аутоантител (IAA, GADA, IA‑2A и ZnT8). Причем даже при позитивном титре двух ОАА риск развития СД‑1 > 80 %. В последующие годы риск возникновения СД‑1 повышается ежегодно на 11 % в течение 12 лет [19, 32, 63].
Следовательно, самое раннее установление риска развития СД‑1 должно проводиться уже в первые годы жизни ребенка (до пяти лет) в виде тестирования на наличие комплекса различных ОАА [42]. Кстати, эти данные стимулировали идею создания иммунных препаратов, препятствующих развитию СД‑1 в самом раннем возрасте ребенка, т.е. наподобие вакцин, которые сейчас успешно применяются для профилактики детских инфекционных заболеваний и туберкулеза. С этой целью в 2015 году немецкими диабетологами совместно с английскими коллегами была создана специальная большая платформа, объединяющая программы TRICR, BABYDIET, TEDDY и FIDIA, посвященная исследованиям в этом направлении [59]. Пилотные исследования, проведенные по этой платформе на детях в возрасте от трех до 18 месяцев, позитивных по наличию ОАА, которые ежедневно получали per os высокую дозу инсулина (65 мг), обнаружили выраженные изменения иммунной реактивности (по реакции CD4+Т-лимфоцитов, связыванию IgG и IgА слюны) по сравнению с плацебо. Настоящие исследования сейчас находятся на третьей стадии испытаний.
Для лучшего понимания целесообразности использования того или иного вида ОАА в клинической практике с целью предсказания риска развития СД‑1 рассмотрим диагностические возможности каждого в отдельности.
IAA — аутоантитела к инсулину, считающиеся наиболее специфическими к антигенам бета-клеток, появляются в организме ребенка самыми первыми. По данным некоторых авторов [47], было установлено, что обнаружение лишь одного IAA дает возможность только предсказать развитие СД‑1 преимущественно у детей до 5-летнего возраста. Причем величина титра ОАА и частота выявления находятся в обратной связи с возрастом. После достижения детьми 12-летнего возраста у большинства из них IAA не обнаруживаются. Недавно с помощью электролюминесцентного метода было показано, что риск возникновения СД‑1 у IAA-позитивных детей во многом зависит также от степени аффинности IAA — чем она выше, тем выше риск развития СД‑1 [57]. Недавно были получены данные, позволяющие прийти к заключению, что утрата IAA-реактивности ассоциирована с замедлением прогресса СД‑1 у детей, позитивных ко многим ОАА [26].
GADA являются самым широкоиспользуемым биомаркером для выявления аутоиммунной деструкции бета-клеток и прогрессирования СД‑1 как в самом раннем детском возрасте, так и в более позднем, т.е. при LADA [15, 50].
Исследование титра различных ОАА у детей с нормальной толерантностью к глюкозе, родственники которых больны СД‑1, по программе РТР (Trial Net Pathway to Prevention of Type 1 Diabetes) показало, что риск развития у них СД‑1 (при использовании из ОАА лишь GADA) по прошествии пяти лет составлял 68 %, особенно у лиц молодого возраста и с наличием диабетогенных генотипов HLA. Для более точного предсказания СД‑1 требуется, кроме GADA, дополнительное определение еще одного ОАА (IAA, IA‑2A или ZnT8A) [14, 15].
В связи с тем, что имелись случаи, когда у отдельных GADA-позитивных пациентов СД‑1 клинически не манифестировал, была разработана улучшенная формула GADA, т.е. GADA65 (96-585) с усеченным N-терминалом, которая обладала большей специфичностью при установлении риска развития СД‑1 радиоиммунологическим методом [54, 55].
При исследовании распространенности GADA65 по позитивности (≥ 65 Eg, ВОЗ) в популяции здоровых взрослых людей Европы не было выявлено географических, половых, возрастных или ИМТ-ассоциированных различий (разница варьировала от 1,2 до 2,0 %) [45].
Недавно были получены новые данные об участии GAD65 в патогенезе СД‑1 у человека [40]. Хорошо известно, что бета-клетки поджелудочной железы человека обладают хорошо развитым эндоплазматическим ретикулумом (ЭР), отражающим их роль в синтезировании и секретировании большого количества инсулина, необходимого для физиологических потребностей организма. Вместе с тем бета-клетки панкреатических ОЛ человека являются высокочувствительными к стрессу, который, как показано, вовлечен в начальный механизм дисфункции и гибели бета-клеток в патогенезе СД‑1 [25]. Периферический мембранный GAD56 синтезирует гамма-аминомасляную кислоту, важную аутокринную и паракринную сигнальную молекулу и фактор выживания ОЛ. Сотрудниками S. Baekkescov [40] было показано, что стресс ЭР бета-клеток приводит к пертурбации пальмитолеиновой кислоты, контролирующей распределение GAD56 на эндогенных мембранах, в результате чего происходит ее накопление на мембранах аппарата Гольджи. В то же время пальмитолеиновая кислота обладает высокой иммуногенностью, проявляющейся в увеличении поглощения антигенпрезентирующих клеток и стимуляции Т-клеток. Подобная аккумуляция GAD56 на мембранах аппарата Гольджи была также выявлена в бета-клетках на срезах поджелудочной железы у GADА-положительных пациентов и больных СД‑1. Экзогенными стрессорами могут быть воспаления и чрезмерное употребление в пищу ненасыщенных жирных кислот и других факторов внешней среды, особенно у индивидуумов с генетической склонностью к СД‑1. Предполагают, что стресс ЭР бета-клеток является начальной стадией аутоиммунного процесса в ОЛ, за которым следует апоптоз, индуцируемый воспалительными цитокинами, секретируемыми иммунными клетками, так же как и самими бета-клетками [25].
IA‑2A считается одним из главных маркеров аутоиммунной деструкции бета-клеток, который обладает высокой специфичностью для диагностирования развивающегося диабета. Он часто используется, особенно в комплексе с другими ОАА, как биомаркер выявления и диагностики асимптомной фазы СД‑1 [17–19, 22, 60].
Процент выявления одного IA‑2A у лиц с риском развития СД‑1, приводимый разными авторами, неодинаков.
GADA и IA‑2A считаются наиболее чувствительными и специфическими биомаркерами, широко используемыми для предсказания возникновения СД‑1, но их отличие друг от друга заключается в том, что они выявляют различные эпитопы антигенов на бета-клетки и обладают неодинаковой аффинностью, ввиду чего обычно для более точного скрининга предсказания диабета рекомендуют их совместное определение [5, 7, 46].
При сравнительном исследовании диагностической ценности GADA и IA‑2A было установлено, что при обнаружении повышенного титра только одного GADA СД‑1 в течение пяти лет возник в 68 % случаев, а IA‑2A — в 16 %. Значительное увеличение процента предсказания обнаруживается при повышении титра обоих ОАА [15].
На основании исследований, проведенных на огромном количестве (несколько тысяч) пациентов, P. Xu et al. (2016) [56] пришли к заключению, что предсказание развития СД‑1 на основании определения GADA у лиц моложе 16 лет во многом зависит от величины его титра. Так, при низком титре одних GADA диабет развивается у 11 %, а при высоком титре — у 45 % обследуемых. Еще большой процент предикции СД‑1 наблюдается при одновременном появлении GADA и IA‑2A (более 70 %). IA‑2A, по мнению авторов, является лучшим маркером прогрессирования дисгликемии (потеря толерантности к глюкозе, снижение продукции С-пептида, повышение уровня HbA1с). При сочетанном определении GADA и IA‑2A и ряда метаболических маркеров степень прогнозирования СД‑1 возрастает до 80 %.
ZnT8A — позже всех открытые ОАА, принадлежат к одним из наиболее достоверных и специфических маркеров предсказания возникновения СД‑1, особенно у детей [53]. При определении только одного ZnT8A он обнаруживается у 63 % детей с впервые выявленным СД‑1 [33]. Определение ZnT8A совместно с GADA, IA‑2A и IAA дает возможность предсказать развитие СД‑1 с точностью свыше 90 % [46]. Характерной особенностью ZnT8A является также то, что они обнаруживаются преимущественно в ОЛ, в то время как GADA и IA‑2A — во многих тканях [35]. Считается, что выявление повышенного титра ZnT8A указывает на тенденцию к быстрому прогрессированию СД‑1 [17].
Собственные исследования аутоантител к антигенам бета-клеток ОЛ поджелудочной железы и их использование как маркера аутоиммунной деструкции ОЛ и для диагностирования асимптомной фазы развития СД‑1 у детей и подростков нашей страны были начаты в сентябре 1996 года. В октябре 1998 года план этих исследований, проводимых проспективно в ГУ «Институт эндокринологии и обмена веществ имени В.П. Комиссаренко НАМН Украины», был оформлен в виде первой в Украине программы «Иммунитет в доклиническую стадию сахарного диабета 1-го типа (ИДСД)» [11].
Согласно плану исследований программы ИДСД решается несколько задач:
1. Освоение и внедрение в клинику впервые в Украине методов определения титров ОАА (IAA, GADA и IA‑2A) в ПК с целью их использования как теста для диагностики асимптомной доклинической фазы развития СД‑1 и предсказания риска возникновения клинического СД‑1 у нормогликемических детей нашей страны. Получение такой информации дало возможность установить в Украине количество нормогликемических детей с отягощенной наследственностью, но с нормальной толерантностью к глюкозе, позитивных к ОАА, и, следовательно, выделить группу риска по развитию СД‑1, требующую постоянного медицинского наблюдения. Полученные нами результаты дают возможность сравнить их с аналогичными данными программ, проводимых в других странах Европы и в США, т.е. выявить региональные особенности.
2. Изучение ряда показателей функционального состояния естественного адаптивного иммунитета (содержание, ультраструктура и функция нейтрофилов, моноцитов и ЕК-клеток), лейкоцитарного состава крови, иммунофенотипа лимфоцитов (CD3+T-, CD4+T-, CD8+T- CD20+- и CD56+-клеток) и их ультраструктуры (с помощью сканирующей и трансмиссионной электронной микроскопии), а также содержания различных цитокинов (ИЛ‑1α, ИЛ‑1β, ИЛ‑2, ИЛ‑6, ИЛ‑10, ФНОα и ИФНγ), хемокинов (ИЛ‑8 и ИЛ‑16) и адипокинов (лептина и адипонектина) в ПК нормогликемических, здоровых, ОАА-положительных, ОАА-отрицательных, с уже развившимся СД‑1 детей и подростков с генетической склонностью к СД‑1. Результаты этой части исследований подробно изложены в нашей недавно опубликованной монографии [3].
К концу 2016 года в реестр программы ИДСД для клинико-иммунологического обследования внесены дети и подростки (561 чел.) обоих полов в возрасте от 7 до 15 лет без каких-либо видимых воспалительных, онкологических или аллергических заболеваний. Из них 457 нормогликемических детей, имеющих в семейном анамнезе отягощенную наследственность — родственников первой линии (отцы, матери, сибсы), больных СД‑1, были отобраны для дальнейшего обследования (рис. 1). После тестирования на наличие ОАА (IAA, GADA и IA‑2A) они были разделены на две подгруппы: 1) ОАА-положительные (n = 161), т.е. с повышенным титром хотя бы двух аутоантител GADA + IA‑2A (у детей до 10 лет определяли и IAA); 2) ОАА-отрицательные (n = 296), у которых все ОАА не определялись даже при повторных измерениях. Контрольная группа (n = 104) состояла из здоровых детей с нормогликемией без отягощенной генетической наследственности и с отрицательными тестами на толерантность к глюкозе и наличие ОАА.
/16.jpg)
У всех обследуемых детей определение титра ОАА проводили высокочувствительным радиоиммунологическим методом при помощи гамма-счетчика 5500В фирмы «Becton» (США) с использованием стандартизированных наборов реактивов для определения титров аутоантител IAA, GADA и IA‑2A фирмы «Cis Bio International» (Франция), контролируемых DASP и рекомендованных экспертами ВОЗ. Приведенные выше иммунологические исследования проводили одновременно с традиционным клиническим обследованием больных, т.е. определением гликемического профиля, уровня HbA1c и др. проспективно в динамике, вплоть до манифестации диабета (у ОАА-позитивных детей).
Многолетние проспективные исследования [3, 6, 7–10], как видно из рис. 1, показали, что при двукратном определении ОАА у 457 нормогликемических детей с отягощенной наследственностью повышенный титр GADA и IAA был обнаружен у 161 ребенка (35,2 %), а 295 детей из этой подгруппы (64,8 %) оказались отрицательными. При этом у 76 детей из 161 ОАА-положительного (в 53,4 %) в среднем через 30,9 ± 3,2 месяца возник клинически диагностируемый СД‑1, в то время как у 75 обследуемых (46,8 %) в оставшейся подгруппе ОАА-положительных детей это заболевание не было выявлено. У ОАА-отрицательных детей за этот же период времени СД‑1 возник только у одного ребенка, т.е. у 0,8 %. Полученные нами результаты оказались созвучны с данными большинства зарубежных программ по этому вопросу [17, 58].
На рис. 2 приводятся сравнительные данные о частоте возникновения СД‑1 у различных когорт детей Украины: А — в общей популяции — 0,12 %; Б — нормогликемических, но с отягощенной наследственностью в плане СД‑1 — 18,81 %; В — ОАА-положительные с отягощенной наследственностью — 53,41 %.
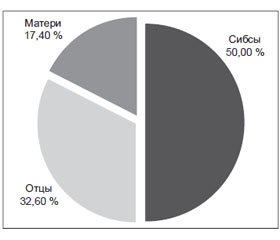
Важно также отметить, что, по нашим данным, среди ОАА-положительных детей, у которых СД‑1 страдал отец, диабет развивался значительно чаще (у 72,1 %), чем у детей, у которых страдала диабетом мать (у 27,9 %) (рис. 3). В этом отношении полученные нами результаты близки к данным других авторов [22, 24]. Было также установлено, что у половины ОАА-положительных детей, у которых развился диабет, больными родственниками первой линии были браться и сестры (рис. 4). Это должно также учитываться дополнительно при возможном предварительном прогнозе риска развития СД‑1.
/17_2.jpg)
Проведенные нами исследования также показали, что процент прогнозируемой предсказуемости возникновения СД‑1 у детей с отягощенной наследственностью увеличивается со временем, прошедшим после первого обнаружения повышения титра ОАА до клинической манифестации заболевания, т.е. чем более длительный период наблюдения за пациентом после первого установления повышенного титра ОАА, тем выше процент предсказуемости клинического дебюта СД‑1.
Вместе с тем, как показывает наш опыт и с учетом достаточно высокой стоимости наборов для определения ОАА, хорошие прогностические результаты могут быть получены и при сочетанном определении только двух видов ОАА, таких как GADA и IA‑2A [3–5].
Следует отметить, что, хотя семейный анамнез и генетические маркеры HLA-DR-DQ генотипа и гены инсулина, безусловно, имеют большое значение для предсказания риска развития СД‑1 [17, 19], а метаболические маркеры необходимы для установления скорости и тяжести прогрессирования СД‑1 [15], только лишь определение титра сывороточных ОАА дает возможность точно указать на уже начавшуюся, пока скрытую аутоиммунную деструкцию бета-клеток. Следовательно, только определение ОАА (особенно нескольких из них) является самым ранним надежным предсказанием возникновения клинической фазы СД‑1 у пока еще здорового человека и указывает на его неизбежность [3, 17, 19, 59].
Таким образом, основываясь на работах, проведенных многочисленными научными коллективами ученых на огромном клиническом материале (свыше 1 млн человек), можно с большой долей уверенности утверждать, что повышение титров сывороточных ОАА является наиболее надежным биомаркером риска возникновения СД‑1 у человека с нормогликемией. Процент достоверности предсказания СД‑1 прямо пропорционален числу видов ОАА, определенных тестированием: чем их больше (но не менее двух), тем точнее прогноз, так как различные ОАА идентифицируют неодинаковые эпитопы бета-клеточных антигенов. Важное значение имеет также величина титра ОАА, аффинность аутоантител и длительность наблюдения, предшествующего возникновению заболевания, после первого посещения врача. К примеру, при исследованиях, проведенных на нормогликемических детях с отягощенной наследственностью, при определении только одного ОАА с низкой аффинностью (IAA, GADA или IA‑2A) развитие клинических признаков СД‑1, по различным источникам, наблюдалось только в 9–22 % после десятилетнего наблюдения [15]. При обнаружении повышенного титра двух ОАА, особенно GADA и IA‑2A, риск развития СД‑1 в течение 10 лет приближается к 60 % [3, 7]. У детей, позитивных к трем ОАА, СД‑1 возникал через 7–10 лет более чем в 60 % случаев [41], а при сочетанном использовании четырех (IAA, GADA, IA‑2A и ZnT8A) и особенно пяти ОАА (ICA, IAA, GADA, IA‑2A и ZnT8A) СД‑1 клинически диагностируется свыше чем в 90 % случаев, особенно при длительном наблюдении [17, 19, 38, 46, 58]. По данным A.G. Ziegler et al. [63], при одновременном выявлении позитивности ко многим ОАА развитие клинического диабета неизбежно.
Вместе с тем следует подчеркнуть, что характерной особенностью ОАА является колебание их титра в ПК на этапах развития СД‑1, т.е. наряду с повышением наблюдается его реверсия к норме, особенно отдельных видов ОАА. По данным K. Vehiк et al. [49], полученным при проспективном исследовании детей с отягощенной наследственностью, до 10-летнего возраста реверсия относительно часто отмечалась при повышении одного GADA в 19 % случаев и IAA — в 27 %, а у пациентов, позитивных ко многим ОАА, меньше чем в 1 % случаев. Реверсия ассоциируется с генотипом HLA, возрастом и снижением титра антител. На основании проведенных исследований авторы приходят к заключению, что дети, которые были позитивны ко многим ОАА, но у которых произошла реверсия одного из них, обладают очень высоким риском возникновения СД‑1. Это наводит авторов на мысль, что у детей, позитивных к одному ОАА, не менее чем через один год после сероконверсии стратификация риска развития СД‑1 возрастает.
Все вышеизложенное послужило основанием для создания новой концепции диагностики СД‑1 [17, 19, 59, 61], заключающейся в том, что началом этого заболевания следует считать не появление характерных клинических признаков (гипергликемии и др.), а обнаружение в ПК многих аутоантител к бета-клеткам, т.е. пресимптомную фазу. Следовательно, заболевание включает в себя две стадии: пресимптомную, длящуюся иногда многие месяцы и годы, и клиническую, характеризующуюся стойкой гипергликемией.
Согласно данным Американской диабетической ассоциации (ADA), на самом раннем начальном этапе СД‑1 следует различать три фазы: первую фазу — бета-клеточного иммунитета (т.е. по обнаружению не менее двух ОАА и нормогликемии), вторую фазу — пресимптоматическую, определяемую по наличию бета-клеток иммунитета и дисгликемии, и третью фазу — симптоматическую, по выявлению клинических симптомов заболевания [30]. Эта концепция имеет значение для тактики предупреждения и лечения СД‑1, так как указывает на то, что блокаду механизмов, приводящих к деструкции бета-клеток, следует проводить в досимптомную стадию СД‑1 [30].
ОАА широко используются также для выявления сохранившихся бета-клеток у впервые выявленных больных СД‑1 в отдаленные сроки после старта заболевания и его лечения. Согласно исторической модели патогенеза СД‑1, предложенной еще в 1986 году Georg Eisenbarth, его клинические проявления у человека наступают только после того, как все инсулинпродуцирующие бета-клетки окончательно потеряны. Однако недавние патоцитохимические исследования поколебали эту догму, так как в поджелудочной железе пациента, длительно болеющего СД‑1, были обнаружены отдельные инсулинпродуцирующие клетки, разбросанные в эндокринной и экзокринной частях поджелудочной железы. Причем у таких больных выявлялась небольшая продукция С-пептида и повышение титров некоторых ОАА, особенно у пациентов с дебютом заболевания в возрасте старше 18 лет с продолжительностью заболевания, достигающей 50 лет [13, 17, 19]. Установление того факта, что резидуальные бета-клетки, способные к эндогенной секреции инсулина, сохраняются в течение длительного времени после старта заболевания диабетом, имеет весьма важное значение для новой стратегии лечения СД‑1 — иммунологической интервенции, так как вселяет большую надежду на возможность повышения пролиферации и восстановления функции резидуальных бета-клеток у пациентов с уже развившимся заболеванием [2]. Определение ОАА также необходимо для установления точного времени старта снижения массы бета-клеток вследствие аутоиммунной деструкции [13].
Одной из важных областей применения ОАА в диабетологии стало их использование как маркеров для более точной диагностики СД‑1 взрослых (LADA) и его дифференциации с СД‑2. Как известно, у взрослых пациентов с СД‑1 (LADA), особенно у более молодых, его часто бывает нелегко дифференцировать с СД‑2. Подтверждением этого стали многочисленные исследования, показавшие, что более чем у 10 % пациентов, которым первоначально был установлен диагноз СД‑2, на самом деле имелся СД‑1 [27].
В 2013 году были опубликованы результаты скрининга ОАА (GADA, IA‑2A ZnT8A) у 6156 больных с впервые выявленным диабетом в возрасте 30–70 лет, проведенного научными коллективами семи стран Европы. Они показали, что 541 человек из них (8,8 %) были GADA-позитивными и 57 лиц (0,9 %) — IA‑2A-позитивными. На основании полученных данных участники консорциума приходят к заключению, что наряду с клинической картиной главным маркером СД‑1 взрослых является наличие у пациентов повышенного титра GADA. Определение GADA должно стать обязательным в рутинной практике диагностики сахарного диабета у взрослых. Это тем более важно, что методы лечения СД‑1 и СД‑2 различны [3, 28].
Подытоживая изложенные выше данные литературы и результаты собственных исследований, можно прийти к заключению, что, несмотря на некоторые дискуссионные вопросы, существует единое мнение ученых, что определение сывороточного титра аутоантител к панкреатическим ОЛ является надежным тестом для предсказания риска возникновения СД‑1 и диагностики асимптомной его фазы у «здорового» человека задолго до возникновения у него клинических симптомов заболевания. Чем большее число ОАА включено в скрининг, тем точнее предсказание риска СД‑1. При позитивности четырех-пяти ОАА процент достоверности предсказания СД‑1 превышает 90, что предиктирует возникновение заболевания как неизбежное. Вместе с тем использование ОАА открывает новые, неосуществимые ранее возможности изучения иммунных механизмов на ранних этапах патогенеза СД‑1 у человека.
Все это дает нам право высказать пожелания о необходимости обязательного проведения скрининга на наличие ОАА у лиц любого возраста (начиная с младенчества) при подозрении на СД‑1, особенно у детей с генетическим отягощением в семейном анамнезе или наличием генотипа HLA-DR-DQ. Следовательно, метод определения ОАА должен стать рутинным в лабораторных медицинских учреждениях нашей страны.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Довідники основних показників діяльності ендокринологічної служби України. — Київ, 2001–2015 рр.
2. Зак К.П., Попова В.В. Иммунная интервенция в терапии сахарного диабета (аналитический обзор) // Диабет. Ожирение. Метаболический синдром. — 2015. — № 6 (IV). — C. 31-44.
3. Зак К.П., Тронько Н.Д., Попова В.В., Бутенко А.К. Сахарный диабет. Иммунитет. Цитокины. — К.: Книга плюс, 2015. — 485 с.
4. Попова В.В. Лейкоцитарний склад та імунофенотип лімфоцитів периферичної крові у ДААт-позитивних і ДААт-негативних щодо вмісту діабет-асоційованих автоантитіл дітей та підлітків на доклінічній и ранній клінічній стадіях розвитку цукрового діабету1-го типу // Здоров’я дитини. — 2015. — Т. 2, № 61. — С. 45-51.
5. Попова В.В. Продукція діабетасоційованих аутоантитіл до острівцевих аутоантигенів (IA‑2A, GADA, IAA) у дітей і підлітків на етапах еволюції цукрового діабету 1-го типу як основа клініко-імунологічного алгоритму доклінічної діагностики захворювання // Современная педиатрия. — 2015. — Т. 2, № 66. — С. 113-118.
6. Попова В.В. Уміст діабетасоційованих автоантитіл до острівцевих автоантигенів (IA‑2A, GADA, IAA) і рівень різних видів цитокінів у дітей та підлітків на доклінічній і ранній клінічній стадіях розвитку цукрового діабету 1-го типу // Міжнародний ендокринологічний журнал. — 2015. — Т. 2, № 66. — С. 138-146.
7. Попова В.В. Частота виникнення цукрового діабету 1-го типу та імунологічний моніторинг у нормоглікемічних здорових дітей з обтяженою спадковістю і позитивних щодо діабетасоційованих автоантитіл до острівців Лангерганса // Ендокринологія. — 2008. — Т. 13, № 2. — С. 211-219.
8. Попова В.В., Зак К.П. Открытие аутоантител к островкам Лангерганса поджелудочной железы — выдающееся достижение в области предсказания возникновения и диагностики типа сахарного диабета в клинике (Обзор с включением собственных данных) // Лікарська справа. — 2006. — № 7. — С. 3-12.
9. Попова В.В., Зак К.П. Хемокины при сахарном диабете 1-го типа у человека // Укр. медичний часопис. — 2008. — Т. 67, № 5. — С. 1-14.
10. Попова В.В., Маньковский Б.Н. Определение частоты выявляемости антител к тирозинфосфатазе (IA‑2A) как иммунологическая стратегия ранней доклинической стадии сахарного диабета 1-го типа у детей и подростков // Здоровье женщины. — 2002. — № 3. — С. 34-41.
11. Тронько Н.Д., Попова В.В., Зак К.П., Маньковский Б.Н. О научно-исследовательской проспективной программе «Иммунитет в доклинический период развития сахарного диабета 1-го типа», созданной в ГУ «Институт эндокринологии и обмена веществ им. В.П. Комиссаренко НАМН Украины» // Ендокринологія. — 2010. — Т. 15, № 2. — C. 180-191.
12. Atkinson M.A., Eisenbarth G.S., Michels A.W. Type 1 diabetes // Lancet. — 2014. — Vol. 38, № 9911. — P. 69-82.
13. Atkinson M.A., von Herrath M., Powers A.C., Clare-Salzler M. Current concepts on the pathogenesis of type 1 diabetes — considerations for attempts to prevent and reverse the disease // Diabetes Care. — 2015. — Vol. 38, № 6. — P. 979-988.
14. Bingley P.J. Clinical application of diabetes antibody testing // J. Clin. Endocrinol. Metab. — 2010. — Vol. 95, № 1. — P. 25-33.
15. Bingley P.J., Boulware D.C., Krischer J.P. Type 1 Diabetes TrialNet Study Group. The implications of autoantibodies to a single islet antigen in relatives with normal glucose tolerance: development of other autoantibodies and progression to type 1 diabetes // Diabetologia. — 2016. — Vol. 59, № 3. — P. 542-549.
16. Bluestone J.A., Herold K., Eisenbarth G. Genetics, pathogenesis and clinical interventions in type 1 diabetes // Nature. — 2010. — Vol. 464, № 7293. — P. 1293-1300.
17. Bonifacio E. Predicting type 1 diabetes using biomarkers // Diabetes Care. — 2015. — Vol. 38, № 6. — P. 989-996.
18. Bonifacio E., Hummel M., Walter M. et al. IDDM and multiple family history of type 1 diabetes combined to identify neonates at high risk for type 1 diabetes // Diabetes Care. — 2004. — Vol. 27, № 11. — P. 2695-2700.
19. Bonifacio E., Ziegler A.G., Klingensmith G. et al. Effects of high-dose oral insulin on immune responses in children at high risk for type 1 diabetes: the Pre-POINT randomized clinical trial // JAMA. — 2015. — Vol. 313, № 15. — P. 1541-1549.
20. Bottazzo G.F., Florin-Christensen A., Doniach D. Islet cell antibodies in diabetes mellitus with autoimmune polyendocrine deficiencies // Lancet. — 1974. — Vol. 2, № 7892. — P. 1279-1283.
21. Christie M.R., Hollands J.A., Brown T.J. et al. Detection of pancreatic islet 64,000 M (r) autoantigens in insulin-dependent diabetes distinct from glutamate decarboxylase // J. Clin. Invest. — 1993. — Vol. 92, № 1. — P. 240-248.
22. Decochez K., Truyen J., Van der Anwera B. et al. Combined positivity for HLA DQ2/DQ8 and IA‑2 antibodies defines population at high risk type 1 diabetes // Diabetologia. — 2005. — Vol. 48, № 4. — P. 687-694.
23. Drexhage H.A., Dik W.A., Leenen P.J., Versnel M.A. The Immune pathogenesis of type 1 diabetes: not only thinking outside the cell but also outside the islet and out of the box // Diabetes. — 2016. — Vol. 65, № 8. — P. 2130-2133.
24. Eisenbarth G.S., Jeffrey J. The natural history of type 1A diabetes // Arq. Bras. Endocrinol. Metabol. — 2008. — Vol. 52, № 2. — P. 146-155.
25. Eizirik D.L, Cardozo A.K., Cnop M. The role for endoplasmic reticulum stress in diabetes mellitus // Endocr. Rev. — 2008. — Vol. 29, № 1. — P. 42-61.
26. Endesfelder D., Hagen M., Winkler C. et al. A novel approach for the analysis of longitudinal profiles reveals delayed progression to type 1 diabetes in a subgroup of multiple-islet-autoantibody-positive children // Diabetologia. — 2016. — Vol. 59, № 10. — P. 2172-2180.
27. Fourlanos S., Dotta F., Greenbaum C.J. et al. Latent autoimmune diabetes in adults (LADA) should be less latent // Diabetologia. — 2005. — Vol. 48, № 11. — P. 2206-2212.
28. Hawa M.I., Kolb H., Schloot N. et al. Adult-onset autoimmune diabetes in Europe is prevalent with a broad clinical phenotype // Diabetes Care. — 2013. — Vol. 36. — P. 908-913.
29. IDF Diabetes Atlas, Seventh edition. — 2016.
30. Insel R.A., Dunne J.L., Atkinson M.A. et al. Staging presymptomatic type 1 diabetes: a scientific statement of JDRF, the Endocrine Society, and the American Diabetes Association // Diabetes Care. — 2015. — Vol. 38, № 10. — P. 1964-1974.
31. Knip M. Prediction and prevention of type 1 diabetes // Acta Pediatr. — 1998. — Vol. 425. — P. 54-62.
32. Krischer J.P, Lynch K.F., Schatz D.A. et al. The 6 year incidence of diabetes-associated autoantibodies in genetically at-risk children: the TEDDY study // Diabetologia. — 2015. — Vol. 58, № 5. — P. 980-987.
33. Lampasona V., Petrone A., Tiberti C. et al. Zinc transporter 8 antibodies complement GAD and IA‑2 antibodies in the identification and characterization of adult-onset autoimmune diabetes: Non Insulin Requiring Autoimmune Diabetes (NIRAD) 4 // Diabetes Care. — 2010. — Vol. 33, № 1. — P. 104-108.
34. Larsson E.H., Vehik K., Haller M.J. et al. Growth and risk for islet autoimmunity and progression to type 1 diabetes in early childhood: the environmental determinants of diabetes in the Young Study // Diabetes. — 2016. — Vol. 65, № 7. — P. 1988-1995.
35. Lebastchi J., Herold K.C. Immunologic and metabolic biomarkers of β-cell destruction in the diagnosis of type 1 diabetes // Cold Spring Harb. Perspect. Med. — 2012. — Vol. 2, № 6. a007708. doi: 10.1101/cshperspect.a007708.
36. Leslie R.D.G., Atkinson M.A., Notkins A.L. Autoantigens IA‑2 and GAD in type 1 (insulin-dependent) diabetes // Diabetologia. — 1999. — Vol. 42, № 1. — P. 3-14.
37. Miao D., Guyer M.K., Dong F. et al. GAD65 Autoantibodies detected by electrochemiluminescence assay identify high risk for type 1 diabetes // Diabetes. — 2013. — Vol. 62. — P. 4174-4178.
38. Parikka V., Nanto-Salonen K., Saarinen M. et al. Early seroconversion and rapidly increasing autoantibody concentrations predict prepubertal manifestation of type 1 diabetes in children at genetic risk // Diabetologia. — 2012. — Vol. 55, № 7. — P. 1926-1936.
39. Patterson C.C., Dahlquist G.G., Gyürüs E. et al. Incidence trends for childhood type 1 diabetes in Europe during 1989-2003 and predicted new cases 2005-2020: a multicentre prospective registration study // Lancet. — 2009. — Vol. 373, № 9680. — P. 2027-2033.
40. Phelps E.A., Cianciaruso C., Michael I.P. et al. Aberrant accumulation of the diabetes autoantigen GAD65 in Golgi membranes in conditions of ER stress and autoimmunity // Diabetes. — 2016. — Vol. 65, № 9. — P. 2686-2699.
41. Pietropaolo M., Yu S., Libman I.M. et al. Cytoplasmic islet cell antibodies remain valuable in defining risk or progression to type 1 diabetes in subjects with other islet autoantibodies // Pediatr. Diabetes. — 2005. — Vol. 6, № 4. — P. 184-192.
42. Raab J., Haupt F., Scholz M. et al. Capillary blood islet autoantibody screening for identifying pre-type 1 diabetes in the general population: design and initial results of the Fr1da study // BMJ Open. — 2016. — Vol. 6, № 5: e011144.
43. Rabin D.U., Pleasic S.M., Shapiro J.A. et al. Islet cell antigen 512 is a diabetes-specific islet autoantigen related to protein tyrosine phosphatases // J. Immunol. — 1994. — Vol. 152. — P. 3183-3187.
44. Röep B.O., Atkinson M. Animal model have little to teach us about type 1 diabetes. In support of this proposal // Diabetologia. — 2004. — Vol. 47, № 10. — P. 1650-1656.
45. Rolandsson O., Hampe Ch.S., Wennberg P. et al. Prevalence and regional distribution of sutoantibodies against GAD65Ab in a European population without diabetes: The EPIC–InterAct Study // Diabetes Care. — 2015. — Vol. 38, № 8. — P. e114-e115.
46. Schlosser M., Lampasona V., Williams A.J.K. et al. Combined appearance of autoantibodies against GAD, IA‑2, insulin and ZnT8 in the islet autoantibody standardization program 2013 proficiency workshop // Diabetologia. — 2014. — Vol. 57, Suppl. 1. — A‑334.
47. Schlosser M., Mueller P.W., Lampasona V. et al. Combined measurement of autoantibodies against GAD, IA‑2, insulin and ZnT8 in the Diabetes Autoantibody Standardization Program 2009 Workshop // Diabetologia. — 2010. — Vol. 53, Suppl. 1. — P. 178.
48. Törn C., Mueller P.W., Schlosser M. et al. Diabetes antibody standardization program: evaluation of assays for autoantibodies to glutamic acid decarboxylase and islet antigen‑2 // Diabetologia. — 2008. — Vol. 51. — P. 846-852.
49. Vehik K., Lynch K.F., Schatz D.A. et al. Reversion of b-cell autoimmunity changes risk of type 1 diabetes: TEDDY Study // Diabetes Care. — 2016. — Vol. 39, № 9. — P. 1535-1542.
50. Vermeulen I., Weets I., Costa O. et al. Seroconversion to persistent antibody-positivity occurs frequently after age 10 and is best predicted by CAD antibodies // Diabetologia. — 2010. — Vol. 53, Suppl. 1. — P. 180.
51. Wenzlau J.M., Frisch L.M., Gardner T.J. et al. Novel antigens in type 1 diabetes: the importance of ZnT8 // Current Diabetes Reports. — 2009. — Vol. 9. — P. 105-112.
52. Wenzlau J.M., Gardner T.J., Yu L. et al. Composite multi-antigen probes enhances detection of type 1 diabetes autoantibodies // Diabetologia. — 2009. — Vol. 52, Suppl. 1. — A‑266.
53. Wenzlau J.M., Juhl K., Yu L. et al. The cation efflux transporter ZnT8 (Slc 30 A8) is a major antiantigen in human type 1 diabetes // Proc. Natl. Acad. Sci. USA. — 2007. — Vol. 104. — P. 17040-17045.
54. Williams A.J., Lampasona V., Schlosser M. et al. Detection of antibodies directed to the N-terminal region of GAD is dependent on assay format and contributes to differences in the specificity of GAD autoantibody assays for type 1 diabetes // Diabetes. — 2015. — Vol. 64, № 9. — P. 3239-3246.
55. Williams A.J., Lampasona V., Wyatt R. et al. Reactivity to N-terminally truncated GAD65(96-585) identifies GAD autoantibodies that are more closely associated with diabetes progression in relatives of patients with type 1 diabetes // Diabetes. — 2015. — Vol. 64, № 9. — P. 3247-3252.
56. Xu P., Krischer J.P. Type 1 Diabetes TrialNet Study Group. Prognostic classification factors associated with development of multiple autoantibodies, dysglycemia, and type 1 diabetes — a recursive partitioning analysis // Diabetes Care. — 2016. — Vol. 39, № 6. — P. 1036-1044.
57. Yu L., Dong F., Miao D. et al. Proinsulin/insulin autoantibodies measured with electrochimiluminescent assay are the earliest indicator of prediabetic islet autoimmunity // Diabetes Care. — 2013. — Vol. 36. — P. 2266-2270.
58. Ziegler A.G., Bonifacio E., and BABYDIAB-BABYDIET Study Group. Age-related islet autoantibody incidence in offspring of patients with type 1 diabetes // Diabetologia. — 2012. — Vol. 55, № 7. — P. 1937-1943.
59. Ziegler A.G., Danne T., Dunger D.B. et al. Primary prevention of beta-cell autoimmunity and type 1 diabetes — The Global Platform for the Prevention of Autoimmune Diabetes (GPPAD) perspectives // Mol. Metab. — 2016. — Vol. 5, № 4. — P. 255-262.
60. Ziegler A.G., Nepom G.T. Prediction and pathogenesis in type 1 diabetes // Immunity. — 2010. — Vol. 32, № 4. — P. 468-478.
61. Ziegler A.G., Bonifacio E., Powers A.C. et al. Type 1 diabetes prevention: a goal dependent on accepting a diagnosis of an asymptomatic disease // Diabetes. — 2016. — Vol. 65, № 11. — P. 3233-3239.
62. Ziegler A.G., Pflueger M., Winkler C. et al. Accelerated progression from islet autoimmunity to diabetes is causing the escalating incidence of type 1 diabetes in young children // J. Autoimmun. — 2011. — Vol. 37, № 1. — P. 3-7.
63. Ziegler A.G., Rewers M., Simell O. et al. Seroconversion to multiple islet autoantibodies and risk of progression to diabetes in children // JAMA. — 2013. — Vol. 309, № 23. — P. 2473-2479.

/16.jpg)
/17.jpg)
/17_2.jpg)