Статтю опубліковано на с. 86-92
Вступ
Коморбідність захворювань визнана визнано загальносвітовою проблемою сучасної медицини, а її дослідження є одним із найважливіших шляхів вдосконалення персоніфікованого лікування пацієнтів із поєднаною патологією та може покращити масштабні соціально-економічні наслідки популяційного характеру [3, 14]. У цьому контексті виникає потреба поглибленого дослідження патології щитоподібної залози (ЩЗ), особливо гіпотиреозу, частота якого останніми десятиріччями зросла з 0,5 до 2–3 % на популяційному рівні [8, 9, 23]. Відомо, що при гіпотиреозі страждають всі функції органів і систем, гірше перебігають та піддаються лікуванню раніше набуті захворювання, клінічно зростають прояви атеросклерозу, кардіоваскулярні ризики та смертність [10, 12, 15, 17, 21].
Маніфестний гіпотиреоз із популяційного рівня 2 % в осіб старше 50, особливо 60 років, зростає до 6–8 %, але субклінічна форма гіпотиреозу зустрічається в 3–4 рази частіше, проте вона не має специфічних клінічних проявів, тому діагностується рідко [8, 13, 15, 18]. Провідними тиреоїдологічними організаціями рекомендується звертати увагу клініцистів усіх профілів на погіршання перебігу і результатів лікування пацієнтів із віковою поліморбідністю та здійснювати скринінг на ранню діагностику субклінічного гіпотиреозу [17]. Відзначається, що навіть незначний дефіцит тиреоїдних гормонів в організмі сприяє посиленню метаболічних розладів, притаманних будь-якому захворюванню чи групі хвороб.
Остеоартроз (ОА) — одне з найбільш поширених вікзалежних захворювань суглобів дегенеративно-дистрофічного характеру з запальним компонентом, якому притаманний високий рівень коморбідності з переважним ураженням різними формами судинних атеросклеротичних захворювань (кардіальної, церебральної локалізації) та системи травлення, раніше набутими чи медикаментозно індукованими [6]. Однак дослідженню патології ЩЗ, особливо гіпотиреозу, при цьому захворюванні та вдосконаленню лікувальної стратегії приділена явно недостатня увага.
З метою уникнення вимушеної поліпрагмазії та побічних ефектів від лікарських засобів при веденні пацієнта з високим рівнем коморбідності пропонується пошук медикаментозних засобів багатогранної метаболічної, регуляторної, поліорганної дії [2]. Одними з таких препаратів можуть бути ліки біологічного, зокрема рослинного, походження, з акцентованою дією на найбільш важливий уражений орган. При маніфестному гіпотиреозі ендокринологами розроблена чітка концепція замісної терапії левотироксином, однак використання цього засобу у випадках субклінічного гіпотиреозу, особливо в осіб старших вікових груп з наявними серцево-судинними захворюваннями до цих пір викликає серйозні дискусії та застереження [8, 9]. Донині триває пошук безпечних та ефективних лікарських засобів лікування хворих із субклінічним гіпотиреозом, які відповідали б також концепції ведення хворих із коморбідними процесами.
Одним із них може бути апробований при ураженнях ЩЗ з різними її функціональними відхиленнями вітчизняний полікомпонентний фітозасіб зобофіт [4, 7]. На нашу думку, складники цього засобу можуть проявляти й іншу дію, впливаючи на коморбідні процеси у хворих на ОА.
Мета дослідження. Вивчити поширеність і форми гіпотиреозу у хворих на ОА та дослідити вплив зобофіту на функціонально-морфологічний стан ЩЗ, прояви коморбідних захворювань та оксидантний статус, фібриноліз, протеоліз у крові хворих на ОА при його застосуванні в комплексному лікуванні цього контингенту хворих.
Матеріал та методи
Обстежено 312 хворих на ОА І–ІІІ клініко-рентгенологічних стадій у віці 37–76 (68,10 ± 6,25) років. Домінуючим контингентом були жінки (254 особи — 81,4 %). Діагноз ОА верифікований згідно з рекомендаціями EULAR (2010) та Наказом МОЗ України № 676 від 12.10.2006 «Клінічний протокол надання медичної допомоги хворим на остеоартроз». Діагнози коморбідних захворювань встановлені згідно з відповідними фаховими протоколами та підтверджені профільними спеціалістами. Тривалість ОА в обстежених була в межах 3–19 (12,20 ± 4,57) років. Переважна більшість коморбідних захворювань виникла на тлі ОА; їх тривалість коливалася в межах 2–9 (4,10 ± 0,62) років. Усі коморбідні захворювання були в стані нестійкої ремісії (цукровий діабет (ЦД) 2-го типу — в стані компенсації) чи медикаментозно керовані. Діагноз гіпотиреозу виставляли згідно з оцінками скарг, пальпацією ЩЗ, ультразвуковим дослідженням (УЗД) ЩЗ, визначенням рівнів тиреотропного гормона (ТТГ), вільного тироксину (Т4), антитіл до тиреоїдної пероксидази (ТПО) радіоімунологічним методом з наступною консультацією ендокринолога.
Згідно із сучасними рекомендаціями, діагноз субклінічного гіпотиреозу встановлювали за рівнів ТТГ в межах 4,1–10 мОД/л, вище 10 мОД/л та з урахуванням клінічних проявів встановлювали діагноз маніфестного гіпотиреозу [17].
Стан про- і антиоксидантної систем крові вивчали за рівнем відновленого глутатіону (ГВ) за О.В. Травіною в модифікації І.Ф. Мещишена, активності глутатіон-S-трансферази та глутатіонпероксидази за І.Ф. Мещишеним [11], рівень малонового альдегіду (МА) в еритроцитах і плазмі крові за А.М. Владимировим і Ю.А. Арчаковим. Фібринолітичну активність плазми крові досліджували за лізисом азофібрину (реактиви фірми Danish Ltd, Львів) з подальшим визначенням сумарної фібринолітичної активності (СФА), неферментативної (НФА) та ферментативної фібринолітичної активності (ФФА) розрахунковим методом ФФА = СФА — НФА [1, 11, 12].
Протеолітичну активність крові вивчали за лізисом азоальбуміну (розпад низькомолекулярних білків), азоказеїну (розпад високомолекулярних білків) та азоколу (розпад колагену) [1, 11, 12].
Досліджували також рівні С-реактивного протеїну (СРП) та фібриногену крові загальноприйнятими методами, швидкість клубочкової фільтрації (ШФК) за формулою Кокрофта — Голта. Рівні ТТГ та вільного Т4 визначали радіоімунологічним методом за допомогою стандартних наборів фірми Amersham (Великобританія), антитіл до ТПО — наборами фірми Immunotech (Чехія). З метою контролю обстежено 30 практично здорових осіб, репрезентативних у віко-статевому відношенні. Базовий лікувальний комплекс включав застосування нестероїдного протизапального засобу, хондропротектора, гастропротектора, місцеве лікування, за потребою — гіпотензивні, антиішемічні, антидіабетичні медикаменти тощо.
Статистична обробка матеріалів здійснена за допомогою ліцензованої комп’ютерної програми Microsoft Excel, версія 2007. Після перевірки даних на нормальність розподілу з використанням критерію Шапіро — Уїлка вірогідність відмінностей показників порівнювальних груп встановлювали за допомогою критерію Манна — Уїтні, t-критерію Стьюдента. Обчислювали середню величину М, стандартне відхилення від середнього значення m. Статистично вірогідними вважали відмінності при р < 0,05.
Результати
Для визначення особливостей поширення й вираженості коморбідних процесів контингент обстежених розподілений на три вікові групи: до 50 років, 51–60 років та старше 60 років. Встановлено, що у віковій групі до 50 років лише в 14 (4,48 %) пацієнтів не виявлено коморбідних захворювань, в інших верифіковано 2–3 захворювання, переважно артеріальна гіпертензія (АГ) І ступеня та набуті раніше чи медикаментозно індуковані гастродуоденопатії з мінімальними клінічними проявами. У всіх хворих старших вікових груп виявляли вже по 4–7 коморбідних процесів із домінуванням кластеру судинних захворювань (АГ ІІ ст., ішемічна хвороба серця (ІХС) різної форми, у тому числі з явищами серцевої недостатності, церебрального чи периферичного атеросклерозу) — у 74,5 % у віковій групі 51–60 років та 81,4 % — у пацієнтів старше 60 років. Меншим кластером були ураження системи травлення (гастродуоденопатії, холецистогепатопанкреатопатії, ентероколопатії): у групі 51–60 років — 52,4 %, старше 60 років — 76,2 %. Третій кластер — метаболічних уражень (ЦД 2-го типу, гіпотиреоз, ожиріння) становив у групі 51–60 років 46,4 %, старше 60 років — 63,8 %, однак цей високий відсоток був переважно за рахунок ожиріння І–ІІ ступеня, оскільки ЦД нами виявлений лише у 20,6 %. Кластер метаболічних уражень переплітався переважно з кластером судинних уражень, меншою мірою — уражень системи травлення. Загальною особливістю всіх коморбідних процесів була тенденція до зростання вираженості клінічних проявів, прогресування зі збільшенням віку пацієнтів та потреба в більшій медикаментозній опіці.
Серед досліджуваного контингенту хворих маніфестні форми гіпотиреозу виявлені лише в 14 осіб (12 жінок, 2 чоловіки), тобто досить мала частка (4,48 %). Усі пацієнти були старше 55 (3 особи) — 60 (11 осіб) років та лікували в подальшому цю хворобу в ендокринолога. Однак за даними УЗ-обстеження різні зміни об’єму і структури ЩЗ виявлені у 138 (44,23 %) осіб. Серед них при дослідженні рівнів ТТГ та вільного Т4 у 14 вищезазначених осіб виявлено рівні ТТГ вище 10,0 мОД/л (коливання 11,6–23,4 мОД/л), у 43 (13,78 %) хворих — підвищення рівня ТТГ в межах 4,12–9,6 мОД/л при нормальних значеннях вільного Т4, що розцінено нами як прояви відповідно маніфестного та субклінічного гіпотиреозу (СГ). При УЗ-дослідженні ЩЗ виявляли переважно дифузні та дифузно-вузлові зміни при незначному збільшенні її розмірів. Рівень антитіл до ТПО в крові вище 50 мОД/л виявлено тільки у 69 (22,1 %) хворих, при тому лише 47 із них мали різні УЗ-ураження ЩЗ, у тому числі 11 пацієнтів із маніфестним гіпотиреозом і 16 — із субклінічним, що давало нам підстави підозрювати автоімунні механізми її пошкодження. Об’єктом подальших наших досліджень були пацієнти з СГ.
Ретельна оцінка проявів ОА та коморбідних захворювань у хворих із СГ за анамнезом не дала нам переконливих доказів негативного впливу останнього на їх перебіг чи результати лікування. Тому нами обрано проспективне піврічне дослідження клінічних особливостей ОА та коморбідних явищ, включаючи СГ, за дії полікомпонентного вітчизняного фітозасобу зобофіт (ТОВ «Нутрімед», Україна), а також його впливу на про- й антиоксидантну системи, фібринолітичну і протеолітичну активність крові, рівні СРП та ШКФ. Такий науковий підхід дозволяв перевірити робочу гіпотезу можливого впливу зобофіту на ОА та коморбідні явища, метаболічні процеси, побудовану на вивченні наукової літератури [5, 7] складу і властивостей рослин — складників зобофіту, що наведені в табл. 1.
/88.jpg)
За наведеними в табл. 1 даними літератури видно, що апробований при захворюваннях ЩЗ засіб зобофіт містить лікарські рослини, які раніше застосовувалися в народній медицині при лікуванні ОА та подагри, атеросклеротичних ураженнях і хворобах нирок, травного каналу. Їх складові мають антиоксидантні, протизапальні, репарантні властивості, а багатий мікроелементний склад може сприяти підвищенню активності металоферментів, синтезу тиреоїдних гормонів.
Згоду на застосування зобофіту в комплексному лікуванні дали 25 із 43 хворих на СГ та ОА (основна група). Інші пацієнти становили групу порівняння. Зобофіт призначали по 2 капсули двічі на день упродовж 3 місяців. Динаміка клініко-біохімічних параметрів врахована через 1 місяць застосування зобофіту, подальша клінічна динаміка та визначення рівнів ТТГ, вільного Т4 — через 3 місяці.
Встановлено, що навіть за суб’єктивними відчуттями хворих основної групи відносно групи порівняння покращився загальний їх стан, помітнішою була дія гіпотензивних, антиішемічних засобів на прояви АГ та ІХС, зменшення суглобового больового синдрому порівняно з попередніми етапами лікування, показники якості життя, включаючи психологічний стан та підвищення толерантності до фізичних навантажень.
Дослідження стану про- та антиоксидантних систем крові показало, що в період загострення ОА на тлі коморбідних захворювань на СГ спостерігається значний їх дисбаланс як прояв оксидативного стресу (табл. 2).
Вже через 1 місяць при застосуванні зобофіту динаміка досліджуваних показників краща, ніж у хворих на СГ групи порівняння. Проте вони ще були вірогідно гірші, ніж у практично здорових осіб, що свідчить про потребу тривалішого використання зобофіту.
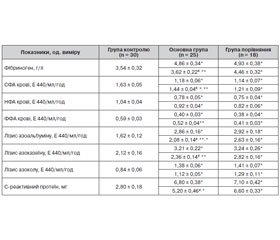
Оскільки гіпотиреоз вважається одним із важливих чинників кардіоваскулярного ризику [16, 20, 22], досліджено стан фібринолітичної і протеолітичної активності плазми крові у цього контингенту хворих, у тому числі за застосування зобофіту (табл. 3).
/90.jpg)
Виявлено, що у хворих на ОА на тлі значного коморбідного фону, в тому числі СГ, в крові початково є суттєве зниження фібринолітичної активності крові (СФА, переважно за рахунок НФА) і вірогідне підвищення рівня фібриногену. Водночас вірогідно підвищена протеолітична активність крові відносно розпаду низькомолекулярних (за лізисом азоальбуміну) та високомолекулярних (за лізисом азоказеїну) білків, меншою мірою — колагену (за лізисом азоколу). Дослідження цих явищ у крові свідчить про існування зростаючих з віковими проявами ОА та коморбідних процесів, у тому числі СГ, катаболічних процесів і зниження фібринолітичних властивостей крові, що є однією із неспецифічних патофізіологічних основ виникнення і прогресування як ОА, так і коморбідних процесів і може бути посилена явищами СГ. Підвищення активності ферментів протеолізу в крові зумовлює розвиток в організмі запальних і деструктивних процесів [1, 20]. Підтвердженням цьому є наявність підвищеного рівня СРП (табл. 3).
За чотиритижневої дії зобофіту також вдалося добитися покращання параметрів сумарної та ферментативної фібринолітичної і протеолітичної (за лізисом азоальбуміну й азоколу) активності крові, рівня СРП відносно групи порівняння, однак ці показники були ще вірогідно гіршими, ніж у практично здорових (табл. 3).
Відомо, що нирки відіграють важливу роль у регуляції судинного тонусу, артеріального тиску (АТ) та виділенні токсичних метаболітів. Щоб уточнити вплив зобофіту на ці процеси, нами досліджена динаміка рівня креатиніну в крові та оцінена ШКФ (табл. 4).
Обговорення результатів
Отримані результати свідчать, що початково у хворих на ОА з високим рівнем коморбідності та СГ спостерігається помірне підвищення рівня креатиніну в крові та помірне зниження ШКФ. Упродовж чотиритижневого застосування зобофіту рівень креатиніну крові вірогідно знизився, а ШКФ підвищилася. У групі порівняння ця динаміка була вірогідно гіршою.
Дослідження рівня ТТГ в крові через 3 місяці показало, що у 20 із 25 хворих, лікованих зобофітом, він був нижче 4,0 (3,3–3,8 мОД/л), а в 5 — у межах 4,3–5,9 мОД/л (середнє значення до лікування — 7,16 ± 1,34, після лікування — 3,70 ± 0,62; р < 0,05). Усі особи із все ще підвищеними рівнями ТТГ були у віці за 65 років. Контрольні УЗ-дослідження ЩЗ показали лише незначне зменшення розмірів ЩЗ, проявів дифузних і вузлових змін; повної нормалізації не встановлено. Побічних ефектів від застосування зобофіту не виявлено. Комплайєнс оцінено як добрий.
Отже, упродовж навіть одномісячного застосування зобофіту в комплексному лікуванні хворих на ОА з віковими явищами коморбідності та СГ вдається добитися помірного клінічного покращання загальних результатів лікування виявлених недуг, особливого судинного характеру, а в крові зменшити прояви оксидативного стресу та рівні порушень фібринолітичної і протеолітичної активності, знизити рівні СРП та креатиніну в крові, покращити ШКФ. Досягнення нормальних значень ТТГ у більшості хворих при застосуванні зобофіту впродовж 3-місячного вживання свідчать про ймовірну достатність такої тривалості. Однак у 1/5 із цього контингенту пацієнтів все-таки його значення вказували про потребу тривалішого періоду використання, особливо в осіб старше 65 років. Слід мати на увазі підвищену схильність осіб старших вікових груп до формування СГ та можливу нестабільність досягнутих результатів.
Проведене нами дослідження підтверджує наявність у фітозасобу зобофіт антиоксидантних, протизапальних, дезагрегантних і седативних властивостей та можливість використовувати його у хворих на ОА з явищами субклінічного гіпотиреозу як альтернативного методу терапії останнього [4, 7].
Враховуючи помірну багатогранну метаболічну, поліорганну дії зобофіту на прояви ОА, коморбідних процесів та явища СГ, його хорошу переносимість, він може розглядатися як засіб оптимізації комплексного лікування таких хворих.
Висновки
1. У хворих на остеоартроз із віковим збільшенням коморбідного фону, особливо у віці за 50 років, доцільно здійснювати скринінгові дослідження на предмет раннього виявлення субклінічного гіпотиреозу (УЗД щитоподібної залози, рівні ТТГ, вільного Т4, антитіл до тиреоїдної пероксидази).
2. Явища субклінічного гіпотиреозу малопомітно впливають на прояви та перебіг остеоартрозу і коморбідних процесів, що є причиною труднощів його ранньої діагностики, і єдиними критеріями до здійснення скринінгу цього патологічного стану є вік старше 50 років та значна коморбідність.
3. Застосування вітчизняного полікомпонентного фітозасобу зобофіт у комплексному лікуванні хворих на остеоартроз з високим фоном коморбідності та субклінічним гіпотиреозом покращує загальні результати лікування виявлених недуг, сприятливо впливає на прояви оксидативного стресу, порушень фібринолітичної і протеолітичної активності крові, зменшує ознаки запалення та покращує швидкість клубочкової фільтрації і тиреоїдний гомеостаз.
Перспективою подальших досліджень може бути вивчення впливу курсового лікування на ліпідний спектр, функціонально-морфологічні порушення в гепатобіліарній системі, обґрунтування застосування підтримуючих курсів зобофіту.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Веремеенко Н.К. Протеолиз в норме и патологии. — К.: Здоров’я, 1993. — 277 с.
2. Коваленко В.М. Коморбідність і шляхи раціональної фармакотерапії в ревматології // Украинский ревматологический журнал. — 2014. — № 2(56). — С. 12-13.
3. Коморбідність і високий кардіоваскулярний ризик — ключові питання сучасної медицини / Г.Д. Фадєєнко, О.Є. Гріднєв, А.О. Несен [та ін.] // Украинский терапевтический журнал. — 2013. — № 1. — С. 102-107.
4. Кравчун Н.А. Клинический опыт применения фитопрепарата Зобофит в терапии аутоиммунного тиреоидита / Н.А. Кравчун // Укр. мед. часопис. — 2010. — № 4(78). — С. 47-48.
5. Лікарські рослини. Енциклопедичний довідник / За ред. акад. Н.М. Гродзінського. — К.: УРЕ, 1991. — 571 с.
6. Національний підручник з ревматології / За ред. акад. В.М. Коваленка, Н.М. Шуби. — К.: Моріон, 2013. — 672 с.
7. Павлюк П.М. Зобофит в лечении и профилактике заболеваний щитовидной железы / П.М. Павлюк // Фітотерапія. Часопис. — 2009. — № 3. — С. 72-73.
8. Паньків В.І. Синдром гіпотиреозу / В.І. Паньків // Міжнародний ендокринологічний журнал. — 2012. — № 5(45). — С. 123-145.
9. Пирс С., Разви С. Субклинический гипотиреоз: практические рекомендации / Перевод В.В. Фадеєва // Thyroid international. — 2012. — № 1. — С. 3-9.
10. Приступюк О.М. Гіпотиреоз: ушкодження органів і систем / О.М. Приступюк // Міжнародний ендокринологічний журнал. — 2011. — № 4(36). — С. 104-109.
11. Сучасні методики експериментальних і клінічних досліджень центральної науково-дослідної лабораторії Буковинської державної медичної академії. Навч. — метод. посібник / В.М. Магаляс, А.О. Міхеєв, Ю.Є. Роговий [та ін.]. — Чернівці, 2001. — 42 с.
12. Тиц Н. Энциклопедия клинических лабораторных тестов: Пер. с англ.; Под ред. В.В. Меньшикова / Н. Тиц. — М.: Лабинформ, 1997. — 960 с.
13. Фадеев В.В. Современные концепции диагностики и лечения гипотиреоза у взрослых / В.В. Фадеев // Проблемы эндокринологии. — 2004. — № 2. — С. 47-53.
14. Фадєєнко Г.Д. Коморбідність та інтегративна роль терапії внутрішніх органів / Г.Д. Фадєєнко, А.О. Несен // Украинский терапевтический журнал. — 2015. — № 2. — С. 7-15.
15. Biondi B. The clinical significance of subclinical thyroid dysfunction / B. Biondi, D.S. Cooper // Endocr. Rev. — 2008. — Vol. 29. — P. 76-131.
16. Cappola A.R., Frid L.P., Arnold A.M. et al. Thyroid status, cardiovascular risk and mortality in older adults. // JAMA. — 2006. — Vol. 295. — P. 1033-1041.
17. Clinical Practice Guidelines for Hypothyroidism in Adults: Cosponsored by the American Association of Clinical Endocrinologists and the American Thyroid Association / Clinical and Experimental Thyroidology. — 2012. — Vol. 8, № 3. — P. 11-12.
18. Crapo L.M. Subclinical hypothyroidism and cardiovascular disease // Arch. Intern. Med. — 2015. — Vol. 165. — P. 2451-2453.
19. Duntas L.H., Mantzon E., Koutras D.A. Effects a six month threatment with selenomethyonine in patients with autoimmune thyroiditis // Eur. J. Endocrinol. — 2003. — Vol. 148(4). — P. 389-393.
20. Erdem T.Y., Ercan M., Ugurlu S. et al. Plasma viscosity, an early cardiovascular risk factor in women with subclinical hypothyroidism // Clin. Hoemorheol. Microcirc. — 2008. — Vol. 38. — P. 219-225.
21. Francesco L., Aldo P. Autoimmune Hypothyroidism // Autoimmune Disease in Endocrinology. — 2007. — Ch. 2. — P. 137-176.
22. Hak A.E., Pols H.A., Visser T.J. et al. Subclinical hypothyroidism is an independent risk factor for atherosclerosis and myocardial infarction in elderly women: the Rotterdam study // Ann. Intern. Med. — 2000. — Vol. 132(4). — P. 270-278.
23. Rodondy N., den Elzen W.P., Bauer D.C. et al. Thyroid Studies Collaboration Subclinical Hypothyroidism an the risk of coronary Heart Disease and Mortality // JAMA. — 2010. — Vol. 304. — P. 1365-1374.

/88.jpg)
/89.jpg)
/90.jpg)