Резюме
Досліджено порушення ліпідних параметрів крові у хворих на ревматоїдний артрит (РА) у поєднанні з артеріальною гіпертензією (АГ), абдомінальним ожирінням (АО) та цукровим діабетом типу 2 (ЦД 2) залежно від поліморфізму гена T-786C ендотеліальної оксиду азоту синтази (eNOS). Матеріал і методи. Етап скринінгу пройшли 60 хворих на ревматоїдний артрит із АГ, АО та ЦД 2 та 20 практично здорових осіб. Поліморфізм гена eNOS (rs2070744) визначали методом полімеразної ланцюгової реакції, а при оцінюванні ліпідного профілю брали до уваги наявність коморбідних станів. Результати. Проведене дослідження показало, що перебіг РА супроводжувався дисліпідемією: рівень загального холестерину (ЗХС), вищий від популяційної норми, наявний у 61,67 % пацієнтів, холестерину ліпопротеїнів низької щільності — майже в кожного другого (45,0 %), тригліцеридів (ТГ) — у 80,0 % осіб, а рівень холестерину ліпопротеїнів високої щільності (ХС ЛПВЩ), навпаки, був нижчим від норми у 2/3 пацієнтів (65,0 %). Типування дисліпідемій засвідчує наявність майже в половини хворих (45,0 %) змішаного ІІb типу за D. Fredrickson, у кожного третього (35,0 %) — ендогенної гіперліпідемії ІV типу (гіпертригліцеридемії). Висновки. Зміни ліпідного обміну з урахуванням поліморфних варіантів гена eNOS (rs2070744) асоціюються з вищим рівнем ТГ у носіїв мутантної С-алелі — на 81,71 % (рТТ = 0,04) і 36,58 % (рТТ = 0,015), а також більшою частотою осіб із рівнем ЗХС, вищим від популяційної норми, серед носіїв СС-генотипу — на 75,0 % (р = 0,005). Натомість серед носіїв дикої Т-алелі частіше наявні особи з нижчим вмістом антиатерогенного ХС ЛПВЩ — на 31,04 % (р = 0,018) і 30,44 % (р = 0,039) та хворі із вищим рівнем ТГ — на 51,72 % (р < 0,001) і 56,52 % (р < 0 ,001) відповідно.
Исследованы нарушения липидных параметров крови у больных ревматоидным артритом (РА) в сочетании с артериальной гипертензией (АГ), абдоминальным ожирением (АО) и сахарным диабетом типа 2 (СД 2) в зависимости от полиморфизма гена T-786C эндотелиальной оксида азота синтазы (eNOS). Материал и методы. Этап скрининга прошли 60 больных ревматоидным артритом с АГ, АО и СД 2 и 20 практически здоровых лиц. Полиморфизм гена eNOS (rs2070744) определяли методом полимеразной цепной реакции, а при оценке липидного профиля принимали во внимание наличие коморбидных состояний. Результаты. Проведенное исследование показало, что течение РА сопровождалось дислипидемией: уровень общего холестерина (ОХС) выше популяционной нормы у 61,67 % пациентов, холестерина липопротеинов низкой плотности — почти у каждого второго (45,0 %), триглицеридов (ТГ) — у 80,0 % лиц, а холестерина липопротеинов высокой плотности (ХС ЛПВП), наоборот, ниже нормы у 2/3 пациентов (65,0 %). Типирование дислипидемий свидетельствует о наличии почти у половины больных (45,0 %) смешанного типа ІІb по D. Fredrickson, у каждого третьего (35,0 %) — эндогенной гиперлипидемии IV типа (гипертриглицеридемии). Выводы. Изменения липидного обмена с учетом полиморфных вариантов гена eNOS (rs2070744) ассоциируются с более высоким уровнем ТГ у обладателей мутантной С-аллели — на 81,71 % (рТТ = 0,04) и 36,58 % (рТТ = 0,015), а также большей частотой лиц с уровнем ОХС выше популяционной нормы среди носителей СС-генотипа — на 75,0 % (р = 0,005). Зато среди носителей дикой Т-аллели чаще наблюдаются лица с низким содержанием антиатерогенного ХС ЛПВП — на 31,04 % (р = 0,018) и 30,44 % (р = 0,039) и больные с высоким уровнем ТГ — на 51,72 % (р < 0,001) и 56,52 % (р < 0,001) соответственно.
We have investigated the violations of blood lipid parameters in patients with rheumatoid arthritis (RA) combined with arterial hypertension (AH), abdominal obesity (AO) and diabetes mellitus type 2 (DM 2) depending on the gene polymorphism T-786C of endothelial nitric oxide synthase (eNOS). Materials and methods. The stage of screening was completed by 60 patients with rheumatoid arthritis, AH, AO and DM 2 and 20 apparently healthy people. The eNOS gene polymorphism (rs2070744) was determined by polymerase chain reaction, and during the evaluation of the lipid profile we took into account the presence of comorbid conditions. Results. The study showed that RA course was associated with dyslipidemia: a cholesterol level above population norm was detected in 61.67 % of patients, low-density lipoprotein cholesterol — almost in every second person (45.0 %), triglycerides (TG) — in 80.0 % of individuals, high-density lipoprotein (HDL) cholesterol, on the contrary, was below normal in 2/3 of patients (65.0 %). Typing of dyslipidemia indicates the presence in almost half of patients (45.0 %) of mixed ІІb type by D. Fredrickson, in every third (35.0 %) — endogenous hyperlipidemia type IV (hypertriglyceridemia). Conclusions. Changes in lipid metabolism taking into account polymorphic variants of eNOS gene (rs2070744) are associated with higher levels of TG in carriers of the mutant С-allele — by 81.71 % (рТТ = 0.04) and 36.58 % (рТТ = 0.015), as well as with a greater number of individuals with cholesterol levels above the population norm, among carriers of СС-genotype — by 75.0 % (p = 0.005). But among carriers of wild T-allele, there are more persons with a low content of antiatherogenic HDL cholesterol — by 31.04 % (p = 0.018) and 30.44 % (p = 0.039), and patients with high levels of TG — by 51.72 % (p < 0.001) and 56.52 % (p < 0.001), respectively.
Вступ
Ревматоїдний артрит (РА) — мультифакторне автоімунне захворювання невідомої етіології, що залишається вагомою проблемою охорони здоров’я в багатьох країнах світу через високу летальність і несприятливий прогноз [6]. Значний інтерес нині викликає зростання частоти серцево-судинної патології серед хворих на РА, пов’язане з прискоренням атерогенезу, в основі якого лежать два взаємозалежних процеси: порушення метаболізму та транспорту ліпідів і локальне запалення судинної стінки на тлі постійно персистуючого автоімунного запального процесу [3]. Окремими дослідженнями було встановлено зв’язок між РА та ішемічною хворобою серця (ІХС) через системну запальну відповідь [20], а також висунуто припущення, що ІХС є проявом позасуглобового РА, спровокованого активним запальним процесом, впливом ліків чи іншими вторинними середниками [19, 23]. Також виявлено, що розвиток ожиріння, артеріальної гіпертензії (АГ), порушення обміну глюкози та ліпідів виникали у 45 % хворих на РА [1, 18, 22].
Відповідно до рекомендацій групи експертів EULAR щодо моніторування кардіоваскулярних ризиків у хворих на РА, у тому числі розвитку та прогресування атеросклерозу, необхідно враховувати рівень ліпідів при оцінці індивідуального та глобального кардіоваскулярних ризиків [14]. У хворих на РА порушення обміну ліпідів відбувається внаслідок порушення процесів мікроциркуляції, перекисного окиснення в клітинних мембранах та впливу ростових факторів [2]. При цьому продукти перекисного окиснення та вільні радикали змінюють баланс між захисними та пошкоджуючими впливами на стінку судини та є своєрідною пасткою для молекул оксиду азоту (NO). Також конкурентно пригнічується активність ендотеліальної NO-синтази (eNOS) асиметричним диметиларгініном, що теж знижує продукцію NO. На додаток холестерин ліпопротеїнів низької щільності (ХС ЛПНЩ) пошкоджує ендотелій судин, зменшуючи транскрипцію й збільшуючи руйнування eNOS [17]. Експресія вищевказаного ферменту також залежить від генетичних чинників. Серед великої кількості генів-кандидатів, структурний поліморфізм яких може викликати експресію eNOS та мати прогностичне значення в розвитку та прогресуванні РА, особлива роль належить гену T-786C ендотеліальної eNOS. За даними низки досліджень, поліморфізм гена eNOS може супроводжуватись пошкодженням біодоступності NO, дисрегуляцією процесів вазоконстрикції/вазодилатації, ендотеліальною дисфункцією, мати протромбогенний і прозапальний ефекти, стимулювати проліферативні процеси в гладеньких м’язах судин, обмежувати оксидацію холестерину проатерогенних ліпопротеїнів низької щільності, відіграючи ключову роль у патогенезі ІХС, серцевої недостатності й АГ [8, 11, 21].
У зв’язку з цим необхідно вивчити вплив частот алелей і генотипів T-786C поліморфізму гена eNOS із змінами ліпідного обміну у хворих на РА, поєднаний з АГ, ожирінням і ЦД 2.
Мета дослідження: визначити залежність змін ліпідного профілю в пацієнтів із РА у поєднанні з ЦД 2, абдомінальним ожирінням (АО), АГ та поліморфізмом гена T-786C eNOS.
Матеріали та методи
У дослідженні взяли участь 60 хворих з РА і супутнім АО, АГ та ЦД 2, які дали письмову інформовану згоду на участь у дослідженні. Групу контролю становили 20 практично здорових осіб, репрезентативних за віком і статтю. Усім хворим було проведено: вимірювання систолічного й діастолічного артеріального тиску, антропометричні вимірювання, зокрема визначали обвід талії та індекс маси тіла (ІМТ), виконували біохімічні аналізи [24]. При ІМТ < 18,5 кг/м2 можна було говорити про дефіцит маси тіла; показники між 18,5–24,9 кг/м2 вважалися нормою, 25–29,9 кг/м2 — надмірна маса тіла, > 30 кг/м2 вказувало на ступені АО [10]. Встановлення й верифікація клінічного діагнозу РА, коморбідних захворювань здійснювались згідно з відповідними настановами та наказами Міністерства охорони здоров’я України [15]. Середній вік пацієнтів становив 48,03 ± 14,91 року, а тривалість захворювання була в межах від одного до 32 років (12,17 ± 8,83 року). Серед обстежених було 71,67 % (43) жінок, 28,33 % (17) чоловіків.
Дослідження поліморфізму Т-786С гена eNOS проводили методом полімеразної ланцюгової реакції у державному закладі «Референс-центр» з молекулярної діагностики МОЗ України (м. Київ). Геномну ДНК виділяли з периферійної крові за допомогою комерційної тест-системи innuPREP Blood DNA Mini Kit (Analytik Jena, Німеччина) з використанням центрифужних фільтрів. Для визначення поліморфних варіантів гена eNOS (T-786C) (rs2070744) [12] використовували модифіковані протоколи з олігонуклеотидними праймерами та подальшим аналізом поліморфізму довжини рестрикційних фрагментів. Досліджувані ділянки генів ампліфікували за допомогою специфічних олігонуклеотидних праймерів (Metabion, Німеччина) (прямого 5’-TGGAGAGTGCTGGTGTACCCA-3’ та зворотного 5’-GCCTCCACCCCCACCCTGTC-3’). Специфічні фрагменти гена eNOS (T-786C) ампліфікували із застосуванням комерційного набору Dream Taq Green PCR Master Mix (2x) (Thermo Scientific, США). Пробірки з готовою ампліфікаційною сумішшю ставили в ампліфікатор Flex Cycler BU (Analytic Jena, Німеччина) для забезпечення відповідного температурного режиму. Після цього продукти ампліфікації фрагментів ДНК гена eNOS (T-786C) підлягали гідролітичному розщепленню за допомогою ендонуклеази рестрикції MspI FastDigest (Thermo Scientific, США). Рестрикцію проводили в мікротермостаті при 37 °С протягом однієї години. Стан рестрикційних фрагментів аналізували в 4% агарозному гелі (агароза фірми Cleaver Scientific, Великобританія) з додаванням бромистого етидію та подальшою візуалізацією за допомогою трансілюмінатора. Обробляли отримане зображення в програмі Vitran.
Для вивчення асоціації поліморфізму гена eNOS (rs2070744) зі змінами ліпідного профілю провели аналіз вмісту в плазмі загального холестерину (ЗХС), холестерину ліпопротеїнів високої щільності (ХС ЛПВЩ) із подальшим розрахунком індексу атерогенності (ІА), а також холестерину ліпопротеїнів низької щільності, тригліцеридів (ТГ) у дослідній та контрольній групах (табл. 2). За популяційну норму ліпідів приймали показники, що відповідали вітчизняним, європейським та загальносвітовим стандартам відповідно до діючих європейських (ESC, ESH, 2013) [13,16], американських (AHA/ACC/TOS, 2013) [9] та вітчизняних рекомендацій [4, 5, 7], брали до уваги наявність коморбідних станів — АГ, ЦД 2, АО: для ЗХС — < 4,5 ммоль/л для осіб високого серцево-судинного ризику (ССР), < 4,0 ммоль/л для осіб украй високого ССР; для ХС ЛПНЩ — < 2,5 ммоль/л із високим ССР, < 1,8 ммоль/л із вкрай високим ССР; для ТГ — < 1,7 ммоль/л; для ХС ЛПВЩ — > 1,04 ммоль/л для чоловіків, > 1,29 ммоль/л для жінок. За цільовий ІА для осіб віком до 30 років приймали < 2,5 ум.од., понад 30 років < 3,5 ум.од.
Статистичну обробку даних здійснювали за допомогою пакета IBM SPSS Statistics® 23.0 та Microsoft Excel 2007. Вірогідність відмінностей у розподілі частот алелей і генотипів між групами визначали за критерієм χ2. Правильність розподілу частот генотипів визначалася відповідністю рівноваги Hardy — Weinberg. Для визначення відносного ризику розвит–ку РА розраховували співвідношення шансів (СШ) із довірчим інтервалом (ДІ) 95 %. Статистично вірогідними вважали відмінності при р < 0,05.
Результати
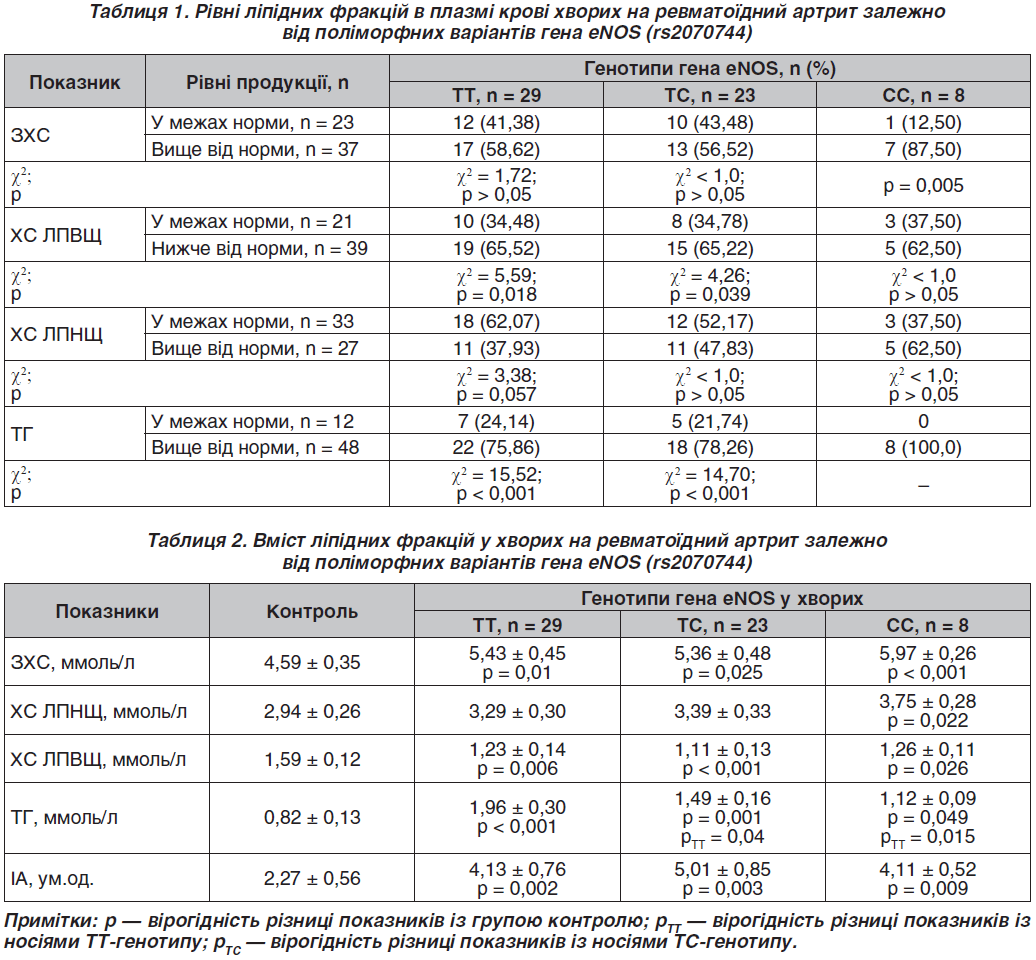
Рівні ліпідних фракцій у плазмі крові хворих на РА залежно від поліморфних варіантів гена eNOS (rs2070744) наведено в табл. 1. Рівень ЗХС був вищим від популяційної норми в 61,67 % пацієнтів, ХС ЛПНЩ — майже в кожного другого (45,0 %), ТГ — у 80,0 % осіб, а ХС ЛПВЩ, навпаки, був нижчим від норми майже у 2/3 пацієнтів (65,0 %). Типування дисліпідемій засвідчує наявність майже в половини хворих (45,0 %) змішаного ІІb типу за D. Fredrickson, у кожного третього (35,0 %) — ендогенної гіперліпідемії ІV типу (гіпертригліцеридемія).
Серед носіїв СС-генотипу частіше відзначали осіб із рівнем ЗХС вище від популяційної норми — на 75,0 % (р = 0,005). Натомість серед носіїв дикої Т-алелі частіше виявляли осіб із нижчим вмістом антиатерогенного ХС ЛПВЩ — на 31,04 % (р = 0,018) і 30,44 % (р = 0,039) та вищим рівнем ТГ — на 51,72 % (р < 0,001) і 56,52 % (р < 0,001) відповідно (табл. 1).
У хворих на РА спостерігали більший вміст ЗХС, ТГ та вищий розрахунковий ІА, ніж у групі контролю, — у 1,17–2,39 раза (р ≤ 0,04–0,001) при нижчій концентрації ХС ЛПВЩ — на 20,75–30,19 % (р ≤ 0,026–0,001) (табл. 2). Рівень ТГ з урахуванням алельного стану гена eNOS (rs2070744) був вищим у носіїв С-алелі порівняно з особами з ТТ-генотипом — на 81,71 % (рТТ = 0,04) і 36,58 % (рТТ = 0,015). За рештою показників вірогідних відмінностей залежно від поліморфних варіантів гена eNOS не встановили.
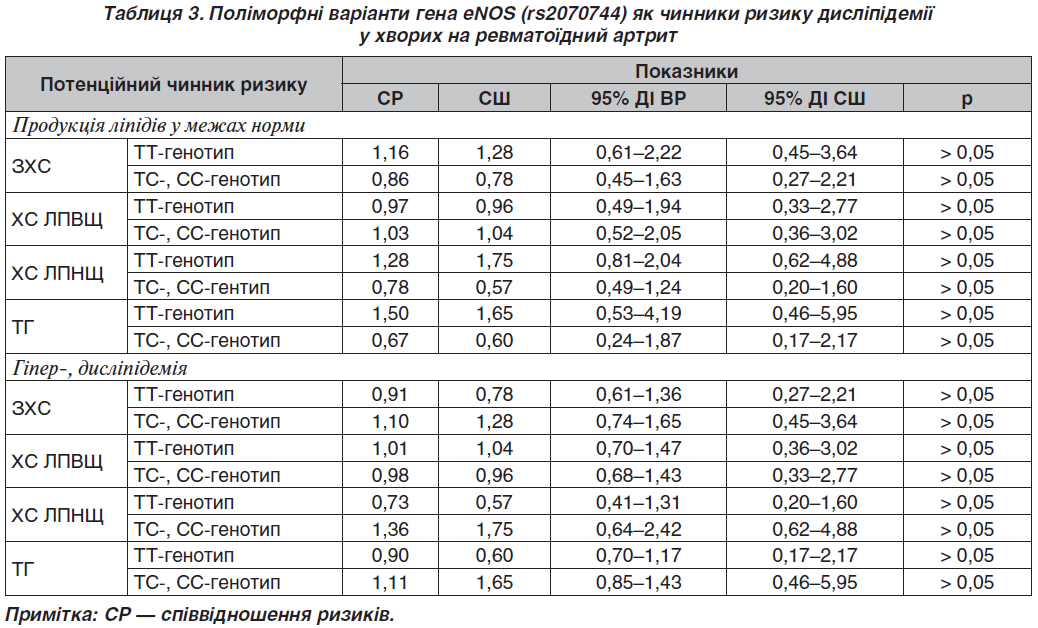
Аналізуючи ризик змін продукції ліпідних фракцій з урахуванням генотипів гена eNOS, встановили, що генотипи аналізованого гена не є чинниками ризику дисліпідемії в обстежених хворих на РА (табл. 3).
Обговорення результатів
Основний контингент хворих на РА формують жінки молодого й середнього віку, тому дослідники розглядають можливість розвитку передчасного, раннього атеросклерозу в цій популяції, причини та механізми якого залишаються остаточно не з’ясованими [18]. При цьому використання загальнопопуляційних підходів для обчислення ризику серцево-судинних захворювань у пацієнтів з автоімунними захворюваннями вважається недостатньо надійним [14, 20]. Експертні групи рекомендують підвищувати показник ризику, визначений за допомогою системи SCORE, при роботі з ревматологічними хворими у 1,5–2 рази, хоча чіткі доказові рекомендації щодо такого підходу не розроблені, а результати клінічних досліджень в основному стосуються хворих із країн з низьким загальним ризиком розвитку серцево-судинної патології, до яких Україна, на жаль, не належить [3].
Hа сьогодні популяційний атеросклероз вже не розглядається як повільно прогресуючий, пов’язаний із метаболічними змінами та віком необоротний процес потовщення судинної стінки. Cучаcними дослідженнями встановлено, що атерогенез є запальним та імунозалежним процесом, який характеризується активацією T-лімфоцитів, макрофагів, супроводжується виділенням широкого спектра прозапальних цитокінів, які відіграють основну роль як на початкових стадіях формування атеросклеротичного ураження судин, так і в процесі дестабілізації бляшок і тромбоутворенні, що клінічно пов’язано з гострими судинними катастрофами [14]. Важливим патогенетичним механізмом формування й прогресування атеросклеротичного ураження є розвиток дисфункції ендотелію судин, що супроводжується експресією судинних молекул адгезії й призводить до активації міграції лейкоцитів, моноцитів, T-лімфоцитів у судинну стінку вже на ранніх стадіях формування атеросклерoтичної бляшки. Tригерами розвитку дисфункції та активації ендотелію є відомі фактори ризику IXC: підвищені рівні ЛПHЩ, ТГ, АГ, тютюнопаління, ожиріння, інсулінорезистентність. Показано, що прозапальні цитокіни (фактор некрозу пухлини, інтерлейкін IL-1, IL-4 тощо) є медіаторами експресії молекул адгезії і таким чином можуть призводити до активації ендотелію та прогресування атеросклерозу незалежно від рівня ЛПHЩ.
Отримані нами дані свідчать, що перебіг РА супроводжується дисліпідемією. У 61,67 % обстежених пацієнтів рівень ЗХС вище від популяційної норми, вміст ХС ЛПНЩ підвищений у 45 %, ТГ — у 80,0 % осіб. При цьому вміст ХС ЛПВЩ був нижче від норми в 65 % пацієнтів. Типування дисліпідемій засвідчує наявність майже в половини хворих (45,0 %) змішаного ІІb типу, у 35 % — ендогенної гіперліпідемії ІV типу (гіпертригліцеридемії).
Встановлено, що зміни ліпідного метаболізму із урахуванням поліморфних варіантів гена eNOS (rs2070744) асоціюються з вищим рівнем ТГ у носіїв мутантної С-алелі — на 81,71 % (рТТ = 0,04) і 36,58 % (рТТ = 0,015), а також більшою частотою осіб із рівнем ЗХС вище від популяційної норми серед носіїв СС-генотипу — на 75,0 % (р = 0,005). У той же час серед носіїв дикої Т-алелі частіше наявні особи з нижчим вмістом антиатерогенного ХС ЛПВЩ — на 31,04 % (р = 0,018) і 30,44 % (р = 0,039) та хворі із вищим рівнем ТГ — на 51,72 % (р < 0,001) і 56,52 % (р < 0,001) відповідно.
Перспективи подальших досліджень полягають у розробці диференційованого підходу до профілактики серцево-судинних ускладнень та раптової коронарної смерті в пацієнтів із РА шляхом корекції змін ліпідного обміну.
Висновки
1. Перебіг РА супроводжується дисліпідемією: рівень ЗХС, вищий від популяційної норми, наявний у 61,67 % пацієнтів, ХС ЛПНЩ — майже в кожного другого (45,0 %), ТГ — у 80,0 % осіб, а ХС ЛПВЩ, навпаки, нижче від норми у 2/3 пацієнтів (65,0 %). Типування дисліпідемій засвідчує наявність майже в половини хворих (45,0 %) змішаного ІІb типу за D. Fredrickson, у кожного третього (35,0 %) — ендогенної гіперліпідемії ІV типу (гіпертригліцеридемії).
2. Зміни ліпідного обміну з урахуванням поліморфних варіантів гена eNOS (rs2070744) асоцію–ються з вищим рівнем ТГ у власників мутантної С-алелі — на 81,71 % (рТТ = 0,04) і 36,58 % (рТТ = 0,015), а також більшою частотою осіб із рівнем ЗХС вище від популяційної норми серед носіїв СС-генотипу — на 75,0 % (р = 0,005). Натомість серед носіїв дикої Т-алелі частіше наявні особи з нижчим вмістом антиатерогенного ХС ЛПВЩ — на 31,04 % (р = 0,018) і 30,44 % (р = 0,039) та хворі із вищим рівнем ТГ — на 51,72 % (р < 0,001) і 56,52 % (р < 0,001) відповідно.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Визир В.А. Иммунопатология атеросклероза. Значение биологических маркеров в оценке кардиоваскулярного риска / В.А. Визир, А.Е. Березин // Український медичний часопис. — 2010. — № 2(76). — III/IV. — С. 76-83.
2. Встречаемость хронической болезни почек и ее структура у больных ревматоидным артритом / А.П. Ребров, Е.В. Волошинова, М.А. Тяпкина // Клин. нефрол. — 2011. — № 6. — С. 32-35.
3. Вплив імунного статусу й ліпідних факторів на прогресування субклінічного атеросклерозу та розвиток серцево-судинних захворювань у пацієнтів із ревматоїдним артритом / В.М. Коваленко, Л.В. Хіміон, Г.І. Лисенко, Е.А. Гарміш // Український ревматологічний журнал. — 2011. — № 43(1). — С. 9-14.
4. Дисліпідемії: діагностика, профілактика та лікування. Методичні рекомендації Асоціації кардіологів України 2011 р. / Робоча група з проблем метаболічного синдрому, діабету та серцево-судинних захворювань: О.І. Мітченко, М.І. Лутай, Є.П. Свіщенко [та ін.] // Новости медицины и фармации. — 2011. — № 19(391). — С. 11-15.
5. Наказ МОЗ України № 564 від 13.06.2016 «Адаптована клінічна настанова, заснована на доказах «Профілактика серцево-судинних захворювань» / МОЗ. — К.: МОЗ, 2016. — Режим доступу: http://www.dec.gov.ua/mtd/reestr.html
6. Насонов Е.Л. Ревматология: Национальное руководство / Е.Л. Насонов, В.А. Насонова. — М.: Гэотар-Медиа, 2008. — 714 с.
7. Настанова та клінічний протокол надання медичної допомоги «Артеріальна гіпертензія». Наказ МОЗ України від 24.05.2012 № 384 «Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги при артеріальній гіпертензії» / Робоча група з артеріальної гіпертензії Української асоціації кардіологів. — К.: МОЗ, 2012. — 108 с.
8. Сидорчук Л.П. Фармакогенетика артеріальної гіпертензії / Л.П. Сидорчук. — Чернівці: БДМУ, 2010. — 532 с.
9. 2013 AHA/ACC/TOS Guideline for the Management of Overweight and Obesity in Adults: A Report of the American College of Cardiology American Heart Association Task Force on Practice Guidelines and The Obesity Society / M.D. Jensen, D.H. Ryan, C.M. Apovian [et al.] // Circulation. — 2013. — Online Version: http://circ.ahajournals.org/content/early/2013/11/11/01.cir.0000437739.71477.ee.citation
10. Association of the HLA-DRB1 gene with premature death, particularly from cardiovascular disease, in patients with rheumatoid arthritis and inflammatory polyarthritis / T.M. Farragher, N.J. Goodson, H. Naseem [et al.] // Arthritis Rheum. — 2008. — Vol. 58. — P. 359-369.
11. Endothelial nitricoxide synthase gene intron 4 VNTR polymorphism in patients with coronary artery disease in Iran / S. Salimi, M. Firoozrai, I. Nourmohammadi [et al.] // Indian J. Med. Res. — 2006. — Vol. 124. — P. 683-688.
12. Endothelial Nitric Oxide Synthase (eNOS) gene polymorphisms and their association with Type 2 diabetes related traits in Mexican Americans / F. Thameem, S. Puppala, N.H. Arar // Diab. Vasc. Dis. Res. — 2008. — Vol. 5(2). — P. 109.
13. 2013 ESC/ESH Guideline for the Management of Arterial Hypertension / Task Force for the Management of Arterial Hypertension of ESH and ESC Members: G. Mancia, R. Fagard, K. Narkiewicz [et al.] // J. Hypertens. — 2013. — Vol. 31. — P. 1281-1357. — Режим доступу: http://www.esh2013.org/wordpress/wp-content/uploads/2013/06/ESC-ESH-Guidelines-2013.pdf
14. EULAR evidence-based recommendations for cardiovascular risk management in patients with rheumatoid arthritis and other forms of inflammatory arthritis / M.J.L. Peters, D.P.M. Symmons, D.Mc. Carey [et al.] // Ann. Rheum. Dis. — 2010. — Vol. 69. — P. 325-331.
15. EULAR evidence-based recommendations for the diagnosis of knee osteoarthritis / W. Zhang, M. Doherty, G. Peat [et al.] // Ann. Rheum. Dis. — 2010. — Vol. 69. — P. 483-489.
16. 2016 European Guidelines on cardiovascular disease prevention in clinical practice / The Sixth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of 10 societies and by invited experts) Members: M.F. Piepoli, A.W. Hoes, S. Agewall [et al.] // European Heart J. — 2016. — Vol. 37. — P. 2315-2381.
17. Guzik T.J. Nitricoxide and superoxide in inflammation and immune regulation / T.J. Guzik, R. Korbut, T. Adamek-Guzik // J. Physiol. Pharmacol. — 2003. — Vol. 54. — P. 469-87.
18. Inflammation and atherosclerosis in rheumatoid arthritis / R.J. Stevens, K.M. Douglas, A.N. Saeatzis [et al.] // Expert Rev. Mol. Med. — 2005. — Vol. 7. — P. 1-24.
19. Pasceri V. A tale of two diseases: atherosclerosis and rheumatoid arthritis / V. Pasceri, E.T. Yeh // Circulation. — 1999. — Vol. 100. — P. 2124-6.
20. Snow M.H. Rheumatoid arthritis and cardiovascular di–sease: the role of systemic inflammation and evolving strategies of prevention / M.H. Snow, T.R. Mikuls // Curr. Opin. Rheumatol. — 2005. — Vol. 17. — P. 234-41.
21. Tamemoto H. Association of the Glu 298 Asp polyrnorphism of the eNOS gene with ischemic heart disease in Japanese diabetic subjects / H. Tamemoto, S.E. Ishikawa, M. Kawakami // Diabetes Res. Clin. Pract. — 2008. — Vol. 80. — P. 275-279.
22. Van Doornum S. Accelerated atherosclerosis: an extraarti–cular feature of rheumatoid arthritis? / S. Van Doornum, G. McColl, I.P. Wicks // Arthritis Rheum. — 2002. — Vol. 46. — P. 62-73.
23. Wolfe F. Increase in cardiovascular and cerebrovascular disease prevalence in rheumatoid arthritis / F. Wolfe, B. Freundlich, W.L. Straus // J. Rheumatol. — 2003. — Vol. 30. — P. 36-40.
24. Yoo W.H. Dyslipoproteinemia in patients with active rheumatoid arthritis: effects of disease activity, sex and menopausal status on lipid profiles / W.H. Yoo // J. Rheumatol. — 2004. — Vol. 31. — P. 1746-1753.