Резюме
Актуальність. Інгаляційні глюкокортикостероїди (іГКС) відіграють зараз провідну роль у лікуванні бронхіальної астми (БА) на етапі як досягнення, так і підтримки повного контролю за клінічними симптомами захворювання. Відомо, що застосування іГКС у високих дозах може супроводжуватися системними побічними ефектами, найбільш тривожним із них є пригнічення функціональної активності гіпоталамо-гіпофізарно-надниркової системи. Проте особливості перебігу захворювання та зміни кортизол-продукуючої функції надниркових залоз у дітей, які отримують іГКС, вивчені недостатньо. Мета роботи. Дослідження клінічних особливостей БА у дітей, які отримують базисну протизапальну терапію іГКС, з урахуванням стану кортизол-продукуючої функції надниркових залоз. Матеріали та методи. Для досягнення мети дослідження методом простої випадкової вибірки комплексно обстежено когорту з 45 дітей шкільного віку, хворих на БА, які отримували іГКС у складі базисного лікування. Вивчення особливостей перебігу БА у хворих проводили у двох групах, залежно від значення сироваткового кортизолу (СК), що або не досягало мінімального показника норми (< 50,0 нг/мл, 20 дітей), або перевищувало його (СК > 50,0 нг/мл, 25 дітей). Результати. Захворювання мало тенденцію до тяжчого варіанта клінічних проявів у хворих зі зниженням кортизол-продукуючої функції надниркових залоз. Попри відсутність статистично вірогідних розбіжностей за маркерами тяжкості перебігу БА, показники її контролю за даними клініко-інструментальної оцінної шкали виявилися вірогідно гіршими у хворих із показниками СК < 50,0 нг/мл, у першу чергу за рахунок клінічної складової цієї шкали. За даними клініко-епідеміологічного аналізу встановлений ризик вмісту СК > 50,0 нг/мл (як маркера збереженої кортизол-продукуючої функції надниркових залоз) за використання низьких доз іГКС. Так, відношення шансів даної події становило 3,14, відносний ризик — 1,5, абсолютний ризик — 0,26. При цьому використання середніх доз іГКС асоціювало з незначно підвищеним ризиком пригнічення кортизол-продукуючої функції надниркових залоз (за даними СК < 50,0 нг/мл): відношення шансів — 3,14, відносний ризик — 2,1, абсолютний ризик — 0,26. Висновки. Перебіг БА у школярів з умістом СК < 50,0 нг/мл характеризується вираженими клінічними ознаками атопії з «накопиченням» коморбідності, тяжчим перебігом у міжприступному і приступному періодах, а також гіршим контролем за захворюванням при незначно довшій його тривалості. При цьому низькі дози іГКС у 3,14 раза підвищують імовірність збереження кортизол-продукуючої функції надниркових залоз, а середні дози асоціюють з аналогічним пригніченням даної функції.
Актуальность. Ингаляционные глюкокортикостероиды (иГКС) сейчас играют ведущую роль в лечении бронхиальной астмы (БА) на этапе как достижения, так и поддержки полного контроля над клиническими симптомами заболевания. Известно, что применение иГКС в высоких дозах может сопровождаться системными побочными эффектами, наиболее тревожным из которых является подавление функциональной активности гипоталамо-гипофизарно-надпочечниковой системы. Однако особенности течения заболевания и изменения кортизол-продуцирующей функции надпочечников у детей, получающих иГКС, изучены недостаточно. Цель работы. Исследование клинических особенностей БА у детей, получающих базовую противовоспалительную терапию иГКС, с учетом состояния кортизол-продуцирующей функции надпочечников. Материалы и методы. Для достижения цели исследования методом простой случайной выборки комплексно обследована когорта из 45 детей школьного возраста, больных БА, получавших иГКС в составе базисного лечения. Изучение особенностей течения БА у больных проводили в двух группах, в зависимости от значения сывороточного кортизола (СК), которое либо не достигало минимального показателя нормы (< 50,0 нг/мл, 20 детей), либо превышало его (СК > 50,0 нг/мл, 25 детей). Результаты. Заболевание имело тенденцию к тяжелому варианту клинических проявлений у больных со снижением кортизол-продуцирующей функции надпочечников. Несмотря на отсутствие статистически достоверных различий по маркерам тяжести БА, показатели ее контроля, по данным клинико-инструментальной оценочной шкалы, оказались достоверно хуже у больных с показателями СК < 50,0 нг/мл, в первую очередь за счет клинической составляющей. По данным клинико-эпидемиологического анализа установлен риск содержания СК > 50,0 нг/мл (как маркера сохраненной кортизол-продуцирующей функции надпочечников) при использовании низких доз иГКС. Так, соотношение шансов данного события составило 3,14, относительный риск — 1,5 и абсолютный риск — 0,26. При этом использование средних доз иГКС ассоциировало с незначительно повышенным риском угнетения кортизол-продуцирующей функции надпочечников (по данным СК < 50,0 нг/мл): соотношение шансов — 3,14, относительный риск — 2,1 и абсолютный риск — 0,26. Выводы. Таким образом, течение БА у школьников с содержанием сывороточного кортизола менее 50,0 нг/мл характеризуется выраженными клиническими признаками атопии с «накоплением» коморбидности, более тяжелым течением в периодах ремиссии и обострения, а также худшим контролем над заболеванием при его более длительной продолжительности. При этом низкие дозы иГКС в 3,14 раза повышают вероятность сохранения кортизол-продуцирующей функции надпочечников, а средние дозы ассоциируют с аналогичным подавлением данной функции.
Background. Nowadays, inhalation glucocorticosteroids (IGCS) play a leading role in the treatment of bronchial asthma (BA), both on the stage of achieving and maintaining a complete control of clinical signs of the disease. IGCS administration in high doses is known to be associated with systemic side effects, one of the most troubled of which is inhibition of the functional activity of the hypothalamic-pituitary-adrenal system. Nevertheless, the peculiarities of the diseases course and changes of the adrenal cortisol-producing function in children receiving IGCS are not studied sufficiently. The purpose of the study was to examine clinical peculiarities of bronchial asthma in children receiving basic anti-inflammatory therapy with IGCS considering the state of the adrenal cortisol-producing function. Materials and methods. To achieve the purpose of the study, the cohort of 45 schoolchildren suffering from BA receiving IGCS as a part of basic therapy were examined comprehensively by means of simple random sampling. Peculiarities of BA course in patients were examined in two groups depending on the value of serum cortisol (SC) that was either lower than minimal value of the norm (< 50.0 ng/ml, 20 children), or higher than it (> 50.0 ng/ml, 25 patients). Results. The disease had a tendency to severe type of clinical manifestations in patients with low adrenal cortisol-producing function. In spite of the lack of statistically reliable differences by the markers concerning BA severity, the control indices according to the data of clinical-instrumental estimating scale appeared to be reliably worse in patients with the parameters of SC < 50.0 ng/ml, first of all at the expense of its clinical constituent. According to the data of clinical and epidemiological analysis, the risk of SC content more than 50.0 ng/ml (as a marker of preserved adrenal cortisol-producing function) was found with the use of low doses of IGCS — odds ratio of this event was 3.14, a relative risk — 1.5, and absolute risk — 0.26. At the same time, the use of average doses of IGCS was associated with inconsiderably high risk of inhibition of the adrenal cortisol-producing function (by the data of SC < 50.0 ng/ml): odds ratio — 3.14 (95% confidence interval (CI) 0.4–26.6), relative risk — 2.1 (95% CI 0.3–12.6), and absolute risk — 0.26. Conclusions. Therefore, the course of BA in schoolchildren with the content of serum cortisol less than 50.0 ng/ml is characterized by pronounced clinical signs of atopy with “accumulation” of comorbidity, more severe control of the disease with its longer duration. At the same time, 3.14 times lower doses of IGCS increase the probability of maintaining the adrenal cortisol-producing function, and average doses are associated with similar inhibition of this function.
Вступ
Інгаляційні глюкокортикостероїди (іГКС) відіграють зараз провідну роль у профілактичному лікуванні бронхіальної астми (БА) як на етапі досягнення, так і підтримки повного контролю за клінічними симптомами захворювання. Застосування цих препаратів спочатку було спрямоване на зменшення використання системних ГКС у хворих на БА через низку побічних ефектів останніх. Глюкокортикостероїди виявилися ефективними при лікуванні БА завдяки різнобічній протизапальній дії, що охоплює численні впливи на транскрипцію багатьох генів, пригнічення надмірної активності ефекторних клітин [1], вони здатні зменшувати ангіогенез бронхіальної стінки та гіперплазію келихоподібних клітин [2]. На фоні протизапального ефекту іГКС у дихальних шляхах зменшується їх гіперреактивність на неспецифічні провокаційні чинники [3], нормалізується функція легень, поліпшується якість життя хворих, зменшується частота і вираженість симптомів БА й астматичних нападів, що призводять до госпіталізації або смерті [4].
Незважаючи на достатню безпеку, дана група лікарських засобів не позбавлена побічних ефектів, причому особливої гостроти набуває це питання при тривалих курсах лікування у дітей дошкільного та шкільного віку. Кандидоз слизової порожнини рота, захриплість (дисфонія) є найбільш поширеними та загальновизнаними побічними ефектами терапії іГКС, і ці ефекти легко усуваються. Відомо, що застосування іГКС у високих дозах може супроводжуватися системними побічними ефектами, найбільш тривожним з них є пригнічення функціональної активності гіпоталамо-гіпофізарно-надниркової системи [5]. Так, зміни функції надниркових залоз були відзначені у пацієнтів, які отримували беклометазону дипропіонат та будесонід у дозах, що перевищували 1500 мкг/добу [6]. У дослідженнях F. Lapi та співавт. (2013) показано, що поточне використання високих доз іГКС збільшує ризик розвитку надниркової недостатності [7]. Проте особливості перебігу захворювання та зміни кортизол-продукуючої функції надниркових залоз у дітей, які отримують іГКС в інших режимах доз вивчене недостатньо, а існуючі відомості є почасти доволі суперечливими.
Мета роботи: дослідити клінічні особливості БА у дітей, які отримують базисну протизапальну терапію інгаляційними глюкокортикостероїдами, з урахуванням стану кортизол-продукуючої функції надниркових залоз.
Матеріали та методи
Для досягнення мети дослідження методом простої випадкової вибірки комплексно обстежено когорту з 45 дітей шкільного віку, хворих на БА. У роботі використані класифікація та менеджмент БА за відповідним протоколом діагностики й лікування захворювання в дітей [8]. Хлопчики становили 58,3 % усіх обстежених, а решту 41,3 % — дівчатка. Середній вік обстежених хворих — 10,1 ± 0,4 (95% довірчий інтервал (ДІ) — 9,3–10,9) (min 6 — max 15) року, а тривалість захворювання на БА сягала 5,4 ± 0,5 (95% ДІ — 4,3–6,4) (min 1 — max 13) року. Легкий персистуючий перебіг астма мала у 10,4 % випадків, середньотяжкий зареєстровано у 22 (45,8 %) хворих, а тяжке персистування — у 43,8 % спостережень.
Середня доза іГКС, що за добу отримували обстежені хворі, у складі базисної терапії становила 394,2 ± 49,6 (95% ДІ — 293,3–495,2) (min 100 — max 1200) мг/добу. Беклометазону дипропіонат отримували 28,6 % хворих, будесонід — 22,90 %, а флутиказон — 14,3 % пацієнтів. Решта пацієнтів отримували різні іГКС у складі базисного лікування. Зазначені препарати іГКС у режимі низьких доз застосовували у 31,3% хворих, середні дози препаратів іГКС — у 39,6 %, а високодозове лікування проводилося 8,3 % хворих. Решта пацієнтів у міжприступному періоді отримувала інший склад базисного лікування.
За допомогою імуноферментного аналізу, проведеного імунологічною лабораторією обласної дитячої клінічної лікарні м. Чернівців, у сироватці периферичної крові визначали концентрацію сироваткового кортизолу (СК) (реактиви Diameb, Україна) як маркера регуляції функції надниркових залоз. Середній уміст СК у когорті обстежених хворих становив 131,9 ± 10,0 (95% ДІ — 112,1–151,8) (min 5,0 — max 430,0) нг/мл при нормі виробника 50,0–230,0 нг/мл. Вивчення особливостей перебігу БА у хворих проводили у двох групах, залежно значення СК, яке або не досягало мінімального показника норми (< 50,0 нг/мл), або перевищувало його (СК > 50,0 нг/мл). До складу 1-ї групи увійшло 20 хворих, до складу 2-ї групи — решта 25 дітей. За основними клінічними характеристиками групи були порівнянні, а встановлені незначні відмінностей не мали суттєвого впливу на результати дослідження, що свідчило про мінімальний ризик систематичної помилки.
Бальна оцінка контролю БА здійснювалася за допомогою клініко-інструментальної оцінної шкали (КІО) [9], згідно з якою 10 і нижче балів відображували контрольовану БА, 11–16 балів — частково контрольоване захворювання, а вище 17 балів — неконтрольований варіант БА. Тяжкість бронхообструктивного синдрому під час загострення захворювання, при надходженні дітей до стаціонару, оцінювали за багатобальною системою впродовж перших 7 днів госпіталізації [10], згідно з якою посилення ознак бронхіальної обструкції відображувалося зростанням суми балів бронхіальної обструкції.
Статистичний аналіз отриманих результатів здійснювали за допомогою пакета програм Statistica -v. 6.0 (StatSoft, США). При порівнянні середніх абсолютних значень використовували критерій Стьюдента (Pt), для порівняння двох часток (у %) — критерій кутового перетворення Фішера (Pφ). При проведенні популяційного аналізу оцінювали відносний ризик (ВР), а також відношення шансів (ВШ) реалізації події з обчисленням їх довірчих інтервалів (95% ДІ).
Результати
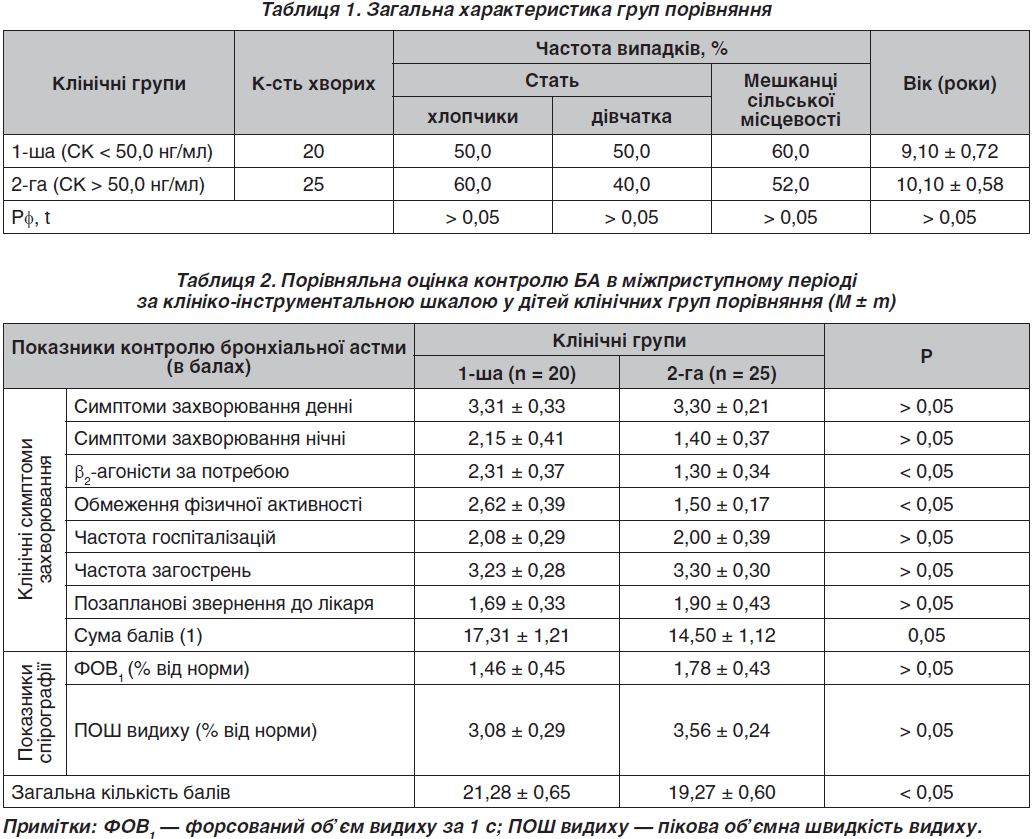
Загальна характеристика клінічних груп порівняння наведена у табл. 1.
За ступенем тяжкості БА діти 1-ї клінічної групи розподілялися так: тяжка форма спостерігалася у 60,0 % хворих, середньотяжка — у 40,0 % дітей, а легка не визначалася. У 2-й групі легка персистуюча БА визначалася у 20,0 % пацієнтів, тяжкий варіант захворювання відзначено у 48,0 %, у решти 32,0 % — середньотяжкий варіант перебігу БА (в усіх випадках Рφ > 0,05).
Слід зауважити, що хворі зазначеної групи у грудному і ранньому віці частіше страждали через шкірні прояви атопічного конституційного типу у вигляді дерматиту, який виявлявся у 90,0 % представників 1-ї та лише у кожної другої дитини (52 %, Рφ > 0,05) 2-ї групи порівняння. Разом із тим у 1,3 раза частіше у дітей 1-ї групи визначалася атопічна форма БА (55,6 проти 41,2 %, Рφ > 0,05), а змішана — настільки же рідше (44,5 проти 58,8 %, Рφ > 0,05).
Слід відзначити, що триваліший перебіг БА у хворих 1-ї групи, в яких виникала схильність до пригнічення кортизол-продукуючої функції надниркових залоз (СК < 50,0 нг/мл), відбивався на «накопиченні» коморбідної алергічної патології. Так, лише у 45,5 % дітей 1-ї групи та у 70,0 % спостережень у 2-й групі не виявлялося коморбідних алергічних захворювань, алергічний риніт визначався в 1-й групі у 1,5 раза частіше (45,5 проти 30,0 % (Рφ > 0,05), а поєднання декількох нозологічних форм атопічних захворювань траплялося у 9,1 % хворих лише у 1-й групі. Слід зауважити на тому, що обтяженість сімейного алергологічного анамнезу, визначена за допомогою генеалогічного індексу, у групах порівняння практично збігалася (0,14 ± 0,02 ум.од. у 1-й групі та 0,13 ± 0,02 ум.од. у 2-й групі, р > 0,05).
Сприятливіші показники соціально-економічного статусу визначалися серед родин представників 2-ї групи, в яких у 41,7 % випадків (проти 25,0 % у 1-й групі, Рφ > 0,05) обидва батьки мали постійне місце працевлаштування, а відсутності працевлаштування обох батьків не виявлялося взагалі (проти 25,0 % спостережень у 1-й клінічній групі). Окрім того, кожний четвертий пацієнт 1-ї групи був сиротою або виховувався у неповній сім’ї, на противагу цьому у 2-й групі таких випадків не було. Відбитком несприятливого соціального оточення хворих 1-ї групи було і те, що випадки відсутності тютюнопаління у даній групі виявлялися з частотою лише 37,5 % на противагу 83,3 % спостережень у 2-й групі (Рφ < 0,05).
Попри зниження показників СК, що асоціювали з пригніченням кортизол-продукуючої функції надниркових залоз, схильність до надмірної маси тіла була більш вираженою також у представників 1-ї групи: при обстеженні ІМТ у середньому становив 19,4 ± 1,0 кг/м2 проти 18,7 ± 1,0 кг/м2 у 2-й клінічній групі, р > 0,05).
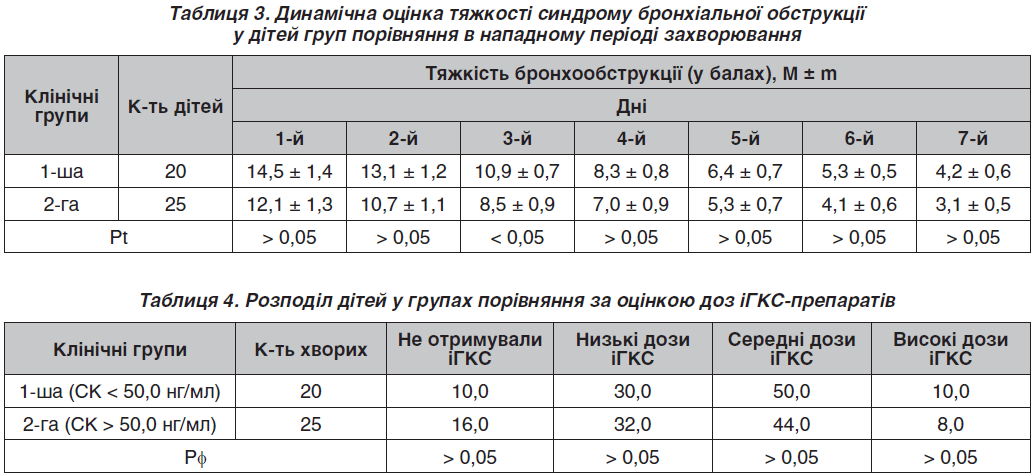
Порівняльний аналіз показників контролю симптомів БА за допомогою бальної КІО-шкали наведений у табл. 2.
Отже, попри відсутність статистично вірогідних розбіжностей за маркерами тяжкості перебігу БА, показники її контролю за даними КІО-шкали виявилися вірогідно гіршими у хворих із показниками СК < 50,0 нг/мл, у першу чергу за рахунок клінічної складової даної шкали.
Слід зауважити, що нападний період БА у хворих 1-ї клінічної групи також характеризувався тяжчим перебігом синдрому бронхіальної обструкції впродовж перших семи діб стаціонарного лікування (табл. 3).
Отже, попри відсутність статистичної значущості відмінностей (за винятком тяжкості бронхіальної обструкції на четверту добу стаціонарного лікування), вираженість загострення астми переважала у хворих із СК, що не досягав нормальних значень.
У позанападному періоді терапію беклометазоном отримували 30,0 і 28,0 % хворих 1-ї та 2-ї груп відповідно, будесонід — 20,0 і 24,0 % дітей, поєднану терапію — 20,0 і 24,0 % хворих, а флутиказон — лише 24,0 % хворих 2-ї групи (в усіх випадках Рφ > 0,05). Середня добова доза іГКС у хворих 1-ї групи становила 471,4 ± 131,8 мг/добу, а у представників 2-ї клінічної групи — 360,5 ± 59,5 мг/добу, але зважаючи на те, що різні препарати мають різну еквіпотентність, проведено аналіз даної складової базисного лікування.
Розподіл пацієнтів за дозовим навантаженням іГКС (за рекомендаціями GINA) наведений у табл. 4. Згідно з результатами, суттєвих відмінностей у призначених еквіпотентних доз препаратів іГКС у групах порівняння не виявлено, як і при порівнянні середніх добових доз.
Обговорення
Отже, у хворих зі зниженням кортизол-продукуючої функції надниркових залоз БА має тенденцію до тяжчого варіанта клінічних проявів, що підтверджується навіть попри відсутність статис–тично вірогідних розбіжностей за маркерами тяжкості перебігу БА, оскільки показники її конт–ролю, за даними КІО-шкали, виявилися вірогідно гіршими у хворих із показниками СК < 50,0 нг/мл, у першу чергу, за рахунок клінічної складової даної шкали. Також попри відсутність суттєвих відмінностей у призначених еквіпотентних доз препаратів іГКС у групах порівняння та статистичної значущості відмінностей (за винятком тяжкості бронхіальної обструкції на четверту добу стаціонарного лікування), вираженість загострення астми переважала у хворих із СК, що не досягав нормальних значень.
Відсутність відмінностей за розподілом еквіпотентних доз у групах порівняння могла свідчити про відсутність комплаєнсу у вигляді порушення режиму дозування препаратів, помилки у використанні інгаляторів чи неправильну профілактику всмоктування іГКС зі слизової ротоглотки, або про те, що вплив на кортизол-продукувальну функцію надниркових залоз мають не лише високі дози іГКС, що співпадає з даними окремих авторів [1, 5]. Проте за даними клініко-епідеміологічного аналізу встановлений ризик вмісту СК понад 50,0 нг/мл (як маркера збереженої кортизол-продукуючої функції надниркових залоз) за використання низьких доз іГКС. Так, ВШ даної події становило 3,14 (95% ДІ — 0,4–26,6), ВР — 1,5 (95% ДІ — 1,1–2,2) та абсолютний ризик — 0,26. При цьому використання середніх доз іГКС асоціювало з незначно підвищеним ризиком пригнічення кортизол-продукуючої функції надниркових залоз (за даними СК < 50,0 нг/мл): ВШ — 3,14 (95% ДІ — 0,4–26,6), ВР — 2,1 (95% ДІ — 0,3–12,6) та абсолютний ризик — 0,26.
Висновки
Перебіг БА у школярів з умістом СК < 50,0 нг/мл характеризується вираженими клінічними ознаками атопії з «накопиченням» коморбідності, тяжчим перебігом у міжприступному і приступному періодах, а також гіршим контролем за захворюванням при незначно довшій його тривалості. При цьому низькі дози іГКС у 3,14 раза підвищують імовірність збереження кортизол-продукуючої функції наднирників, а середні дози асоціюють з аналогічним пригніченням даної функції.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Effects of inhaled corticosteroids on pathology in asthma and chronic obstructive pulmonary disease / P. Chanez, A. Bourdin, I. Vachier [et al.] // Proceedings of the American Thoracic Society. — 2004. — Vol. 1 (3). — P. 184-190. PMID: 16113433, DOI: 10.1513/pats.200402-006MS.
2. Effects of inhaled fluticasone on angiogenesis and vascular endothelial growth factor in asthma / B.N. Feltis, D. Wignarajah, D.W. Reid [et al.] // Thorax. — 2007. — Vol. 62(4). — P. 314-319. PMID: 17105777, PMCID: PMC2092477, DOI: 10.1136/thx.2006.069229.
3. Brannan J.D. Bronchial hyperresponsiveness in the assessment of asthma control: airway hyperresponsiveness in asthma: its measurement and clinical significance / J.D. Brannan // CHEST Journal. — 2010. — Vol. 138, № 2 suppl. — P. 11-17. PMID: 20668013, DOI: 10.1378/chest.10-0231.
4. Fanta C.H. Asthma / C.H. Fanta // The New England journal of medicine. — 2009. — Vol. 360, № 10. — P. 1002. DOI: 10.1056/NEJMra0804579.
5. Survey of adrenal crisis associated with inhaled corticosteroids in the United Kingdom / G.R. Todd, C.L. Acerini, R. Ross-Russell [et al.] // Arch. Dis. Child. — 2002. — Vol. 87. — P. 457-461. PMID: 12456538, PMCID: PMC1755820.
6. Hanania N.A. Adverse effects of inhaled corticosteroids / N.A. Hanania, K. R. Chapman, S. Kesten // The American Journal of Medicine. — 1995. — Vol. 98. — P. 196-208. PMID: 7847437, DOI: 10.1016/S0002-9343(99)80404-5.
7. The use of inhaled corticosteroids and the risk of adrenal insufficiency / F. Lapi, A. Kezouh, S. Suissa [et al.] // Eur. Respir. J. — 2013. — Vol. 42. — P. 79-86. PMID: 23060630, DOI: 10.1183/09031936.00080912.
8. Наказ МОЗ України від 08.10.2013 p. № 868 «Уніфікований клінічний протокол первинної, вторинної (спеціалізованої) медичної допомоги. Бронхіальна астма у дітей».
9. Boulet L-P. Нow should we quantify asthma control?: a proposal / L.-P. Boulet, V. Boulet, J. Milot // Chest. — 2002. — Vol. 122. — P. 2217-2223 PMID: 12475866.
10. Безруков Л.А. Диагностика и лечение острых пневмоний и ОРВИ, осложненных БОС у детей раннего возраста // [Л.А. Безруков, Ю.Н. Нечитайло, С.А. Черевко и др.]; под ред. А.Ф. Мозолевского. — Черновцы, 1989. — 231 с.