Вступ
Цукровий діабет (ЦД) є одним з найбільших викликів здоров’ю у ХХІ сторіччі. З кожним роком збільшується кількість людей, які живуть із ЦД. Згідно з даними Міжнародної діабетичної федерації (МДФ), у 2015 році зареєстровано 415 млн дорослих людей з ЦД, 318 млн — з порушеною толерантністю до глюкози й 193 млн — з недіагностованим ЦД, у яких є великий ризик розвитку клінічного ЦД і хронічних ускладнень. МДФ прогнозує 642 млн хворих на ЦД у 2040 році Відомо, що ЦД 2-го типу (ЦД2) становить 91 % від усієї кількості випадків ЦД [1]. На тлі значного збільшення поширеності ЦД2 в популяції, захворюваності на ожиріння однією з ключових проблем у світі є вивчення неалкогольної жирової хвороби печінки (НАЖХП).
НАЖХП посідає одне з провідних місць серед причин непрацездатності, інвалідності, смертності, а також має тенденцію до зростання. У розвитку НАЖХП виділяють стадію стеатозу печінки, стеатогепатиту, фіброзу та стеатогенного цирозу. У 7 % хворих із компенсованим цирозом печінки внаслідок НАЖХП упродовж 10 років розвивається гепатоцелюлярна карцинома, причому близько 50 % з них потребують трансплантації печінки або помирають унаслідок печінкових ускладнень. НАЖХП трапляється в 30–100 % хворих з ожирінням, у 20–92 % — з дисліпідемією та в 10–75 % хворих на ЦД2, а в загальній популяції її частота становить 10–24 %. У 2003 році Американською асоціацією клінічних ендокринологів НАЖХП була визнана невід’ємним компонентом метаболічного синдрому. Вона сприяє розвитку атеросклерозу та ішемічної хвороби серця [5].
Проблема діагностики НАЖХП у пацієнтів із ЦД2 є актуальною. Золотим стандартом її діагностики є пункційна біопсія печінки. Для діагностики НАЖХП також застосовується комп’ютерна томографія органів черевної порожнини (ОЧП) у нативній фазі та магнітно-резонансна томографія. Однак ці методи є дорогими, не дозволяють оцінити стан жирового гепатозу в пацієнтів у динаміці та проводити контроль за ефективністю лікування. Європейська асоціація з вивчення печінки (EASL, 2016) рекомендує ультразвукове дослідження (УЗД) як метод першої лінії для діагностики жирового гепатозу. Метод УЗД дозволяє вірогідно визначити стеатоз помірного й тяжкого ступенів, а також надати інформацію про гепатобіліарну систему пацієнтів [2, 3]. Але кількісне визначення жиру в гепатоцитах В-методом неможливе. При розрахунку гепаторенального індексу й оцінці гістограми ехогенності печінки немає стандартних умов для отримання В-зображень паренхіми печінки, тож вони не застосовуються як єдиний метод діагностики стеатозу печінки [4]. Тому для постановки діагнозу НАЖХП у пацієнтів із ЦД2 та всебічного обстеження пацієнта застосовується принцип мультипараметричного ультразвуку (мп-УЗ), що забезпечує одномоментну оцінку даних В-режиму, допплерографії (допплерометрії), компресійної й зсувнохвильової еластографії (еластометрії), стеатографії (стеатометрії), реалізованих в одному ультразвуковому (УЗ) сканері [4].
Метою даного дослідження є оцінка мультипараметричного ультразвуку для діагностики НАЖХП у пацієнтів з ЦД2, що містить одночасне, одноразове й порівняльне використання сукупності УЗ-мето–дик (визначення гепаторенального індексу, стеатометрії, допплерографії, еластографії), реалізованих в одному УЗ-приладі для діагностики та всебічної оцінки стану стеатогепатозу.
Матеріали й методи
Дослідження проводилось на базі Київського міського клінічного ендокринологічного центру у 2015–2017 рр. Обстежено 111 хворих обох статей віком 18–79 років. Критеріями включення хворих у дослідження були: наявність ЦД2, індекс маси тіла (ІМТ) 25 кг/м2 і більше, використання метформіну як монотерапії або метформіну в комбінації з іншими цукрознижувальними засобами.
Критеріями виключення суб’єктів дослідження були: наявність антитіл до вірусних гепатитів В і С; зловживання алкоголем (споживання понад 30 г/день алкоголю для чоловіків і понад 20 г/день для жінок); прийом наркотичних засобів; вагітність; наявність психічних захворювань; шкідливі умови праці (з токсичним впливом на печінку); парентеральне харчування; наявності гемохроматозу, автоімунного гепатиту, целіакії, хвороби Вільсона — Коновалова, гіпопітуїтаризму, декомпенсованого гіпотиреозу, синдрому гіперкортицизму, вродженого дефіциту лізосомної кислої ліпази (хвороба Вольмана), ЦД 1-го типу, хвороби Крона.
Дизайн даного дослідження — крос-секційний. З дослідження було виключено 6 пацієнтів у зв’язку з наявністю антитіл до вірусного гепатиту В (HBsAg) (одна особа) і вірусного гепатиту С (сумарні антитіла) (5 осіб). Усім 105 пацієнтам було проведено одномоментне УЗД ОЧП на приладі Soneus P7 (Ultrasign, Україна) з конвексним датчиком 1–6 МГц, що включало В-режим, допплерографію (допплерометрію), компресійну й зсувнохвильову еластографію (еластометрію), стеатографію (стеатометрію). У В-режимі оцінювали положення печінки (відносно краю реберної дуги, доступність акустичних вікон). Досліджували обидві частки печінки й проводили біометрію їх передньозаднього розміру при спокійному диханні пацієнта; описували контур (рівний чи нерівний) і передньонижній кут печінки (гострий чи заокруглений); ехогенність печінки (нормальна, знижена, підвищена); ехоструктуру — дрібно- (1–2 мм), середньо- (3–4 мм) і великозернисту (5 мм і більше)) [4]. У В-режимі за критеріями М. Hamaguchi оцінювали звукопровідність паренхіми печінки або згасання ультразвуку за товщиною печінки в передньозадньому напрямку [6]. На однаковій глибині вимірювали гепаторенальний індекс [14], величину коефіцієнта затухання ультразвуку (ВКЗ) у паренхімі печінки, виконували УЗ-стеатографію й стеатометрію за 2D-технологією кількісного вимірювання концентрації жирових крапель у режимі реального часу, розробленою українськими вченими (патент UA № 20141111234) [8]. Розподіл за стадіями стеатозу за результатами УЗ-стеатометрії проводили за шкалою затухання УЗ, запропонованою M. Sasso et al. і валідизованою за морфологічною шкалою жирової інфільтрації NAS [7]:
1) S0 відповідає нормі (частка гепатоцитів з жиром становить від 0 до 5 %): від 1,0 до 2,19 дБ/см;
2) S1 відповідає легкому ступеню стеатозу (частка гепатоцитів з жиром становить 6–33 %): від 2,20 до 2,29 дБ/см;
3) S2 відповідає помірному ступеню стеатозу (частка гепатоцитів з жиром становить 34–66 %): від 2,30 до 2,90 дБ/см;
4) S3 відповідає тяжкому ступеню стеатозу (частка гепатоцитів з жиром становить > 66 %): > 2,90 дБ/см.
УЗ-допплерографію з допплерометрією портальної вени проводили за загальноприйнятою методикою з урахуванням метаболічної активності органів травлення й селезінки. Методику зсувнохвильової еластографії (ЗХЕГ) та фіброеластометрії/зсувно–хвильової еластометрії (ФЕМ/ЗХЕМ) проводили за встановленим алгоритмом з урахуванням можливого виникнення артефактів для визначення ступеня фіброзу й цирозу за шкалою Metavir (впроваджена в клінічну практику шкала оцінки жорсткості печінки Castera et al.) у кПа [9, 10]:
1. Фіброз відсутній (F0): 2,5–6 кПа.
2. Слабо виражений фіброз (F1): 6–7 кПа.
3. Помірно виражений фіброз (F2): 7–9,5 кПа.
4. Сильно виражений фіброз (F3): 9,5–12,5 кПа.
5. Цироз (F4): 12,5 і більше кПа.
Результати
Для діагностики НАЖХП було застосовано принцип одномоментного мп-УЗ ОЧП з оцінкою даних В-режиму, допплерографії (допплерометрії), компресійної й зсувнохвильової еластографії (еластометрії), стеатографії (стеатометрії), реалізованих в одному приладі Soneus P7 (Ultrasign, Україна), у 105 пацієнтів з ЦД2, серед яких були 81 жінка і 24 чоловіки. Вік пацієнтів становив 57,75 ± 8,62 року; тривалість ЦД2 10,19 ± 5,99 року, максимальне значення стеатозу печінки 2,60 ± 0,31 дБ/см, максимальне значення еластографії правої частки печінки 6,70 ± 1,47 кПа, максимальне значення еластографії лівої частки печінки 6,50 ± 1,42 кПа, гепаторенальний індекс 1,55 ± 0,36, розміри правої частки 161,80 ± 16,36 мм, розміри лівої частки 72,95 ± 12,53 мм, діаметр ворітної вени 11,73 ± 1,31 мм, максимальна лінійна швидкість кровотоку портальної вени 25,49 ± 5,07. У В-режимі було проведено біометрію й оцінку ехоструктури органів черевної порожнини, а саме: печінки, біліарного тракту, підшлункової залози, лімфатичних вузлів, пошук рідини. Окрім цього, для діагностики НАЖХП було визначено відповідність УЗ-даних критеріям Хамагочі. Цим критеріям відповідали 99 пацієнтів (91,4 %). У 104 пацієнтів (99 %) визначили потовщення правої частки печінки, а в 31 (29,5 %) розміри лівої частки відповідали нормі. У 104 осіб (99 %) було діагностовано хронічний панкреатит згідно з УЗ-параметрами. При дослідженні жовчного міхура було виявлено: гіпотонічний жовчний міхур — у 35 осіб (33 %), поліпи — в 7 осіб (6,7 %), жовчнокам’яну хворобу — в 17 пацієнтів (16,2 %), холецистектомію — у 10 пацієнтів (9,5 %). Спленомегалія виявлена у 25 пацієнтів (24 %), що свідчить про перехід стеатозу в стеатогепатит.
Окрім цього, значення застосування В-режиму полягало у виборі оптимального акустичного доступу інших УЗ-режимів. Наступним кроком було проведення УЗ-допплерографії з допплерометрією портальної вени. Діаметр портальної вени вимірювали в 96 пацієнтів (91,4 %), а швидкість лінійного кровотоку — у 98 (93,3 %). У двох пацієнтів діаметр ворітної вени становив 14 мм і в одного — 17 мм (верхня межа норми — 13 мм), але при цьому ознак асциту не було виявлено. Зі 105 осіб у 13 максимальний лінійний кровотік ворітної вени перевищував 30,3 см/с, що було зумовлено метеоризмом, гіперсекрецією шлунка натще, запальним процесом.
Після цього пацієнтам з ЦД2 та НАЖХП було проведено УЗ-стеатографію (стеатометрію) з визначенням ВКЗ правої частки печінки й стадіюванням стеатогепатозу в дБ/см:
1. S0: 9 пацієнтів (8,6 %).
2. S1: 4 особи (3,8 %).
3. S2: 73 пацієнти (69,5 %).
4. S3: 19 осіб (18,1 %).
Методику зсувнохвильової еластографії та фіброеластометрії/зсувнохвильової еластометрії правої частки печінки застосовували для визначення ступеня фіброзу й цирозу за шкалою Metavir [9, 10] у кПа:
1. F0 (норма): 30 пацієнтів (29,7 %).
2. F1 (слабо виражений): 35 осіб (34,7 %).
3. F2 (помірно виражений): 30 пацієнтів (29,7 %).
4. F3 (сильно виражений): 5 осіб (5 %).
5. F4 (цироз): 1 пацієнт (1 %).
У чотирьох пацієнтів зі 105 не вдалося провести ЗХЕГ правої частки печінки у зв’язку з метеоризмом.
Методику ЗХЕГ та ФЕМ/ЗХЕМ лівої частки печінки проводили для визначення ступеня фіброзу й цирозу за шкалою Metavir [9, 10] у кПа:
1. F0 (норма): 32 пацієнти (34 %).
2. F1 (слабо виражений): 38 осіб (40 %).
3. F2 (помірно виражений): 20 осіб (21 %).
4. F3 (сильно виражений): 4 особи (4,2 %).
5. F4 (цироз): 1 пацієнт (1,1 %).
У 10 пацієнтів зі 105 не вдалося провести ЗХЕГ лівої частки печінки, оскільки анатомічно ліва частка може бути недоступною за рахунок високого стояння печінки, дорсоверсії, а також метеоризму.
Для визначення діагностичної можливості мп-УЗД було проведено кореляційний аналіз таких показників пацієнтів з ЦД2, як максимальне значення стеатозу (дБ/см), максимальне значення еластографії правої частки печінки (кПа), максимальне значення еластографії лівої частки печінки (кПа), середнє значення гепаторенального індексу, розміри правої частки печінки (мм), розміри лівої частки печінки (мм), діаметр ворітної вени (мм), кровотік ворітної вени (см/с).
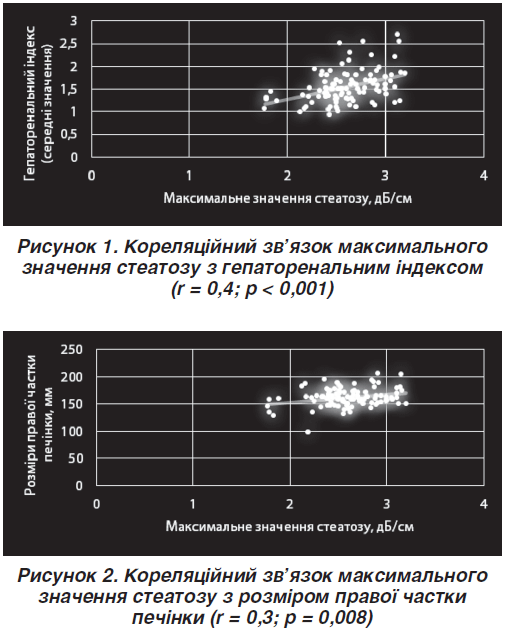
При проведенні кореляційного аналізу був виявлений статистично значущий позитивний середньої сили кореляційний зв’язок максимального значення стеатозу з гепаторенальним індексом (рис. 1), розміром правої частки печінки (рис. 2) та розміром лівої частки печінки (рис. 3).
Водночас не було виявлено кореляційного зв’язку максимального значення стеатозу з максимальним значенням еластографії правої (r = 0; p = 0,25) і лівої частки печінки (r = 0; p = 0,0940, а також діаметром (r = 0; p = 0,077) і кровотоком ворітної вени (r = 0; p = 0,075).
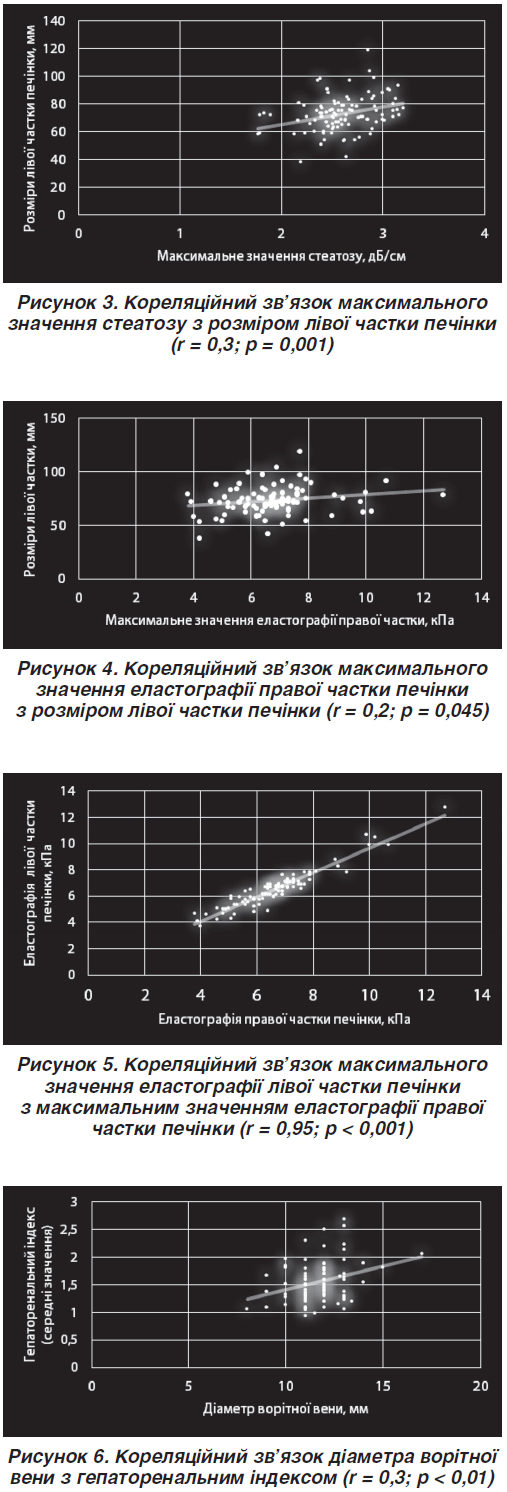
Було визначено статистично значущий позитивний слабкої сили кореляційний зв’язок максимального значення еластографії правої частки печінки з розмірами лівої частки печінки (рис. 4).
При цьому було виявлено статистично значущий позитивний сильний кореляційний зв’язок між максимальним значенням еластографії правої частки та максимальним значенням еластографії лівої частки (рис. 5).
Визначено статистично значущий позитивний середньої сили кореляційний зв’язок діаметра ворітної вени з гепаторенальним індексом (був застосований коефіцієнт кореляції Спірмена) (рис. 6).
Обговорення
У проведеному дослідженні для діагностики НАЖХП у пацієнтів з ЦД2 було застосовано принцип одномоментного мп-УЗ ОЧП з оцінкою даних В-режиму, допплерографії (допплерометрії), компресійної й зсувнохвильової еластографії (еластометрії), стеатографії (стеатометрії), реалізованих в одному приладі Soneus P7 (Ultrasign, Україна), що, згідно з рекомендаціями EASL (2016 р.), відповідає вимогам сучасної діагностики НАЖХП із визначенням ступеня стеатозу та жорсткості паренхіми печінки [2, 3]. Відомо, що при стеатогепатозі відбувається накопичення ліпідів у печінці, що призводить до збільшення її розмірів [7, 11]. Оскільки було визначено зв’язок максимального значення стеатозу з гепаторенальним індексом, розмірами правої й лівої частки печінки, ці дані свідчать про визначення накопичення ліпідів у печінці за допомогою ВКЗ.
За даними літератури, інтенсивно вивчається вплив стеатозу на фіброз [12, 13]. До стадій НАЖХП належить стеатоз і стеатогепатит (ранній стеатогепатит з фіброзом або без нього; фібротичний стеатогепатит) [2]. У нашому дослідженні не було виявлено зв’язку максимального значення стеатозу з даними еластографії, діаметром і кровотоком ворітної вени, тому гепатостеатоз і жорсткість паренхіми печінки можуть бути окремими патологічними процесами в пацієнтів із ЦД2 з урахуванням різних факторів впливу. Методика ЗХЕГ відображає стан жорсткості паренхіми печінки [8, 10], що й було підтверджено наявністю зв’язку між даними еластографії правої та лівої часток печінки. При цьому визначений у нашому дослідженні зв’язок показників еластографії правої частки печінки з розмірами лівої частки печінки підтверджує компенсаторне збільшення лівої частки печінки при наявності ураження правої частки. Стеатогепатоз призводить до порушення гемодинаміки печінкового кровотоку [4], що й було визначено при наявності зв’язку гепаторенального індексу з діаметром ворітної вени.
Висновки
1. Принцип мп-УЗ передбачає одномоментне проведення алгоритму обстежень у В-режимі, допплерографії (допплерометрії), компресійної й зсувнохвильової еластографії (еластометрії), стеатографії (стеатометрії) для визначення стеатогепатозу в пацієнтів з ЦД2.
2. ВКЗ є одним із методів мп-УЗ для діагностики НАЖХП і кількісного визначення ступеня стеатозу. Мп-УЗ об’єктивно відображає стан жорсткості паренхіми печінки.
3. Виконання алгоритму обстеження пацієнта з ЦД2 згідно з принципом мп-УЗ є необхідним, оскільки дозволяє всебічно й ґрунтовно оцінити стан печінки в пацієнтів з ЦД2, встановити особливості перебігу НАЖХП, визначити жорсткість паренхіми печінки, порушення її гемодинаміки та призначити відповідне лікування.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Atlas IDF 2015.
2. EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease // Journal of Hepatology. — 2016. — Vol. 64. — P. 1388-1402.
3. European Association for the Study of the Liver, Association Latinoamericana para el Estudio del Higado. EASL-ALEH Clinical Practice Guidelines: non-invasive tests for evaluation of liver disease severity and prognosis // Journal of Hepatology. — 2015. — Vol. 63. — P. 237-264.
4. Дынник О.Б., Федусенко А.А., Кобыляк Н.Н., Линс–кая А.В. 6 измерений ультразвуковой диагностики диффузных заболеваний печени // Променева діагностика, променева терапія. — 2016. — № 3–4. — С. 69-84.
5. Кобиляк Н.М., Динник О.Б., Кирієнко Д.В. Сучасні підходи до діагностики та скринінгу метаболічних порушень у хворих із неалкогольною жировою хворобою печінки // Міжнародний ендокринологічний журнал. — 2015. — № 5(69). — С. 89-99.
6. Hamaguchi M., Kojima T., Itoh Y. et al. The Severity of Ultrasonographic Findings in Nona-lcoholic Fatty Liver Disease Reects the Metabolic Syndrome and Visceral Fat // American Journal of Gastroenterology. — 2007. — Vol. 102. — P. 2708-2715.
7. Sasso M., Tengher-Barna I., Ziol M. et al. Novel Controlled Attenuation Parameter (CAP™) for non-invasive assessment of steatosis using FibroScan®: validation in chronic hepatitis C // Journal of Viral Hepatitis. — 2011. — Vol. 19. — P. 224-253.
8. Myers R.P., Pollett A., Kirsch R. et al. A Noninvasive Method for the Detection of Hepatic Steatosis Based on Transient Elastography // Disclosures Liver International. — 2012. — Vol. 32(6). — P. 902-910.
9. Castera L., Forns X., Alberti A. Non-invasive evaluation of liver fibrosis using transient elastography // Journal of Hepato–logy. — 2008. — Vol. 48. — P. 835-847.
10. Ferraioli G., Filice C., Castera L. et al. WFUMB guidelines and recommendations for clinical use of ultrasound elastography: Part 3: liver // Ultrasound Med Biol. — 2015. — Vol. 41(5). — P. 1169-1171.
11. Stern C., Castera L. Noninvasive diagnosis of hepatic steatosis // Hepatology international. — 2017. — Vol. 11(1). — P. 70-78.
12. Singh S., Allen A.M., Wang Z. et al. Fibrosis progression in nonalcoholic fatty liver vs nonalcoholic steatohepatitis: a systematic review and meta-analysis of paired-biopsy studies // Clinical Gastroenterology and Hepatology. — 2015. — Vol. 13. — P. 643-654.
13. Petta S., Vanni E., Bugianesi E. et al. The combination of liver stiffness measurement and NAFLD fibrosis score improves the noninvasive diagnostic accuracy for severe liver fibrosis in patients with nonalcoholic fatty liver disease // Liver international. — 2015. — Vol. 35. — P. 1566-1573.
14. Chauhan A., Sultan RL, Furth L. et al. Diagnostic accuracy of hepatorenal index in the detection and grading of hepatic steatosis // Journal of Clinical ultrasound. — 2016. — Vol. 44(9). — P. 580-586.