Резюме
Метою наведеної роботи було вивчення морфологічних характеристик змін головного мозку у хворих із діабетичною енцефалопатією (ДЕ) на підставі дослідження аутопсійного матеріалу. Матеріали та методи. В роботі наведено результати 14 секційних спостережень. Середній вік хворих становив 51,0 ± 3,4 року. Шматочки мозку фіксували в розчині IHC Zink Fixative, виготовляли серійні парафінові зрізи товщиною 10 ± 1 мкм. Препарати фарбували гематоксиліном і еозином, конго рот, тіоніном за методом Ніссля, ставили ШИК-реакцію, імпрегнували нітратом срібла за методом Більшовського і хлоридом золота за Кахалем, проводили морфометричне дослідження за Г.Г. Автанділовим. Препарати досліджували на мікроскопі Olympus AX70 з цифровою камерою Olympus DP50. Мікрофотографування препаратів здійснювалося з використанням програми AnalysisPro 3.2. Результати. Основними цито-ангіоархітектонічними проявами ДЕ є дифузна альтерація базальних мембран і ендотелію судин мікроциркуляторного русла, меншою мірою — артеріол, внутрішньомозкових артерій і вен. Висока щільність (питомий обсяг) капілярної мережі при ДЕ морфологічно відображає картину капілярного паралітичного застою. Капілярний застій супроводжується стазом крові, збільшенням навколосудинного капілярного простору (простір Вірхова — Робіна), ширина якого є морфологічним еквівалентом лімфатичної дисциркуляції. Ранні морфологічні ушкодження стінок капілярів — потовщення і розщеплення основної мембрани з накопиченням ШИК-позитивних речовин, вогнищева проліферація ендотеліоцитів. До пізніх пошкоджень відносяться капілярний фіброз і гіаліноз, проліферація перицитів, що супроводжується різким порушенням транскапілярного транспорту. Порушення стріарної і радіарної цитоархітектоніки в I–IV шарах головного мозку, випадіння нейронів (нейрональні спустошення) проявляються вогнищевим випадінням гангліозних і пірамідальних клітин. Висновки. Ранніми зворотними морфологічними змінами нейронів є набухання нейронів (гідропічна дистрофія нервових клітин), вогнищевий гіперхроматоз. Незворотними структурними ушкодженнями нейронів є лізис ядра і ядерця з гомогенізацією цитоплазми, формування клітин-тіней, вакуолізація цитоплазми, перицелюлярний набряк, лізис відростків у поєднанні з нейрофагією. Є характерним поєднання гострих альтернативних ушкоджень нейронів із хронічними (ішемічного характеру) — пікноз, зморщування ядер з вираженою атрофією цитоплазми.
Целью представленной работы являлось изучение морфологических характеристик изменений головного мозга у больных с диабетической энцефалопатией (ДЭ) на основании исследования аутопсийного материала. Материалы и методы. В работе представлены результаты 14 секционных наблюдений. Средний возраст больных составил 51,0 ± 3,4 года. Кусочки мозга фиксировали в растворе IHC Zink Fixative, изготавливали серийные парафиновые срезы толщиной 10 ± 1 мкм. Препараты окрашивали гематоксилином и эозином, конго рот, тионином по методу Ниссля, ставили ШИК-реакцию, импрегнировали нитратом серебра по методу Бильшовского и хлоридом золота по Кахалю, проводили морфометрическое исследование по Г.Г. Автандилову. Препараты исследовали на микроскопе Olympus AX70 с цифровой камерой Olympus DP50. Микрофотографирование препаратов осуществлялось с использованием программы AnalysisPro 3.2. Результаты. Основным цито-ангиоархитектоническим проявлением ДЭ является диффузная альтерация базальных мембран и эндотелия сосудов микроциркуляторного русла, в меньшей степени — артериол, внутримозговых артерий и вен. Высокая плотность (удельный объем) капиллярной сети при ДЭ морфологически отражает картину капиллярного паралитического застоя. Капиллярный застой сопровождается стазом крови, увеличением околососудистого капиллярного пространства (пространство Вирхова — Робина), ширина которого является морфологическим эквивалентом лимфатической дисциркуляции. Ранние морфологические повреждения стенок капилляров — утолщение и расщепление основной мембраны с накоплением ШИК-позитивных веществ, очаговая пролиферация эндотелиоцитов. К поздним повреждениям относятся капиллярный фиброз и гиалиноз, пролиферация перицитов, что сопровождается резким нарушением транскапиллярного транспорта. Нарушение стриарной и радиарной цитоархитектоники в I–IV слоях головного мозга, выпадение нейронов (нейрональное опустошение) проявляются очаговым выпадением ганглиозных и пирамидальных клеток. Выводы. Ранними обратимыми морфологическими изменениями нейронов являются набухание нейронов (гидропическая дистрофия нервных клеток), очаговый гиперхроматоз. Необратимыми структурными повреждениями нейронов являются лизис ядра и ядрышка с гомогенизацией цитоплазмы, формирование клеток-теней, вакуолизация цитоплазмы, перицеллюлярный отек, лизис отростков в сочетании с нейрофагией. Характерно сочетание острых альтернативных повреждений нейронов с хроническими (ишемического характера) — пикноз, сморщивание ядер с выраженной атрофией цитоплазмы.
Background. The purpose of this work was to study the morphological characteristics of brain changes in patients with diabetic encephalopathy (DE) on the basis of autopsy material research. Materials and methods. The paper presents the results of 14 postmortem observations. The mean age of the patients was 51.0 ± 3.4 years. The pieces of the brain were fixed in a solution of IHC Zinc Fixative, serial paraffin sections were made with a thickness of 10 ± 1 μm. The preparations were stained with hematoxylin and eosin, Congo red, thionin according to the Nissl method, Schick test was applied, with silver nitrate impregnation according to the Bielschowsky method and gold chloride — by Cajal, morphometric examination was performed according to G.G. Avtandilov. The study of the preparations was carried out on the Olympus AX70 microscope with a digital camera Olympus DP50. Microphotography of the preparations was performed using the program Pro 3.2. Results. The main cyto-angioarchitectonic manifestations of DE are: diffuse alteration of basal membranes and vascular endothelium of the microcirculatory bed, and to a lesser extent — arterioles, intracerebral arteries and veins. High density (specific volume) of the capillary network at DE morphologically reflects the pattern of capillary paralytic stagnation. Capillary stagnation is accompanied by a stasis of the blood, an increase in the perivascular capillary space (Virchow-Robin space), the width of which is the morphological equivalent of lymphatic dyscirculation. Early morphological damage to the capillary walls is thickening and cleft of the main membrane with the accumulation of Schick-positive substances, focal proliferation of endotheliocytes. Late injuries include capillary fibrosis and hyalinosis, proliferation of pericytes, which is accompanied by a sharp violation of transcapillary transport. Violation of striatal and radial cytoarchitectonics in the I–IV layers of the brain, prolapse of neurons (neuronal depopulation) is manifested by focal prolapse of ganglionic and pyramidal cells. Conclusions. Early reversible morphological changes of neurons are neuronal swelling (hydrophonic degeneration of nerve cells), focal hyperchromatosis. Irreversible structural damage to neurons is the lysis of the nucleus and nucleolus with homogenization of the cytoplasm, formation of shadow cells, vacuolization of the cytoplasm, pericellular edema, lysis of the processes in combination with neurophagia. The combination of acute alternative damage to neurons with chronic (ischemic) ones — pycnosis is typical, as well as coring of nuclei with pronounced atrophy of the cytoplasm.
Введение
Сахарный диабет (СД) является одной из наи–более актуальных медико-социальных проблем. В настоящее время 422 млн человек страдают СД, к 2040 году эта цифра возрастет до 642 млн [1]. По прогнозам Всемирной организации здравоохранения (ВОЗ) в 2030 году СД станет одной из основных причин смерти во всем мире [2]. Ведущей причиной высокой летальности и ранней инвалидизации являются сердечно-сосудистые заболевания [3, 4], в том числе церебральный инсульт [5, 6]. Острым нарушениям мозгового кровообращения предшествуют и сопутствуют хронические нарушения, лежащие в основе развития диабетической энцефалопатии (ДЭ) [7, 8]. Термин «диабетическая энцефалопатия» предложен R. DeJong в 1950 г. [9]. Под ДЭ понимают стойкую церебральную патологию, возникающую под воздействием острых, подострых и хронических диабетических обменных и сосудистых нарушений. В основе ДЭ лежат диабетические микро-, макроангиопатии. Для обозначения прогрессирующего диффузного поражения головного мозга, обусловленного нарастающим ухудшением кровоснабжения мозговой ткани, был предложен термин «дисциркуляторная энцефалопатия» [8]. В соответствии с Международной классификацией болезней 10-го пересмотра вместо термина «дисциркуляторная энцефалопатия» применяется термин «хроническая ишемия мозга» [4]. Хроническая ишемия мозга — медленно прогрессирующее нарушение мозгового кровообращения многоочагового или диффузного характера, возникающее вследствие постепенного накопления ишемических и вторичных дегенеративных изменений в головном мозге, обусловленных повторяющимися ишемическими эпизодами [3]. Приводя к развитию энцефалопатии, хроническая ишемия мозга вызывает широкий спектр субъективных и объективных неврологических нарушений, –ограничивающих интеллектуально-мнестические функции больного, его физические возможности, и значительно ухудшает качество жизни. Ишемическое повреждение мозга подготавливает церебральную ткань к возможности развития инфаркта мозга. Следовательно, процесс ишемизации мозга во многом определяет уровень здоровья и длительность жизни пациента. Своевременная диагностика и эффективное лечение ДЭ обусловлены пониманием сложных соотношений между сосудистым обеспечением и морфофункциональным состоянием тканей головного мозга.
Целью представленной работы являлось изучение морфологических характеристик изменений головного мозга у больных ДЭ на основании исследования аутопсийного материала.
Материалы и методы
В данной работе представлены результаты собственного морфологического исследования ткани головного мозга у лиц с клиническим диагнозом сахарного диабета, диабетической энцефалопатии (14 секционных наблюдений). Средний возраст больных с диагнозом ДЭ составил 51,0 ± 3,4 года. Причиной смерти больных с СД в 8 наблюдениях был острый инфаркт миокарда, в 6 случаев — политравма с повреждением внутренних органов. В качестве контрольной группы для количественных морфологических исследований взяты кусочки ткани мозга у 5 лиц, погибших в результате несчастных случаев и не страдавших при жизни ни СД, ни расстройствами психики (данные собраны путем катамнеза). Возраст контрольной группы составил 58,5 ± 2,3 года.
Кусочки ткани мозга были взяты из симметричных зон разных отделов головного мозга. Исследованы лобная, затылочная, теменная, височные доли и мозжечок. Забор материала осуществляли не позднее 6–8 часов после смерти. Кусочки мозга фиксировали в растворе IHC Zink Fixative (PharMingen, USA), заливали в парафин, изготавливали серийные парафиновые срезы толщиной 10 ± 1 мкм. Препараты окрашивали по стандартным методикам: гематоксилином и эозином, конго рот, тионином по методу Ниссля, ставили ШИК-реакцию, импрегнировали нитратом серебра по методу Бильшовского и хлоридом золота по Кахалю, проводили морфометрическое исследование по Г.Г Автандилову. Препараты исследовали в проходящем свете на микроскопе Olympus AX70 (Япония) с цифровой камерой Olympus DP50, соединенной с персональным компьютером. Микрофотографирование препаратов осуществлялось с использованием программы AnalysisPro 3.2 (Softimaging, Германия) соответственно рекомендациям изготовителя программного обеспечения.
Результаты
При макроскопическом исследовании 14 ауто–псийных случаев ДЭ отмечено, что масса головного мозга была несколько снижена и колебалась в диапазоне 1320 ± 80 г, но не имела достоверных отличий от массы головного мозга контрольной группы (p > 0,05). Масса головного мозга у конт–рольной группы составила 1430 ± 110 г. Достоверная зависимость между степенью уменьшения головного мозга и продолжительностью заболевания отсутствовала. Макроскопически центральные извилины, подкорковые ядра, зрительные бугры ствола мозга сохранены. На поперечных серийных срезах отмечено, что граница между серым и белым веществом четкая, атрофия умеренно выражена в большей степени в белом веществе мозга. Мягкие мозговые оболочки во всех наблюдениях были неравномерно утолщены, с признаками венозного полнокровия, отечны. Толщина мягких мозговых оболочек в 6–8 раз превосходила параметры лиц контрольной группы. Просвет вен резко эктазирован и заполнен гомогенными эритроцитарными массами (рис. 1, 2).
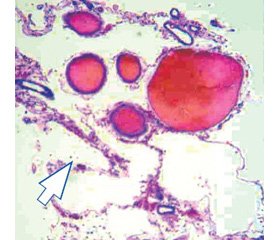
При ДЭ обращали внимание на симметричность и однотипность структурных изменений ангио- и цитоархитектоники в лобной, височной, теменной и затылочной областях головного мозга. Нарушения ангиоархитектоники касались главным образом сосудов микроциркуляторного русла как белого, так и коркового вещества: капилляров, прекапилляров, венул, артериол, внутримозговых артерий и вен. При ДЭ наблюдался широкий спектр структурных изменений со стороны капиллярного русла. Прежде всего обращала на себя внимание высокая плотность капиллярной сети, особенно в корковом веществе лобной и височных областей, где показатели удельного объема капилляров достигали максимальных величин 0,286 ± 0,015 и 0,253 ± 0,020 (в контрольной группе соответственно 0,076 ± 0,022 и 0,080 ± 0,012) (рис. 3, 4).
/59-1.jpg)
Необходимо подчеркнуть, что при ДЭ речь идет не о неоангиогенезе, а увеличение удельного объема микроциркуляторного русла обусловлено значительным продолжительным расширением капилляров и прекапилляров, которому предшествует их сужение. Генерализованное расширение капиллярных сосудов морфологически отражает картину капиллярного паралитического застоя. Стаз крови на отдельных участках сопровождался расширением околососудистого капиллярного пространства (пространство Вирхова — Робина). Известно, что расширение пространства Вирхова — Робина является морфологическим эквивалентом лимфатической дисциркуляции. На начальном этапе лимфатической дисциркуляции нейропиль был структурно сохранен, при дальнейшем нарастании отека наблюдалось мелкоячеистое периваскулярное разрушение нейропиля (рис. 5). Прогрессирование процесса транссудации сопровождалось пролиферацией микроглии, а в ряде случаев — нейроглии и макрофагов (сидерофагов), а также микроячеистым спонгиозом, выявляемым на некотором расстоянии от поврежденного капилляра (рис. 5, 6).
Микроглиальная и нейроглиальная пролиферация с макрофагальной реакцией и спонгиозом является проявлением токсического и аллергического характера ДЭ.
Известно, что при СД накапливаются депозиты в базальной мембране капилляров, что приводит к значительному ее утолщению и резкому нарушению транскапиллярного транспорта. Наиболее ранними изменениями в стенке капилляров было не только утолщение основной мембраны с накоплением ШИК-позитивных веществ, но и ее расщепление с пролиферацией эндотелиоцитов (рис. 7).
К поздним проявлениям ДЭ следует отнести капиллярный фиброз, характеризующийся наличием в стенке капилляров аргентофильных ретикулиновых и коллагеновых волокон, пролиферацией перицитов (рис. 8).
Помимо фиброза в стенке капилляров, прекапилляров и венул выявлялся гиалиноз (рис. 9).
Гиалиноз стенки капилляров, так же как и фиброз, представляет собой хроническое повреждение, которое выявляется чаще всего в ишемических очагах, в очагах артериосклероза. Оба процесса способствуют развитию так называемой артериолизации капилляров, под которой следует понимать выраженное расширение просвета капилляров, сопровождающееся утолщением и фиброзированием стенок, в результате чего практически полностью прекращается их проницаемость. В результате прекращения транскапиллярного транспорта наблюдался коллапс нейропиля, сближение капилляров и формирование гломусных узелков, напоминающих картину ангиоматоза (рис. 10, 11).
Одной из важных структурных перестроек капиллярного русла является формирование различных типов микроаневризм. Тонкостенные микроаневризмы относятся к ранним морфологическим проявлениям ДЭ. Они представляют собой в отрезке капиллярного русла тонкостенные выпячивания колбовидной или грушевидной формы (рис. 12) либо имеют вид сосудистых цистерн с гофрированными стенками (рис. 13).
На поперечном разрезе они имеют вид шарообразных венул, заполненных эритроцитами или плазмой крови.
В просвете микроаневризм нередко выявляется стаз крови, сладж-феномен, наличие гиалиновых и конглютинационных тромбов. Именно такие микроаневризмы часто служат источниками мелких диапедезных кровоизлияний, но чаще всего выявляются перикапиллярные колликвационные микроинфаркты. Во всех наблюдениях обнаруживались мелкие периваскулярные острые и хронические диапедезные кровоизлияния с формированием клеточно-волокнистых периваскулярных узелков (рис. 14, 15).
Следует подчеркнуть, что у погибших с диагнозом сахарного диабета, диабетической энцефалопатии практически во всех сосудах имели место значительные структурные повреждения: фибриноидные изменения вплоть до фибриноидного некроза, острые и хронические преимущественно лакунарные диапедезные кровоизлияния, фиброз адвентиции, пролиферация перицитов, гиалиноз. Несмотря на то, что структурные повреждения сосудов микроциркуляторного русла при ДЭ являются манифестными, проведенное морфологическое исследование коры лобной, височной, теменной и затылочных областей головного мозга показало, что выпадение нейронов, острые и хронические дистрофические их повреждения, спонгиоз, формирование бляшек, которые обусловливают основную клиническую симптоматику ДЭ, также достаточно четко выражены. Очаги значительного выпадения нейронов (нейрональное опустошение) выявлялись во всех наблюдениях главным образом в I–IV слоях, в меньшей степени — в V–VI слоях. В V–VI слоях стриарная и радиарная цитоархитектоника была частично сохранена. Отмечено очаговое выпадение ганглиозных и пирамидальных клеток. Степень выраженности выпадения нейронов была достаточно вариабельна в пределах как одного, так и нескольких наблюдений. Прямой зависимости между объемом сосудов микроциркуляторного русла и плотностью распределения нейронов в различных областях коры головного мозга не установлено. При достаточно высоком удельном объеме капилляров плотность распределения нейронов в коре одновременно мог–ла быть большой и низкой.
В сохранившихся нейронах обнаруживались дистрофические изменения различной степени тяжести. Наблюдались острые изменения нервных клеток (рис. 16).
Также наблюдались хронические процессы, обратимые и необратимые изменения нервных клеток при ДЭ (рис. 17).
Обсуждение
Наиболее частыми обратимыми изменениями нервных клеток при ДЭ были набухание нейронов (гидропическая дистрофия нервных клеток), гиперхроматоз с гомогенизацией цитоплазмы, тигролиз (хроматолиз) — очаговый и тотальный. Эти ранние острые повреждения нейронов часто сочетались с умеренно выраженным сателлитозом макроглии. К необратимым изменениям нервных клеток были отнесены: лизис ядра (кариолизис) и ядрышка с гомогенизацией цитоплазмы, формирование клеток-теней, вакуолизация цитоплазмы, перицеллюлярный отек, лизис отростков.
Необратимые повреждения нейронов нередко сопровождались нейронофагией. Имел место мелкозернистый распад нейропиля, усиливалась макрофагальная реакция, обнаруживались в большом количестве гематоксилиновые шары и единичные тельца Лафора. В центре таких участков в просвете сосудов микроциркуляторного русла выявлялись микротромбы (рис. 18). Появление телец Лафора не во всех случаях были адекватны типу и величине повреждаемого сосуда, альтернативным и компенсаторно-приспособительным процессам.
Наряду с острыми альтернативными повреждениями нейронов, например перицеллюлярный отек, лизис отростков, тотальный хроматолиз, выявлялись изменения ишемического характера в виде пикноза, сморщивания ядер и выраженной атрофией цитоплазмы. Имели место сочетания отека и набухания цитоплазмы в одном нейроне и ишемическая атрофия — в другом (рис. 19). Встречались участки, где выявлялись нейроны, цитоплазма которых перегружена липофусцином.
В участках хронической ишемии встречались единичные нейроны или группы нейронов с морфологическими признаками нейродистрофии альцгеймеровского типа. Кроме того, при импрегнации серебром по Бильшовскому выявлялись единичные терминальные бляшки, околососудистые и перинейрональные аргентофильные муфты.
Выводы
Проведенное морфологическое исследование головного мозга у лиц с СД показало, что основными цито-ангиоархитектоническими проявлениями ДЭ являются:
а) диффузная альтерация базальных мембран и эндотелия сосудов микроциркуляторного русла как белого, так и коркового вещества: капилляров, прекапилляров, венул, в меньшей степени — артериол, внутримозговых артерий и вен;
б) высокая плотность (удельный объем) капиллярной сети в корковом веществе лобной, височной областей, теменной и затылочной областях головного мозга при ДЭ обусловлена продолжительной генерализованной эктазией просвета сосудов микроциркуляторного русла и морфологически отражает картину паралитического застоя;
в) капиллярный застой сопровождается стазом крови, увеличением околососудистого капиллярного пространства (пространство Вирхова — Робина), ширина которого является морфологическим эквивалентом лимфатической дисциркуляции;
г) ранними морфологическими повреждениями стенок капилляров является утолщение и расщеп–ление основной мембраны с накоплением ШИК-позитивных веществ, очаговая пролиферация эндотелиоцитов (сегментарный пролиферативный капиллярит); к поздним структурным проявлениям ДЭ относятся капиллярный фиброз и гиалиноз, пролиферация перицитов, что сопровождается резким нарушением транскапиллярного транспорта;
д) выявлено, что нарушение стриарной и радиарной цитоархитектоники в I–IV слоях головного мозга, выпадение нейронов (нейрональное опустошение) осуществляются преимущественно за счет очагового выпадения ганглиозных и пирамидальных клеток;
ж) в сохранившихся нейронах имеет место сочетание острых и хронических, обратимых и не–обратимых альтернативных повреждений и компенсаторно-приспособительных процессов: ранними обратимыми морфологическими изменениями являются набухание нейронов, очаговый гиперхроматоз и хроматолиз в сочетании с умеренно выраженным сателлитозом макроглии; необратимыми структурными повреждениями нейронов являются лизис ядра (кариолизис) и ядрышка с гомогенизацией цитоплазмы, формирование клеток-теней, вакуолизация цитоплазмы, перицеллюлярный отек, лизис отростков в сочетании с нейрофагией, наличие единичных нейронов с морфологическими признаками альцгеймеровского типа;
з) сочетание острых альтернативных повреждений нейронов с хроническими (ишемического характера) — пикноз, сморщивание ядер с выраженной атрофией цитоплазмы;
и) мелкозернистый распад нейропиля в зоне острой ишемии (вокруг сосудов микроциркуляторного русла с микротромбами) с наличием гемато–ксилиновых шаров, телец Лафора с макрофагальной реакцией, адекватных типу и величине повреждаемого сосуда, альтернативным компенсаторно-приспособительным процессам.
Конфликт интересов. Автор заявляет об отсутствии какого-либо конфликта интересов при подготовке данной статьи.

/59-1.jpg)
/60-1.jpg)
/61-1.jpg)
/62-1.jpg)