Резюме
Streptococcus salivarius K12 (SsK12) — пробіотичний штам, який належить до I класу лантибіотиків, інтенсивно пригнічує ріст патогенної мікрофлори, що виступає основним етіологічним чинником бактеріальних інфекцій респіраторного тракту в дітей. Після перорального прийому SsK12 колонізує порожнину рота та носоглотки і зберігається там протягом місяця після прийому останньої дози, конкуруючи з патогенною мікрофлорою. Проведене відкрите клінічне дослідження, що включало 66 пацієнтів дитячого віку з рекурентними захворюваннями верхніх дихальних шляхів. У 26 з них була діагностована рецидивуюча фаринготонзилярна інфекція, у 18 дана інфекція була пов’язана з бета-гемолітичним стрептококом групи А, у 22 дітей виявлено гіпертрофію носоглоткової мигдалини. Основну групу становили 42 дитини, які приймали лантибіотик на основі Streptococcus salivarius K12 (Бактобліс) за схемою, зазначеною в інструкції. До групи контролю увійшли 24 пацієнти аналогічного віку (по 8 у кожній підгрупі), яким профілактика рецидивів не проводилась. При аналізі отриманих даних виявилось, що діти, які отримували SsK12 протягом 30 днів, мали вірогідно меншу кількість епізодів фаринготонзилярних інфекцій, пов’язаних із бета-гемолітичним стрептококом групи А. У дітей з рецидивуючими інфекціями верхніх дихальних шляхів після лікування спостерігалась виражена позитивна динаміка, що характеризувалась вірогідним зменшенням колонізації гемофільною паличкою, золотистим стафілококом та пневмококом слизової оболонки ротоглотки. У пацієнтів основної групи визначалось вірогідне зменшення частоти епізодів вірусних фарингітів, трахеїтів, ринітів, ларингітів і гострих середніх отитів впродовж 6 місяців. Зважаючи на добру переносимість Streptococcus salivarius K12 (Бактобліс), а також необхідність тривалого застосування з метою досягнення максимального терапевтичного ефекту, рекомендовано повторні курси по 30 днів 2–3 рази на рік.
Streptococcus salivarius K12 (SsK12) — пробиотический штамм, который относится к I классу лантибиотиков и интенсивно подавляет рост патогенной микрофлоры, выступающей в качестве основного этиологического фактора бактериальных инфекций респираторного тракта у детей. После перорального приема SsK12 колонизирует полость рта, носоглотку и персистирует в течение месяца после приема последней дозы, конкурируя с патогенной микрофлорой. Проведено открытое клиническое исследование, которое включало 66 пациентов детского возраста с рекуррентными заболеваниями верхних дыхательных путей. У 26 из них была диагностирована рецидивирующая фаринготонзиллярная инфекция, у 18 данная инфекция была связана с бета-гемолитическим стрептококком группы А, у 22 детей выявлена гипертрофия носоглоточной миндалины. Основную группу составили 42 ребенка, которые принимали лантибиотик на основе Streptococcus salivarius K12 (Бактоблис) по схеме, указанной в инструкции. В группу контроля вошли 24 пациента аналогичного возраста, которым профилактика рецидивов не проводилась. Дети, которые получали SsK12 в течение 30 дней, имели достоверно меньше эпизодов фаринготонзиллярной инфекции, связанной с бета-гемолитическим стрептококком группы А. В группе пациентов с рецидивирующими инфекциями верхних дыхательных путей выраженная положительная динамика характеризовалась достоверным уменьшением колонизации слизистой оболочки ротоглотки патогенной микрофлорой. У пациентов основной группы определялось достоверное уменьшение частоты эпизодов вирусных фарингитов, трахеитов, ринитов, ларингитов и острых средних отитов в течение 6 месяцев. Учитывая хорошую переносимость SsK12, а также необходимость длительного применения с целью достижения максимального терапевтического эффекта, рекомендуются повторные курсы по 30 дней 2–3 раза в год.
Lantibiotics are antimicrobial peptides produced mostly by the Gram-positive bacteria. These peptides are effective against most of the Gram-positive bacteria and few Gram-negative bacteria. Lantibiotics have a huge potential as alternatives for antimicrobial drugs. Currently, there is very limited knowledge about the action of lantibiotics which still need to be explored thoroughly. Streptococcus salivarius K12 (SsK12) is a probiotic strain producing the bacteriocins salivaricin A2 and salivaricin B, both of which strongly antagonize the growth of the pathogenic microorganisms that act as the main etiological factor of bacterial infections of the respiratory tract in children. After oral administration, SsK12 colonizes the oral cavity, nasopharynx and persists for a month after the last dose, competing with the pathogenic bacteria. An open clinical trial was conducted, which included 66 children with recurrent upper respiratory tract diseases. In 26 of them, a recurrent pharyngo-tonsillar infection was diagnosed, in 18 children this infection was associated with group A beta-hemolytic streptococcus, in 22 children, hypertrophy of the nasopharyngeal tonsil was detected. The main group consisted of 42 children who received a lantibiotic with Streptococcus salivarius K12 (Bactoblis) according to the instruction. The control group included 24 patients of the same age in whom relapse prevention was not carried out. Children who received SsK12 for 30 days had significantly less episodes of pharyngo-tonsillar infection associated with beta-hemolytic group A streptococcus. In the group of patients with recurrent upper respiratory tract infections, a pronounced positive effect was characterized by a significant decrease in the degree of the oropharynx mucous membrane colonization by pathogenic microorganisms. The patients of the main group had a significant decrease in the incidence of episodes of viral pharyngitis, tracheitis, rhinitis, laryngitis and acute otitis media within 6 months. Taking into consideration a good tolerability of SsK12, as well as the need for prolonged using in order to achieve maximum therapeutic effect, repeated courses are recommended for 30 days 2–3 times a year.
Вступ
Сьогодні, в епоху інтенсивного зростання антибіотикорезистентності, стає актуальною проблема адекватної, ефективної та водночас безпечної антибактеріальної терапії. Є низка ефективних засобів, що розглядаються як альтернатива антибіотиків, зокрема бактеріоцини, пробіотичні бактерії та бактеріофаги. В даному контексті саме лантибіотики в найближчому майбутньому можуть стати гідними кандидатами серед арсеналу антимікробних засобів, що застосовуються в клінічній практиці.
Лантибіотики — це протимікробні пептиди, до яких чутливі більшість грампозитивних та частково грамнегативні бактерії. Наприклад, нізин Z у високих концентраціях ефективний проти Escherichia coli, Neisseria та Helicobacter pylori. Саме він став першим лантибіотиком, що був відкритий ще у 20-х роках минулого сторіччя (Rogers & Whittier, 1928) як безпечний харчовий консервант. Дослідження, що стосуються застосування лантибіотиків, знову відродилися разом з інтенсивно зростаючою антибіотикорезистентністю, а саме зниженням чутливості Staphylococcus aureus до метициліну (Rubin et al., 1999), Enterococcus faecium до ванкоміцину, полірезистентністю грамнегативних патогенів Pseudomonas aeruginosa та ентеробактерій (Livermore, 2004). З цього часу були відкриті та описані сотні лантибіотиків (рис. 1), але більшість з них виробляються грампозитивними бактеріями і широко застосовуються у харчовій промисловості для виробництва молочних продуктів (Emma et al., 2013).
/14-1.jpg)
Streptococcus salivarius K12 (SsK12) — пробіотичний штам, що належить до I класу лантибіотиків та інтенсивно пригнічує in vitro ріст Streptococcus pyogenes [1], Streptococcus pneumoniaе, Haemophilus influenzaе та Moraxella catarrhalis, які належать до основних етіологічних чинників бактеріальних інфекцій респіраторного тракту в дітей [2]. Даний антагонізм лантибіотика перш за все пов’язаний із виділенням саліварицину А2 (бактеріостатик), що порушує синтез мембран бактерій та гальмує їх розмноження, та саліварицину В3 (бактерицид), що руйнує стінки клітин чутливих до них бактерій і призводить до їх загибелі [3]. Лантибіотик характеризується вираженою антибактеріальною чутливістю і має високий профіль безпеки [4, 5]. Після перорального прийому SsK12 колонізує порожнину рота та носоглотки [6] і зберігається там протягом місяця після прийому останньої дози, конкуруючи з патогенною мікрофлорою [7].
З огляду на спектр дії SsK12 та активність саліварицинів регулярне застосування препарату демонструє позитивний ефект щодо профілактики рецидивів фаринготонзилітів та отитів [8–10]. Є також пілотні закордонні дослідження, що демонструють активність даного перорального пробіотика протягом тривалого застосування (до 90 днів) щодо профілактики вірусних інфекцій [11] шляхом індукції гамма-інтерферону, при цьому рівень інтерлейкіну-1β та фактор некрозу пухлини α залишаються незмінними [2]. Це дозволяє рекомендувати даний пробіотичний штам для профілактики респіраторних інфекцій у дітей з рецидивуючими стрептококовими фаринготонзилітами.
Матеріали та методи
Проведене відкрите нерандомізоване клінічне дослідження, яке включало 66 пацієнтів дитячого віку з рекурентними захворюваннями верхніх дихальних шляхів. У 26 з них була діагностована рецидивуюча фаринготонзилярна інфекція (РФТІ), у 18 дана інфекція була пов’язана із бета-гемолітичним стрептококом групи А (БГСГА), у 22 дітей виявлено гіпертрофію носоглоткової (глоткової) мигдалини (ГНГМ). Набір пацієнтів проводився з березня по травень 2017 року. Учасниками були діти дошкільного та молодшого шкільного віку (від 3 до 10 років).
Клінічна оцінка пацієнтів груп спостереження формувалася на підставі даних анамнезу щодо рекурентності гострих захворювань носоглотки, особливостей їх перебігу, швидкості досягнення лікувального ефекту при використанні стандартних методів терапії, наявності порушень носового дихання внаслідок збільшення розмірів глоткової мигдалини. Діагностика фаринготонзилярної інфекції, пов’язаної з БГСГА, здійснювалась за клінічною шкалою McIsaac: при наявності ≥ 2 балів (аденопатія, лихоманка 38 °С, відсутність кашлю, фаринготонзилярний ексудат, вік, сезон) + підтвердження присутності БГСГА за допомогою швидкого стрептококового тесту (Streptatest) або оцінка за шкалою McIsaac = 5. РФТІ визначалася як три та більше епізоди фаринготонзиліту протягом 6 місяців або чотири і більше епізоди протягом 12 місяців.
Основну групу становили 42 дитини, яким амбулаторно призначали протирецидивну терапію захворювань верхніх дихальних шляхів. До групи контролю увійшли 24 пацієнти аналогічного віку (по 8 у кожній підгрупі), яким профілактика рецидивів не проводилась (рис. 2).
Діти основної групи приймали лантибіотик на основі Streptococcus salivarius K12 (Бактобліс) за схемою, зазначеною в інструкції (по 1 таблетці 1 раз на день безпосередньо перед сном, розсмоктуючи в порожнині рота) протягом 30 днів. Кожна таблетка містить один мільярд одиниць, що утворюють колонії Streptococcus salivarius K12 (SsK12). Дослідження проходило в два етапи: І — період прийому препарату Бактобліс (30 днів) та ІІ — катамнез (5 місяців).
З дослідження виключались діти з імунодефіцитами, вродженими захворюваннями бронхолегеневої системи чи аномаліями щелепно-лицевої ділянки, соматичними захворюваннями в стадії декомпенсації, автоімунними захворюваннями, туберкульозом, а також діти, яким була проведена тонзилектомія, аденотомія, які мали в анамнезі епізоди бронхоспазму, хворіли на ревматизм або отримували якусь профілактичну терапію з приводу частих застудних захворювань.
Дослідження проводилось за згодою локального етичного комітету та підписом батьками інформованої згоди. Усі діти знаходились під динамічним наглядом у педіатра та дитячого оториноларинголога з оцінкою показників локального статусу.
Основна мета дослідження полягала в оцінці чотирьох інформаційних блоків: 1) частоти рецидивів інфекції, пов’язаної з БГСГА до та після лікування; 2) динаміки клінічної симптоматики, що пов’язана з гіпертрофією глоткової мигдалини; 3) вивчення бактеріальної колонізації глотки; 4) наявності епізодів наступних інфекцій: вірусний фарингіт, трахеїт, риніт, ларингіт і гострий середній отит впродовж 6 місяців, включаючи період лікування у всіх трьох підгрупах.
З метою порівняння результатів 6-місячних спостережень за дітьми з РФТІ використовували точний тест Фішера, для аналізу порядкових змінних — непараметричний U-критерій Манна — Уїтні.
Результати
За віком групи обстежених дітей розподілились так: в основній групі — 22 дівчинки (середній вік 7,0 ± 1,3 року) та 20 хлопців (7,2 ± 1,6 року); у групі контролю осіб жіночої та чоловічої статей було порівну (по 12 в кожній з них), їх середній вік становив 6,9 ± 1,7 та 7,3 ± 1,5 року відповідно). Обидві групи за віком та статтю статистично не відрізнялись між собою.
При аналізі отриманих даних щодо профілактики рецидивів фаринготонзилітів, пов’язаних із бета-гемолітичним стрептококом групи А, виявилось, що діти, які отримували SsK12 протягом 30 днів, за 6 місяців мали вірогідно менше епізодів фаринготонзилярних інфекцій, ніж у період до лікування (P < 0,001), табл. 1.
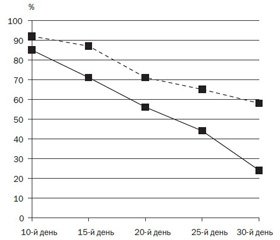
При вивченні динаміки клінічного індексу, що характеризує хронічний аденоїдит у підгрупі дітей з ГНГМ, проводилась оцінка таких критеріїв: утруднене носове дихання, сон з відкритим ротом, храп під час сну, кашель, переважно вночі та зранку, виділення з носа, зниження слуху.
Аналізуючи отримані результати, ми встановили вірогідне зменшення симптоматики в пацієнтів, які поряд із базисним лікуванням отримували SsK12, порівняно з контролем (рис. 3). Важливо зауважити: якщо у перші дні лікування тенденція до зменшення клінічних симптомів вірогідно не відрізнялась, то під час терапії розрив клінічного індексу між підгрупами значно збільшився.
Діти з рецидивуючою фаринготонзилярною інфекцією становили більшість у загальній групі обстежених. Вивчаючи ефективність профілактичного лікування пацієнтів даної підгрупи, поряд із частотою рецидивів гострих респіраторних інфекцій оцінювали роль бактеріальної колонізації ротоглотки. Усім дітям з РФТІ (n = 26) було проведене бактеріологічне обстеження мазків. Як видно з табл. 2, домінували кокова мікрофлора (46,2 %) та бактерії роду Haemophilus (42,3 %), у поодиноких випадках висівались Pseudomonas та Candida, в однієї дитини патогенна мікрофлора взагалі не була виділена.
Після лікування спостерігалась виражена позитивна динаміка в дітей основної групи, що характеризувалась вірогідним зменшенням колонізації гемофільною паличкою, золотистим стафілококом та пневмококом слизової ротоглотки порівняно з дітьми, яким профілактика рецидивів респіраторної інфекції не проводилась.
Одним із основних інформаційних блоків, що підлягав дослідженню, було визначення частоти епізодів вірусних фарингітів, трахеїтів, ринітів, ларингітів і гострих середніх отитів впродовж 6 місяців, включаючи період лікування, в усіх трьох підгрупах.
Отримані дані, подані в табл. 3, наочно демонструють позитивний ефект застосування лантибіотика на основі Streptococcus salivarius K12 у профілактиці рекурентних епізодів інфекцій верхніх дихальних шляхів у дитячій популяції. Водночас необхідно відмітити, що аналіз ефективності препарату в часовому інтервалі (протягом 6 місяців) показав тенденцію до поступового збільшення епізодів фарингітів і ринітів у дітей основної групи після 4-го місяця спостереження.
Оцінюючи переносимість препарату, слід підкреслити відсутність побічних реакцій під час його призначення, що характеризує його високий профіль безпеки та підвищує комплайєнс під час лікування.
Обговорення
Незважаючи на активну зацікавленість у застосуванні лантибіотиків у практичній медицині, все ще багато питань залишаються відкритими; перш за все це стосується механізмів реалізації клінічних ефектів. Сьогодні вже доведено факт здатності SsK12 модулювати імунну відповідь, реалізувати протизапальну та антивірусну активність, але не зовсім зрозумілими залишаються молекулярні механізми впливу на продукцію тих або інших цитокінів, зокрема IL-8 та γ-інтерферону [2]. Результати нашого дослідження наочно підтверджують доведені властивості SsK12, перш за все у профілактиці стрептококового фарингіту. Це один із перших вивчених механізмів впливу Streptococcus salivarius, що дозволяє застосовувати його не лише як засіб вторинної профілактики захворювань, що пов’язані з бета-гемолітичним стрептококом групи А, але й як засіб, що знижує частоту повторного інфікування. Даний факт, швидше за все, обумовлений імунною компетенцією та нормалізацією біоценозу у порожнині рота, що представлена здебільшого нормальною (індигенною) мікрофлорою [12]. Паралельно також включається й протизапальний механізм, який властивий Бактоблісу, що пояснює позитивний клінічний ефект під час комплексного лікування дітей з гіпертрофією глоткової мигдалини.
У здорової людини зазвичай бактеріальна інтерференція проявляється витісненням індигенною мікрофлорою транзиторних (високопатогенних) мікроорганізмів, що за певних обставин стають постійними супутниками макроорганізму. Персистенція на поверхні слизової оболонки бактеріальних асоціацій (біоплівок) відіграє важливу роль у формуванні резистентності до антибактеріальних препаратів [13]. Крім того, проведені дослідження вказують на те, що бактерії роду Haemophilus мають механізм активного імпорту антимікробних пептидів у цитоплазму з їх подальшою внутрішньоклітинною деградацією, що надалі сприяє розвитку надмірного бактеріального росту, насамперед за рахунок грамнегативної мікрофлори, та хронізації запального процесу в носоглотці [14]. Хронічне вогнище інфекції стає надзвичайно вагомим тригером у виникненні рекурентних епізодів гострих респіраторних захворювань. Саме тому висока ефективність SsK12 в їх профілактиці, продемонстрована в даному дослідженні, обумовлена перш за все зменшенням бактеріальної колонізації носоглотки. Важливо зауважити, що даний ефект є дозозалежним і потребує тривалого застосування лантибіотика, а зменшення профілактичної ефективності після 4-го місяця лікування спонукає до призначення його повторних курсів.
Висновки
Отримані позитивні результати свідчать про можливість застосування Streptococcus salivarius K12 (Бактобліс): 1) у профілактиці рецидивів інфекції, пов’язаної з БГСГА; 2) у дітей з гіпертрофією глоткової мигдалини; 3) у профілактиці епізодів наступних інфекцій: вірусний фарингіт, трахеїт, риніт, ларингіт і гострий середній отит. Враховуючи його добру переносимість та відсутність побічних явищ під час 30-денного прийому, а також необхідність тривалого застосування з метою досягнення максимального терапевтичного ефекту, рекомендовано повторні курси по 30 днів 2–3 рази на рік.
Ми визнаємо, що дане спостереження має менш важливе значення, ніж рандомізоване подвійне сліпе контрольоване дослідження, а також його цінність знижує невелика кількість залучених суб’єктів, але у будь-якому випадку отримані результати на–очно демонструють високу ефективність Streptococcus salivarius K12 та розширюють можливості його застосування в клінічній практиці, перш за все у педіатричної категорії пацієнтів. Будемо сподіватися, що подальші дослідження у даному напрямку відкриють нові можливості застосування лантибіотиків як препаратів, що зменшують ризик розвитку резистентності до антибіотиків.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Wescombe P.A. Megaplasmids encode differing combinations of lantibiotics in Streptococcus salivarius / P.A. Wescombe, J.P. Burton, P.A. Cadieux et al. // Antonie Van Leeuwenhoek. — 2006. — 90(3). — 269-280. doi: 10.1007/s10482-006-9081-y.
2. Wescombe P.A. Developing oral probiotics from Streptococcus salivarius / P.A. Wescombe, J.D. Hale, N.C. Heng, J.R. Tagg // Future Microbiol. — 2012. — 7(12). — 1355–1371. doi: 10.2217/fmb.12.113.
3. Hyink O. Salivaricin A2 and the novel lantibiotic salivaricin B are encoded at adjacent loci on a 190-kilobase transmissible megaplasmid in the oral probiotic strain Streptococcus salivarius K12 / O. Hyink, P.A. Wescombe, M. Upton, N. Ragland, J.P. Burton, J.R. Tagg // Appl. Environ. Microbiol. — 2007. — 73(4). — 1107-1113. doi: 10.1128/AEM.02265-06.
4. Burton J.P. Safety assessment of the oral cavity probiotic Streptococcus salivarius K12 / J.P. Burton, P.A. Wescombe, C.J. Moore, C.N. Chilcott, J.R. Tagg // Appl. Environ. Microbiol. — 2006. — 72(4). — 3050-3053. doi: 10.1128/AEM.72.4.3050-3053.2006.
5. Burton J.P. Evaluation of safety and human tolerance of the oral probiotic Streptococcus salivarius K12: a randomized, placebo-controlled, double-blind study / J.P. Burton, S. Cowley, R.R. Simon, J. McKinney, P.A. Wescombe, J.R. Tagg // Food Chem. Toxicol. — 2011. — 49(9). — 2356-2364. doi: 10.1016/j.fct.2011.06.038.
6. Power D.A. Preliminary investigations of the colonisation of upper respiratory tract tissues of infants using a paediatric formulation of the oral probiotic Streptococcus salivarius K12 / D.A. Power, J.P. Burton, C.N. Chilcott, P.J. Dawes, J.R. Tagg // Eur. J. Clin. Microbiol. Infect. Dis. — 2008. — 27(12). — 1261-1263. doi: 10.1007/s10096-008-0569-4.
7. Horz H.P. Distribution and persistence of probiotic Streptococcus salivarius K12 in the human oral cavity as determined by real-time quantitative polymerase chain reaction / H.P. Horz, A. Meinelt, B. Houben, G. Conrads // Oral Microbiol. Immunol. — 2007. — 22(2). — 126-130. doi: 10.1111/j.1399-302X.2007.00334.x.
8. Di Pierro F. Clinical evaluation of the oral probiotic Streptococcus salivarius K12 in the prevention of recurrent pharyngitis and/or tonsillitis caused by Streptococcus pyogenes in adults / F. Di Pierro, T. Adami, G. Rapacioli, N. Giardini, C. Streitber–ger // Expert Opin. Biol. Ther. — 2013. — 13(3). — 339-343. doi: 10.1517/14712598.2013.758711.
9. Di Pierro F. Preliminary pediatric clinical evaluation of the oral probiotic Streptococcus salivarius K12 in preventing recurrent pharyngitis and/or tonsillitis caused by Streptococcus pyogenes and recurrent acute otitis media / F. Di Pierro, G. Donato, F. Fomia, T. Adami, D. Careddu, C. Cassandro, R. Albera // Int. J. Gen. Med. — 2012. — 5. — 991-997. doi: https://doi.org/10.2147/IJGM.S38859.
10. Di Pierro F. Oral use of Streptococcus salivarius K12 in children with secretory otitis media: preliminary results of a pilot, uncontrolled study / F. Di Pierro, D. Di Pasquale, M. Di Cicco // Int. J. Gen. Med. — 2015. — 8. — 303-308. doi: 10.2147/IJGM.S92488.
11. Di Pierro F. Use of Streptococcus salivarius K12 in the prevention of streptococcal and viral pharyngotonsillitis in children / F. Di Pierro, M. Colombo, A. Zanvit, P. Risso, A.S. Rottoli // Drug Healthc. Patient Saf. — 2014. — 6. — 15-20. doi: 10.2147/DHPS.S59665.
12. Hod K., Ringel Y. Probiotics in functional bowel disorders // Best Pract. Res. Clin. Gastroenterol. — 2016. — 30(1). — 89-97. doi: 10.1016/j.bpg.2016.01.003
13. Абатуров А.Е., Крючко Т.А. Настоящая и будущая этиологическая терапия бактериальных пневмоний. 3. Разрабатываемые антибактериальные препараты // Здоровье ребенка. — 2017. — Т. 12, № 5. — С. 74-80. doi: 10.22141/2224-0551.12.5.2017.109278.
14. Леженко Г.О., Абатуров О.Є., Пашкова О.Є. Роль ендогенних антимікробних пептидів у бактеріальній колонізації носоглотки в дітей із гіперплазією ретроназальної мигдалини / Г.О. Леженко // Здоровье ребенка. — 2016. — № 6(74). — С. 74-80. doi: 10.22141/2224-0551.6.74.2016.82136.
/16-1.jpg)

/14-1.jpg)
/15-1.jpg)
/15-3.jpg)
/15-2.jpg)