Резюме
Актуальність. Ожиріння — це дисбаланс імуноцитокінової та нейроендокринної регуляції енергетичного обміну з надлишковим накопиченням жирової тканини в організмі, пов’язаний з формуванням хронічної прозапальної імунної відповіді, асоційованої з генотипом С/С 13910 гена лактази. Мета дослідження: визначити особливості тиреоїдного, статевого гормонального статусу, жирового обміну та формування лептинорезистентності в дітей з ожирінням та поліморфізмами (SNP) гена лактази (LCT). Матеріали та методи. Проведено комплексне обстеження згідно з діючим протоколом зі спеціальності «дитяча ендокринологія» 76 дітей віком 6–18 років з ожирінням та SNP LCT. Першу групу (n = 36) становили діти з генотипом С/С 13910, що асоціюється з лактазною недостатністю дорослого типу. До другої групи (n = 40) увійшли фенотипово схожі діти з генотипами С/Т та Т/Т 13910, що асоціюються з лактазною персистенцією. Визначення порушень жирового обміну проводили методом біоімпедансометрії на електронних вагах Tefal Bodysignal (Франція). Дослідження ендокринного статусу виконували за допомогою імунохімічного методу тестування з електрохемілюмінісцентною детекцією (ECLIA), генотипування гену лактази — за допомогою полімеразної ланцюгової реакції в режимі реального часу. Результати. У дітей з генотипом С/С 13910 виявляються статистично значимі відмінності в ендокринному статусі, пов’язані з підвищенням інсулінорезистентності у хлопчиків до 6,79 ± 1,12 за індексом НОМА проти 3,29 ± 0,99 у хлопчиків з генотипами С/Т та Т/Т 13910 при р = 0,028. У дівчаток з генотипом С/С 13910 відмічається відносне, в межах фізіологічної норми, зниження вільного естрадіолу до 40,10 ± 0,05 пг/мл порівняно з рівнем у дівчаток з генотипами С/Т та Т/Т 13910 — 75,61 ± 4,6 пг/мл при р < 0,01, з одночасним патологічним підвищенням в 3,5 раза дегідроепіандростерону сульфату у віці 15–18 років до 594,50 ± 8,81 мкг/дл відносно рівня у дівчаток з генотипами С/Т та Т/Т 13910 — 167,06 ± 12,80 мкг/дл при р < 0,01. Для дівчаток з генотипом С/С 13910 характерне статистично значиме (р < 0,05) підвищення рівня лептину до 47,84 ± 4,40 нг/мл порівняно з дівчатками з генотипами С/Т та Т/Т 13910 — 32,54 ± 4,30 нг/мл. Порушення жирового обміну асоціюються з більш високим рівнем жирової маси тіла (ЖМТ) у хлопчиків та дівчат з генотипом С/С 13910 відносно дітей з генотипами С/Т та Т/Т 13910, а саме: у хлопчиків з генотипом С/С 13910 середній рівень ЖМТ становив 35,46 ± 2,52 %, тоді як у хлопчиків з генотипами С/Т та Т/Т 13910 — 25,04 ± 2,14 %. У дівчаток з генотипом С/С 13910 середній рівень ЖМТ становив 38,19 ± 2,25 %, тоді як у дівчат з генотипами С/T та Т/Т 13910 середній рівень ЖМТ — 28,99 ± 0,76 % при р < 0,001. Висновки. Фактором ризику ожиріння в дітей є генотип С/С 13910 гена лактази, що асоціюється з лактазною недостатністю дорослого типу. Хлопчики 6–18 років, хворі на ожиріння, носії даного генотипу, мають в 1,5 раза вищий ризик формування інсулінорезистентності. Дівчата 15–18 років з генотипом С/С 13910, хворі на ожиріння, мають в 1,5 раза вищий ризик виникнення лептинорезистентності та в 3,5 раза вищий ризик інвертованого перебігу пубертатного періоду за рахунок гіперандрогенії надниркового генезу.
Актуальность. Ожирение — это дисбаланс иммуноцитокиновой и нейроэндокринной регуляции энергетического обмена с избыточным накоплением жировой ткани в организме, связанный с формированием хронического провоспалительного иммунного ответа, ассоциированного с генотипом С/С 13910 гена лактазы. Цель исследования: определить особенности тиреоидного, полового гормонального статуса, жирового обмена и формирования лептинорезистентности у детей с ожирением и полиморфизмами (SNP) гена лактазы (LCT). Материалы и методы. Проведено комплексное обследование согласно действующим протоколам по специальности «детская эндокринология» 76 детей 6–18 лет с ожирением и SNP LCT. Первую группу (n = 36) составили дети с генотипом С/С 13910, который ассоциируется с лактазной недостаточностью взрослого типа. Во вторую группу (n = 40) вошли фенотипически похожие дети с генотипами С/Т и Т/Т 13910, ассоциирующимися с лактазной персистенцией. Определение нарушений жирового обмена проводили методом биоимпедансометрии на электронных весах Tefal Bodysignal (Франция). Исследование эндокринной системы выполняли с помощью иммунохимического метода тестирования с электрохемилюминисцентной детекцией (ECLIA), генотипирование гена лактазы — с помощью полимеразной цепной реакции в режиме реального времени. Результаты. У детей с генотипом С/С 13910 отмечаются статистически значимые различия в эндокринном статусе, связанные с повышением инсулинорезистентности у мальчиков до 6,79 ± 1,12 по индексу НОМА против 3,29 ± 0,99 у мальчиков с генотипами С/Т и Т/Т 13910 при р = 0,028. У девочек с генотипом С/С 13910 отмечается относительное, в пределах физиологической нормы, снижение свободного эстрадиола до 40,10 ± 0,05 пг/мл по сравнению с уровнем у девочек с генотипами С/Т и Т/Т 13910 — 75,61 ± 4,60 пг/мл, р < 0,01, с одновременным патологическим повышением в 3,5 раза дегидроэпиандростерона сульфата в возрасте 15–18 лет до 594,50 ± 8,81 мкг/дл относительно уровня у девочек с генотипами С/Т и Т/Т 13910 — 167,0 ± 12,8 мкг/дл, р < 0,01. Для девочек с генотипом С/С 13910 характерно статистически значимое (р < 0,05) повышение уровня лептина в 47,84 ± 4,40 нг/мл по сравнению с девочками с генотипами С/Т и Т/Т 13910 — 32,54 ± 4,30 нг/мл. Нарушения жирового обмена ассоциируются с более высоким уровнем жировой массы тела (ЖМТ) у мальчиков и девочек с генотипом С/С 13910 в отношении детей с генотипами С/Т и Т/Т 13910, а именно: у мальчиков с генотипом С/С 13910 средний уровень ЖМТ составил 35,46 ± 2,52 %, тогда как у мальчиков с генотипами С/С и Т/Т 13910 — 25,04 ± 2,14 %. У девочек с генотипом С/С 13910 средний уровень ЖМТ составил 38,19 ± 2,25 %, тогда как у девочек с генотипами С/T и Т/Т 13910 средний уровень ЖМТ — 28,99 ± 0,76 % при р < 0,001. Выводы. Фактором риска ожирения у детей является генотип С/С 13910 гена лактазы, который ассоциируется с лактазной недостаточностью взрослого типа. Мальчики 6–18 лет, страдающие ожирением, носители данного генотипа, имеют в 1,5 раза выше риск формирования инсулинорезистентности. Девушки 15–18 лет с генотипом С/С 13910, страдающие ожирением, имеют в 1,5 раза выше риск возникновения лептинорезистентности и в 3,5 раза выше риск инвертированного течения пубертатного периода за счет гиперандрогении надпочечникового генеза.
Background. Obesity is an imbalance of immunocytokine and neuroendocrine regulation of energy metabolism with excessive accumulation of adipose tissue in the body accompanied by the formation of a chronic proinflammatory immune response associated with the genotype C/C 13910 of the lactase gene. Childhood obesity is a risk factor for the development of type 2 diabetes, steatohepatosis, cardiovascular diseases, orthopedic problems and mental disorders causing both short-term and long-term adverse effects on physical and psychosocial well-being. Materials and methods. A comprehensive examination was carried out according to the current protocols in the field of pediatric endocrinology for 76 children aged 6 to 18 years with obesity and SNP LCT. The first group (n = 36) was composed of children with genotype С/C 13910, which is associated with adult type of lactase deficiency. The second group (n = 40) presented phenotypically similar children with genotypes C/T and T/T 13910 associated with lactase persistence. The determination of lipid disorders was carried out using bioimpedancemetry on the Tefal Bodysignal electronic scales (France). The study of the endocrine system was performed using an immunochemical test method with electrochemiluminescence immunoassay, genotyping of the lactase gene by real time polymerase chain reaction. Results. Children with genotype C/C 13910 have statistically significant differences in endocrine status associated with an increase in insulin resistance in boys up to 6.79 ± 1.12 in the HOMA index, compared with 3.29 ± 0.99 in boys with C/T and T/T 13910 genotypes; p = 0.028. In girls with the C/C 13910 genotype, there is a relative, within the limits of the physiological norm, decrease in free estradiol to 40.10 ± 0.05 pg/ml, as compared with the level of girls with C/T and T/T 13910 genotypes — 75.61 ± 4.60 pg/ml, p < 0.01, with simultaneous pathological dehydroepiandrosterone sulfate increase by 3.5 times at the age of 15–18 years to 594.50 ± 8.81 μg/dl relative to the level of girls with genotypes C/T and T/T 13910 — 167.0 ± 12.8 μg/dl, p < 0.01. For girls with the genotype C/C 13910, a statistically significant (p < 0.05) increase in the level of leptin to 47.84 ± 4.40 ng/ml is observed, compared with girls with genotypes C/T and T/T 13910 — 32.54 ± 4.30 ng/ml.
Malnutrition disorders are associated with a higher body fat mass (BFM) in boys and girls with the C/C 13910 genotype as compared to children with genotypes C/T and T/T 13910, namely, in boys with the genotype C/C 13910, mean BFM level was 35.46 ± 2.52 %, while in boys with C/C and T/T 13910 genotypes — 25.04 ± 2.14 %. For girls with genotype C/C 13910, the mean BFM was 38.19 ± 2.25 %, whereas in girls with genotypes C/T and T/T 13910, the mean BFM was 28.99 ± 0.76 %, with p < 0.001. Conclusions. The risk factor for obesity in children is the lactase gene C/C 13910 genotype, which is associated with adult lactase deficiency. Obese boys aged 6–18 years, carriers of this genotype, have 1.5 times higher risk of developing insulin resistance and type 2 diabetes. Obese girls aged 15–18 years with the C/C 13910 genotype have 1.5 times higher risk of leptin resistance and 3.5 times — the risk of inverted puberty period due to hyperandrogenemia of the adrenal origin, which taken as a whole causes polycystic ovary syndrome, infertility. The obtained data can be used to substantiate the scientific and practical program for optimization of protocols for the diagnosis and treatment of obesity associated with lactase deficiency of an adult type in childhood.
Вступ
Ожиріння — це дисбаланс імуноцитокінової та нейроендокринної регуляції енергетичного обміну з надлишковим накопиченням жирової тканини в організмі, пов’язаний з персистенцією хронічної прозапальної імунної відповіді. За даними Всесвітньої організації охорони здоров’я, на планеті близько 22 мільйонів дітей молодше 5 років і 155 мільйонів дітей шкільного віку мають надлишкову вагу і ожиріння [4, 15, 16]. На даний час в розвинених країнах 20–30 % дітей і підлітків мають надлишкову масу тіла і страждають від ожиріння [5].
Важливою складовою механізмів патогенезу ожиріння є сама жирова тканина, яка має ендо-, ауто- і паракринну функції. Речовини, що синтезуються жировою тканиною, представлені лептином, адіпонектином, інтерлейкіном 6, неетерифікованими жирними кислотами (НЕЖК), протеїном, що стимулює ацетилювання; інгібітором активатора плазміногену 1 (ІАП-1), що трансформує ростовий фактор В, ангіотензиногеном, мають різноманітну біологічну дію і можуть впливати на активність метаболічних процесів в тканинах і системах організму безпосередньо або опосередковано через ней–роендокринну систему, взаємодіючи з гормонами гіпофіза, катехоламінами, стероїдами, інсуліном. Жирова тканина також містить важливі регулятори ліпопротеїнового метаболізму: ліпопротеїнову ліпазу, гормоночутливу ліпазу; протеїн, який переносить ефіри холестерину.
Ожиріння асоціюється зі значними порушеннями в ендокринному статусі: інсулінорезистентністю, гіпотиреозом, гіперкортицизмом, гіпогонадизмом у хлопчиків та гіперандрогенією у дівчат. Інсулінорезистентність запускає каскад реакцій імуноцитокінового та нейроендокринного дисбалансу, особливо виражений в період статевого дозрівання, та характеризується, за даними літератури, розвитком гіпоестрогенемії, гіперандрогенії надниркового генезу за рахунок підвищення дегідроепіандростерону сульфату у дівчат та нормогонадотропного гіпогонадизму у хлопців [11, 12]. Хронічна гіперінсулінемія первинно носить компенсаторний, для підтримки еуглікемії, характер, призводить до активації ліполізу в вісцеральній жировій тканині з вивільненням НЕЖК, що є важливим метаболічним фактором ризику дисліпопротеїдемії та прогресування лептинорезистентності. Передбачається, що функція лептину спрямована головним чином на збереження запасів енергії, тобто на адекватність накопичення жиру. Лептинемія корелює із загальною кількістю жиру в організмі і є важливим сигналом для лімбічної системи, що спонукає ссавців шукати їжу. Надлишок лептину, в свою чергу, призводить до пригнічення секреції інсуліну, викликає резистентність скелетних м’язів і жирової тканини до його впливу, сприяє гіперглікемії, формуючи гіперфагію [13].
Доведено, що більш висока поширеність надмірної маси тіла та ожиріння пов’язана з генотипом С/С 13910 гена лактази, але порушення в ендокринному статусі при SNP LCT не вивчались [1–3, 9].
Незважаючи на досягнуті успіхи в ендокринології та молекулярній генетиці, проблема дитячого ожиріння залишається досить актуальною та потребує подальшого пошуку впливу на ключові фактори метаболічного ризику.
Мета дослідження: визначити особливості тиреоїдного, статевого гормонального статусу, жирового обміну та формування лептинорезистентності в дітей з ожирінням та SNP LCT.
Матеріали та методи
Під нашим спостереженням знаходилось 76 дітей віком 6–18 років з верифікованим діагнозом «ожиріння» згідно з Наказом МОЗ України № 254 від 27.04.06 зі спеціальності «дитяча ендокринологія», які перебували на стаціонарному лікуванні в ендокринологічному відділенні КЗ «Дніпропетровська МДКЛ № 1» ДОР».
Визначення наявності поліморфізмів у гені лактази проводилось в сертифікованій лабораторії Sinevo за допомогою полімеразної ланцюгової реакції з детекцією результатів в режимі реального часу. Як аналізатор використовувався детектор ДТ 96 тест-системи «ДНК-Технологія» (РФ). Матеріалом для дослідження була венозна кров.
За результатами дослідження SNP LCT усі діти були поділені на дві групи спостереження. До першої групи спостереження (n = 36) увійшли діти з ожирінням, які мали генотип С/С 13910, асоційований з лактазною недостатністю дорослого типу. Другу групу (n = 40) становили діти з ожирінням, які мали фенотипово схожі генотипи С/Т 13910 (гетерозиготна лактазна персистенція) та Т/Т 13910 (гомозиготна лактазна персистенція). За кількісними, віковими та гендерними характеристиками групи були порівняними. Так, середній вік представників у першій клінічній групі становив 13,8 року, кількість хлопчиків — 60 %. У другій клінічній групі середній вік становив 13 років, кількість хлопчиків — 56,4 % (р > 0,05).
Лабораторне дослідження включало загальноклінічні обстеження, визначення імунореактивного базального інсуліну та глікемії з підрахунком індексу інсулінорезистентності (IR HOMA); гормональне дослідження з визначенням в венозній крові тиреотропного гормона (ТТГ), вільного тироксину (вТ4), антитіл до тиреопероксидази (АТПО), пролактину (Пр), вільного тестостерону (вТ), естрадіолу (Е), фолікулостимулюючого та лютеінізуючого гормонів (ФСГ та ЛГ), дегідроепіандростерону сульфату (ДЕАС-SO4), вільного кортизолу (К), лептину (Л).
Визначення рівня базального інсуліну було виконано в лабораторії Sinevo за допомогою імунохімічного методу тестування з електрохемілюмінісцентною детекцією (ECLIA) з використанням аналізатора і тест-системи Cobas 6000, Roche Diagnostics (Швейцарія). Нормальним вважався рівень базального інсуліну в венозній крові 2,6–
24,9 мкOд/мл. Використовуючи формулу (1), обчислювали рівень чутливості периферичних тканин до інсуліну, індекс інсулінорезистентності НОМА (Homeostasis Model Assesment):
IR НОМА = (глікемія натще (ммоль/л) × інсулін
натще (мкOД/л)) / 22,5. (1)
Підвищення інсулінорезистентності відмічалось при НОМА-IR > 95-го перцентилю відповідно до перцентильних кривих, рекомендованих Консорціумом IDEFICS для європейської популяції згідно з віком та статтю дитини [6, 7, 10].
Гормональне дослідження було виконано в лабораторії Sinevo за допомогою імунохімічного методу тестування з електрохемілюмінісцентною детекцією (ECLIA) з використанням аналізатора і тест-системи Cobas 6000, Roche Diagnostics (Швейцарія). Забір венозної крові для визначення гормональної панелі у дівчат проводився на 5–7-й день менструального циклу в фолікулярну фазу.
Визначення лептину було проведене в лабораторії Sinevo за допомогою имуноферментного аналізу ELISA з використанням аналізатору і тест-системи LDN (Німеччина). Референтні значення для хлопців були 2,0–5,6 нг/мл, для дівчат — 3,7–11,1 нг/мл.
Вивчення порушень жирового обміну проводили методом біоімпедансометрії на електронних підлогових вагах Tefal Bodysignal (Франція), з визначенням біоелектричного імпедансу (Ом) — опіру тканин при проходженні безпечного електричного струму (50 кГц, 800 мкА) між контактними електродами, що розташовувались в місцях контакту зі стопами дитини на вимірювальній платформі вагів. Розрахунок відсоткового вмісту жиру або жирової маси тіла (ЖМТ) в організмі проводився автоматично з дискретністю 0,1 %, згідно з вимогами Tefal Bodysignal, з оцінюванням результатів відповідно до уніфікованих центильних шкал для дітей даного віку [8, 14].
Статистичний аналіз отриманих даних був виконаний з використанням пакета прикладних програм Statistica 6.0. Відмінності визначались значущими при р < 0,05.
Критеріями виключення пацієнтів з дослідження були: наявність вторинних форм ожиріння, спадкових синдромів, що супроводжуються ожирінням, та захворювань, лікування яких потребує використання медикаментів, що впливають на обмін вуглеводів та ліпідів, вагітність.
Дослідження проведене з урахуванням основних положень ICH GCP та Гельсінської декларації щодо біомедичних досліджень, у яких людина виступає їх об’єктом.
Результати та обговорення
У нашому дослідженні у більшості дітей з ожирінням незалежно від SNP LCT тиреоїдна функція не була порушеною та характеризувалась базальними рівнями ТТГ, вТ4 та АТПО в межах референтних значень (табл. 1).
У дітей з ожирінням порушення статевого дозрівання асоціювались з SNP LCT. Базальний рівень пролактину в дітей з ожирінням, незалежно від статті, реєструвався в межах референтних значень, але у хлопчиків віком 14–18 років з генотипом С/С 13910 відмічалось його збільшення в 2 рази порівняно з хлопчиками з генотипом С/Т та Т/Т 13910 при р < 0,05. Таким чином, відносне збільшення пролактину у хлопчиків з генотипом С/С 13910 може пригнічувати репродуктивну функцію та фізіологічний процес статевого дозрівання за рахунок подальшого зменшення секреції ЛГ та ФСГ, блокуючи процеси стероїдогенезу в гонадах, сприяючи формуванню синдрому гіпогонадизму.
Статистично значимих відхилень при вивченні обміну ЛГ, ФСГ, вТ у хлопчиків віком 6–18 років з ожирінням та SNP LCT не виявлено.
У пізньому пубертатному періоді у дівчаток та хлопчиків з ожирінням та SNP LCT розраховувалось співвідношення між ЛГ/ФСГ в фолікулярну фазу, яке було менше 1,5 ум.од. та відповідало фізіологічним нормам.
Для дівчаток 11–18 років з генотипом С/С 13910 патогномонічним є відносне, в межах фізіологічної норми, зниження в 1,8 раза вільного естрадіолу до 40,10 ± 0,05 пг/мл порівняно з рівнем у дівчаток з генотипами С/Т та Т/Т 13910 — 75,61 ± 4,60 пг/мл при р < 0,01.
У той же час у ранньому пубертатному періоді визначалось патологічне підвищення рівнів ДГЕА-SO4, більш виражене при фенотипово однакових генотипах С/Т та Т/Т 13910 — до 412,30 ± 14,56 мкг/дл
і у дівчаток з генотипом С/С 13910 — до 309,0 ± 8,2 мкг/дл. У пізньому пубертатному періоді у дівчаток з генотипом С/С 13910 підвищення ДГЕА-SO4 було в 3,5 раза більшим відносно фізіологічного рівня у дівчаток з генотипами С/Т та Т/Т 13910 — до 594,50 ± 8,81 та 167,06 ± 12,80 мкг/дл при р < 0,01.
Отримані дані свідчать, що більш домінуючу роль, ніж естрадіол, в процесі статевого дозрівання дівчаток з ожирінням відіграє ДГЕА-SO4, особливо у віці 11–14 років при генотипах С/Т та Т/Т 13910, що сприяє інвертованому пубертатному періоду з первинним виникненням адренархе, затримкою телархе. У подальшому, у 15–18 років, патологічні зміни в статевому дозріванні дівчат прогресують та порушують процеси фемінізації при генотипі С/С 13910, нормалізуючись при генотипах С/Т та Т/Т 13910.
Для дівчаток з генотипом С/С 13910 також характерне підвищення рівня лептину до 47,84 ± 4,40 нг/мл порівняно з дівчатками з генотипами С/Т та Т/Т 13910 — 32,54 ± 4,30 нг/мл при р < 0,05.
У хлопчиків з генотипом С/С 13910 відмічається підвищення інсулінорезистентності до 6,79 ± 1,12 за ІR НОМА проти рівня 3,29 ± 0,99 у хлопчиків з генотипами С/Т та Т/Т 13910 при р = 0,028.
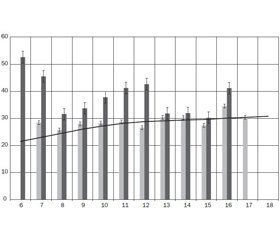
При дослідженні порушень жирового обміну у хлопчиків з генотипом С/С 13910 середній рівень ЖМТ становив 35,46 ± 2,52 %, тоді як у хлопчиків з генотипами С/Т та Т/Т 13910 — 25,04 ± 2,14 % –(t-критерій 3,15; р < 0,005). Протягом усього періоду дитинства середні рівні ЖМТ у хлопчиків з першої групи спостереження були вище 85-го перцентилю та представлені таким чином: 6–10 років — 42,17 ± 4,86 %; 11–14 років — 33,32 ± 1,61 %; 15–18 років — 29,36 ± 5,09 %. У хлопців з другої групи спостереження середній рівень ЖМТ нормалізувався та був нижче 85-го перцентилю у віці 10, 14–15 років, а саме: 6–10 років — 26,78 ± 6,26 %; 11–14 років — 24,6 ± 4,7 %; 15–18 років — 22,30 ± 2,34 % (рис. 1).
У дівчаток з генотипом С/С 13910 середній рівень ЖМТ становив 38,19 ± 2,25 %, мав тенденцію до нормалізації у 15-річному віці (дорівнював 85-му перцентилю), але був статистично вищим (t-критерій 3,87; р < 0,001), ніж середній рівень ЖМТ (28,99 ± 0,76 %) у дівчат з генотипами С/T та Т/Т 13910. У різних вікових відрізках середні рівні ЖМТ у дівчаток з першої клінічної групи були представлені таким чином: 6–10 років — 40,85 ± 5,73 %; 11–14 років — 38,36 ± 2,78 %; 15–18 років — 34,42 ± 4,16 %. Тоді як середні рівні ЖМТ у дівчат з другої групи порівняння становили: 6–10 років — 27,61 ± 0,72 %; 11–14 років — 29,00 ± 1,03 %; 15–18 років — 28,99 ± 0,76 % та практично співпадали з віссю 85-го перцентилю (рис. 2).
Висновки
Вивчення особливостей ендокринного статусу в дітей з ожирінням та поліморфізмами гена лактази дозволяє доповнити уявлення про молекулярно-генетичні механізми даної коморбідної патології в умовах сучасного урбанізованого суспільства. Фактором ризику ожиріння в дітей є генотип С/С 13910 гена лактази, що асоціюється з лактазною недостатністю дорослого типу.
Хлопчики 6–18 років, хворі на ожиріння, носії даного генотипу, мають в 1,5 раза вищий ризик формування інсулінорезистентності та, в майбутньому, цукрового діабету 2-го типу. Дівчата 15–18 років з генотипом С/С 13910, хворі на ожиріння, мають в 1,5 раза вищий ризик виникнення лептинорезистентності та в 3,5 раза вищий ризик інвертованого перебігу пубертатного періоду за рахунок гіперандрогенії надниркового генезу, що в комплексі може спричиняти безпліддя.
Перспективним видається розробка персоніфікованих схем патогенетичної терапії з використанням препаратів екзогенної лактази. Отримані дані можуть бути використані для обґрунтування науково-практичної програми з оптимізації протоколів діагностики та лікування ожиріння, асоційованого з лактазною недостатністю дорослого типу в дитячому віці.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів.
Список литературы
1. Абатуров О.Є. Асоціація однонуклеотидного поліморфізму гена лактази з інсулінорезистентністю у дітей / О.Є. Абатуров, А.О. Нікуліна // Сучасні медичні технології. — 2016. — 4(31). — С. 33-36.
2. Абатуров О.Є. Асоціація однонуклеотидного поліморфізму гена лактази з дисліпопротеїдемією при ожирінні у дітей / О.Є. Абатуров, А.О. Нікуліна // Современная педиатрия. — 2017. — 2(82). — С. 118-121. — doi: 10.15574/SP.2017.82.118.
3. Абатуров О.Є. Молекулярно-генетична концепція формування психотипів особистості у дітей при ожирінні, асоційованому з лактозною інтолерантністю / О.Є. Абатуров, А.О. Нікуліна // Здоровье ребенка. — 2017. — 4(12). — С. 17-22. — doi: 10.22141/2224-0551.12.4.2017.1076222.
4. International Association for the Study of Obesity. Online database of national prevalence data from published national surveys. London: IASO, 2014. (Accessed 25 January 2014, at http://www.iaso.org/site_media/library/resource_images/Global_Childhood _Overweight _October_2013.pdf.)
5. Kiess W. Childhood obesity at the crossroads / W. Kiess, М. Penke, E. Sergeyev et al. // Journal of Pediatric Endocrinology and Metabolism. — 2015. — 25. — Р. 481-4. — doi: 10.1515/jpem-2015-0168.
6. Lissner L. Television habits in relation to overweight, diet and taste preferences in European children: the IDEFICS study / L. Lissner, A. Lanfer, W. Gwozdz et al. // Eur. J. Epidemiol. — 2012. — № 27(9). — P. 705-715. — doi: 10.1007/s10654-012-9718-2.
7. Martin R.M. Filter paper blood spot enzyme linked immunoassay for insulin and application in the evaluation of determinants of child insulin resistance / R.M. Martin, R. Patel, A. Zinovik et al. // PLoS One. — 2012. — № 7(10). — Р. e46752. — doi: 10.1371/journal.pone.0046752.
8. McCarthy H.D. Body fat reference curves for children / H.D. McCarthy, T.J. Cole, T. Fry et al. // Int. J. Obes. (Lond.). — 2006 Apr. — 30(4). — Р. 598-602. — doi: 10.1038/sj.ijo.0803232.
9. Paasela M. Lactose inhibits regulatory T-cell-mediated suppression of effector T-cell interferon-γ and IL-17 production / M. Paasela, K.-L. Kolho, O. Vaarala et al. // British Journal of Nutrients. — 2014. — № 112(11). — Р. 1819-1825. — doi: 10.1017/S0007114514001998. Epub 2014 Oct 21.
10. Peplies J. IDEFICS consortium. Longitudinal associations of lifestyle factors and weight status with insulin resistance (HOMA-IR) in preadolescent children: the large prospective cohort study IDEFICS / J. Peplies, C. Börnhorst, K. Günther et al. // Int. J. Behav. Nutr. Phys. Act. — 2016 Sep 2. — № 13(1). — P. 97. — doi: 10.1186/s12966-016-0424-4/.
11. Qiu X. Insulin and Leptin Signaling Interact in the Mouse Kiss1 Neuron during the Peripubertal Period / X. Qiu, H. Dao, M. Wang, A. Heston et al. // PLoS One. — 2015. — 10(5). — Р. e0121974. — doi: 10.1371/journal.pone.0121974.
12. Reinehr T. Metabolic Syndrome in Children and Adolescents: a Critical Approach Considering the Interaction between Pubertal Stage and Insulin Resistance // Curr. Diab. Rep. — 2016 Jan. — 16(1). — Р. 8. — doi: 10.1007/s11892-015-0695-1.
13. Reinehr T. Strong effect of pubertal status on metabolic health in obese children: a longitudinal study / T. Reinehr, B. Wol–ters, C. Knop et al. // J. Clin. Endocrinol. Metab. — 2015 Jan. — 100(1). — Р. 301-8. — doi: 10.1210/jc. 2014-2674.
14. Schwandt P. Percentiles of Percentage Body Fat in German Children and Adolescents: An International Comparison / P. Schwandt, A. von Eckardstein, G.-M. Haas // Int. J. Prev. Med. — 2012 Dec. — 3(12). — Р. 846-852. — PMCID: PMC3530302.
15. WHO European Childhood Obesity Surveillance Initiative (COSI). (Accessed June 24, 2014).
16. Wijnhoven T.M. WHO European Childhood Obesity Surveillance Initiative 2008: weight, height and body mass index in 6-9-year-old children / T.M. Wijnhoven, J.M. van Raaij, A. Spinelli et al. // Pediatr. Obes. — 2013. — 8. — Р. 79-97. — doi: 10.1111/j.2047-6310.2012.00090.x. Epub 2012 Sep 21.

/28-1.jpg)
/29-1.jpg)