Вступ
Венозні мальформації (ВМ) є вродженими судинними мальформаціями з повільним кровотоком, що формуються з непроліферативних аномальних ектазованих венозних каналів [1]. Вони є найбільш поширеними серед судинних аномалій, поступаючись за частотою лише інфантильним гемангіомам. Їх частоту описують як 1–2 на 10 000 живих новонароджених дітей [2].
Історично так склалося, що в ранньому віці ВМ приймають за гемангіоми, використовуючи застарілий термін «кавернозна гемангіома», «кавернома». Однак гемангіоми як судинні пухлини мають іншу етіологію, ембріогенез, клінічні прояви, прогноз і потребують відмінної лікувальної тактики. На той час як найбільш поширені інфантильні гемангіоми є специфічними пухлинами дитячого віку зі спонтанною інволюцією, ВМ є залишками ембріональних тканин, які ніколи не інволюціонують спонтанно. Чітке розуміння цих критичних чинників та точне формулювання діагнозу необхідні для успішного лікування ВМ [3].
Лікування ВМ у дітей залишається складною проблемою, оскільки вони нерідко охоплюють великі ділянки тіла й мають потенційні комуніканти з магістральними венами. З огляду на ембріональну структуру периферичних ВМ та збережений потенціал росту радикальне лікування не завжди можливе. Метою терапії є довготривалий контроль розмірів та симптомів ВМ. Виключно хірургічне лікування використовувалося в той час, коли знання стосовно патофізіології й біології ВМ були значно обмеженими [4]. Хірургічне втручання є ефективним у випадку невеликих, чітко локалізованих, переважно надфасціальних уражень, при мальформаціях великих розмірів хірургічне втручання застосовується для паліативного видалення лише частини новоутворення [5]. Незадовільні результати операційного втручання привели до впровадження в практику чисельних лікувальних маніпуляцій, зокрема, у різні періоди використовували іонізуюче випромінювання, електрокоагуляцію, технології заморожування тощо [6].
На відміну від терапії інфантильних гемангіом, на даний час не відомі лікарські засоби, що могли б покращити перебіг ВМ [7]. Тому медикаментозну терапію використовують лише для лікування ускладнень ВМ, в основному це прямі антикоагулянти для корекції локальної внутрішньосудинної коагулопатії та антибактеріальні препарати, що застосовуються у випадку інфекційних ускладнень. Антиагреганти, такі як аспірин і тиклопідин, нестероїдні протизапальні засоби не рекомендуються ні для лікування ВМ-асоційованих коагуляційних порушень, ні для знеболення, оскільки клінічний результат відсутній або мінімальний [8]. Ретроспективне дослідження доводить ефективність низькомолекулярного гепарину для зменшення болю, спричиненого локальним внутрішньосудинним згортанням (ЛВЗ), нормалізації коагуляційного профілю й запобігає прогресуванню тяжкого ЛВЗ у дисеміноване внутрішньосудинне згортання (ДВЗ), особливо в пацієнтів із низьким рівнем фібриногену [9].
Склерозуюча терапія є найбільш давнім методом лікування ВМ і на сьогодні залишається одним з основ–них методів терапії [10]. Речовина, що потенційно буде використовуватися як склерозант, повинна чинити фізичний, хімічний та/або біологічний вплив на тканину-мішень та індукувати контрольовану запальну відповідь [11]. Фармакологічний препарат може ініціювати виникнення інших процесів, таких як тромбоз, денатурація білків, дегідратація клітин унаслідок різниці осмотичного тиску, оклюзія просвіту судини в результаті реакції полімеризації [8]. Прогнозованою метою зазначених процесів є контрольоване порушення біологічної функції тканини-мішені.
Незважаючи на великий перелік склерозуючих речовин, у практиці кожної країни використовується лише обмежена їх кількість. У першу чергу це пов’язано з дозвільною системою урядів. По-друге, ідеальна склерозуюча речовина не знайдена, кожна з них має свої переваги й недоліки [12]. Найбільш поширеною хімічною сполукою є етиловий спирт, історія використання якого нараховує понад сто років. Проте при використанні етанолу в дітей є небезпека виникнення ускладнень, що пов’язані з підвищенням вмісту препарату в крові внаслідок проникнення його через стінку судини та необхідності використання достатньо високих доз для отримання терапевтичного ефекту [13]. Найбільш широко в дитячій хірургії використовуються детергенти для склерозування ВМ, які є ефективними та безпечними, загальна частка описаних ускладнень становить 1,44 % [14].
Недоліком детергентів є потенційна небезпека реканалізації, тому можливість досягнення повної ерадикації вогнища ВМ лише шляхом використання склерозантів сумнівна, проте за їх допомогою можна досягти істотного зниження больового синдрому та зменшення об’єму ВМ [15].
У щоденній практиці спосіб лікування судинних мальформацій обирається з огляду на досвід спеціалістів, технічне оснащення клініки, доступність певних видів препаратів та обговорення ризику лікувальних маніпуляцій і природного перебігу захворювання з пацієнтами та/або їх родичами. Наявні міжнародні рекомендації пропонують лише певну стратегію лікувальної тактики, а не детальні протоколи лікування [16].
При аналізі літератури останнього десятиріччя, присвяченої лікуванню ВМ, привертає увагу не–однорідність критеріїв оцінки ефективності різних способів лікування, що включають як суб’єктивну оцінку пацієнтів за шкалою опитування [17], так і імпровізовану шкалу результатів без цифрової градації (істотне покращання, помірне покращання, незначне покращання, без змін, погіршення) [18]. Це відображає наявність низки питань щодо тактики лікування ВМ у дітей.
Мета дослідження — визначити інформативні методи діагностики та ефективні й безпечні способи лікування ВМ у дітей.
Матеріали та методи
Протягом періоду від грудня 2010 до березня 2017 року на клінічній базі дитячої хірургії НМУ імені О.О. Богомольця НДСЛ «ОХМАТДИТ» перебували на стаціонарному лікуванні 163 дитини із судинними мальформаціями, серед яких ВМ діагностовано у 27 (16,56 %). Вік пацієнтів із ВМ на момент госпіталізації становив від 2 місяців до 17,5 року. Співвідношення статей становило 1 : 1,1 (представники жіночої статі — 13, чоловічої — 14).
При надходженні в клініку всім пацієнтам виконували ультразвукове дослідження (УЗД) апаратом Philips із лінійним датчиком 12–3 MHz у режимах сірої шкали, кольорового допплерівського сканування (КДС) та частково в режимі Допплера. Магнітно-резонансну томографію (МРТ) виконували на апараті Siemens Avanto 1,5T у режимі Т1, Т2, FetSet, STIR.
Для визначення розмірів ВМ використовували сферичну геометрію [19], обчислювали об’єм ураження, використовуючи формулу:
V = 4/3πr3,
де V — об’єм та r — радіус (у випадку ВМ — умовний радіус).
Найбільший розмір ураження у будь-якій проекції вимірювали в режимі Т2, потім ділили на 2, щоб отримати умовний радіус. Малі ураження визначали як такі, що мають об’єм менше від 250 мл і, відповідно, діаметр до 8 см, середні ураження мають об’єм в межах 250–500 мл (близько 10 см у діаметрі) та великі ураження — понад 500 мл. Ураження, максимальний розмір яких перевищував 20 см, визначали як гігантські.
Для визначення коагуляційних розладів проводили лабораторне дослідження периферичної крові, яку отримували з вени, що знаходиться поза ділянкою ураження. Визначали кількість тромбоцитів (референтне значення 150–400 × 103/µл, конвертоване до 109), рівень фібриногену (референт–ні значення 2–4 г/л), D-димерів у плазмі крові (референтне значення < 0,5 µл/мл).
Склерозування проводили в умовах операційної зали з використанням загального знеболювання на фоні адекватної гідратації пацієнта. Контроль за проведенням маніпуляції здійснювали за допомогою УЗД у реальному часі. Для склерозування периферичних ВМ у дітей використовували метод Tessari [12], що полягає у введенні склерозуючої речовини у вигляді піни, яку отримували шляхом змішування лікарського препарату й повітря у співвідношенні 2 : 3 за допомогою двох шприців і 3-просвітного перехідника (рис. 1). Максимальний об’єм детергенту для однієї маніпуляції становить 0,5 мл/кг у випадку 3% розчину і не більше ніж 20 мл на одну маніпуляцію.
Тривалість спостереження після завершення лікування ВМ становила від 10 до 83 місяців.
Цифрові результати піддавали статистичній обробці з використанням програми IBM SPSS Statistics, версія 23. Дані наведені як середні з 95% довірчим інтервалом або зі стандартним відхилен–ням. Для оцінки якісних даних для кожного випадку було використано одноваріантний аналіз із застосуванням χ2 критерію Пірсона й тесту Фішера. Для кількісних варіант використовували парний t-тест. Порівняння рівня D-димерів до й після лікування проведено з використанням тесту Wilcoxon у пацієнтів з коагуляційними порушеннями та позитивними тестами на D-димери. Для всіх статистичних аналізів P < 0,05 було статистично значимим.
Результати
ВМ виявлено в таких анатомічних ділянках: кінцівки (n = 8; 29,63 %), грудна стінка (n = 4; 14,81 %), голова й шия (n = 3; 11,11 %), аксилярна ділянка (n = 2; 7,41 %), промежина (n = 2; 7,41 %), а також відзначені ураження, що охоплюють декілька анатомічних ділянок (n = 8; 29,63 %).
Клінічні симптоми ВМ у дітей з’явились у віці від 0 до 15 років, у середньому в 2,87 ± 3,74 року. Клінічні симптоми наявні з народження в 9 (33,33 %) пацієнтів, протягом першого року життя вони з’явилися ще в 7 (25,93 %) випадках. Клінічними проявами ВМ були: біль (n = 19; 70,37 %), косметичні деформації (n = 14; 51,85 %), набряк кінцівки (n = 8; 29,63 %), кровотеча, постгеморагічна анемія (n = 3; 11,11 %), різниця в довжині кінцівок (n = 3; 11,11 %), сколіоз (n = 2; 7,41 %), гемартроз (n = 2; 7,41 %), компресія верхніх дихальних шляхів, трахеостома (n = 1; 3,70 %), порушення зору (n = 1; 3,70 %), кривошия (n = 1; 3,70 %), гіпергідроз (n = 1; 3,70 %).
Діагноз ВМ було встановлено на основі УЗД у режимі сірої шкали та режимі допплера, який проводили всім пацієнтам при первинному звертанні, а також у динаміці, МРТ (n = 27), комп’ютерної томографічної ангіографії (n = 8), гістологічного дослідження препаратів у випадку хірургічного втручання (n = 14).
УЗД з визначенням гемодинамічних характеристик ураження з використанням режиму допплера та КДС застосовували в усіх пацієнтів як скринінговий метод діагностики, а також для контролю динаміки захворювання й результатів лікування. Патогномонічною ознакою ВМ є флеболіти, при УЗД вони виявляються за характерною акустичною тінню (рис. 2).
За результатами проведеного МРТ іденти–фікували тканини, уражені в пацієнтів із ВМ: лише шкіра й підшкірна клітковина (n = 2; 7,69 %), м’язи (n = 20; 76,92 %), суглоби (n = 3; 11,54 %), внутрішні органи (n = 4; 15,38 %), слизові оболонки (n = 6, 22,22 %), зовнішні статеві органи (n = 2; 7,69 %), заочеревинний простір (n = 3; 11,54 %).
За розміром ВМ розподілялись таким чином: малі (n = 4; 14,81 %), середні (n = 13; 48,15 %), великі (n = 8; 29,63 %), гігантські (n = 2; 7,40 %).
Для малих ВМ характерне ураження певного виду тканин, наприклад, при ізольованому ураженні двоголового м’яза стегна (рис. 3) ураження обмежене м’язовою тканиною, відмежована ВМ розташована в ділянці шиї в межах підшкірної клітковини (рис. 4).
Для ВМ середніх і великих розмірів характерне ураження тканин різного походження (шкіри, підшкірної клітковини, м’язів, клітковинних просторів тощо). У пацієнта з розширеною венозною підшкірною сіткою в ділянці грудної стінки за результатами МРТ виявлено дифузне ураження м’язів, поширення в заочеревинну клітковину (рис. 5).
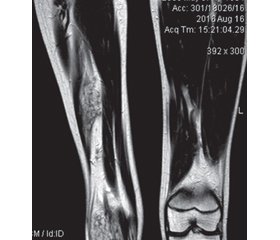
Дифузне ураження великої площі м’язів кінцівок призводить до їх атрофії, що візуально проявляється зменшенням діаметра ураженої кінцівки порівняно зі здоровою, ускладненням гемартрозу є контрактура суглоба та вкорочення кінцівки (рис. 6).
Рівень D-димерів був підвищений у 15 (55,56 %) пацієнтів, тоді як помірне зниження фібриногену (у межах 1,2–2,0 г/л) спостерігали лише в 3 (11,12 %) дітей. Флеболіти виявлено в 19 (70,37 %) пацієнтів. Флеболіти при поверхневому розташуванні можна визначити пальпаторно, вони мають характерну картину при УЗД (рис. 2), їх можна також виявити на оглядовій рентгенограмі, КТ, МРТ (рис. 7).
Встановлено, що підвищення рівня D-димерів не залежить від статі пацієнтів (критерій Пірсона 0,078; р = 0,705), виявлена слабка залежність від віку появи перших симптомів (критерій Пірсона 0,394; р = 0,04) та сильна залежність від наявності флеболітів (критерій Пірсона 0,709; р = 0,000) і розміру ВМ (критерій Пірсона 0,632; р = 0,001). За результатами проведеного одноваріантного аналізу створена таблиця мультиваріантного аналізу прогнозування ЛВЗ у пацієнтів із ВМ (табл. 1).
Згідно з результатами проведеного дослідження, високий ризик ЛВЗ спостерігається в пацієнтів із ВМ великих та гігантських розмірів та наявністю флеболітів.
Лікувальна тактика в дітей з ВМ включала консервативну терапію, хірургічне лікування, склерозування та комбіноване лікування. Для консервативного лікування нами використано компресійний трикотаж, низькомолекулярний гепарин, антибактеріальну терапію. Хірургічне лікування включало радикальне видалення ВМ, резекцію ВМ, перев’язку патологічно змінених судин. Для склеротерапії використовували детергенти — полідоканол та тетрадецилсульфат натрію в концентрації 0,2–3 %.
Лікування розпочинали у віці від двох місяців до 16 років, середній вік становив 5,30 ± 4,46 року.
8 пацієнтів (29,63 %) надійшли на лікування вперше, 19 (70,37 %) попередньо отримували лікування, а саме: операційне лікування (n = 14; 53,85 %), консервативну терапію пропранололом тривалістю від 6 місяців до 2 років (n = 6; 22,22 %), іммобілізацію кінцівки (n = 1; 3,85 %), прошивання судин при кровотечі (n = 1; 3,85 %). Іммобілізація кінцівки в дівчинки з ВМ ступні та консервативна терапія пропранололом у пацієнтів з ВМ нижньої кінцівки (n = 3), голови і шиї (n = 2) та кисті (n = 1) клінічного результату не мали.
Використано такі способи лікування ВМ у дітей: склерозування як самостійний метод лікування (n = 8; 29,63 %), склерозування й компресійний трикотаж, І–ІІ клас компресії протягом дня (n = 8; 29,63 %), операційне лікування й компресія (n = 5; 18,52 %), склерозування, емболізація й операційне лікування (n = 2; 7,41 %), склерозування й операційне лікування (n = 1; 3,70 %), склерозування й ортопедичне лікування (n = 1; 3,70 %), лише хірургічне лікування (n = 2; 7,41 %). Склерозування як самостійний метод і в комбінації з хірургічним видаленням, емболізацією, еластичною компресією проведено у 20 пацієнтів із 27 (74,07 %), що визначає склеротерапію як основний метод лікування ВМ.
У 20 пацієнтів виконано від 1 до 12 процедур склерозування, у середньому 4,45 ± 2,94 процедури для одного пацієнта. Для корекції ЛВЗ використано низькомолекулярний гепарин відповідно до прий–нятого міжнародного консенсусу з лікування ВМ 2015 року [16] у добовій дозі 100 U/кг маси тіла тривалістю 7–14 днів до проведення лікування (ендоваскулярного та/або хірургічного) та протягом 5–10 днів після лікування.
Порівняння рівня D-димерів до й після лікування проведені з використанням непараметричного тесту Wilcoxon (W-test = 0,5, p = 0,002), що свідчить про вірогідне зниження рівня D-димерів на фоні лікування низькомолекулярним гепарином. Оскільки будь-який зовнішній вплив, включаючи інвазивні діагностичні процедури, склерозування, хірургічне втручання, може провокувати підвищення рівня D-димерів [10], терапію низькомолекулярним гепарином продовжували після проведеного втручання протягом 7–14 днів.
Результатом лікування в дітей з ВМ є зникнення болю (n = 3; 11,53 %), зменшення больового відчуття (n = 16; 61,54 %), збільшення денного фізичного навантаження (n = 7; 26,92 %), зупинка кровотечі та відсутність її рецидивів (n = 3; 11,54 %), покращання косметичного результату за рахунок зменшення деформації та зміни кольору шкіри (n = 5; 19,23 %) (рис. 8), відсутність змін (n = 1, 3,84 %), погіршення за рахунок збільшення набряку після операційного видалення ВМ в аксилярній ділянці (n = 1; 3,84 %). Результат лікування оцінили таким чином: відмінний (зменшення розмірів ВМ більше ніж на 75 %) — у двох (7,04 %) осіб; добрий (зменшення ВМ більш ніж на 50 %, відсутність скарг) — у 17 (62,96 %); задовільний (зменшення об’єму менше ніж на 50 %, зменшення больового синдрому) — у 6 (22,22 %), без змін — в одного (3,70 %) пацієнта та незадовільний результат (збільшення в об’ємі ВМ) після хірургічного видалення — в одного (3,70 %) пацієнта.
/134-1.jpg)
Реканалізацію ВМ за даними УЗД після склерозування діагностовано в 16 з 20 пацієнтів (80 %) у термін від 8 місяців до 2 років.
Обговорення
На відміну від ІГ, спонтанна інволюція ВМ не описана в літературі, навпаки, для них характерний прогресуючий перебіг і погіршення клінічних симптомів з віком [20]. Для ВМ не характерні ні бурхливий ріст, ні спонтанний регрес. Патологічно змінені вени нерідко видимі вже в ранньому віці, проте пік клінічних проявів припадає на вік близько 20 років [21]. Цією особливістю можна пояснити невідповідність статистичних даних у загальній популяції та дитячій клініці. У нашому дослідженні серед 163 пацієнтів із судинними мальформаціями ВМ становлять лише 16,56 %. Вік появи перших симптомів ВМ у цьому дослідженні становив 2,65 ± 3,69 року, лікування розпочато у віці 5,84 ± 4,97 року.
Діагноз ВМ у дітей, особливо молодшого віку, викликає істотні труднощі. Зокрема, 55,56 % пацієнтів надходили в нашу клініку з діагнозом при направленні «гемангіома», «ангіома», а 22,22 % попередньо отримували тривалу терапію неселективним бета-блокатором пропранололом, який зарекомендував себе як ефективний препарат для лікування ІГ, однак не має ефекту в пацієнтів з уродженими судинними мальформаціями [22].
Пацієнти з ВМ найчастіше описують симптоми, пов’язані з п’ятьма патогенетичними чинниками [4]: венозний стаз, що призводить до болю й набряку; пухлиноподібний ефект унаслідок компресії нервів, м’язів або структурних елементів суглобів, що призводить до виникнення больового синдрому; місцева інфільтрація та компресія сусідніх суглобів; локальна гематома або гемартроз, що призводить до істотного набряку й болю; локальний стаз і пов’язана з ним локальна внутрішньосудинна коагулопатія, що лежить в основі тромбозів, тромбо–флебітів та за певних умов може реалізуватися у ДВЗ-синдром.
Рецидив та перманентне існування є відмінною ознакою (trademark) усіх вроджених периферичних судинних мальформацій. ВМ у ранньому дитячому віці нерідко нагадують ІГ, капілярну мальформацію, також їх важко відрізнити від АВМ та рідкісних пухлин лише на основі візуального огляду. Застосування різних способів візуалізації необхідне, однак слід уникати в дітей використання багатьох діагностичних процедур, оскільки деякі з них є достатньо травматичними й малоінформативними. Як і при інших судинних аномаліях, у дітей із підозрою на ВМ використовують УЗД для першочергового обстеження, оскільки воно є безпечним, доступним, неінвазивним та високоінформативним. Проте навіть для досвідченого фахівця диференціальна діагностика з іншими судинними мальформаціями є складним завданням [23]. Крім того, УЗД дає обмежену інформацію стосовно нервових структур, кісток.
У публікаціях останніх років зазначається, що МРТ є золотим стандартом дослідження судинних мальформацій із повільним кровотоком, її необхідно провести перед початком лікувальних заходів [24]. ВМ візуалізуються як поодинокі або множинні структури часточкової або кавернозної будови, іноді з інфільтративним поширенням, ізоінтенсивні або гіпоінтенсивні в режимі Т1 та гіперінтенсивні в режимі Т2 і STIR. Втрата сигналу може вказувати на наявність тромбованих судин, флеболітів, фіброзних структур і може бути уточнена при дослідженні з контрастуванням [16]. Ретроспективні дослідження доводять, що ВМ супроводжуються спонтанним тромбоутворенням і тромболізисом. Біль у ділянці судинних мальформацій, а також наявність флеболітів підвищують небезпеку коагулопатії, що описана під назвою «внутрішньосудинний коагуляційний феномен» [25]. Коагуляційні порушення є наслідком хронічного венозного стазу всередині великих нерівномірних венозних просторів, що призводить до активації каскаду реакцій згортання крові з наступною продукцією тромбіну, перетворенням фібриногену у фібрин, що індукує утворення тромбів [26]. Наявність численних флеболітів є непрямою ознакою ЛВЗ і одним із показань до призначення антикогулянтної терапії, особливо у випадках ВМ великих розмірів.
При деяких видах ВМ рівень D-димерів у периферичній крові, отриманій з неуражених судин, є дуже високим (> 3 μг/мл), що перевищує референтні значення в десятки разів. D-димер, що є продуктом розпаду фібрину за участі плазміну, названий «новим діагностичним біомаркером» для ВМ [27]. Тяжкість коагулопатії корелює з поширеністю судинних мальформацій, також має значення наявність флеболітів, вісцерального ураження.
Як показують численні дослідження, не усі ВМ піддаються вилікуванню [15, 17]. Крім того, не у всіх випадках ВМ потребують лікування. Нерідко практичні лікарі вважають саму лише наявність ВМ абсолютним показанням для лікування. Спостереження іноді є найкращою тактикою до з’ясування точного характеру ураження. Невтручання часто є більш правильним вибором, ніж необдумане лікування без повного розуміння природи захворювання [3].
Клінічно доведеного ефективного способу медикаментозної терапії ВМ на сьогодні немає, однак певні медикаменти мають значення в профілактиці життєво небезпечних ускладнень. Ретроспективне дослідження доводить ефективність низькомолекулярного гепарину для зменшення болю, спричиненого ЛВЗ, нормалізації коагуляційного профілю й запобігає прогресуванню тяжкого ЛВЗ у ДВЗ-синдром, особливо в пацієнтів із низьким рівнем фібриногену [22]. У нашому дослідженні ми встановили статистично вірогідне (р < 0,05) зниження рівня D-димерів у пацієнтів із ВМ великих розмірів та при вісцеральних вогнищах ураження.
Упровадження ендовенозних технологій змінили тактичні підходи до лікування ВМ у дітей [20]. Черезшкірна склеротерапія набуває першочергового значення, оскільки вона є малоінвазивною, безпечною та ефективною. Для склерозування ВМ у дітей нами використано детергенти, які є ефективними для лікування й безпечними у використанні за умови дотримання техніки маніпуляції та дозування препарату. Слід також звертати увагу на повноту обстеження пацієнтів з ВМ, враховуючи побічну дію препаратів [28].
Крім самої техніки проведення лікувальних маніпуляцій, у сучасній літературі приділяється немало уваги спілкуванню з пацієнтами та їх родичами. Перед початком лікування необхідно детально поінформувати батьків стосовно мети склерозуючої терапії. Зазвичай метою лікування є зменшення розмірів та симптомів мальформації, а не повне одужання пацієнта [12]. Крім того, батькам потрібно чітко усвідомити, що потрібні повторні процедури, а також те, що лікування не слід розпочинати в ранньому віці, за винятком рідкісних ускладнених випадків.
Висновки
Для ВМ характерний прогресуючий перебіг та відсутність тенденції до спонтанної інволюції. МРТ є інформативним способом діагностики ВМ різної локалізацію в дітей. Склеротерапія з використанням детергентів є ефективним і безпечним методом лікування ВМ у дітей. Недоліком склерозування ВМ є їх реканалізація, що діагностовано у 80 % випадків у термін від 8 місяців до 2 років.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Legiehn G.M., Heran M.K. Venous malformations: classification, development, diagnosis, and interventional radiologic management // Radiol. Clin. North Am. — 2008. — Vol. 46. — P. 545-597.
2. Wassef M., Blei F., Adams D. et al. Vascular Anomalies Classification: Recommendations From the International Society for the Study of Vascular Anomalies // Pediatrics. — 2015. — Vol. 136 (1). — P. e203-e215.
3. Dasgupta R., Fishman S.J. ISSVA classification // Seminars in Pediatric Surgery. — 2014. — Vol. 23. — P. 158-161.
4. Dasgupta R., Patel M. Venous malformations // Seminars in Ped. Surgery. — 2014. — Vol. 23. — P. 221-226.
5. Gulsen F., Cantasdemir M., Solak S., Gulsen G., Ozluk E., Numan F. Percutaneous sclerotherapy of peripheral venous malformations in pediatric patients // Pediatr. Surg. Int. — 2011. — Vol. 27. — Р. 1283-1287.
6. Gurgacz S., Zamora L., Scott N.A. Percutaneous sclerotherapy for vascular malformations: a systematic review // Ann. Vasc. Surg. — 2014. — Vol. 28(5). — P. 1335-1349.
7. McCafferty I. Management of Low-Flow Vascular Malformations: Clinical Presentation, Classification, Patient Selection, Ima–ging and Treatment // Cardiovasc. Intervent. Radiol. — 2015. — Vol. 38(5). — P. 1082-1104.
8. Martin L., Russell S., Wargon O. Chronic localized intravascular coagulation complicating multifocal venous malformations // Austral. J. of Dermatol. — 2009. — P. 50. — Vol. 276-280.
9. Rodriguez-Manero M., Aguado L., Redondo P. Pulmonary arterial hypertension in patients with slow-flow vascular malformations // Arch Dermatol. — 2010. — Vol. 146. — P. 1347-1352.
10. Dompmartin A., Acher A., Thibon P. et al. Association of Localized Intravascular Coagulopathy With Venous Malformations // Arch. Dermatol. — 2008. — Vol. 144(7). — Р. 873-877.
11. Burrows P.E. Endovascular treatment of slow-flow vascular malformations // Tech. Vasc. Interv. Radiol. — 2013. — Vol. 16(1). — P. 12-21.
12. Cavezzi A., Tessari L. Foam sclerotherapy techniques: different gases and methods of preparation, catheter versus direct injection // Phlebology. — 2009 — Vol. 24(6). — P. 247-51.
13. Dompmartin A.,Vikkula M., Boon L.M. Venous malformation: update on aetiopathogenesis, diagnosis and management // Phlebology. — 2010. — Vol. 25. — P. 224-235.
14. Guevara C.J., Gonzalez-Araiza G., Kim S.K., Sheybani E., Darcy M.D. Sclerotherapy of Diffuse and Infiltrative Venous Malformations of the Hand and Distal Forearm // Cardiovasc. Intervent. Radiol. — 2016. — № 39(5). — P. 705-710.
15. Clemens R.K., Baumann F., Husmann M., Meier T.O., Thalhammer C., MacCallum G., Amann-Vesti B.R., Alomari A.I. Percutaneous sclerotherapy for spongiform venous malformations — analysis of patient-evaluated outcome and satisfaction // Vasa. — 2017. — Vol. 46(6). — P. 477-483.
16. Lee B.B., Baumgartner I., Berlien P. et al. Diagnosis and Treatment of Venous Malformations. Consensus Document of the International Union of Phlebology (IUP): updated 2013 // Int. Angiol. — 2015. — Vol. 34(2). — P. 97-149.
17. Wohlgemuth W.A., Müller-Wille R., Teusch V., Hammer S., Wildgruber M., Uller W. Ethanolgel sclerotherapy of venous malformations improves health-related quality-of-life in adults and children — results of a prospective study // Eur. Radiol. — 2017. — Vol. 27(6). — P. 2482-2488.
18. Ali S., Weiss C.R., Sinha A., Eng J., Mitchell S.E. The treatment of venous malformations with percutaneous sclerothe–rapy at a single academic medical center // Phlebology. — 2016. — Vol. 31(9). — P. 603-609.
19. Koo K.S., Dowd C.F., Mathes E.F., Rosbe K.W., Hoffman W.Y., Frieden I.J., Hess C.P. MRI phenotypes of localized intravascular coagulopathy in venous malformations // Pediatr. Radiol. — 2015. — Vol. 45(11). — P. 1690-1695.
20. Wieck M.M., Nowicki D., Schall K.A., Zeinati C., Ho–well L.K., Anselmo D.M. Management of pediatric intramuscular venous malformations // J. Pediatr. Surg. — 2017. — № 52(4). — P. 598-601.
21. Upton J., Taghinia A. Special considerations in vascular anomalies: operative management of upper extremity lesions // Clin. Plast. Surg. — 2011. — Vol. 38(1). — P. 143-151.
22. Léauté-Labrèze C., Hoeger P., Mazereeuw-Hautier J. et al. A randomized, controlled trial of oral propranolol in infantile hemangioma // N. Engl. J. Med. — 2015. — Vol. 19(8). — P. 735-46.
23. Glade R.S., Richter G.T., James C.A., Suen J.Y., Buckmil–ler L.M. Diagnosis and management of pediatric cervicofacial venous malformations: retrospective review from a vascular anomalies center // Laryngoscope. — 2010. — Vol. 120(2). — P. 229-235.
24. Lee B.B., Antignani P.L., Baraldini V. et al. ISVI-IUA consensus document diagnostic guidelines of vascular anomalies: vascular malformations and hemangiomas // Int. Angiol. — 2015. — Vol. 34(4). — P. 333-374.
25. Dompmartin A., Ballieux F., Thibon P. et al. Elevated D-dimer Level in the Differential Diagnosis of Venous Malformations // Arch. Dermatol. — 2009. — Vol. 145(11). — P. 1239-1244.
26. Redondo P., Aguado L., Marquina M., Paramo J.A., Sierra A., Sánchez-Ibarrola A., Martínez-Cuesta A., Cabrera J. Angiogenic and prothrombotic markers in extensive slow-flow vascular malformations: implications for antiangiogenic/antithrombotic strategies // British Journal of Dermatology. — 2010. — Vol. 162. — P. 350-356.
27. Weibel L. Vascular anomalies in children // Vasa. — 2011. — Vol. 40. — P. 439-447.
28. Stuart S., Barnacle A.M., Smith G., Pitt M., Roebuck D.J. Neuropathy after sodium tetradecyl sulfate sclerotherapy of venous malformations in children // Radiology. — 2015. — Vol. 274(3). — P. 897-905.

/130-1.jpg)
/130-2.jpg)
/131-1.jpg)
/131-2.jpg)
/131-3.jpg)
/132-1.jpg)
/133-1.jpg)
/134-1.jpg)