Резюме
Мета: оцінити вплив лікування фіксованою комбінацією екстракту гарцинії камбоджійської, хрому піколінату, L-тирозину, L-карнітину та водоростей бурих сухого екстракту на антропометричні показники, а також кількість жирової тканини (ЖТ) і характер її розподілу за допомогою двофотонної рентгенівської абсорбціометрії у хворих на цукровий діабет (ЦД) 2-го типу з ожирінням та артеріальною гіпертензією. Матеріали та методи. У дослідження були включені 53 пацієнти (з них 25 чоловіків) віком 55,90 ± 2,15 року з ЦД 2-го типу, артеріальною гіпертензією та ожирінням (індекс маси тіла (ІМТ) ≥ 30 кг/м2). Результати. Через 12 тижнів лікування такою фіксованою комбінацією в дозі по 1 капсулі 3 рази на день відмічене статистично значуще зниження маси тіла на 4,5 ± 0,6 % (P1 = 0,0001) та ІМТ — на 4,60 ± 0,59 % (P1 = 0,0001), а також зменшення загальної кількості ЖТ на 4,16 ± 1,33 % (P1 = 0,003). Зниження маси тіла відбулося за рахунок абдомінальної ЖТ, про що свідчить статистично значуще зменшення кількості ЖТ в абдомінальному компартменті на 6,02 ± 10,15 % (P1 = 0,0003), а також зниження окружності талії як у чоловіків, так і в жінок на 6,73 ± 1,24 % (P1 = 0,0001) і 4,06 ± 0,77 % (P1 = 0,0009) відповідно. Висновки. Терапія означеною фіксованою комбінацією привела до зниження маси тіла в основному за рахунок абдомінальної ЖТ.
Цель: оценить влияние лечения фиксированной комбинацией экстракта гарцинии камбоджийской, хрома пиколината, L-тирозина, L-карнитина и водорослей бурых сухого экстракта на антропометрические показатели, а также количество жировой ткани (ЖТ) и характер ее распределения с помощью двухфотонной рентгеновской абсорбциометрии у больных сахарным диабетом (СД) 2-го типа с ожирением и артериальной гипертензией. Материалы и методы. В исследование были включены 53 пациента (25 мужчин) в возрасте 55,90 ± 2,15 года с СД 2-го типа, артериальной гипертензией и ожирением (индекс массы тела (ИМТ) ≥ 30 кг/м2). Результаты. Через 12 недель лечения такой фиксированной комбинацией в дозе по 1 капсуле 3 раза в день отмечено статистически значимое снижение массы тела на 4,5 ± 0,6 % (P1 = 0,0001) и ИМТ — на 4,60 ± 0,59 % (P1 = 0,0001), а также уменьшение общего количества ЖТ на 4,16 ± 1,33 % (P1 = 0,003). Снижение массы тела произошло за счет абдоминальной ЖТ, о чем свидетельствует статистически значимое уменьшение количества ЖТ в абдоминальном компартменте на 6,02 ± 10,15 % (P1 = 0,0003), а также снижение объема талии как у мужчин, так и у женщин на 6,73 ± 1,24 % (P1 = 0,0001) и 4,06 ± 0,77 % (P1 = 0,0009) соответственно. Выводы. Терапия указанной фиксированной комбинацией привела к снижению массы тела в основном за счет абдоминальной ЖТ.
Background. The purpose of the study was to evaluate the impact of treatment with a fixed combination of extract of Garcinia cambogia, chromium picolinate, L-tyrosine, L-carnitine and dry extract of brown algae on anthropometric parameters, as well as the amount of adipose tissue (AT) and its distribution revealed by dual energy X-ray absorptiometry in patients with type 2 diabetes with obesity and arterial hypertension. Materials and methods. 53 patients (25 men) aged 55.90 ± 2.15 years with type 2 diabetes, arterial hypertension and obesity (body mass index (BMI) ≥ 30 kg/m2) were recruited in the study. Results. After 12 weeks of treatment with above-mentioned fixed combination at a dose of 1 capsule 3 times a day, a statistically significant reduction in body weight was observed — by 4.5 ± 0.6 % (P1 = 0.0001) and in BMI — by 4.60 ± 0.59 % (P1 = 0.0001), as well as a decrease in the total amount of AT by 4.16 ± 1.33 % (P1 = 0.003). Reduction in body weight occurred predominantly due to abdominal AT, as evidenced by a statistically significant decrease in the amount of AT in the abdominal compartment by 6.02 ± 10.15 % (P1 = 0.0003), as well as reduced waist circumference in both men and women by 6.73 ± 1.24 % (P1 = 0.0001) and 4.06 ± 0.77 % (P1 = 0.0009), respectively. Conclusions. Therapy with a fixed combination of Garcinia cambogia extract, chromium picolinate, L-tyrosine, L-carnitine and dry extract of brown algae has led to a decrease in body weight, mainly due to decrease of abdominal fat.
Вступ
Поширеність ожиріння у світі впродовж останніх 30 років набула епідемічного характеру, що призвело до подвоєння загальної кількості хворих [1]. Кількість осіб з ожирінням (з індексом маси тіла (ІМТ) > 30 кг/м2) у країнах із розвиненою економікою подолала 30% бар’єр, сягнувши, наприклад, у США 36 % від загальної популяції [2]. В Україні, згідно з даними ВООЗ за 2010 р., 21,3 % осіб мають ожиріння, що приблизно відповідає поширеності цієї хвороби в Європейському регіоні [2].
Дослідження ідентифікували ожиріння як провідну причину розвитку серцево-судинних захворювань (артеріальної гіпертензії та атеросклерозу), цукрового діабету (ЦД) 2-го типу, онкологічних захворювань, синдрому обструктивного апное сну, деформуючого остеоартрозу, жовчнокам’яної хвороби, безплідності, варикозної хвороби, жирового гепатозу та інших тяжких хвороб, що створюють істотні проблеми для систем охорони здоров’я багатьох країн та є першопричиною значних видатків з їх бюджетів. Відмічено зростання смертності осіб на фоні збільшення ІМТ ≥ 30 кг/м2 від усіх причин, у першу чергу серцево-судинної смертності, з 50 до 100 % [3].
Ожиріння за характером розподілу жирової тканини (ЖТ) поділяється на абдомінальне, коли основна маса ЖТ розташована в черевній порожнині, на передній черевній стінці, тулубі, шиї й обличчі (чоловічий, або андроїдний, тип ожиріння, вісцеральне ожиріння), і таке, якому властиве переважне розташування ЖТ на сідницях і стегнах (жіночий, або гіноїдний, тип ожиріння). Саме надмірне відкладання ЖТ в абдомінальному депо найбільше асоціюється з негативними наслідками ожиріння метаболічного та судинного характеру [4].
Баріатричне (від гр. βάρος — вага, тяжкість; ἰατρεία — лікування) лікування, тобто таке, що спрямоване на зменшення маси тіла, при досягненні її зниження хоча б на 5–10 % призводить до покращення кардіоваскулярного прогнозу та зниження захворюваності на ЦД 2-го типу [5, 6]. Тому першочерговою задачею в лікуванні хворих на ожиріння й захворювань, що виникають унаслідок нього, є зниження ваги.
До немедикаментозної терапії ожиріння належить модифікація стилю життя зі збільшенням фізичної активності та зниженням калорійності добового раціону. На жаль, тільки менше від половини пацієнтів з ожирінням дотримуються необхідних рекомендацій [7]. Саме тому застосування медикаментозної терапії ожиріння має важливе значення в досягненні й утриманні зниження маси тіла.
Сьогодні особлива увага приділяється комплексним препаратам, що містять рослинні компоненти для зниження маси тіла. До них належить вітчизняний препарат Стифімол виробництва ПрАТ «Київський вітамінний завод», 1 капсула якого містить екстракту гарцинії камбоджійскої (що відповідає вмісту гідроксилимонної кислоти (ГЛК) 0,05 г) 0,1 г, хрому піколінату 0,0001 г, L-тирозину 0,5 г, L-карнітину 0,015 г, водоростей бурих сухого екстракту (Fucus vesiculosus L.) у перерахунку на йод 0,037 мг.
Механізм дії гарцинії камбоджійської щодо зниження маси тіла пов’язаний з дією гідроксилимонної кислоти, яка призводить до зниження активності ферменту АТФ-цитратліази, що, у свою чергу, пригнічує утворення ацетил-КоА та обмежує подальший синтез жирних кислот через малоніл-КоА [8]. Також під дією ГЛК відбувається активація ферменту карнітинацилтрансферази, завдяки чому активується утворення карнітину й, відповідно, посилюється транспорт внутрішньоклітинних жирних кислот у мітохондрії та їх окислення [9]. Результатом блокади АТФ-цитратліази та активації карнітин–ацилтрансферази є зниження ліпогенезу.
ГЛК справляє також регулюючий вплив на апетит, що полягає в її опосередкованому впливі на активність нейронів гіпоталамуса, які контро–люють відчуття голоду й насичення шляхом блокади зворотного захвату серотоніну, що призводить до збільшення його концентрації в синапсах, справляючи, отже, ефект, подібний до такого в антидепресантів (інгібіторів зворотного захвату серотоніну) [10]. Характерною особливістю дії ГЛК у пацієнтів, які отримували ГЛК, було зниження потягу до вживання в їжу продуктів з великим вмістом легкозасвоюваних вуглеводів. У кількох дослідженнях було доведено, що прийом ГЛК спричинював зниження маси тіла в пацієнтів з ожирінням [11–13].
Компонентом Стифімолу, що також здатний впливати на вагу, є ароматична α-амінокислота тирозин, представлена оптичною ізомерною L-формою. L-тирозин — замінна амінокислота, яка утворюється з фенілаланіну. З тирозину синтезуються тирамін і 3,4-дигідроксифенілаланін — попередники катехоламинів, дофаміну, а також дийодтирозин, з якого утворюється тироксин. L-тирозин покращує процеси обміну катехоламінів, оскільки біосинтез катехоламінів починається з тирозину [14]. Адреналін та норадреналін стимулюють ліполіз через β1-адренергічні рецептори, які через систему цАМФ активують гормончутливу ліпазу триацилгліцеролів. Терапія тирозином покращує емоційний стан: допомагає зняти відчуття тривоги та подолати депресію [15–19]. Біосинтез тиреоїдних гормонів, які відповідають за підтримку енергетичного балансу організму, починається з йодування тирозину [20].
Хром наявний у препараті у вигляді солі піколінової кислоти. У дослідженнях продемонстрована здатність хрому покращувати вуглеводний та ліпідний обмін у хворих на ЦД 2-го типу [21]. Лікування хрому піколінатом також знижує потяг до солодощів і апетит [22].
L-карнітин — амінокислота, що є незамінним кофактором у транспорті довголанцюгових жирних кислот через внутрішню мембрану мітохондрій для подальшого розщеплення жирів і вироблення енергії [23]. Іншою роллю L-карнітину є перенесення коротколанцюгових жирних кислот з мітохондрій до цитозолю. Тому L-карнітин відповідає за утримання енергетичного гомеостазу всього організму. Крім того, L-карнітин відповідає за експресію PPARγ та специфічного для ЖТ кислотозв’язуючого протеїну (aP2), який залучений до адипогенезу. Під дією L-карнітину знижується концентрація aP2 в адипоцитах, що приводить до посилення ліполізу та зниження адипогенезу [24].
Препарат Стифімол досліджувався кількома дослідницькими центрами в Україні [25, 26], але дослідження проводилися в популяції хворих на ожиріння без порушень вуглеводного обміну й наявності артеріальної гіпертензії. Тому нами було сплановане дослідження з метою вивчення ефективності препарату саме в цієї категорії пацієнтів.
Мета дослідження:
1. Вивчити зміни антропометричних показників (маси тіла, ІМТ, окружності талії (ОТ), стегон (ОС), співвідношення ОТ/ОС) у хворих на ЦД 2-го типу з ожирінням та гіпертонічною хворобою (ГХ) після лікування препаратом «Стифімол».
2. Дослідити зміни кількості ЖТ і характеру її розподілу методом двофотонної рентгенівської абсорбціометрії (ДРА) до і після лікування досліджуваним препаратом.
Матеріали та методи
У дослідження були включені 53 пацієнти (з них 25 чоловіків) віком 55,90 ± 2,15 року з ЦД 2-го типу, ГХ І–ІІ стадії, 2-го ступеня (згідно з рекомендаціями Української асоціації кардіологів 2008 р.) та ожирінням, які перебували на лікуванні в Українському науково-практичному центрі ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України впродовж 2012–2013 рр. [27].
Вимірювання офісного артеріального тиску (АТ) проводилося на апараті Omron НЕМ-907 (Японія). Визначення ступеня ожиріння проводилося відповідно до рекомендацій ВООЗ (1997 р.) за розрахунком ІМТ за формулою: ІМТ = маса тіла/зріст2 (кг/м2). Відбувалось визначення антропометричних показників: зросту й маси тіла пацієнта з подальшим розрахунком ІМТ, визначення окружності талії, стегон звичайними методами за допомогою вагів та сантиметрової стрічки.
Критеріями включення в дослідження були: діагностований ЦД 2-го типу згідно з критеріями ВООЗ (2007), вік ≥ 18 і ≤ 75 років, ІМТ ≥ 30 і ≤ 45 кг/м2, діагностована артеріальна гіпертензія І–ІІ ст. (офісний систолічний і діастолічний АТ у положенні сидячи: САТ ≥ 140 і ≤ 179 мм рт.ст., ДАТ ≥ 90 і ≤ 109 мм рт.ст. або наявність антигіпертензивної терапії на момент включення в дослідження), терапія метформіном ≥ 1000 мг/добу, підписана інформована згода на участь у дослідженні. Критеріями виключення з дослідження були: ЦД 1-го типу, анамнез симптоматичної артеріальної гіпертензії (синдром Кушинга, феохромоцитома, первинний гіперальдостеронізм, гіперпаратиреоз, дисфункція щитоподібної залози тощо), креатинін сироватки крові ≥ 140 мкмоль/л, вік ≤ 18 і ≥ 75 років, наявність інших уроджених чи набутих захворювань, що можуть впливати на результати дослідження, наявність онкологічного захворювання на момент дослідження за винятком базаліоми шкіри, відома підвищена чутливість до компонентів Стифімолу, вагітність або годування груддю, гострі стани (інфекції, травми, операції) в період менше від 2 місяців до початку дослідження.
Досліджуваних пацієнтів було розподілено на дві групи: основну (n = 30) і контрольну (n = 23). Основна група на відміну від контрольної на додаток до цукрознижувальної, антигіпертензивної, гіполіпідемічної та антиагрегантної терапії отримувала препарат Стифімол — 1 капсула 3 рази на день перед їжею, запивати склянкою води. Курс лікування для всіх пацієнтів становив 12 тижнів.
Обстежуваним проводилося визначення структури тіла методом ДРА на апараті Lunar Prodigy Primo фірми General Electric (США). Метод ґрунтується на аналізі структури тіла як трикомпонентної моделі: оцінюється кісткова мінеральна маса, а також жирова маса тіла та безжирова. Враховуючи ступінь послаблення рентгенівських променів після проходження крізь кісткову та м’які тканини, можна виміряти з точністю до 1 г об’єм ЖТ та безжирову масу пацієнта [42]. Променеве навантаження при ДРА є незначним і становить менше від 0,0004 мЗв. Вивчалися показники вмісту загальної кількості ЖТ в організмі та в окремих ділянках (компартментах): абдомінальному та глютеофеморальному (рис. 1).
/21-1.jpg)
Усім пацієнтам були надані рекомендації з модифікації способу життя щодо розширення обсягу фізичних навантажень до мінімум 30 хвилин щодня та дотримання гіпокалорійної дієти (1200 ккал/добу), а також була проведена раціональна психотерапія, спрямована на усунення або полегшення найбільш виражених розладів харчової поведінки.
Візити до дослідника в основній групі проводилися чотири рази впродовж усього дослідження: на початку, через 2 тижні, через 1,5 місяця та через 3 місяці від початку прийому досліджуваного препарату. У контрольній групі візити проводилися двічі: на початку дослідження й через 3 місяці від початку спостереження. В основній і контрольній групі на кожному візиті проводилося визначення антропометричних показників (зріст, маса тіла, ІМТ, ОТ, ОС), вимірювався офісний АТ, визначалася прихильність до лікування (комплайєнс) за кількістю прийнятих капсул та оцінювалась вираженість можливих побічних ефектів. Визначення лабораторних показників (у даній статті не наводяться), ДРА проводилися в обох групах на початку та наприкінці дослідження.
Як супутню терапію всі досліджувані пацієнти отримували лікування з використанням підібраної комбінації антигіпертензивних препаратів (табл. 1). Терапію аспірином у дозі 75 мг на добу і симвастатином у дозі 40 мг на добу впродовж дослідження було призначено всім пацієнтам в основній і контрольній групах. Цукрознижувальна терапія в пацієнтів упродовж дослідження не змінювалась. Усі хворі в обох групах отримували метформін у дозі 2000 мг на добу.
При статистичному аналізі даних перевірку розподілу кількісних ознак на відповідність закону Гауса проводили, розраховуючи показники асиметрії та ексцесу. Порівняння незалежних груп (основної та контрольної) за кількісними ознаками проводили за допомогою двостороннього t-критерію Стьюдента. Для порівняння пов’язаних вибірок (до та після лікування) використовували парний t-критерій Стьюдента. При проведенні статистичного аналізу були обчислені рівні статистичної значущості порівняння незалежних вибірок за двостороннім t-критерієм Стьюдента (Р), порівняння пов’язаних вибірок за парним t-критерієм Стьюдента (Р1), а також порівняння відсотків незалежних вибірок за двостороннім t-критерієм Стьюдента (Р2).
Перевірку статистичних гіпотез проводили на рівні значущості р < 0,05. Статистичні характеристики подано у вигляді середнього арифметичного (M) та стандартної похибки (± SE). При порівнянні демографічних показників основної та контрольної груп наведенні 95% довірчі інтервали (95% ДI). Статистичний аналіз даних виконано за допомогою комп’ютерної програми Statgraphics Plus 3.0 фірми Manugistic Inc. (СШA).
Результати та обговорення
Основна та контрольна група пацієнтів не відрізнялись за віком, статтю, антропометричними показниками, показниками вмісту ЖТ в організмі за даними ДРА, ступенем компенсації цукрового діабету, а також рівнем офісного АТ. Показники, що характеризують пацієнтів в обох групах на початку дослідження, подані в табл. 1.
Усі пацієнти в основній (n = 30) і контрольній (n = 23) групах дійшли до завершення дослідження. Зміни антропометричних показників, показників розподілу ЖТ, що визначалися методом ДРА, в основній і контрольній групах подані в табл. 2.
Через 12 тижнів лікування в основній групі було відмічено статистично значуще зниження маси тіла з 98,1 ± 2,6 кг до 93,4 ± 2,4 кг (на 4,5 ± 0,6 %, P1 = 0,0001), тоді як у контрольній групі вага до і після лікування фактично залишилась незмінною (100,80 ± 3,67 кг і 100,8 ± 3,7 кг відповідно, P1 = 0,81), при цьому різниця між групами була статистично значущою (P2 = 0,001). Така ж динаміка відмічена стосовно ІМТ: в основній групі ІМТ знизився на 4,60 ± 0,59 % (P1 = 0,0001), тоді як у конт–рольній групі відмічене статистично незначуще зниження ІМТ на 0,11 ± 0,68 % (P1 = 0,79), при цьому різниця між групами була статистично значущою (P2 = 0,001) (рис. 2).
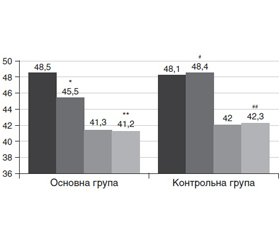
Зменшення маси тіла в основній групі відбувалося саме за рахунок ЖТ. Про це свідчить статистично значуще зменшення загальної кількості ЖТ з 41,20 ± 1,58 % до 39,30 ± 1,53 % (на 4,16 ± 1,33 %, P1 = 0,003), тоді як у контрольній групі відбулося статистично значуще збільшення цього показника з 38,80 ± 2,02 % до 40,00 ± 1,96 % (на 2,18 ± 1,56 %, P1 = 0,001) (рис. 3). Різниця між групами щодо загальної кількості ЖТ була статистично значущою (P2 = 0,001).
Звертає на себе увагу те, що зменшення кількості ЖТ у групі пацієнтів, які приймали препарат Стифімол, відбулося в основному за рахунок абдомінальної ЖТ, про що свідчить статистично значуще зменшення ЖТ в абдомінальному компартменті на 6,02 ± 10,15 % (P1 = 0,0003), тоді як у цій групі пацієнтів зниження відсотка ЖТ у глютеофеморальному компартменті було статистично незначущим і становило 0,63 ± 0,74 % (P1 = 0,55) (рис. 4). У контрольній групі відбулося як статистично значуще зростання кількості ЖТ в абдомінальному компартменті — на 1,04 ± 1,32 % (P1 = 0,04), так і статистично незначуще збільшення кількості ЖТ на 0,65 ± 0,84 % у глютеофеморальному компартменті (P1 = 0,12).
/24-1.jpg)
Про позитивну динаміку зниження кількості абдомінальної ЖТ свідчать також зміни ОТ. У дослідженні як у чоловіків, так і в жінок основної групи після лікування препаратом Стифімол відмічене статистично значуще зменшення ОТ на 6,73 ± 1,24 % (P1 = 0,0001) і 4,06 ± 0,77 % (P1 = 0,0009) відповідно. У контрольній групі динаміка зменшення ОТ була статистично незначущою (табл. 2). При порівнянні в обох групах ефект терапії відрізнявся залежно від гендерної приналежності досліджуваних пацієнтів. Так, порівняно з контрольною групою в чоловіків основної групи відмічене статистично значуще зменшення ОТ (Р2 = 0,001) і ОС (Р2 = 0,001), тоді як у жінок основної групи порівняно із контрольною відбулося статистично значуще зменшення ОТ (Р2 = 0,001), а зміни ОС були статистично незначущими (Р2 = 0,13).
Висновки
1. Терапія препаратом Стифімол у дозі 1 капсула 3 рази на добу впродовж 12 тижнів у пацієнтів з ЦД 2-го типу з ожирінням та артеріальною гіпертензією призвела до статистично значущого зниження маси тіла на 4,5 ± 0,6 % (P1 = 0,0001) та ІМТ — на 4,60 ± 0,59 % (P1 = 0,0001).
2. На фоні терапії препаратом Стифімол відмічене статистично значуще зменшення загальної кількості ЖТ на 4,16 ± 1,33 % (P2 = 0,001).
3. У групі пацієнтів, які приймали препарат Стифімол, зниження маси тіла відбулося в основному за рахунок абдомінальної ЖТ, про що свідчить статистично значуще зменшення кількості ЖТ в абдомінальному компартменті на 6,02 ± 10,15 % (P1 = 0,0003), а також зниження ОТ як у чоловіків, так і в жінок на 6,73 ± 1,24 % (P1 = 0,0001) і 4,06 ± 0,77 % (P1 = 0,0009) відповідно.
Конфлікт інтересів. Спонсор дослідження — ПрАТ «Київський вітамінний завод».
Список литературы
1. World Health Organization (WHO). Global Status Report on Noncommunicable Diseases 2014. — Switzerland: WHO, 2014.
2. Дані з офіційного сайту ВОЗ: http://www.who.int/nmh/countries/ukr_en.pdf
3. Troiano R.P., Frongillo E.A. Jr, Sobal J. et al. The relationship between body weight and mortality: a quantitative analysis of combined information from existing studies // Int. J. Obes. Relat. Metab. Disord. — 1996. — 20. — P. 63-75.
4. Rexrode K.M., Carey V.J., Hennekens C.H. et al. Abdominal adiposity and coronary heart disease in women // JAMA. — 1998. — 2, 280(21). — P. 1843-1848.
5. Lindström J., Ilanne-Parikka P. et al. Sustained reduction in the incidence of type 2 diabetes by lifestyle intervention: The follow-up results of the Finnish Diabetes Prevention Study // Lancet. — 2006. — Vol. 368. — P. 1673-1679.
6. The Diabetes Prevention Program Research Group: Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin // N. Engl. J. Med. — 2002. — 346. — P. 393-403.
7. De Bacquer D., De Backer G. EUROASPIRE III: Lifestyle and risk factor management and use of drug therapies in coronary patients from 22 countries in Europe // European Journal of Cardiovascular Nursing. — 2008. — Vol. 7. — P. 24-28.
8. Chatterjee A., Bagchi D., Stohs, S.J. Physico-chemical properties of a novel (-)-hydroxусіtric acid extract and its effect on body weight, selected organ weights, hepatic lipid peroxidation and DNA fragmentation, hematology and clinical chemistry, and histopathological changes over a period of 90 days // Molec. Cell Biochem. — 2004. — 260 (1–2). — P. 171-186.
9. Sullivan AC., Singh M., Srere P.A. et al. Reactivity and inhibitor potential of hydroxycitrate isomers with citrate synthase, citrate lyase, and ATP citrate lyase // J. Biol. Chem. — 1977. — 10, 252(21). — P. 7583-90.
10. Ohia S.E., Opere C.A, LeDay et al. Safety and mechanismof appetite suppression by a novel hydroxycitric acid extract (HCA-SX) // Molecular and Cellular Biochemistry. — 2002. — 238. — P. 89-103.
11. Hayamizu K., Ishii Y., Kaneko I. et al. Effects of Garci–nia cambogia (hydroxycitric acid) on visceral fat accumulation: a double-blind, randomized, placebo-controlled trial // Curr. Ther. Res Clin. E. — 2003. — 64. — P. 551-567.
12. Ramos R.R., Saenz J.F., Aguilar M.C.F.A. Control of obesity with Garcinia cambogia extract // Invest. Med. Int. — 1996. — 22. — P. 97-100.
13. Bilal T., Gursel F.E., Ates A. et al. Effect of Garcinia cambogia extract on body weight gain, feed intake and feed conversion ratio, and serum non-esterified fatty acids and C-reactive protein levels in rats fed with atherogenic diet // Iran J. Vet. Res. — 2012. — 13. — P. 330-333
14. Rasmussen D.D., Ishizuka B., Quigley M.E. et al. Effects of tyrosine and tryptophan ingestion on plasma catecholamine and 3,4-dihydroxyphenylacetic acid concentrations // J. Clin. Endocrinol. Metab. — 1983. — 57(4). — P. 760-763.
15. Leathwood P.D., Pollet P. Diet-induced mood changes in normal populations // Journal of Psychiatric Research. — 1982. — 17(2). — P. 147-54.
16. Deijen J.B., Orlebeke J.F. Effect of tyrosine on cognitive function and blood pressure under stress // Brain Res. Bull. — 1994. — 33(3). — P. 319-23.
17. Lieberman H.R., Corkin S., Spring B.J. et al. The effects of dietary neurotransmitter precursors on human behavior // Am. J. Clin. Nutr. — 1985. — 42(2). — P. 366-370.
18. Hao S., Avraham Y., Bonne O. et al. Separation-induced body weight loss, impairment in alternation behavior, and autonomic tone: effects of tyrosine // Pharmacol. Biochem. Behav. — 2001. — 68(2). — P. 273-81.
19. Chinevere T.D., Sawyer R.D., Creer A.R. et al. Effects of L-tyrosine and carbohydrate ingestion on endurance exercise performance // J. Appl. Physiol. — 2002. — 93(5). — P. 1590-1597.
20. Nussey S., Whitehead S. Endocrinology: An Integrated Approach. — Oxford: BIOS Scientific Publishers, 2001. — Chapter 3. The thyroid gland.
21. Broadhurst C.L., Domenico P. Clinical studies on chromium picolinate supplementation in diabetes mellitus // Diabetes Technol. Ther. — 2006. — 8(6). — P. 677-687.
22. Docherty J.P., Sack D.A. et al. A double-blind, placebo-controlled, exploratory trial of chromium picolinate in atypical depression: effect on carbohydrate craving // J. Psychiatr. Pract. — 2005. — 11(5). — P. 302-314.
23. Tein I., Bukovac S.W., Xie Z.W. Characterization of the human plasmalemmal carnitine transporter in cultured skin fibroblasts // Arch. Biochem. Biophys. — 1996. — 329. — P. 145-155.
24. Lee M.S., Lee H.J., Lee H.S. et al. L-carnitine stimulates lipolysis via induction of the lipolytic gene expression and suppression of the adipogenic gene expression in 3T3-L1 adipocytes // J. Med Food. — 2006. — 9. — P. 468-473.
25. Сергієнко О.О., Сергієнко В.О., Підсадочна І.І. та ін. Ефективність «Стифімолу» в лікуванні ожиріння // Фундаментальна та клінічна ендокринологія: проблеми, здобутки, перспективи (Восьмі Данилевські читання): матеріали наук.-практ. конф. з міжнар участю (Харків, 26–27 лютого 2009 р.) / Ін-т проблем ендокринної патології ім. В.Я. Данилевського АМН України, Харк. нац. мед. ун-т, Харк. мед. акад. післядиплом. освіти МОЗ України; відповід. ред. Ю.І. Караченцев. — Х.: [б. в.], 2009.
26. Корпачев В.В., Ховака В.В. Стифимол — новый лекарственный препарат для лечения ожирения с доказанной клинической эффективностью // Consilium Medicum Ukraina. — 2008. — Т. 2, № 5. — С. 34-36.
27. Зуєв К.О. Особливості впливу комбінації гарцинії камбоджійської, піколінату хрому, карнітину та екстракту бурих водоростей на антропометричні, клініко-метаболічні та гормональні показники у хворих на цукровий діабет 2-го типу з ожирінням та артеріальною гіпертензією / К.О. Зуєв // Актуальні питання клінічної ендокринології, імунології та алергології: Міжнар. наук.-практ. конф.: тези доповідей. — [Чернівці, 24–25 жовтня 2013 р.] // Міжнародний ендокринологічний журнал. — 2013. — № 6(54). — C. 141-142.
28. Albanese C.V., Diesel E., Genant H.K. A review: clinical application of body composition measurements using DXA // J. Clin. Densit. — 2003. — 6. — P. 161-172.

/21-1.jpg)
/22-1.jpg)
/23-1.jpg)
/24-1.jpg)