Вступ
Як критерії диференціальної діагностики фолікулярних аденом (ФА) та фолікулярного раку щитоподібної залози (ФРЩЗ) пропонуються численні імуногістохімічні, імуноцитохімічні та молекулярні маркери, жоден з яких, на жаль, не має стовідсоткової специфічності [1, 2]. Відрізнити доброякісну пухлину від злоякісної, використовуючи рутинні морфологічні методи, наприклад, дослідження гістологічних препаратів хірургічно видаленої пухлинної тканини, іноді нескладно, іноді — нелегко. В останньому випадку йдеться про так звані групи пухлин неуточненого потенціалу злоякісності (ПНПЗ) [3].
Відомо, що фолікулярно-клітинні пухлини ЩЗ представлені широким спектром новоутворень різної гістологічної будови й потенціалу злоякісності: від доброякісних ФА до диференційованого папілярного й ФРЩЗ, більш агресивного низькодиференційованого раку і вкрай злоякісної недиференційованої карциноми. ПНПЗ займають проміжне положення між ФА і високодиференційованими папілярним і ФРЩЗ [3]. Це пояснюється тим, що проблема встановлення злоякісності пов’язана не стільки з морфологічними та клінічними особливостями самих пухлин, скільки з недостатнім знанням біологічної сутності новоутворень [1, 2]. Однак пошук імуногістохімічних і молекулярно-генетичних відмінностей проводиться між групами очевидно доброякісних і очевидно злоякісних тиреоїдних новоутворень. Вивченню ж діагностичної значущості імуногістохімічних маркерів у встановленні злоякісності вузлового зоба присвячені поодинокі роботи [4]. У літературі згадується не менше 50 різних молекулярних маркерів, однак лише деякі з них виявилися корисними в клінічній практиці. Це насамперед маркери проліферації Ki-67 і апоптозу р53 та bcl-2 [5].
Ki-67 є найбільш специфічним маркером проліферації і димерною молекулою, що має тісний зв’язок із 10-ю хромосомою та складається з двох поліпептидних ланцюгів із молекулярною масою 345 і 395 кДа. Визначення експресії Кi-67 дозволяє виділити пухлинні клітини, що знаходяться в усіх фазах (G1, S, G2 і M) клітинного циклу, крім G0 [6, 7].
Транскрипційний фактор р53, який складається з 392 амінокислот і включає 6 доменів, регулює клітинний цикл і виконує функцію супресора утворення злоякісних пухлин та експресується в усіх клітинах організму. Білок р53 активується при ушкодженнях генетичного апарату, а також при стимулах, які можуть призвести до подібних ушкоджень, або є сигналом при несприятливому стресовому стані клітини. Функція його полягає у видаленні з пулу клітин, які є потенційно онкогенними (звідси образна назва р53 — guardian of the genome — хранитель геному) [8, 9]. Але це стосується р53 «дикого типу», який, як вважають, стимулює апоптоз, у той час як мутантний р53 інгібує запрограмовану клітинну загибель. Втрата функції білка р53 може бути встановлена в 50 % випадків злоякісних пухлин людини. Передбачається, що рак формується шляхом активації протоонкогенів і втрати або інактивації гена супресора пухлини (антионкогена). Відповідно до цієї теорії вважається, що фолікулярна карцинома трансформується з фолікулярної аденоми, папілярний рак — із клітин-попередників тиреоцитів, а анапластичнй рак може розвиватися як з папілярної, так і з фолікулярної карциноми внаслідок втрати диференціювання [5, 10]. Дефекти р53 дозволяють клітинам знайти толерантність до цитотоксичної дії ефекторів імунної системи протягом усього злоякісного переродження і формування клону злоякісних клітин [11, 12].
Родину bcl-2 становлять 17 клітинних білків, які мають широкий спектр активності щодо апоптотичних процесів. Субродина близьких до bcl-2 за морфологією білків (bcl-2, bcl-XL, bcl-w та ін.) пригнічує апоптоз, у той час як білки субродин bax и bH3 активують апоптотичні процеси. Функціональна різниця між близькими за структурою молекулами цієї родини білків полягає у впливі на вивільнення цитохрому С із мітохондрій. Білки bcl-2 та bcl-XL здатні безпосередньо зв’язувати цитохром С і витісняти його з апоптосоми, запобігаючи таким чином активації каспаз [8, 13].
Отже, визначення взаємозв’язку між експресією Ki-67, р53, bcl-2 та морфологічними характеристиками фолікулярних неоплазій (ФН) вважається актуальним для встановлення спорідненості між доброякісними та злоякісними тиреоїдними пухлинами, пошуку маркерів їх диференціальної діагностики.
Мета дослідження — визначення експресії імуногістохімічних маркерів апоптозу р53 та bcl-2 і маркера проліферації Ki-67 у фолікулярних неоплазіях ЩЗ.
Матеріали та методи
Досліджено операційний матеріал 50 хворих, оперованих у клініці ДУ «Інститут проблем ендокринної патології імені В.Я. Данилевського НАМН України» протягом 2014–2016 рр. При остаточному патоморфологічному дослідженні виявлено 25 випадків ФРЩЖ, 5 нормофолікулярних аденом, 10 аденом солідної будови та 10 фетально-ембріональних аденом. Для визначення злоякісного потенціалу пухлин ІГХ-методом визначали експресію р53; як маркер антиапоптозу досліджувалася експресія bcl-2; проліферативну активність пухлин оцінювали за експресією маркера Ki-67. Використовувалися мишачі й кролячі моноклональні та поліклональні антитіла фірми DAKO (Данія), фірми Thermo Scientific (Великобританія), фірми Diagnostic BioSystems (США) і Abcam (США). Матеріал фіксували 10% нейтральним формаліном протягом 24 годин. Заливали в парафін, готували зрізи завтовшки 4 мкм, які наносили на високоадгезивні скла і висушували при температурі 37 °С протягом 18 годин. Демаскуюча термічна обробка була виконана за методом кип’ятіння зрізів у цитратному буфері (рН — 6,0). Для візуалізації первинних антитіл використовувалася система детекції UltraVision Quanto Detection Systems HRP Polymer (Thermo Scientific). Як хромоген використовувався DAB (діамінобензидин). Підрахунок результатів здійснювали за допомогою окулярної сітки Автанділова в довільно вибраних полях зору при збільшенні 400 [14]. Оцінку імуногістохімічної мітки виробляли за двома параметрами: ступінь поширення та інтенсивність забарвлення. Ступінь поширення мітки враховували за процентним умістом забарвленої цитоплазми клітин від загального числа клітин у полі зору. Комплексні морфологічні та морфометричні дослідження проводилися на мікроскопі Primo Star (Carl Zeiss) з використанням програм AxioCam (ERc 5s) і Microsoft Excel.
Результати
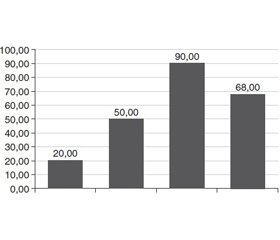
Отримані дані свідчили про різний характер експресії досліджуваних маркерів у препаратах ново–утворень фолікулярної будови. При визначенні Ki-67 встановлено, що прості ФА (нормофолікулярні) стовідсотково не експресували даний маркер (рис. 1). Максимальний рівень експресії виявлено в тканинах ФРЩЗ (72,0 %). ФА солідного та фетально-ембріонального характеру займали проміжне місце (10 та 40 % відповідно). Слід відзначити, що експресія Кі-67 в нормальній та доброякісно зміненій тиреоїдній паренхімі не визначалася. Крім того, у випадках, коли вузлові новоутворення оточували мікрокарциноми, проліферативна активність доброякісних тиреоцитів збігалася з рівнем проліферації клітин у злоякісній пухлині ЩЗ, яка нещодавно виникла. Такі дані можуть розцінюватися, як підтвердження вірогідної малігнізації доброякісних утворень ЩЗ.
Звертає на себе увагу і той факт, що фетально-ембріональні аденоми ЩЗ виявляли високий рівень проліферації. Такі властивості цих аденом можуть опосередковано вказувати на високий потенціал ФА до малігнізації.
За нашими даними, маркер р53 мав високу частоту експресії в тканинах солідних, фетально-ембріональних ФА та ФРЩЗ, що демонструє значні порушення процесу апоптозу при вказаних патологіях (рис. 2). Крім того, у поєднанні з високим рівнем проліферації за показниками експресії Ki-67 вказані аденоми мали найвищий ризик до подальшої малігнізації.
За результатами досліджень bcl-2 визначено його високий рівень експресії для всіх типів ФН, що свідчить про втрату апоптотичних властивостей клітин як доброякісних тиреоїдних аденом, так і ФРЩЗ (рис. 3).
Обговорення
Проліферативна активність (ПА) новоутворення є однією з найбільш важливих характеристик його фенотипу, що визначає швидкість росту новоутворення, здатність його до метастазування, ефективність лікувальних заходів. Індекс ПА як кількісний критерій досить активно застосовується в мамології при оцінці агресії злоякісного процесу. ПА пухлинних клітин при раку ЩЗ досить активно вивчається в країнах Західної Європи, США, Росії та Японії [15]. Багато досліджень демонструють високий рівень експресії при злоякісній патології ЩЖ, зокрема при папілярному раку ЩЗ, а також як прогностично несприятливий фактор при диференціальній діагностиці ФА і ФРЩЗ [16, 17]. Виражена експресія Кі-67 при ФРЩЗ, за результатами наших досліджень, узгоджується із загальноприйнятою гіпотезою. Звертає на себе увагу близькість за показниками маркера проліферації Кі-67, ФРЩЗ і ФА фетально-ембріональної будови, що вірогідно свідчить про найвищий потенціал останніх до малігнізації й подальшого метастазування. Низький рівень експресії Кі-67 вказує на відносну ефективність регуляції клітинного циклу, що є характерним для незміненої тиреоїдної тканини, що, за нашими даними, демонструють нормофолікулярні аденоми.
Згідно з даними численних досліджень, підвищена експресія р53 була виявлена в багатьох ракових клітинних лініях. У нормальних тканинах рівень р53 залишається низьким, але у відповідь на ушкодження ДНК відбувається активація р53 із великим накопиченням його рівня. Але існують дані, що не підтверджують відмінності в експресії р53 у пацієнтів з фолікулярною аденомою і фолікулярною карциномою, чи навпаки, показують зниження експресії у диференційованих формах РЩЗ [8, 18]. Також недостатньо досліджені мутації цього гена у хворих із доброякісними й автоімунними захворюваннями ЩЗ [19]. Відповідно до отриманих нами даних, вірогідно встановити прогностичну цінність даного маркера в диференціальній діагностиці фолікулярних новоутворень поки не вдається, що вказує на необхідність глибокого вивчення патогенетичних факторів існування схожих форм пухлинної патології ЩЗ.
Bcl-2 є найбільш вивченим геном, гіперекспресія якого характерна для багатьох злоякісних процесів. Численні дослідження показують, що експресія bcl-2 може блокувати апоптоз індукованих поряд сигналів, у тому числі радіацією, хіміотерапевтичних препаратів, стероїдними гормонами та ін. [20]. Білок bcl-2 також здатний захищати клітину від апоптозу регульованого р53, що передбачає супресiю фенотипічного сигналу і трапляється при пухлинній трансформації. Наявність вираженої експресії білка bcl-2, за деякими даними, є маркером підвищеної агресивності таі маркером втрати диференціювання у хворих на тиреоїдний рак; за іншими даними, — забезпечує кращий прогноз виживання. Крім того, існують дослідження, що показують резистентність пухлин до дії протипухлинних препаратів і променевої терапії на тлі підвищеної експресії bcl-2, що обумовлено апоптотичним механізмом загибелі пухлинних клітин [21]. Також у літературі зустрічаються дані як про відсутність експресії bcl-2 у більше ніж 70 % аденом і карцином, так і про наявність її практично в усіх варіантах тканини ЩЗ (нормальна незмінена тканина, ФА, ФРЩЗ), що збігається з отриманими результатами наших досліджень [22].
Висновки
1. Дослідження маркера проліферації Ki-67 виявило високу частоту експресії в препаратах ФРЩЗ і відсутність у нормофолікулярних аденомах. Високий рівень експресії Ki-67 у тканинах ФРЩЗ і ФА фетально-ембріональної будови свідчить про ймовірно найвищий потенціал останніх до малігнізації та подальшого метастазування.
2. Високий рівень експресії р53 та стабільно високий рівень експресії bcl-2 в клітинах ФРЩЗ та ФА солідної та фетально-ембріональної будови вказує на глибокі порушення апоптотичних процесів при розвитку фолікулярних неоплазій ЩЗ.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Longterm assessment of a multidisciplinary approach to thyroid nodulediagnostic evaluation [Text] / L. Yassa, E.S. Cibas, C.B. Benson [et al.] // Cancer. — 2007. — Vol. 111. — Р. 508-516.
2. Xing М. Progress in molecular-based management of differentiated thyroid cancer [Text] / М. Xing, B.R. Haugen, M. Schlumberger // Lancet. — 2013. — Vol. 381, № 9871. — P. 1058-1069.
3. Чернухина Д.Ю. Роль галектина-3, HBME-1 и цитокератина в иммуногистохимической диагностике папиллярного рака щитовидной железы / Д.Ю. Чернухина, А.С. Прилуцкий // Международный эндокринологический журнал. — 2012. — № 5(45). — С. 21-23.
4. Абросимов А.Ю. The diagnostic value of immuno-expression of galectin-3, HBME-1 and cytokeratin-19 in tumors of the thyroid gland of various malignant potentials [Текст] / А.Ю. Абросимов, Н.Ю. Двинских // Российский онкологический журнал. — 2010. — № 1. — С. 26-31.
5. Parameswaran R. Molecular pathogenesis of follicular cell derived thyroid cancers [Text] / R. Parameswaran, S. Brooks, G.P. Sadler // Int. J. Surg. — 2010. — Vol. 8(3). — P. 186-193
6. Role of Ki-67 as a proliferative marker in lesions of thyroid [Text] / M. Pujani, D. Arora, M. Rujani [et al.] // Indian. J. Cancer. — 2010. — Vol. 47, № 3. — Р. 304-307.
7. Improvement of the cytological diagnostic accuracy of follicular thyroid lesions by the use of the Ki-67 proliferative index in addition to cytokeratin-19 and HBME-1 immunomarkers: a study of 61 cases of liquid-based FNA cytology with histological controls [Text] / L. Lacoste-Collin, E. D’Aure, D. Bérard [et al.] // Cytopathology. — 2014. — Vol. 25, № 3. — P. 160-169.
8. Markers of apoptosis and proliferation in patients with oncological and autoimmune thyroid diseases [Текст] / В.Н. Цыган, С.П. Казаков, Т.Н. Заботина, Н.Е. Кушлинский // Вестник российской военно-медицинской академии. — 2010. — Т. 4, № 32. — С. 197-204.
9. Хазієв В.В. Експресія онкомаркерів Кі-67 та р53 у фолікулярних неоплазіях щитоподібної залози [Текст] / В.В. Хазієв, І.В. Сорокіна // Експериментальна і клінічна медицина. — 2013. — № 2(59). — С. 77-81.
10. The problem of diagnostic significance of molecular testing in differential diagnosis of thyroid nodules / [Текст] / И.С. Березкина, Т.В. Саприна, А.П. Зима [и др.] // Российский биотерапевтический журнал. — 2014. — Т. 3, № 13. — С. 83-94.
11. Lehmann, B.D. Targeting mutant p53 in human tumors [Text] / B.D. Lehmann, J.A. Pietenpol // J. Clin. Oncol. — 2012. — Vol. 30. — P. 3648-3650.
12. Мужичук О.В. Значення прогностичних маркерів пухлинної прогресії P53, P21WAF1/CIP1, P63 ТА KI-67 в пухлинах щитовидної залози [Текст] / О.В. Мужичук, Н.І. Афанасьєва, В.В. Мужичук // Вiсник Харкiвського нацiонального унiверситету iм. В.Н. Каразiна. Сер. Медицина.–2009. — № 879, вип. 18. — С. 4-9.
13. Bouillet, P. Bax and Bak: back-bone of T cell death [Text] / P. Bouillet, A. Strasser // Nat. Immunol. — 2002. — Vol. 3, № 10. — P. 893-894.
14. Автандилов Г.Г. Fundamentals of quantitative pathologi–cal anatomy: монография / Г.Г. Автандилов. — М.: Медицина, 2002. — 240 с.
15. Significance of AgNORs and ki-67 proliferative mark ers in differential diagnosis of thyroid lesions [Text] / H.A. Aiad, M.A. Bashandy, A.G. Abdou, A.A. Zahran // Pathol. Oncol. Res. — 2013. — Vol. 19, № 2. — P. 167-175.
16. Ito Y. Prognostic significance of ki-67 labeling index in papillary thyroid carcinoma [Text] / Y. Ito, A. Miyauchi // World J. Surg. — 2010. — Vol. 34, № 12. — P. 3015-3021.
17. Growth Activity in Hyperplastic and Neoplastic Human Thyroid Determined by an Immunohstochemical Staining Procedure Using Monoclonal Antibody MIB-1 [Text] / R. Katon, K. Suzuki, A. Hemmi [et al.] // Human Pathology. — 1995. — Vol. 26, № 2. — P. 139-146.
18. Koioтecki К. Evaluation of р53 аnd solubie Fas ligand (sFasL) serum level соnсеntгаtiоn as indicators of apoptosis iп serurn of patients with benign and mаlignаnt primary follicular thyroid tumors [Text] / К. Koiomecki [et al.] // Еndоkrуnоl. Pol. — 2006. — Vol. 57, № 4. — Р. 320-325.
19. Hasbek Z. P53 antibody: is it an indicator of dedifferentiated thyroid cancer? [Text] / Z. Hasbek, B. Turgut, T. Erselcan // Ann. Nucl. Med. — 2014.–Vol.28, № 1. — P. 42-46.
20. Letsas К.Р. Transcription factor-mediated рrolifеrаtiоn аnd apoptosis in benign and malignant thyroid lesions [Text] / К.Р. Letsas, М. Frаngоu-Lаzаridis, А. Skyrlas // Pathol. Int. — 2005. — Vol. 55, № 11. — Р. 694-702.
21. Thorlacius S. Somatic р53 mutations in humal1 breast carcinomas in аn lcelandic population: а prognostic factor [Text] / S. Thorlacius, A.L. Borresen, J.E. Eyfjord // Саnсеr. — 1993. — Vol. 53, № 7. — Р. 1637-1641.

/52-1.jpg)