Журнал «Боль. Суставы. Позвоночник» Том 8, №2, 2018
Вернуться к номеру
Особливості метаболізму кісткової тканини у хворих на остеоартроз, цукровий діабет 2-го типу та при їх поєднанні
Авторы: Журавльова Л.В., Олійник М.О.
Харківський національний медичний університет, м. Харків, Україна
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
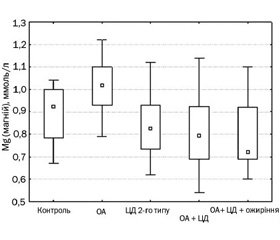
Актуальність. Остеоартроз (ОА) є одним із найчастіших захворювань суглобів, що характеризується періодичними загостреннями, наявністю больового синдрому різного ступеня вираженості, прогресуючим перебігом та призводить до деформації суглобів, зниження їх функції та погіршення якості життя хворих. Важливим є зв’язок ОА з низкою метаболічних порушень, а саме вуглеводного та ліпідного обміну. Мета дослідження — вивчення параметрів метаболізму кісткової тканини у хворих на ОА, цукровий діабет (ЦД) 2-го типу та при їх поєднанні в осіб із різним фенотипом, а також взаємозв’язок між показниками маркерів метаболізму кісткової тканини та рівнем прозапальних цитокінів. Матеріали та методи. До дослідження було включено 104 пацієнти (31 чоловік та 73 жінки) з ОА, ЦД 2-го типу та поєднанням ОА та ЦД 2-го типу з різним фенотипом, середній вік яких становив 54,02 ± 0,67 року. Контрольну групу становили 20 практично здорових осіб. Дослідження включало визначення рівня остеоасоційованих елементів (Ca, P, Mg), С-реактивного протеїну (СРП), остеокальцину, кальцитоніну, фактора некрозу пухлин α (ФНП-α) та інтерлейкіну-1β (ІЛ-1β). Усім хворим на ОА було проведене рентгенологічне дослідження суглобів. Результати. Вірогідно вищі показники рівня остеокальцину було визначено у хворих у контрольній групі та в пацієнтів з OA на відміну від пацієнтів з встановленим діагнозом ЦД 2-го типу. Тобто для остеокальцину справедливим є такий ряд: контроль = ОА > ЦД 2-го типу = ОА + ЦД 2-го типу = ОА + ЦД 2-го типу + ожиріння. Відмінності в значеннях інших показників метаболізму кісткової тканини між досліджуваними п’ятьма групами були менш вираженими, що не дозволяло сформувати для них єдиний ряд. Дослідження рівня цитокінів показало їх вірогідне підвищення у всіх обстежених хворих на відміну від контрольної групи (р < 0,001). Установлено зв’язок показників метаболізму кісткової тканини з підвищеними рівнями прозапальних цитокінів. У хворих із коморбідною патологією та ожирінням було визначено найбільшу кількість вірогідних кореляційних зв’язків, а саме: між остеокальцином та ФНП-α (r = –0,78; p < 0,05), ІЛ-1β (r = –0,75; p < 0,05), СРП (r = –0,46; p < 0,05), між Са та ФНП-α (r = 0,67; p < 0,05), ІЛ-1β (r = 0,59; p < 0,05), між кальцитоніном та ФНП-α (r = 0,56; p < 0,05), ІЛ-1β (r = 0,46; p < 0,05), СРП (r = 0,42; p < 0,05), між Mg та ФНП-α (r = –0,47; p < 0,05). Результати канонічного аналізу між показниками активності цитокінів і метаболізму кісткової тканини дозволяють стверджувати, що між цитокінами і характеристиками метаболізму кісткової тканини існує вірогідний зв’язок (канонічна кореляція = 0,52; p < 0,05), найбільший внесок до якого з показників активності цитокінів, що визначали, вносить ІЛ-1β, а з показників метаболізму кісткової тканини — рівень остеокальцину. Висновки. Отримані дані дозволяють зробити висновки про певну роль системного запалення в порушенні метаболізму кісткової тканини, що може впливати на прогресування перебігу ОА.
Актуальность. Остеоартроз (OA) является одним из самых частых заболеваний суставов, которое характеризуется периодическими обострениями, наличием болевого синдрома различной степени выраженности, прогрессирующим течением и приводит к деформации суставов, снижению их функции и ухудшению качества жизни больных. Важной является связь OA с целым рядом метаболических нарушений, а именно углеводного и липидного обмена. Цель исследования — изучение показателей метаболизма костной ткани у больных с ОА, сахарным диабетом (СД) 2-го типа и при их сочетании у пациентов с различным фенотипом, a также взаимосвязь между показателями маркеров метаболизма костной ткани и уровнем провоспалительных цитокинов. Материалы и методы. В исследование были включены 104 больных (31 мужчина и 73 женщины) с ОА, СД 2-го типа и сочетанием ОА и СД 2-го типа с различным фенотипом, средний возраст которых составил 54,02 ± 0,67 года. Контрольную группу составили 20 практически здоровых лиц. Исследование включало определение уровня остеоассоциированных элементов (Ca, P, Mg), С-реактивного протеина (СРП), остеокальцина, кальцитонина, фактора некроза опухоли α (ФНО-α), интерлейкина-1β (ИЛ-1β). Всем больным с OA было проведено рентгенологическое исследование суставов. Результаты. Достоверно более высокие показатели уровня остеокальцина были определены у больных в контрольной группе и у пациентов с OA в отличие от пациентов с установленным диагнозом СД 2-го типа. То есть для остеокальцина справедлив следующий ряд: контроль = ОА > СД 2-го типа = ОА + СД 2-го типа = ОА + СД 2-го типа + ожирение. Отличия в значениях других показателей метаболизма костной ткани между исследуемыми пятью группами были менее выраженными, чтo не позволяло сформулировать единый для них ряд. Исследование уровня цитокинов показало их достоверное повышение у всех обследованных больных в отличие от контрольной группы (р < 0,001). Установлена связь показателей метаболизма костной ткани с повышенными уровнями провоспалительных цитокинов. У больных с коморбидной патологией и ожирением было определено наибольшее количество достоверных корреляционных связей, а именно: между остеокальцином и ФНО-α (r = –0,78; p < 0,05), ИЛ-1β (r = –0,75; p < 0,05), СРП (r = –0,46; p < 0,05), между Са и ФНО-α (r = 0,67; p < 0,05), ИЛ-1β (r = 0,59; p < 0,05), между кальцитонином и ФНО-α (r = 0,56; p < 0,05), ИЛ-1β (r = 0,46; p < 0,05), СРП (r = 0,42; p < 0,05), между Mg и ФНО-α (r = –0,47; p < 0,05). Результаты канонического анализа между показателями активности цитокинов и метаболизма костной ткани позволяют утверждать, что между цитокинами и характеристиками метаболизма костной ткани существует значимая связь (каноническая корреляция = 0,52; p < 0,05), наибольший вклад в которую из исследуемых показателей активности цитокинов вносит ИЛ-1β, а из показателей метаболизма костной ткани — уровень остеокальцина. Выводы. Полученные данные позволяют сделать вывод об определенной роли системного воспаления в нарушении метаболизма костной ткани, что может влиять на прогрессирование ОА.
Background. Osteoarthritis (OA) is one of the most common joint diseases characterized by periodic exacerbations, pain syndrome of varying severity, progressive course, which leads to deformity of the joints, a decrease of their function and deterioration of patients’ life quality. The association of OA with a variety of metabolic disorders, such as type 2 diabetes mellitus (DM) and obesity, is very important. The purpose of the study was to investigate the parameters of bone metabolism in patients with OA, type 2 diabetes mellitus and their combination in patients with different phenotypes, as well as the correlation between parameters of bone metabolism and the level of proinflammatory cytokines. Materials and methods. A total of 104 patients with OA alone, type 2 DM alone and a combination of OA with type 2 DM were examined (31 men, mean age 54.02 ± 0.67 years). The survey plan included evaluation of C-reactive protein (СRP), osteocalcin, calcitonin, Ca, P, Mg, tumor necrosis factor α (TNF-α), interleukin-1β (IL-1β) in the blood. The X-ray examination of the knees was performed in all patients with OA. Results. The significantly higher levels of osteocalcin were determined in the control group and in the group of patients with OA alone as compared to the groups of patients with type 2 DM alone and OA combined with type 2 DM. That is, the following was valid for osteocalcin: control = OA > T2DM = = ОА + T2DM = ОА + + T2DM + obesity. The highest number of significant correlations was found in the group with comorbid pathology and obesity. We determined the relationships between osteocalcin and TNF-α (r = –0.78, p < 0.05), IL-1β (r = –0.75, p < 0.05), CRP (r = –0. 46, p < 0.05), between Ca and TNF-α (r = 0.67, p < 0.05), IL-1β (r = 0.59; p < 0.05), between calcitonin and TNF-α (r = 0.56, p < 0.05), IL-1β (r = 0.46, p < 0.05), CRP (r = 0.42, p < 0.05), between Mg and TNF-α (r = –0.47, p < 0.05). The results of the canonical analysis of cytokine activity and parameters of bone metabolism suggest that a significant correlation exists between cytokines and the characteristics of bone metabolism (canonical correlation = 0.52, p < 0.05), the largest contribution to this connection is made by IL-1β among cytokines, and by osteocalcin — among bone metabolism indices. Conclusions. The study demonstrates a definite role of systemic inflammation in the development of bone metabolism disorders that can influence the progression of OA.
метаболізм кісткової тканини; метаболічний синдром; остеоартроз; цукровий діабет 2-го типу
метаболизм костной ткани; метаболический синдром; остеоартроз; сахарный диабет 2-го типа
bone metabolism; metabolic syndrome; osteoarthritis; type 2 diabetes mellitus
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Balabanova RM. Role of interleukin-1 in osteoarthrosis and possibilities of its arrest. Sovremennaya Revmato–logiya. 2011;5(1):58-62. (in Russian). doi: 10.14412/1996-7012-2011-653.
- Balabanova RM. Pain type in osteoarthritis: Approaches to treatment. Sovremennaya Revmatologiya. 2014;8(2):103-106. (in Russian). doi: 10.14412/1996-7012-2014-2-103-106.
- Alekseeva LI, Zaitseva EM. Perspective directions of osteoarthritis therapy. Nauchno-prakticheskaya revmatologiya. 2014;52(3):247-250. (In Russ.) doi: 10.14412/1995-4484-2014-247-250.
- Loeser RF, Goldring SR, Scanzello CR, Goldring MB. Osteoarthritis: A Disease of the Joint as an Organ. Arthritis Rheum. 2012 Jun;64(6):1697-707. doi: 10.1002/art.34453.
- Kartamysheva NN, Tchumakova OV. Bone remode–ling as model of intercellular actions. Nephrology and Dialysis. 2004;(6)1:43-46. (in Russian).
- Upton AR, Holding CA, Dharmapatni AA, Haynes DR. The expression of RANKL and OPG in the various grades of osteoarthritic cartilage. Rheumatol Int. 2012 Feb;32(2):535-40. doi: 10.1007/s00296-010-1733-6.
- Kwan TS, Lajeunesse D, Pelletier JP, Martel-Pelletier J. Targeting subchondral bone for treating osteoarthritis: what is the evidence? Best Pract Res Clin Rheumatol. 2010 Feb;24(1):51-70. doi: 10.1016/j.berh.2009.08.004.
- Sanchez C, Deberg MA, Bellahcène A, et al. Phenotypic characterization of osteoblasts from the sclerotic zones of osteoarthritic subchondral bone. Arthritis Rheum. 2008 Feb;58(2):442-55. doi: 10.1002/art.23159.
- Chan TF, Couchourel D, Abed E, Delalandre A, Duval N, Lajeunesse D. Elevated Dickkopf-2 levels contribute to the abnormal phenotype of human osteoarthritic osteoblasts. J Bone Miner Res. 2011 Jul;26(7):1399-410. doi: 10.1002/jbmr.358.
- Pankiv VI. Insulinorezystentnist yak kliuchovyi patofiziolohichnyi mekhanizm rozvytku metabolichnoho syndromu. Journal Practical Angiology. 2012;(54-55):496. (in Ukrainian).
- Pacifici R. Role of T cells in ovariectomy induced bone loss-revisited. J Bone Miner Res. 2012 Feb;27(2):231-9. doi: 10.1002/jbmr.1500.
- Yoshimura N, Muraki S, Oka H, Tanaka S, Kawaguchi H, Nakamura K, Akune T. Accumulation of metabolic risk factors such as overweight, hypertension, dyslipidaemia, and impaired glucose tolerance raises the risk of occurrence and progression of knee osteoarthritis: a 3-year follow-up of the ROAD study. Osteoarthritis Cartilage. 2012 Nov;20(11):1217-26. doi: 10.1016/j.joca.2012.06.006.
- Lajeunesse D. The role of bone in the treatment of osteoarthritis. Osteoarthritis Cartilage. 2004;12 Suppl A: S34-8.
- Hashimoto M, Nakasa T, Hikata T, Asahara H. Molecular network of cartilage homeostasis and osteoarthritis. Med Res Rev. 2008 May;28(3):464-81. doi: 10.1002/med.20113.
- Hoff P, Buttgereit F, Burmester GR, et al. Osteoarthritis synovial fluid activates pro-inflammatory cytokines in primary human chondrocytes. Int Orthop. 2013 Jan;37(1):145-51. doi: 10.1007/s00264-012-1724-1.
- Wang X, Hunter D, Xu J, Ding C. Metabolic triggered inflammation in osteoarthritis. Osteoarthritis Cartilage. 2015 Jan;23(1):22-30. doi: 10.1016/j.joca.2014.10.002.
- Franchimont N, Lambert C, Huynen P, et al. Interleukin-6 receptor shedding is enhanced by interleukin-1beta and tumor necrosis factor alpha and is partially mediated by tumor necrosis factor alpha-converting enzyme in osteoblast-like cells. Arthritis Rheum. 2005 Jan;52(1):84-93. doi: 10.1002/art.20727.
- Ripmeester EGJ, Timur UT, Caron MMJ, Wel–ting TJM. Recent Insights into the Contribution of the Changing Hypertrophic Chondrocyte Phenotype in the Development and Progression of Osteoarthritis. Front Bioeng Biotechnol. 2018 Mar 19;6:18. doi: 10.3389/fbioe.2018.00018.
- Hiraiwa H, Sakai T, Mitsuyama H, Hamada T, et al. Inflammatory effect of advanced glycation end products on human meniscal cells from osteoarthritic knees. Inflamm Res. 2011 Nov;60(11):1039-48. doi: 10.1007/s00011-011-0365-y.
- Bakharev IG. The urgency of the problem of diabe–tic osteopenia. RMJ. 2006;9:24-25. (in Russian).
- Manulenko VV, Shishkin AN, Mazurenko SO. Clinical Features of Osteopathy Development in Patients with Diabetes Mellitus Type 2. Mìžnarodnij endokrinologìčnij žurnal. 2010;(27):28-31. (in Russian).
- Felson DT. Developments in the clinical understan–ding of osteoarthritis. Arthritis Res Ther. 2009;11(1):203. doi: 10.1186/ar2531.
- Mastbergen SC, Lafeber FP. Changes in subchondral bone early in the development of osteoarthritis. Arthritis Rheum. 2011 Sep;63(9):2561-3. doi: 10.1002/art.30306.
- Hayami T, Pickarski M, Zhuo Y, Wesolowski GA, Rodan GA, Duong LT. Characterization of articular cartilage and subchondral bone changes in the rat anterior cruciate ligament transection and meniscectomized models of osteoarthritis. Bone. 2006 Feb;38(2):234-43. doi: 10.1016/j.bone.2005.08.007.
- Kovalenko VN, Bortkevych OP, editors. Osteoartroz: Prakticheskoe rukovodstvo [Osteoarthrosis. Practical guidance]. 3rd ed. Kyiv: MORION; 2010. 608 p. (in Ukrainian).
- Sanchez C, Deberg MA, Bellahcène A, et al. Phenotypic characterization of osteoblasts from the sclerotic zones of osteoarthritic subchondral bone. Arthritis Rheum. 2008 Feb;58(2):442-55. doi: 10.1002/art.23159.
- Ren K, Torres R. Role of interleukin-1beta during pain and inflammation. Brain Res Rev. 2009 Apr;60(1):57-64. doi: 10.1016/j.brainresrev.2008.12.020.
- Aigner T, Söder S, Gebhard PM, McAlinden A, Haag J. Mechanisms of disease: role of chondrocytes in the pathogenesis of osteoarthritis-structure, chaos and senescence. Nat Clin Pract Rheumatol. 2007 Jul;3(7):391-9. doi: 10.1038/ncprheum0534.
- Thijssen E, van Caam A, van der Kraan PM. Obesity and osteoarthritis, more than just wear and tear: pivo–tal roles for inflamed adipose tissue and dyslipidaemia in obesity-induced osteoarthritis. Rheumatology (Oxford). 2015 Apr;54(4):588-600. doi: 10.1093/rheumatology/keu464.
- Yuan XL, Meng HY, Wang YC, et al. Bone-cartilage interface crosstalk in osteoarthritis: potential pathways and future therapeutic strategies. Osteoarthritis Cartilage. 2014 Aug;22(8):1077-89. doi: 10.1016/j.joca.2014.05.023.
- Musumeci G, Szychlinska MA, Mobasheri A. Age-related degeneration of articular cartilage in the pathogene–sis of osteoarthritis: molecular markers of senescent chondrocytes. Histol Histopathol. 2015 Jan;30(1):1-12. doi: 10.14670/HH-30.1.

/21-1.jpg)
/22-1.jpg)
/23-2.jpg)
/23-1.jpg)
/24-1.jpg)