Пацієнтів з онкологічною патологією відносять до групи ризику розвитку остеопорозу та переломів у зв’язку з безпосереднім впливом пухлинного процесу й побічними ефектами хіміотерапевтичних препаратів і променевої терапії. Окрім безпосереднього впливу на кісткову тканину засоби терапії новоутворень здатні викликати гіпогонадизм, що також сприяє прогресуванню втрати кісткової тканини (табл. 1). До ново–утворень з підвищеним ризиком розвитку остеопорозу відносять перш за все пухлини, чутливі до статевих гормонів (рак передміхурової залози, молочної залози), а також пухлини шлунка й кишечника, які сприяють розвитку синдрому мальабсорбції, пухлини щитоподібної залози та ін.
Рак передміхурової залози
Кісткова патологія у пацієнтів, які страждають від раку передміхурової залози, може бути зумовлена як безпосереднім впливом захворювання, так і лікуванням ракової пухлини. У випадках чутливості пухлини до статевих гормонів лікування вимагає значного зниження їх концентрації, яке досягається видаленням статевих залоз або застосуванням андрогендеприваційної терапії (АДТ), що, у свою чергу, призводить до зниження мінеральної щільності кісткової тканини (МЩКТ) і збільшення ризику низькоенергетичних переломів.
АДТ призводить до зниження рівня циркулюючих андрогенів. А якщо врахувати, що у чоловіків синтез естрогенів відбувається шляхом ароматизації тесто–стерону, то результатом застосування АДТ є тяжкий AДT-індукований гіпогонадизм зі зниженням рівнів як андрогенів, так і естрогенів [2, 3]. Застосування селективних модуляторів естрогенових рецепторів (ралоксифен, тореміфен) в експерименті підвищувало показники МЩКТ при застосуванні AДT [4]. Результати цих досліджень були прийняті як підтвердження впливу естрогенів на стан кісткової тканини в чоловіків. Максимальне зниження МЩКТ розвивалося протягом першого року й становило 5–10 %, у подальшому втрата кісткової маси сповільнювалася, але тривала. Частота остеопорозу в чоловіків з АДТ становить понад 40 % через 2 роки терапії й досягає 80 % через 10 років [5].
Діагностика. Оцінку МЩКТ, визначеної методом двофотонної рентгенівської абсорбціометрії (ДРА), проводять згідно з Т-показником на рівні поперекового відділу хребта, шийки чи проксимального відділу стегнової кістки. З огляду на високу поширеність дегенеративних процесів у чоловіків старших вікових груп оцінку МЩКТ рекомендують проводити також за показниками кісток передпліччя (променева кістка — 33 %) [6].
Для визначення груп підвищеного ризику остеопорозу доцільно, крім дослідження МЩКТ, проводити оцінку ризику переломів FRAX. В опитувальнику, що використовується для розрахунку FRAX, пацієнти, які приймають АДТ, можуть бути віднесені до групи вторинного остеопорозу в зв’язку з гіпогонадизмом. Для пацієнтів, які отримують АДТ, не розроблені спеціальні критерії FRAX, тому National Comprehensive Cancer Network рекомендує використовувати відрізні точки для застосування медикаментозної терапії, такі ж, як і для популяції в цілому.
Рак передміхурової залози супроводжується високим ризиком кісткового метастазування, зокрема при кастраційно-рефрактерному раку частота розвитку метастазів досягає 80–90 % [7, 8], що необхідно пам’ятати при встановленні діагнозу остеопорозу, особливо в разі виникнення низькоенергетичних переломів. Ризик виникнення метастазів вищий у пацієнтів з високими рівнями PSA (> 10 нг/мл) і високою швидкістю приросту PSA [3].
Лікування. Для корекції кісткової тканини в цій категорії пацієнтів були досліджені декілька класів лікарських препаратів. Терапія бісфосфонатами (алендроновою [9], памідроновою [10] та золедроновою кислотою [11]) вірогідно збільшувала МЩКТ у чоловіків, які отримують AДT, але вплив цих препаратів на ризик виникнення переломів на сьогодні не доведений.
Єдиний препарат з доведеним впливом на ризик переломів у чоловіків, які отримують АДТ, — деносумаб. Останній вивчали в подвійному сліпому рандомізованому дослідженні з залученням 1468 чоловіків, які отримують AДT для лікування неметастатичного раку передміхурової залози і додатково деносумаб (60 мг підшкірно кожні 6 місяців) або плацебо [12]. Результати лікування оцінювали за двома критеріями: перший — зміна МЩКТ на рівні поперекового відділу хребта через 24 місяці, виражена у відсотках, і другий — частота нових переломів тіл хребців. Результати дослідження показали позитивний ефект застосування деносумабу, оскільки в групі пацієнтів, які отримували деносумаб, були зареєстровані вірогідне збільшення МЩКТ на рівні поперекового відділу хребта через 24 місяці (5,6% приріст при втраті 1 % у контрольній групі; р < 0,001) і більш низька частота нових переломів хребців через 36 місяців (1,5 і 3,9 %; р = 0,006).
Тривають дослідження селективних модуляторів естрогенових рецепторів (ралоксифен, тореміфен) у чоловіків, які отримують AДT в зв’язку з раком перед–міхурової залози. Попередні результати показали збільшення МЩКТ під впливом цих препаратів, а при дослідженні тореміфену у великому дослідженні фази III було показано зниження ризику переломів [13], але поки жоден препарат не рекомендований для застосування в цієї категорії чоловіків.
Рак молочної залози
Рак молочної залози відносять до найбільш поширених онкологічних захворювань у жінок. Історія лікування раку цієї локалізації ендокринними препаратами налічує понад століття. Вперше George Beatson ще в кінці ХІХ століття припустив, що видалення яєчників може призвести до регресії пухлини в жінок у пременопаузі [14].
У жінок у репродуктивному періоді хіміотерапія індукує ранню менопаузу, предиктор прискореної втрати кісткової маси. Зниження функції яєчників [15, 16] виникає у більшості пацієнток — від 40 до 70 %, за даними різних досліджень [17].
Ад’ювантна терапія пухлини агоністами гонадотропін-рилізинг гормона (гозерелін) призводить до пригнічення функції яєчників, а значне зниження рівня естрогенів — до прискореної втрати кісткової тканини. Доведено, що МЩКТ у жінок з передчасною менопаузою в результаті хіміотерапії на 14 % нижча, ніж в осіб із збереженою менструальною функцією [18].
Втрата кісткової тканини залежить від препарату, що застосовується. Найбільш значне зниження МЩКТ спостерігається при лікуванні гозереліном (золадекс) — 10,5 % на рік на рівні поперекового відділу хребта. У пременопаузальних пацієнток, які отримували хіміотерапію (циклофосфамід, метотрексат і 5-фторурацил), втрата кісткової маси протягом першого року становила 4–8 % на рівні поперекового відділу хребта та 2–4 % — проксимального відділу стегнової кістки [16, 17]. Проте після припинення терапії 5-флорурацилом дефіцит естрогенів зберігається, а втрата кісткової тканини продовжується, в разі використання гозереліну МЩКТ відновлюється через рік після відміни препарату [18].
У жінок у постменопаузальному періоді, незважаючи на припинення функціонування яєчників, зберігається певний рівень естрогенів у сироватці крові. Тривалий час походження цих гормонів залишалося нез’ясованим, але участь у цьому процесі гіпофіза й надниркових залоз не викликала сумнівів. Тому з метою зниження концентрації естрогенів у цієї категорії пацієнток проводили адренектомію та гіпофізектомію (1950-ті роки) [14]. Наведені методи лікування були ефективними, але супроводжувалися великою кількістю негативних побічних ефектів.
Згодом був визначений механізм синтезу естрогенів у сироватці крові в жінок у постменопаузальному періоді — конвертація з циркулюючих андрогенів за участю ферменту ароматази. Після з’ясування походження естрогенів почалися дослідження інгібіторів ароматази як протипухлинних засобів для лікування раку молочної залози в посменопаузальному періоді.
Ці препарати мають різний вплив на кісткову тканину, але всі вони асоціюються зі значним підвищенням рівнів маркерів як резорбції, так і формування кісткової тканини, що свідчить про прискорення кісткового ремоделювання [19]. Застосування інгібіторів ароматази асоціюється зі зниженням МЩКТ і підвищенням ризику виникнення переломів [20]. Але в більшості досліджень доведено зворотний ефект інгібіторів ароматази на кісткову тканину [19].
У лікуванні раку молочної залози застосовується ще один препарат — тамоксифен — агоніст естрогенових рецепторів. У жінок у постменопаузальному періоді він уповільнює процеси ремоделювання, що сприяє стабілізації кісткової тканини та зниженню ризику переломів [21, 22]. У молодих жінок, навпаки, тамоксифен асоціюється з втратою кісткової тканини, оскільки інтенсивність його впливу на кісткову тканину значно поступається ефектам естрогенів. При застосуванні тамоксифену пременопаузальним жінками протягом 3 років зареєстровано незначне зниження МЩКТ на рівні поперекового відділу хребта порівняно з жінками, які отримували плацебо [22]. У жінок у постменопаузі тамоксифен призводив до збільшення МЩКТ на 1,17 % на рівні поперекового відділу хребта та на 1,71 % — проксимального відділу стегнової кістки (р < 0,001); у групі плацебо МЩКТ вірогідно не змінювалася [22]. У дослідженні первинної профілактики раку молочної залози застосування тамоксифену протягом 5 років призвело до зниження кількості переломів, пов’язаних з остеопорозом, на 32 % (95% довірчий інтервал (ДІ) 0,51–0,92). І все ж тамоксифен менш ефективний, ніж інгібітори ароматази, що було показано в дослідженні АТАС, де оцінювалися наслідки раку молочної залози [23].
Дослідження ATAC включало 9366 пацієнтів, які отримували терапію протягом 5 років. У цьому дослідженні вимірювали маркери резорбції (сечовий N-телопептид зшивок колагену І типу (NTX) і сироватковий С-телопептид зшивок колагену І типу (CTX)) та маркери формування кісткової тканини (N-пропептид проколагену І типу (P1NP) і сироваткову кісткову фракцію лужної фосфатази). У групі пацієнтів, які отримували інгібітор ароматази (анастрозол, летрозол), зареєстровано збільшення рівнів маркерів кісткового метаболізму, а у пацієнтів, які отримували тамоксифен, реєструвалося їх зниження. Через 1 рік у групі анастрозолу маркери резорбції CTX і NTX збільшилися на 26 і 15 % відповідно (95% ДІ від 3 до 25 %), а маркери формування P1NP і кісткова лужна фосфатаза збільшилися на 18 і 20 % відповідно (95% ДІ 14–25 %). Використання тамоксифену, навпаки, асоціювалось зі зниженням темпів кісткової резорбції: CTX зменшився на 56 % і NTX — на 52 % (95% ДІ від 62 до 33 %); P1NP знизився на 72 % і кісткова лужна фосфатаза — на 16 % (95% ДІ від 24 до 11 %). Лікування анастрозолом протягом 2 років було пов’язане з втратою кісткової маси на рівні проксимального відділу стегнової кістки й хребта та з прискоренням кісткового метаболізму [19].
Дослідження ATAC показало, що естрогени у жінок у постменопаузальному періоді є важливим фактором у збереженні щільності кісткової тканини й регулюванні процесів ремоделювання кісткової тканини. Ефекти анастрозолу були найбільш значущими протягом перших 4 років після настання менопаузи, тобто в період, пов’язаний із фізіологічною втратою кісткової тканини. Тамоксифен, навпаки, призводив до стабілізації МЩКТ.
Діагностика остеопорозу в даній категорії пацієнтів здійснюється відповідно до рекомендацій Всесвітньої організації охорони здоров’я (ВООЗ). Доцільно також застосування української версії FRAX з метою врахування додаткових факторів ризику. В опитувальнику, що використовується для розрахунку 10-річного ризику переломів, пацієнти з раком молочної залози можуть бути віднесені до групи вторинного остеопорозу в зв’язку з гіпогонадизмом.
Лікування й профілактика остеопорозу в жінок з раком молочної залози. Обов’язковою умовою профілактики та лікування остеопорозу в цієї категорії жінок є прийом адекватної дози кальцію, вітаміну D, виконання вправ з навантаженням і регулярне вимірювання МЩКТ. При недостатності профілактичних заходів у схеми лікування включають остеотропні препарати, зокрема антирезорбенти. Останні інгібують активність остеокластів і зменшують швидкість ремоделювання кісткової тканини, що особливо актуально в умовах застосування інгібіторів ароматази (анастразол).
Дослідження пероральних бісфосфонатів — ризедронату (35 мг/тиждень) і клодронату [15, 16] показали мінімізацію втрати кісткової тканини, але прийом пероральних бісфосфонатів може викликати побічні ефекти з боку шлунково-кишкового тракту, що важливо для онкологічних пацієнтів, які можуть відчувати нудоту, блювання або інші симптоми, пов’язані з хіміотерапією. Альтернативою є застосування парентеральних препаратів.
Введення парентеральних бісфосфонатів можливе паралельно з хіміотерапією, вони доступні, добре переносяться й тому є препаратами вибору в запобіганні втраті кісткової тканини, зумовленої хіміотерапією [24]. Австрійська Breast Cancer Group опублікувала результати дослідження, де показала, що застосування золедронової кислоти може повністю запобігти втраті кісткової тканини, викликаній терапією раку молочної залози, навіть у пременопаузальних жінок, які перенесли видалення яєчників і отримували в подальшому анастрозол [19]. Вивченню ефективності золедронової кислоти в пацієнток з раком молочної залози було присвячено багато досліджень, серед них 8 мультицентрових рандомізованих контрольованих проспективних досліджень за участю понад 7 тисяч пацієнтів. У дослідженнях III фази Z-FAST, ZO-FAST і E-ZOFAST [25, 26] були включені переважно жінки в постменопаузальному періоді. У дослідження ABCSG-12 III фази були включені жінки в пременопаузі з гормонзалежним раком молочної залози і вторинним гіпогонадизмом на тлі прийому гозереліну [28]. Метааналіз, проведений з включенням цих досліджень, свідчить про те, що використання золедронової кислоти в дозі 4 мг кожні 6 місяців нівелює негативний вплив терапії пухлини на кісткову тканину й знижує ризик переломів [27].
Ще один парентеральний антирезорбент є ефективним у лікуванні остеопорозу в жінок з раком молочної залози — деносумаб. Його застосування в дозі 60 мг 1 раз на 6 місяців вірогідно знижувало темпи резорбції кісткової тканини, збільшувало МЩКТ і зменшувало ризик переломів у жінок з раком молочної залози, які приймали інгібітори ароматази. Крім того, кількість побічних ефектів вірогідно не відрізнялася в групах активної терапії та контролю, зокрема не було зареєстровано випадків остеонекрозу верхньої щелепи [28].
Рак шлунка
Рак шлунка — один з найбільш поширених видів раку в світі і друга за частотою причина смерті від раку в світі. Хоча загальний прогноз раку шлунка несприятливий, у разі раннього виявлення виживаність може досягати 90 % у зв’язку з агресивним хірургічним втручанням — гастректомією. На жаль, багато пацієнтів, які вижили, страждають від наслідків, викликаних хірургічною процедурою. Поширеність остеопорозу в пацієнтів з раком шлунка варіює за даними різних досліджень і становить 22–37 % на рівні поперекового відділу хребта та 10–61 % — шийки стегнової кістки. Втрата кісткової тканини після резекції шлунка становить близько 14 % на рівні поперекового відділу хребта, 9 % — проксимального відділу стегнової кістки і 10 % — дистального відділу кісток передпліччя [29]. Частота переломів у цієї категорії пацієнтів висока й за результатами різних досліджень становить від 18,0 до 46,6 %. Серед пацієнтів з раком шлунка 45,9 % скаржаться на біль у спині [30].
Механізм розвитку остеопорозу після резекції шлунка поліетіологічний, але основна роль належить мальабсорбції з подальшим дефіцитом кальцію, фосфору, вітаміну D, заліза та білка. Дефіцит вітаміну D і кальцію призводить до вторинного гіперпаратиреозу, що збільшує резорбцію кісткової тканини. Крім того, низькі рівні вітаміну D і гіпокальціємія можуть призвести до остеомаляції. Основна група серед пацієнтів після резекції шлунка — пацієнти з низькою масою тіла [31].
Гастректомія з формуванням анастомозу з кишечником змінює фізіологію шлунково-кишкового тракту та істотно порушує всмоктування кальцію, яке відбувається переважно в дванадцятипалій кишці. Крім того, порушення всмоктування жирів призводить до формування нерозчинних кальцієвих мил, що також зменшує всмоктування кальцію. У середньому рівень кальцію в крові цих пацієнтів нижчий, ніж у контрольній групі, і відповідає нижньому діапазону норми [32].
Після резекції шлунка пацієнти часто страждають від стеатореї, що призводить до мальабсорбції вітаміну D. Крім того, пацієнти після гастректомії часто дотримуються дієти з низьким вмістом жирів, що також погіршує всмоктування вітаміну D. Дефіцит вітаміну D, у свою чергу, ще більше погіршує всмоктування кальцію. МЩКТ проксимального відділу стегнової кістки корелює зі зміною маси тіла, що підтверджує провідну роль мальабсорбції в генезі остеопорозу в пацієнтів після резекції шлунка.
Низькі рівні кальцію та вітаміну D стимулюють продукцію паратгормону (ПТГ) і збільшують резорбцію кісткової тканини, формування кісткової тканини при цьому не змінюється, що призводить до зниження МЩКТ, яка корелює з сироватковим рівнем ПТГ [29].
Застосування хіміотерапевтичних агентів впливає на темпи ремоделювання кісткової тканини, зокрема пригнічує функцію остеобластів, зменшує їх кількість і викликає порушення мінералізації, що пояснює гірші показники кісткової тканини в пацієнтів, які отримували хіміотерапію, порівняно з пацієнтами тільки після гастректомії.
Діагностика остеопорозу в цієї категорії пацієнтів здійснюється відповідно до рекомендацій ВООЗ та Міжнародного товариства клінічної денситометрії (International society for clinical densitometry). З метою врахування додаткових факторів ризику рекомендовано також застосування української версії FRAX. В опитувальнику, що використовується для розрахунку FRAX, пацієнти з раком шлунка можуть бути віднесені до групи вторинного остеопорозу в зв’язку з мальабсорбцією. Американська асоціація гастроентерології внесла в свої рекомендації обов’язкове проведення ДРА пацієнтам, що перенесли гастректомію. Через високий ризик розвитку остеомаляції рекомендований динамічний контроль рівнів кальцію та вітаміну D.
Лікування включає застосування препаратів кальцію, вітаміну D і остеотропних засобів. Переважна ефективність будь-якого остеотропного препарату на сьогодні не доведена, але препарати вибору — парентеральні засоби в зв’язку з порушенням всмоктування й кислотністю середовища. Особливості лікування цієї категорії пацієнтів включають: контроль вживання основних нутрієнтів, великі дози кальцію та вітаміну D в зв’язку з порушеним всмоктуванням, а також початок остеотропної терапії тільки після лабораторно підтверджених адекватних рівнів кальцію та вітаміну D у сироватці крові через поліетіологічне порушення процесів мінералізації.
Рак щитоподібної залози
Одним із компонентів лікування диференційованої карциноми щитоподібної залози є пригнічення рівня тиреотропного гормона (ТТГ) супрафізіологічними дозами левотироксину, спрямоване на зниження ризику рецидиву пухлини. Крім позитивних ефектів у зниженні рецидиву пухлини слід враховувати потенційні ризики медикаментозного гіпертиреозу. Субклінічний тиреотоксикоз може негативно впливати на метаболізм кісткової тканини, хоча дані клінічних досліджень з цього приводу суперечливі. Частина дослідників не знаходять збільшення частоти остеопорозу в пацієнтів з раком щитоподібної залози [34], частина вказує на незначне підвищення частоти порівняно з популяційними показниками (відносний ризик (ВР) 1,39; 95% ДІ 1,22–1,58) [35]. Є дані про додаткове дозозалежне підвищення ризику остеопорозу при кумулятивній дозі левотироксину ≤ 265 мг (ВР 1,53; 95% ДІ 0,91–2,57), > 395 мг (ВР 3,62; 95% ДІ 2,16–6,06) [35]. Гіпотеза про пряму асоціацію рівнів ТТГ і МЩКТ була підтверджена у жінок у постменопаузальному періоді у великому когортному дослідженні U.S. National Health and Nutrition Examination Survey (NHANES III). Дослідження показало вірогідний зв’язок між низькими рівнями ТТГ і низькою МЩКТ. Проте ступінь впливу застосування субмаксимальних доз левотироксину на кісткову тканину залишається дискутабельним [36].
Діагностика. У зв’язку з незначним збільшенням ризику остеопорозу і переломів у пацієнтів з раком щитоподібної залози в рутинній практиці рекомендовано визначення МЩКТ тільки за наявності додаткових факторів ризику або з появою низькоенергетичних переломів. Після нормалізації рівня ТТГ показники МЩКТ збільшуються й у частині випадків можуть нормалізуватися. На сьогодні відомо про приріст МЩКТ протягом наступних 24 місяців після нормалізації ТТГ [36], що дозволяє не призначати остеотропну терапію зазначеній категорії пацієнтів без інших факторів ризику. Але поєднання декількох чинників, зокрема застосування субмаксимальних доз левотироксину, низька маса тіла й рання менопауза, можуть призвести до кумуляції ефектів і вираженої втрати кісткової маси.
Рекомендації щодо ведення пацієнтів з остеопорозом при онкологічній патології
1. Визначити групи високого ризику розвитку остеопорозу й низькоенергетичних переломів серед пацієнтів з онкологічною патологією, зокрема [37]:
— жінки з ранньою менопаузою, викликаною хіміо–терапією або застосуванням аналогів гонадотропін-рилізинг гормона;
— жінки у постменопаузальному періоді, які отримують терапію інгібіторами ароматази;
— чоловіки, які отримують андрогендеприваційну терапію;
— пацієнти після резекції шлунка з приводу раку шлунка та ін.
2. Оцінка чинників ризику з метою виключення вторинних причин розвитку остеопорозу, зокрема таких, як дефіцит вітаміну D, гіперпаратиреоз або гіпертиреоз.
3. Профілактика розвитку остеопорозу: зміна способу життя (відмова від куріння), додатковий прийом кальцію та вітаміну D або збільшення їх у дієті, виконання вправ з навантаженням.
4. Моніторинг МЩКТ кожні 1–2 роки для пацієнтів з остеопорозом і остеопенією й кожні 2–5 років для пацієнтів з нормальною МЩКТ залежно від наявності інших факторів ризику. Остеопороз діагностується при значенні Т-показника ≤ –2,5 на рівні поперекового відділу, шийки або проксимального відділу стегнової кістки; або на рівні 33 % променевої кістки в пацієнтів, які отримують андрогендеприваційну терапію.
5. Визначення 10-річного ризику остеопоротичних переломів за допомогою української моделі FRAX з метою врахування інших факторів ризику, зокрема віку, низької маси тіла, куріння та ін. Для пацієнтів з онкологічною патологією не розроблені специфічні відрізні точки для початку остеотропної терапії, тому рекомендовано використовувати популяційні: значення 10-річного ризику основних остеопоротичних переломів більше 15 у осіб віком старше 70 років і більше 12 у осіб віком 50–69 років і/або значення 10-річного ризику перелому шийки стегнової кістки більш 2 в осіб віком старше 70 років і більше 1,5 у осіб 50–69 років [38].
6. Терапія антирезорбентами для пацієнтів із діагностованим остеопорозом за результатами ДРА або показниками FRAX, які потребують остеотропної терапії. Серед препаратів найбільша доказова база в золедронової кислоти в дозі 4 мг кожні 6 місяців і деносумаба 60 мг кожні 6 місяців. Ефективність пероральних бісфосфонатів залежить від регулярності прийому препаратів і вимагає контролю комплайєнтності [39].
Ведення пацієнтів з остеопорозом на тлі онкологічної патології — складне завдання, оскільки це пацієнти з ризиком кісткового метастазування. Перелом у цій категорії хворих завжди залишає питання: що це — наслідок остеопорозу або метастазування? А можливо, що й поєднаної двох нозологій у одного пацієнта.
Клінічний випадок
Пацієнтка П., 1938 р.н., звернулася до Українського науково-медичного центру проблем остеопорозу в липні 2017 року зі скаргами на інтенсивний біль у грудному й поперековому відділі хребта, який посилюється в положенні лежачи й при ходьбі. Біль істотно порушує сон і якість життя пацієнтки, а також вимагає постійного прийому знеболюючих засобів.
Анамнез захворювання. Вважає себе хворою з травня 2017 року, коли з’явився біль у грудо-поперековому відділі хребта. Лікувалася амбулаторно без ефекту. На амбулаторному етапі виконано магнітно-резонансну томографію (МРТ) поперекового відділу хребта, де діагностований перелом Th12 хребця без ознак метастазування.
Анамнез життя. Жінка 78 років, не курить і не курила, алкоголь не вживає. Професійні шкідливі чинники заперечує. Алергологічний анамнез не обтяжений. Менархе з 13 років, менопауза у віці 55 років, замісну гормональну терапію не приймала. В анамнезі — гастректомія з приводу раку шлунка (2012) і 6 курсів хіміотерапії. Інфекційні захворювання, зокрема туберкульоз, вірусний гепатит заперечує. Переломи, травми, інші оперативні втручання заперечує. Супутні захворювання: ішемічна хвороба серця, гіпертонічна хвороба II ст., ризик високий.
Об’єктивний статус. Правильної статури, зріст 163 см, маса тіла 69 кг, індекс маси тіла — 25,9 кг/м2. Шкіра, видимі слизові фізіологічного кольору. Периферичні лімфатичні вузли не збільшені. Пульс — 68 ударів/хв, артеріальний тиск — 130/80 мм рт.ст., частота дихання — 14 в 1 хв. Тони серця ритмічні, приглушені, акцент II тону на аорті. У легенях дихання везикулярне, хрипів немає. Живіт при пальпації м’який, безболісний. Нижня межа печінки — біля краю реберної дуги. Селезінка не пальпується. Периферичних набряків немає. Діурез достатній, стілець у нормі.
Хода не змінена, без додаткових засобів опори. Постава кіфотична, тулуб нахилений вперед. Рухи в шийному відділі хребта дещо обмежені, безболісні. Рухи в поперековому відділі хребта обмежені, в основному за рахунок розгинання, супроводжуються посиленням больового синдрому. Паравертебральні м’язи гіпертонічні на грудо-поперековому рівні, більше справа, паравертебральні точки болючі на рівні Th8–Th10, Th12–L1 з двох сторін. Болючість остистих відростків на рівні Th8–9, Th12. Рухи в суглобах кінцівок збережені в повному обсязі, безболісні. Сила й тонус м’язів кінцівок збережені.
В Українському науково-медичному центрі проблем остеопорозу проведена двофотонна рентгенівська абсорбціометрія (21.07.2017), визначено рівень вітаміну D і маркерів ремоделювання кісткової тканини. Мінеральна щільність кісткової тканини відповідає остеопорозу відповідно до критеріїв ВООЗ (на рівні поперекового відділу хребта Т = –2,4, шийки стегнової кістки справа Т = –2,4 і зліва Т = –2,5, усього скелета Т = –3,2 і кісток передпліччя Т = –2,5) (рис. 1). Показник якості трабекулярної кісткової тканини (TBS) — 1,102.
Показники метаболізму кісткової тканини: Ca загальний — 2,32 (норма — 2,15–2,58 ммоль/л), паратгормон — 57,98 (15,0–65,0 пг/мл), вітамін D загальний (25(ОН)D) — 11,49 (30,0–50,0 нг/мл).
Маркери ремоделювання кісткової тканини: пропептид проколагену I типу (P1NP) — 27,01 (16,3–
73,9 нг/мл), β-термінальні телепептиди колагену I типу (β-СТХ) — 0,71 (< 1,008 нг/мл).
На підставі проведених досліджень встановлено діагноз «вторинний системний остеопороз з переломом Th12 хребця на тлі резекції шлунка з приводу Сr (2012 р.). Дефіцит вітаміну D». Призначено препарати кальцію та вітаміну D, напівжорсткий корсет, періодичний прийом знеболюючих препаратів. Призначення остеотропної терапії відстрочено до досягнення цільового рівня вітаміну D. Больовий синдром не зменшувався, пацієнтку було госпіталізовано в клініку відділу клінічної фізіології та патології опорно-рухового апарату ДУ «Інститут геронтології імені Д.Ф. Чеботарьова НАМН України». Перед госпіталізацією пацієнтка була на консультації у онколога — дані щодо пролонгації хвороби відсутні.
Під час госпіталізації були проведені дослідження.
Результати лабораторних досліджень. Загальний аналіз крові (17.08.2017): еритроцити — 4,31 (3,8–5,8 • 1012/л), гемоглобін — 109 (120–140 г/л), лейкоцити — 5,6 (4–10 • 109/л), лімфоцити — 24,1 (17,0–48,0 %), моноцити — 4,5 (4,0–10,0 %), гранулоцити — 71,4 (43,0–76,0 %), тромбоцити — 343 (150–400 • 109/л), швидкість осідання еритроцитів — 18 (2–18 мм/год). Біохімічний аналіз крові: альбумін — 36,7 (32,0–52,0 г/л), аланінамінотрансфераза — 23 (до 41 ммоль/л), аспартатамінотрансфераза — 27 (до 40 ммоль/л), глюкоза крові — 4,43 (3,8–6,1 ммоль/л), сечовина — 6,2 (2,5–8,3 ммоль/л), креатинін — 68,6 (53,0–97,0 мкмоль/л).
Результати інструментальних досліджень
Електрокардіографія (17.08.2017): ритм синусовий, правильний, з частотою серцевих скорочень 68 в 1 хв. Електрична вісь серця — горизонтально. Ознаки гіпертрофії лівого шлуночка, лівого передсердя.
Ультразвукове дослідження органів черевної порожнини (22.08.2017): кісти правої долі печінки, гемангіома правої долі печінки, дифузні зміни в підшлунковій залозі, жовчнокам’яна хвороба, кісти обох нирок, опущення правої нирки.
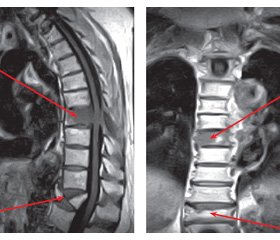
Під час стаціонарного лікування під впливом знеболюючих засобів, протинабрякової терапії, застосування міорелаксантів больовий синдром зменшився в денний час і при навантаженні, але посилювався в горизонтальному положенні, особливо в нічні години. Біль локалізувався в проекції тіла Th8 хребця. При проведенні рентгенморфометрії виявлено деформацію тіла Th12 хребця, деформацій інших тіл хребців не виявлено. Рекомендовано МРТ грудного відділу хребта. На МРТ від 28.08.2017 виявлена патологічна перебудова тіла Th8 хребця з ознаками вторинного спінального стенозу (рис. 2).
Після діагностування метастатичного пошкодження хребта пацієнтка була направлена до онколога для продовження терапії.
Наявність декількох нозологій, особливо у пацієнтів старших вікових груп, змінює клінічну картину й ускладнює діагностичний пошук. Тому з огляду на дані літератури та власний досвід вважаємо за необхідне рекомендувати не тільки проведення рентгенівської двофотонної абсорбціометрії, але і МРТ для визначення генезу больового синдрому в пацієнтів з остеопорозом, особливо за наявності інших факторів ризику розвитку болю.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.

/42-1.jpg)
/45-1.jpg)
/46-1.jpg)