Вступ
Сечокам’яна хвороба (СКХ) — одне з найпоширеніших урологічних захворювань, що характеризується складною етіологією і патогенезом [1]. За сучасними уявленнями, СКХ — це поліетіологічне захворювання, зумовлене порушенням обмінних процесів в організмі у поєднанні з локальними змінами в сечовій системі, що характеризується формуванням із компонентів сечі у нирках і/або сечових шляхах каменів [2]. СКХ посідає друге місце у структурі патології нирок і сечових шляхів, третє місце в структурі причин смерті та четверте — в структурі інвалідності при урологічній патології. СКХ реєструється в населення всіх країн світу з частотою 10–30 випадків на 1000 осіб дорослого населення і становить 30–40 % усіх урологічних захворювань. Аналіз загальної кількості хворих на СКХ в Україні свідчить, що з 2004 по 2012 р. в Україні їх стало більше на 26,9 %. У 73 % хворих відзначають рецидивуючий перебіг СКХ. З приводу СКХ в Україні щороку виконують близько 2000 нефректомій [3]. При цьому, спостерігаючи за хворими з єдиною ниркою, що залишилась після видалення контралатеральної, урологи діагностують порівняно швидке порушення функціонального стану та виникнення патологічного процесу в єдиній нирці, яка залишилась після нефректомії [4]. Після виконання нефректомії найчастіше в нирці, що залишилась, виникають пієлонефрит (47–89 %) і нефролітіаз (12–50 %). Нефролітіаз нерідко виявляється вже через 1–4 роки після нефректомії, тобто в період функціональної реабілітації єдиної нирки [5].
Значно ускладнює перебіг цих патологічних змін і наявність у пацієнта цукрового діабету (ЦД) 2-го типу, захворюваність на який у наш час дуже зросла. Відповідно до даних світової статистики, кожні 13–15 років кількість людей із ЦД подвоюється. Аналогічна тенденція спостерігається і в Україні — показник захворюваності збільшився з 115,6 у 1993 р. до 267,0 у 2012 р. на 100 тис. населення; показник поширеності — відповідно з 699,2 до 2885,0 [6]. Переважно це стосується кількості пацієнтів із ЦД 2-го типу. А проведений аналіз рівня глікованого гемоглобіну (HbA1c) у 85 458 хворих на ЦД в Україні показав, що стан компенсації ЦД мають лише 25 % пацієнтів, декомпенсації — 75 %, причому майже половина пацієнтів (47 %) перебувають у стані вираженої декомпенсації ЦД із рівнем HbA1c понад 9 % [7].
При цьому чимало досліджень показують, що ЦД є фактором високого ризику розвитку нефролітіазу. Так, A.E. Weinberg та співавт. досліджували зв’язок між тяжкістю ЦД 2-го типу і ризиком нефролітіазу. Було встановлено, що рівень HbA1c 6,4 % і більше в осіб із ЦД 2-го типу підвищує ризик утворення каменів у нирках майже вдвічі [8].
Крім того, серед причин розвитку хронічної ниркової недостатності спостерігається постійне зростання відсотка діабету; так, ЦД стає причиною термінальної хронічної ниркової недостатності (ХНН) у 20 % хворих у Великобританії и 42 % у США, а серед пацієнтів, які перебувають на діалізі, фіксується у 48 % хворих [9]. Наявність СКХ у цих хворих є фактором, який прискорює прогресування діабетичної хвороби нирок і розвиток ХНН, особливо у пацієнтів з єдиною ниркою.
Стан ниркового кровотоку при СКХ єдиної нирки залежить від ступеня ХНН, обструкції сечовивідних шляхів єдиної нирки та супутньої патології у хворого. Застосування радіоізотопної реографії та динамічної сцинтиграфії має досить важливе значення для визначення стану ефективного ниркового кровотоку та інших показників роботи єдиної нирки. При СКХ єдиної нирки спостерігається пригнічення ниркового плазмотоку та кровотоку і загалом роботи нирки, що негативно позначається на процесах підтримки загального гомеостазу [10]. Основне завдання в лікуванні СКХ за умов єдиної нирки — це збереження функціонуючої паренхіми, попередження уродинамічних і септичних ускладнень [11, 15, 16].
Серед усіх методів обстеження в урології методи візуалізації займають провідні позиції. Найголовніше у цих методах — це визначення структурно-анатомічних параметрів і деякою мірою функціональних особливостей нирок та сечовивідних шляхів. Радіонуклідна візуалізація нирок та сечовивідних шляхів (динамічна реносцинтиграфія) завдяки значній інформативності та точності дуже широко застосовується у практиці уролога при діагностиці функціональних, структурних порушень сечової системи, дозволяє виявити функціональні порушення набагато раніше від появи анатомічних змін. Динамічна реносцинтиграфія з 99mTc-диметиленсукцинат–ацетатом при первинному обстеженні урологічних хворих є стандартом діагностики порушень клубочкового апарату нирки. Гемодинаміка та екскреторно-евакуаторна функція нирок взаємозалежні, і цей метод дає нам можливість оцінити їх [12, 13].
Мета дослідження: вивчити внутрішньониркову гемодинаміку (час артеріального притоку та венозного відтоку) та фільтраційно-екскреторну функцію з використанням динамічної реносцинтиграфії з 99mTc-діетилентріамінопентацетатом (ДТПА) у хворих із сечокам’яною хворобою єдиної нирки на тлі ЦД 2-го типу.
Матеріали та методи
Обстежено 62 пацієнти: 21 пацієнт із нефролітіазом єдиної нирки та супутнім ЦД 2-го типу, середній вік яких становив 58,3 ± 11,3 року, 23 пацієнти з нефролітіазом єдиної нирки (середній вік 59,7 ± 10,4 року) та 18 пацієнтів зі «здоровою» набутою єдиною ниркою, середній вік яких — 52,7 ± 8,3 року. Відповідно пацієнти були розподілені на 3 групи. 1-ша група — пацієнти з нефролітіазом єдиної нирки на тлі ЦД 2-го типу (n = 21), 2-га група — пацієнти з нефролітіазом єдиної нирки без ЦД (n = 23), 3-тя група (контрольна) — пацієнти з єдиною «здоровою» ниркою (n = 18).
Середній термін після нефректомії в 1-й групі становив 7,6 ± 4,6 року; в 2-й групі — 7,9 ± 5,4 року; в 3-й групі — 6,4 ± 3,3 року. В 1-й групі середня тривалість захворювання на ЦД 2-го типу дорівнювала 8,5 ± 3,7 року, середній рівень глікемії натще в групі був 7,3 ± 1,5 ммоль/л (від 6,2 до 11,5 ммоль/л).
Всім пацієнтам проводили динамічну реносцинтиграфію (ДРСГ). Досліджували показники внутрішньониркової гемодинаміки та фільтраційно-екскреторної функції нирок, визначали біохімічні показники крові (креатинін, сечовина). Обстеження здійснювались за загальноприйнятими методиками на фотометричному біохімічному аналізаторі Star Dust MC15 (Іспанія).
ДРСГ виконувалась на гамма-камері «Офект-1» з використанням комп’ютерного забезпечення SpectWork (Україна). Хворим проводили процедуру з радіофармацевтичним препаратом (РФП) 99mTc-ДТПА. Активність РФП розраховувалась на основі величини маси тіла пацієнта і в середньому становила 1,5–2 МБк/кг. Обстеження виконували при горизонтальному положенні хворого. Датчик під спиною пацієнта розташовували так, щоб його серединна вертикальна вісь була паралельна хребту, а горизонтальна — на рівні ХІІ ребра. РФП вводили внутрішньовенно болюсно. Всі отримані під час обстеження дані аналізували за стандартною схемою. Динамічна сцинтиграфія нирок складалася з двох фаз — непрямої ренангіографії протягом 60 с після введення РФП з експозицією 1 кадр за 1 с і ДРСГ протягом 30 хв після непрямої ренангіографії з експозицією 1 кадр за 20 с. Кількісний аналіз ренангіограми виконувався методом розрахунку часу артеріального притоку, часу венозного відтоку в секундах та відносної венозної ємності (співвідношення вищенаведених показників). Оцінку фільтраційної функції проводили з урахуванням часу максимального накопичення РФП у нирках (Тmax) та швидкості клубочкової фільтрації (ШКФ), екскреторну — за часом напіввиведення з нирок (Т1/2).
Результати
При оцінці біохімічних показників крові (креатиніну, сечовини) значущої відмінності між 1-ю та 2-ю групами не було. При цьому виявлена статистично значуща відмінність між 1-ю та 3-ю групами (р < 0,05), 2-ю та 3-ю групами (р < 0,05).
У 1-й групі хворих середній рівень креатиніну крові становив 101,00 ± 26,32 мкмоль/л (р < 0,01); середній рівень сечовини крові — 7,38 ± 2,64 ммоль/л (р < 0,01).
У 2-й групі середній рівень креатиніну крові дорівнював 105,00 ± 35,42 мкмоль/л (p < 0,01); середній рівень сечовини — 6,13 ± 2,11 ммоль/л (р < 0,01).
У 3-й групі середній рівень креатиніну був 83,08 ± 15,13 мкмоль/л (р < 0,01); середній рівень сечовини — 4,51 ± 1,28 ммоль/л (p < 0,01).
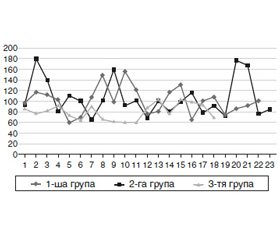
При цьому крива креатиніну крові в 1-й групі була стабільно високою, в 2-й групі мала пікові підвищення внаслідок більш високих показників у пацієнтів, у яких термін після нефректомії перевищував 10 років (рис. 1). Показники ж сечовини були більш високими в групі СКХ єдиної нирки на тлі ЦД 2-го типу (рис. 2).
При аналізі змін внутрішньониркової гемодинаміки у хворих із СКХ єдиної нирки на тлі ЦД 2-го типу виявлена статистично значуща відмінність у часі артеріального притоку 15,2 ± 1,5 с та венозного відтоку 12,0 ± 0,51 с у порівняні з пацієнтами зі «здоровою» єдиною ниркою — відповідно 8,87 ± 0,29 с та 6,74 ± 0,31 с і пацієнтів із СКХ єдиної нирки без ЦД — відповідно 10,87 ± 0,97 с і 8,97 ± 0,61 с. Ці показники знизились майже вдвічі (табл. 1). При цьо–му уповільнення венозного відтоку превалює над уповільненням артеріального притоку. Це може свідчити про наявність у цих хворих внутрішньоклубочкової гіпертензії, тобто підвищеного градієнта внутрішньоклубочкового гідростатичного тиску.
/49-3.jpg)
У хворих 1-ї та 2-ї груп відзначається статистично значуща відмінність показників фільтраційно-екскреторної функції єдиної нирки у порівняні з 3-ю групою, що проявлялася підвищенням періоду максимального накопичення РФП і зниженням ШКФ. У 1-й групі середній час Тmax становив 9,27 ± 0,56 хв (р < 0,05), середній час напіввиведення Т1/2 — 18,65 ± 1,87 хв (р < 0,05), середня ШКФ — 59 ± 10 мл/хв/1,73 м2 (р < 0,05). В 2-й групі середній час Тmax становив 6,58 ± 0,29 хв (р < 0,05), середній час Т1/2 — 15,05 ± 1,28 хв (р < 0,05). У 3-й групі середній час Тmax дорівнював 4,35 ± 0,28 хв (р < 0,05), середній час напіввиведення Т1/2 — 12,82 ± 1,35 хв (р < 0,05), середня ШКФ — 83 ± 11 мл/хв/1,73 м2 (р < 0,05). При цьому статистично значущої відмінності в ШКФ між 1-ю та 2-ю групами виявлено не було, що вказує на більш швидко прогресуюче зниження функціонального ниркового резерву у пацієнтів з єдиною набутою ниркою при наявності супутньої патології — СКХ і ЦД.
Обговорення
Також за результатами динамічної нефросцинтиграфії у двох пацієнтів у групі єдиної «здорової» нирки та одного пацієнта в групі СКХ єдиної нирки на тлі ЦД 2-го типу була виявлена гломерулярна гіперфільтрація. У всіх трьох пацієнтів термін після нефректомії був до трьох років. Гломерулярна гіперфільтрація за результатами різних досліджень є поганим прогностичним фактором, ознакою швидкого зниження функції нирки та предиктором розвитку прогресуючої ниркової недостатності, особливо при супутньому ЦД 2-го типу [14].
Отримані нами дані свідчать, що у хворих з єдиною ниркою, незважаючи на великий компенсаторний потенціал нирки, при виникненні сечокам’яної хвороби діагностується нирково-венна гіпертензія, збільшується внутрішньоклубочковий тиск і формується гіперфільтрація та гіперсекреція. А при наявності супутніх захворювань, зокрема цукрового діабету, розвиток нейро- та мікроангіопатії, що його супроводжує, призводить до поступового підвищення периферичного судинного опору в нирці, гломерулярної гіпертензії, погіршення ниркового кровообігу, порушення клубочкової фільтрації. Внаслідок цього знижується фільтраційно-екскреторна функція нирок, про що свідчить збільшення часу максимального накопичення РФП та зниження клубочкової фільтрації.
Висновки
При умовній компенсації ниркової функції за біохімічними показниками крові — креатиніну та сечовини у хворих на нефролітіаз єдиної нирки при динамічній нефросцинтиграфії виявляються значні негативні зміни внутрішньониркового кровотоку та фільтраційно-екскреторної функції нирки, особливо у пацієнтів з ЦД 2-го типу.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Romero V., Akpinar H., Assimos D.G. Kidney stones: a global picture of prevalence, incidence, and associated risk factors // Rev. Urol. 2010; 12: 86-96.
2. Lieske J.C., Peña de la Vega L.S., Slezak J.M., Bergstralh E.J, Leibson C.L., Ho K.L., Gettman M.T. Renal stone epidemiology in Rochester, Minnesota: an update // Kidney Int. 2006; 69: 760-764.
3. Dmytryshyn S.P. Urolithiasis: epidemiology features in a regional aspect // Urologiya. 2015; 19(4): 21-9. (in Ukrainian)
4. Spiridonenko V.V. Violation of homoeostasis and functio–nal state of only kidney, by the staggered urolithiasis // Urologiya. 2004; 2: 12-15. (in Ukrainian)
5. Saucier N.A., Sinha M.K., Liang K.V. et al. Risk factors for CKD in persons with kidney stones: a case-control study in Olmsted County, Minnesota // Am. J. Kidney Dis. 2010; 55(1): 61-68.
6. Matiuha L.F., Titova T.A., Buhanovska T.M., Smal B.O. Ukrainian experience of health care for patients with diabetes // Wiad. Lek. 2016; 69(3 pt 2): 465-470. (in Ukrainian)
7. Mankovskyi B.M., Larin O.S., Bertayeva L.V. Indexes of diabetes mellitus compensation in Ukraine. Results of Diacontrol research // Klinichna endokrynologiya ta endokrynna hirurgiya. 2007; 4: 46-48. (in Ukrainian)
8. Weinberg A.E. Diabetic Severity and Risk of Kidney Stone Disease // J. Eur. Urol. 2014; 65(1).
9. Reutens A.T. Epidemiology of Diabetic Kidney Disease // Medical Clinics of North America. 2013; 97(1): 1-18. doi: 10.1016/j.mcna.2012.10.001.
10. Spiridonenko V.V. Radionuclides researches at the nephrolithiasis of only kidney: the state of internal blood circulation // Urologiya. 2004; (1): 70-74. (in Ukrainian)
11. Serniak P.S. Comparative estimation of methods and results of treatment of urolithiasis of only kidney // Urologiya. 2013; (3): 51-55. (in Ukrainian)
12. Pospelov S.V. Radiopharmaceutical preparations for visualization and estimation of the functional state of the urinary system // Urologiya. 2012; (61): 58-64. (in Ukrainian)
13. Kundin V.Yu., Pospelov S.V. Dynamic scintigraphy in urology practice // Urologiya. 2012; 5-24. (in Ukrainian)
14. Low S., Zhang X., Wang J., Yeoh L.Y., Liu Y.L., Ang K.K.L., Tang W.E., Kwan P.Y., Tavintharan S., Sum C.F., Lim S.C. Long-term prospective observation suggests that glomerular hyperfiltration is associated with rapid decline in renal filtration function: A multiethnic study // Diab. Vasc. Dis. Res. 2018: 1479164118776465. doi: 10.1177/1479164118776465.
15. Boyko A.I. About the functional state of only "healthy" kidney // Zdorovia cholovika. 2011; (4): 136-139. (in Ukrainian)
16. Baron A.D. Insulin resistance and vascular function // J. Diabetes Complications. 2002; 45(16): 92-102.

/49-1.jpg)
/49-2.jpg)
/49-3.jpg)