Резюме
Актуальність. Сучасним завданням лікування пацієнтів із цукровим діабетом 2-го типу й дисліпопротеїнемією є аналіз ефективності поєднання стандартних цукрознижувальних засобів з фітотерапевтичними препаратами, але інформація про особливості їх використання потребує уточнення. Мета: оцінити вплив лікування фіксованою комбінацією екстракту листя джимнеми, листя банаби й гіркої дині в поєднанні з препаратами сульфонілсечовини й метформіну на динаміку клінічного стану, вуглеводний і ліпідний обміни в пацієнтів із цукровим діабетом 2-го типу. Матеріали та методи. У дослідженні брали участь 40 пацієнтів (з них 16 чоловіків) віком 61,7 ± 7,8 року із цукровим діабетом 2-го типу. В усіх хворих до початку лікування й через 2 місяці виконували загальний аналіз крові, визначали рівень глікованого гемоглобіну, креатиніну, сечовини, білірубіну, аланінамінотрансферази, аспартатамінотрансферази, холестерину, ліпопротеїнів високої та низької щільності, тригліцеридів, глюкози. Усі пацієнти відповідно до базової цукрознижувальної терапії були поділені на чотири групи. 1-ша група отримувала метформін (n = 6); 2-га група — метформін і гліклазид (n = 10); 3-тя група — метформін і глімепірид (n = 14). Пацієнтам дозу цукрознижувальних препаратів не змінювали під час усього дослідження, додатково був призначений Глюцемедін по 1 капсулі тричі на день протягом 2 місяців. У 4-й (контрольній) групі (n = 10) стандартну цукрознижувальну терапію не модифікували. Результати. Включення в лікувальні заходи прийому Глюцемедіну привело до статистично значущого зниження рівня глікемії, глікованого гемоглобіну, тригліцеридів і збільшення рівня ліпопротеїнів високої щільності й не вплинуло на концентрацію загального холестерину й ліпопротеїнів низької щільності. Висновки. Отримані результати дозволяють вважати, що ефективність комбінованої терапії Глюцемедіном і пероральними цукрознижувальними засобами є наслідком взаємної потенціюючої дії цих фармакологічних агентів на досліджувані показники, що обґрунтовує доцільність її використання в лікуванні хворих на цукровий діабет 2-го типу.
Актуальность. Современной задачей лечения пациентов с сахарным диабетом 2-го типа и дислипопротеинемией является анализ эффективности сочетания стандартных сахароснижающих средств с фитотерапевтическими препаратами, но информация об особенностях их использования требует уточнения. Цель: оценить влияние лечения фиксированной комбинацией экстракта листьев джимнемы, листьев банабы и горькой дыни в сочетании с препаратами сульфонилмочевины и метформина на динамику клинического состояния, углеводного и липидного обменов у пациентов с сахарным диабетом 2-го типа. Материалы и методы. В исследовании принимали участие 40 пациентов (из них 16 мужчин) в возрасте 61,7 ± 7,8 года с сахарным диабетом 2-го типа. У всех больных до начала лечения и через 2 месяца после него проводили общий анализ крови, определяли уровень гликированного гемоглобина, креатинина, мочевины, билирубина, аланинаминотрансферазы, аспартатаминотрансферазы, холестерина, липопротеинов высокой плотности, липопротеинов низкой плотности, триглицеридов, глюкозы. Все пациенты в соответствии с базовой сахароснижающей терапией были разделены на четыре группы. 1-я группа получала метформин (n = 6); 2-я группа — метформин и гликлазид (n = 10); 3-я группа — метформин и глимепирид (n = 14). Пациентам дозу сахароснижающих препаратов не меняли во время всего исследования, дополнительно был назначен Глюцемедин в дозе по 1 капсуле три раза в день в течение 2 месяцев. В 4-й (контрольной) группе (n = 10) стандартную сахароснижающую терапию не модифицировали. Результаты. Включение в лечебные мероприятия Глюцемедина привело к статистически значимому снижению уровня гликемии, гликированного гемоглобина, триглицеридов и увеличению уровня липопротеинов высокой плотности и не повлияло на концентрацию общего холестерина и липопротеидов низкой плотности. Выводы. Полученные результаты позволяют считать, что эффективность комбинированной терапии Глюцемедином и пероральными сахароснижающими средствами является следствием взаимопотенциирующего действия этих фармакологических агентов на исследуемые показатели, что обосновывает целесообразность ее использования в лечении больных сахарным диабетом 2-го типа.
Background. The current task of treating patients with type 2 diabetes mellitus and dyslipoproteinemia is the analysis of efficiency of the combination of standard hypoglycemic agents with phytotherapeutic drugs, but information about the feature of their use requires clarification. The purpose was to evaluate the influence of treatment with a fixed combination of gymnema, banaba leaves and bitter melon extract together with sulfonylurea and metformin on the dynamics of the clinical state, carbohydrate and lipid metabolism in patients with diabetes mellitus type 2. Materials and methods. The study involved 40 patients (16 men) aged 61.7 ± 7.8 years with type 2 diabetes. All patients before the treatment and after 2 months underwent: general blood test, evaluation of glycated hemoglobin, creatinine, urea, bilirubin, alanine aminotransferase, aspartate aminotransferase, cholesterol, high-density lipoproteins, low-density lipoproteins, triglyce-rides, glucose levels. All patients were divided into four groups according to the basic hypoglycemic therapy: group 1 received metformin (n = 6); group 2 — metformin and gliclazide (n = 10); group 3 — metformin and glimepiride (n = 14). The dose of hypoglycemic drugs was not changed during the whole study, Glucemedin was additionally administered in a dose of 1 capsule three times a day during 2 months. In group 4 (controls; n = 10), standard hypoglycemic therapy was not modified. Results. The inclusion of Glucemedin in the treatment resulted in a statistically significant decrease in the level of glycemia, glycated hemoglobin, triglycerides and an increase in high-density lipoproteins, and did not affect the concentration of total cholesterol and low-density lipoproteins. Conclusions. The obtained results demonstrated that the efficacy of combining standard hypoglycemic therapy with Glucemedin are consequent of the interacting impact of these pharmacological agents on the investigated parameters, which justifies the expediency of its use in the treatment of patients with type 2 diabetes mellitus.
Вступ
Цукровий діабет (ЦД) є одним із найпоширеніших захворювань сьогодення. Поширеність ЦД набула у світі епідемічного характеру і досягла, за даними Міжнародної федерації діабету, у 2016 році рекордної межі — 425 мільйонів, і вона продовжує стрімко зростати: вже у 2045 році очікують на цифру 629 мільйонів [1]. Крім того, ЦД є однією з 10 провідних причин смерті у всьому світі [2]. Особливого поширення набуває ЦД 2-го типу (ЦД-2), що обумовлено нераціональним харчуванням, вживанням великої кількості вуглеводів на фоні гіподинамії, спадковістю й негативними факторами зовнішнього середовища [3]. Тому, незважаючи на велику кількість пероральних цукрознижувальних засобів, лікування ЦД-2 і його ускладнень залишається провідною проблемою діабетології, а інтерес до використання фітопрепаратів, як ефективних і безпечних гіпоглікемізатів, постійно зростає. Адже рослини завжди були важливим джерелом для пошуку нових ліків від ЦД [4, 5], а пероральні цукро–знижувальні препарати часто мають побічні ефекти, такі як збільшення маси тіла, підвищення ризику виникнення кардіоваскулярних захворювань, остеопенія [6].
Відомо, що провідна роль у патогенезі хронічних судинних ускладнень за наявності ЦД-2 належить механізмам, асоційованим із гіперглікемією й атерогенною дисліпопротеїнемією (ДЛП) — гіперхолестеринемією, гіпертригліцеридемією, низьким рівнем холестерину ліпопротеїнів високої щільності й підвищеною концентрацією холестерину ліпопротеїнів низької щільності [7]. Повідомляється, що ефективне лікування ДЛП супроводжується зниженням частоти макросудинних ускладнень [8]. Отже, зменшення ризику виникнення хронічних судинних ускладнень у хворих на ЦД-2 потребує комплексного вирішення, зокрема контролю рівня глікемії й провідних атерогенних чинників.
До немедикаментозної терапії ЦД-2 належить модифікація стилю життя зі збільшенням фізичної активності, врахуванням макро- та мікронутрієнтного складу й калорійності добового раціону. На жаль, тільки менше від половини пацієнтів з ЦД-2 дотримуються необхідних рекомендацій [9, 10]. Саме тому застосування медикаментозної терапії ЦД-2 має важливе значення в досягненні й утриманні нормального рівня глікемії та ліпідів. У фармакотерапії ЦД-2 з ДЛП застосовують гіпоглікемізуюче лікування такими препаратами першої лінії, як метформін і похідні сульфонілсечовини, а також використовують статини, фібрати, секвестранти жовчних кислот, нікотинову кислоту та її похідні, препарати омега-3 поліненасичених жирних кислот та інгібітори поглинання холестерину [11, 12].
Особливу зацікавленість викликає аналіз ефективності комбінування фітопрепаратів і стандартної гіпоглікемізуючої терапії в лікуванні ЦД-2, однак інформація про особливості їх використання не–однозначна, має фрагментарний характер, є предметом дискусії, а тому потребує подальшого уточнення [13].
Сьогодні особлива увага приділяється комплекс-ним препаратам, що містять рослинні компоненти для зниження рівня глікемії. До них належить –вітчизняний рослинний засіб Глюцемедін виробництва ТОВ «Нутрімед», 1 капсула якого містить екстракт листя джимнеми (Gymnema sylvestre) 150 мг, екстракт листя банаби (Lagerstroemia speciosa) 125 мг, екстракт гіркої дині (Momordica charantia) 100 мг.
Екстракт листя джимнеми (Gymnema sylvestre) містить y своєму складі низку активних речовин, що впливають на метаболізм глюкози. Глікозиди (гімнемозиди) та джимнемова кислота підвищують секрецію інсуліну, сприяють відновленню β-клітин острівців Лангерганса, підвищують периферичну утилізацію глюкози, зменшують глюконеогенез і знижують надходження глюкози з кишечника до кров’яного русла [14], а гурмарин має регулюючий вплив на апетит і пригнічує смакові відчуття, за рахунок чого знижує вагу при ЦД-2 [15]. Джимнема використовується як гіпоглікемічний і гіполіпідемічний засіб, що пригнічує всмоктування глюкози й жирних кислот з кишечника в кров’яне русло, а отже, знижує ризик виникнення судинних ускладнень при цукровому діабеті. Крім того, джимнема збільшує гіпоглікемічний ефект при застосуванні антидіабетичних засобів [16].
Екстракт листя банаби (Lagerstroemia speciosa) містить коросолієву кислоту й галові кислоти, що достовірно знижують рівень глюкози, тригліцеридів і холестерину в крові за рахунок підвищення чутливості до інсуліну, збільшення клітинного захвату глюкози, сприяють зменшенню ваги тіла, про що свідчать клінічні дослідження, проведені в спеціалізованих клініках [17]. Банаба використовується при дієтичному харчуванні осіб з надмірною масою тіла й хворих на цукровий діабет для запобігання розвитку ускладнень і нормалізації вуглеводного обміну [18].
Екстракт гіркої дині (Momordica charantia) є додатковим джерелом глікозидів, амінокислот, сапонінів (харантин), алкалоїдів, редукуючих цукрів, рослинних жирів і вільних кислот, що здатні безпечно знижувати рівень глюкози й холестерину в крові у хворих на ЦД-2, стимулювати секрецію інсуліну підшлункової залози, зменшувати всмоктування глюкози в кишечнику, а також збільшувати поглинання й утилізацію глюкози в периферичних тканинах [19]. Харантин, що входить до складу екстракту плодів гіркої дині, чинить інсуліноподібну дію, сприяє проникненню глюкози в клітини. Клінічні дослідження ефективності використання гіркої дині порівняно з похідними сульфонілсечовини довели достовірне зниження рівня глюкози й холестерину, стимуляцію продукції інсуліну клітинами підшлункової залози при її застосуванні [20].
Ефективність використання екстрактів листя джимнеми, банаби й гіркої дині була доведена в клінічних дослідженнях [21], але дієвість поєднання фітопрепаратів з пероральними гіпоглікемізатами з метою оптимізації терапії ЦД-2 і його хронічних ускладнень не вивчалась. Нами було сплановано дослідження з вивчення ефективності комбінованої терапії із включенням комплексного препарату Глюцемедін і стандартної цукрознижувальної терапії.
Мета дослідження: оцінити переносимість і виявити можливі побічні ефекти фітопрепарату Глюцемедін; вивчити вплив Глюцемедіну на динаміку клінічного стану, вуглеводний і ліпідний обміни в пацієнтів із ЦД-2.
Матеріали та методи
Після отримання письмової згоди на проведення комплексного обстеження згідно з принципами Гельсінської декларації, Конвенції Ради Європи про права людини й біомедицину й відповідними законами України у дослідження було включено 40 хворих на ЦД-2 віком 61,7 ± 7,8 року з показниками глікованого гемоглобіну (HbA1c) 8,7 ± 0,6 %, які перебували на лікуванні в Київському міському клінічному ендокринологічному центрі впродовж 2017–2018 рр.
Концентрацію глюкози в крові визначали глюкозооксидазним методом, HbA1c — методом високочутливої іонообмінної рідинної хроматографії за допомогою аналізатора Cobas e411 фірми Roche Diagnostics GmbH (Німеччина). Стан ліпідного обміну оцінювали за показниками загального холестерину (ЗХС), тригліцеридів (ТГ), ліпопротеїнів високої щільності (ХС ЛПВЩ) і ліпопротеїнів низької щільності (ХС ЛПНЩ). Вміст ліпідів та креатиніну, сечовини, білірубіну, аланінамінотрансферази (АлАТ), аспартатамінотрансферази (АсАТ) визначали на аналізаторі Pentra C400 Horiba Medical (Франція).
Критеріями включення були: діагностований ЦД 2-го типу згідно з критеріями ВООЗ (2007), вік ≥ 18 і ≤ 75 років, індекс маси тіла ≥ 30 і ≤ 45 кг/м2. Критерії виключення: декомпенсований ЦД-2; гострий панкреатит в анамнезі; порушення активності ліпопротеїнліпази та/або ДЛП ІІІ типу; хронічна ниркова, печінкова й дихальна недостатність; гіпотиреоз; наркотична, алкогольна або нікотинова залежність; хворі з тяжкими соматичними захворюваннями (новоутвореннями, органічними стадіями захворювань печінки й нирок); жінки в період вагітності й лактації; хворі на цукровий діабет 1-го типу; підвищена чутливість до компонентів препаратів.
Досліджуваних пацієнтів було поділено на дві групи: основну (n = 30) і контрольну (n = 10). Основна група на додаток до цукрознижувальної терапії отримувала рослинний засіб Глюцемедін у дозі 1 капсула 3 рази на день перед їдою й була поділена за базовою цукрознижувальною терапією на три групи:
— перша група отримувала метформін (6 осіб, у тому числі 2 жінки, 4 чоловіки);
— друга група — метформін і гліклазид (10 осіб, у тому числі 7 жінок, 3 чоловіки);
— третя група — метформін і глімепірид (14 осіб, у тому числі 9 жінок, 5 чоловіків).
Контрольна група отримувала стандартну цукрознижувальну терапію. Пацієнтам дозу цукро–знижувальних препаратів не змінювали протягом усього дослідження. Курс лікування для всіх пацієнтів становив 2 місяці.
Візити до дослідника проводилися двічі: до та через 2 місяці від початку прийому досліджуваного фітокомплексу. В основній і контрольній групі на кожному візиті проводилося визначення маси тіла, вимірювався артеріальний тиск, оцінювалась вираженість можливих побічних ефектів. У всіх хворих до початку лікування й через 2 місяці проводили загальний аналіз крові, визначення глікованого гемоглобіну, креатиніну, сечовини, білірубіну, АлАТ, АсАТ, холестерину, ліпопротеїнів високої щільності, ліпопротеїнів низької щільності, тригліцеридів, глюкози. Проміжний контроль ефективності здійснювався за рівнем глікемії.
При статистичному аналізі даних перевірку розподілу кількісних ознак на відповідність закону Гауса проводили, розраховуючи показники асиметрії й ексцесу. При проведенні статистичного аналізу були обчислені рівні статистичної значущості порівняння незалежних вибірок (основна й контрольна групи) за двостороннім t-критерієм Стьюдента (Р), порівняння пов’язаних вибірок (до та після лікування) за парним t-критерієм Стьюдента (Р1), а також порівняння відсотків незалежних вибірок за двостороннім t-критерієм Стьюдента (Р2), відсоток змін після проведеного курсу лікування вираховували у вигляді дельти (∆%, M ± m). Перевірку статистичних гіпотез проводили на рівні значущості р < 0,05. Статистичні характеристики подано у вигляді середнього арифметичного (M) і стандартної похибки (± SE). Статистичний аналіз даних виконано за допомогою комп’ютерної програми Statgraphics Plus 3.0 фірми Manugistic Inc. (СШA).
Результати та обговорення
Основна й контрольна група пацієнтів не відрізнялись за віком, статтю, показниками вуглеводного й ліпідного обмінів, ступенем компенсації цукрового діабету (табл. 1).
В основній групі (n = 30) до завершення дослідження дійшло 29 пацієнтів, а в контрольній (n = 10) — усі. В однієї пацієнтки з основної групи спостерігалась під час дослідження поява алергічної реакції на невідомий агент.
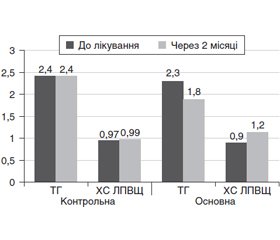
У результаті проведених досліджень встановлено, що Глюцемедін сприяв нормалізації показників вуглеводного обміну в усіх групах пацієнтів (табл. 2). Через 2 місяці лікування в основній групі було відмічено статистично значуще зниження рівня глюкози натще з 8,7 ± 0,6 ммоль/л до 7,0 ± 0,6 ммоль/л (р < 0,05), а в групі хворих, які отримували лише метформін, незважаючи на незначущі зміни (р > 0,05), рівень глікемії мав чітку тенденцію до зниження й набув значень, що характерні для компенсованого цукрового діабету: 6,2 ± 0,3 ммоль/л. У контрольній групі рівень глюкози натще до і після лікування фактично залишився незмінним (8,6 ± 0,3 ммоль/л і 8,9 ± 0,3 ммоль/л відповідно, р > 0,05), при цьому різниця між основною й контрольною групами була статистично значущою (р < 0,05). Така ж динаміка відмічена й стосовно постпрандіальної глікемії: рівень глюкози через 2 години після прийому їжі достовірно знизився під впливом 2-місячного прийому Глюцемедіну в цілому в усій групі обстежуваних з 9 ± 0,3 ммоль/л до 8,2 ± 0,2 ммоль/л (р < 0,05), тоді як у контрольній групі відмічені статистично незначущі зміни рівня постпрандіальної глікемії на 1,0 ± 0,3 % (р > 0,05), при цьому різниця між групами статистично значуща (р < 0,05). Особливий інтерес викликає достовірне зниження рівня глікозильованого гемоглобіну з 8,7 ± 0,4 % до 7,5 ± 0,4 % (р < 0,05) в основній групі пацієнтів, що є найбільш важливим підтвердженням стабільного й довготривалого гіпоглікемізуючого ефекту Глюцемедіну (рис. 1). Група пацієнтів, що отримувала як базову цукрознижувальну терапію лише метформін, мала на початку дослідження показники вуглеводного обміну, найбільш наближені до компенсації, тому зміни рівня глікованого гемоглобіну у них найменш виражені (р > 0,05), але з чітким напрямком до зниження: з 7,3 ± 0,5 % до 6,7 ± 0,3 %. У контрольній групі рівень глікованого гемоглобіну до і після лікування залишився незмінним (8,5 ± 0,2 і 8,6 ± 0,3 ммоль/л відповідно, р > 0,05), з достовірною різницею між основною й контрольною групами (р < 0,05).
/34-1.jpg)
Звертає на себе увагу те, що комбінування Глюцемедіну із стандартною цукрознижувальною терапією в лікуванні хворих на ЦД-2 супроводжувалось позитивними змінами показників ліпідного обміну (табл. 3). Глюцемедін сприяв вираженому зниженню рівня ТГ загалом в основній групі пацієнтів (р < 0,05) з 2,3 ± 0,2 ммоль/л до 1,8 ± 0,1 ммоль/л, отже, на 21,7 ± 0,6 %, а різниця між основною й конт–рольною групами є достовірною (р < 0,05). Комбінування Глюцемедіну із пероральними цукро–знижувальними препаратами в лікуванні хворих на ЦД-2 супроводжувалось збільшенням вмісту ХС ЛПВЩ (р < 0,05) на 33,3 ± 0,8 % (рис. 2). Використання в комплексному лікуванні хворих на ЦД-2 Глюцемедіну статистично значуще не впливало на показники концентрації ЗХС (р > 0,05) і ХС ЛПНЩ (р > 0,05). Причому рівень ЗХС мав тенденцію до зниження — 5,3 ± 0,2 ммоль/л на початку лікування і 5,1 ± 0,3 ммоль/л після нього. Необхідно зауважити, що клінічний досвід застосування екстрактів листя джимнеми, банаби й гіркої дині передбачає тривалий прийом даних препаратів (6 місяців) для досягнення вираженого терапевтичного ефекту [13–19]. Отже, можна зробити висновок, що для більш вираженого впливу на ліпідний обмін необхідно продовження терміну застосування Глюцемедіну. У контрольній групі пацієнтів із ЦД-2 не виявлено позитивної динаміки вмісту досліджених показників ліпідного обміну, зокрема ЗХС (р > 0,05), ХС ЛПНЩ (р > 0,05), ХС ЛПВЩ, ТГ (р > 0,05). Використання в комплексному лікуванні хворих на ЦД-2 Глюцемедіну сприяло більш вираженим позитивним змінам досліджених параметрів, що має особливе значення для запобігання судинним ускладненням цукрового діабету та їх лікування.
Через 2 місяці лікування в основній групі було відмічено статистично незначуще зниження маси тіла — з 86,8 ± 13,7 кг до 84,75 ± 13,4 кг (на 2,40 ± 0,02 %), але кожен хворий втратив за час дослідження 1–2 кг, що є рекомендованою швидкістю втрати ваги. У контрольній групі вага до і після лікування фактично залишилась незмінною — 88,6 ± 12,0 кг і 89,4 ± 10,5 кг відповідно, р > 0,05 (табл. 4).
Глюцемедін у проведеному дослідженні в цілому не проявляв побічної дії, лікування добре переносилося хворими.
Висновки
1. Включення в лікувальні заходи хворим на ЦД-2 прийому Глюцемедіну в дозі 1 капсула 3 рази на добу протягом 2 місяців зумовлює достовірне зменшення рівня глюкози натще, постпрандіальної глюкози й глікованого гемоглобіну.
2. Використання Глюцемедіну сприяло достовірному зниженню вмісту ТГ і збільшенню вмісту ХС ЛПВЩ.
3. Терапія препаратом Глюцемедін у пацієнтів з ЦД-2 сприяє зменшенню маси тіла, але для досягнення значущих результатів рекомендовано подовження тривалості прийому комплексу.
4. Глюцемедін має безпечний профіль застосування й може бути рекомендований як цукрознижувальний рослинний засіб, а також коректор дисліпопротеїнемії у хворих на ЦД-2.
5. Отримані результати дозволяють обгрунтовано рекомендувати Глюцемедін для включення до комбінованої терапії пероральними цукрознижувальними засобами хворих на ЦД-2 з метою підвищення її ефективності, покращення ліпідного та вуглеводного обміну та профілактики судиних ускладнень.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. IDF Diabetes Atlas. — Eighth edition. — Belgium: International Diabetes Federation, 2017.
2. The top 10 causes of death / World Health Organization. — http://www.who.int/news-room/fact-sheets/detail/the-top-10-causes-of-death.
3. Lindström J., Ilanne-Parikka P. et al. Sustained reduction in the incidence of type 2 diabetes by lifestyle intervention: The follow-up results of the Finnish Diabetes Prevention Study // Lancet. — 2006. — Vol. 368. — P. 1673-1679.
4. Ahmad Ghorbani Best herbs for managing diabetes: a review of clinical studies / Ahmad Ghorbani // Brazilian Journal of Pharmaceutical Sciences. — 2013. — Vol. 49(3). — P. 413-422.
5. Uma Makheswari M. Phytomedicine for diabetes mellitus: an overview / Uma Makheswari M., Sudarsanam D. // Research in Pharmacy. — 2011. — Vol. 1(4). — P. 28-37.
6. AHFS Drug information, Authority of the Board of the American Society of Health-System Pharmacists, American Hospital Formulary Service, Bethesda, Md, USA, 2012.
7. Сергієнко В.О. Діабетична кардіоваскулярна автономна нейропатія / В.О. Сергієнко, О.О. Сергієнко. — Львів: Львівський національний медичний університет імені Данила Галицького, 2016. — 268 с.
8. Valensi P. Cardiovascular autonomic neuropathy / P. Valensi // Diabetes in cardiovas cular disease: A companion to braunworld’s heart disease / McGuire D.K., Marx N. editors. — Amsterdam: Elsevier Saunders, 2015. — P. 361-368.
9. The Diabetes Prevention Program Research Group: Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin // N. Engl. J. Med. — 2002. — 346. — P. 393-403.
10. De Bacquer D., De Backer G. EUROASPIRE III: Lifestyle and risk factor management and use of drug therapies in coronary patients from 22 countries in Europe // European Journal of Cardiovascular Nursing. — 2008. — Vol. 7. — P. 24-28.
11. Ascaso J.F. Advances in cholesterol-lowering interventions / J.F. Ascaso // Endocrinol. Nutr. — 2010. — Vol. 57(1). — P. 210-219. doi: 10.1016/j.endonu.2010.03.008.
12. Сергієнко В.О. Дисліпопротеїнемії при цукровому діабеті 2 типу: основні напрямки лікування (огляд літератури та власних досліджень) / В.О. Сергієнко // Журнал Національної академії медичних наук України. — 2012. — Т. 18, № 2. — C. 205-216.
13. Ashok K. Tiwari Diabetes mellitus and multiple therapeutic approaches of phytochemicals: present status and future prospects / Ashok K. Tiwari, J. Madhusudana Rao // Current –Science. — 2002. — Vol. 83(1). — P. 30-38.
14. Gulab S. Thakur Gymnema sylvestre: an alternative therapeutic agent for management of diabetes / Gulab S. Thakur, Rohit Sharma, Bhagwan S. Sanodiya et al. // Journal of Applied Pharmaceutical Science. — 2012. — Vol. 2(12). — P. 001-006.
15. Parijat Kanetkar. Gymnema sylvestre: a memoir / Parijat Kanetkar, Rekha Singhal, Madhusudan Kamat // Journal of Clini–cal Biochemistry and Nutrition. — 2007. — Vol. 41. — P. 77-81
16. Ulbricht С. An evidence-based systematic review of Gymnema (Gymnema sylvestre R.Br) by Natural standard research collaboration / Catherine Ulbricht, Tracee Rae Abrams, Ethan Basch et al. // Journal of Dietary Supplements. — 2011. — Vol. 8(3). — P. 311-330.
17. Toshihiro Miura Management of Diabetes and its complicatons with Banaba (Lagerstroemia speciosa L.) and Corosolic acid / Toshihiro Miura, Satoshi Takagi, Torao Ishida // Hindawi Publishing Corporation Evidence-Based Complementary and Alternative Medicine. — Vol. 2012. Article ID 871495, 8 pages, doi: 10.1155/2012/871495.
18. Sidney J. Stohs A review of the efficacy and safety Banaba (Lagerstroemia speciosa L.) and Corosolic acid / Sidney J. Stohs, Howard Miller, Gilbert R. Kaats // Phytotherapy research. — 2012. — Vol. 26. — P. 317-324.
19. Baby J. Antidiabetic effect of Momordica charantia (bitter melon) and its medicinal potency / Baby Joseph, D. Jini // Asian Pacific Journal of Tropical Disease. — 2013. — Vol. 3(2). — P. 93-102.
20. Rahman I.U. Lower hypoglycemic but higher antiatherogenic effect of bitter melon than glibenclamide in type 2 diabetic patients / Inayat U. Rahman, Rooh Ullah Khan, Khalil Ur Rahman, Mohammad Bashir // Nutrition Journal. — 2015. — 14, 13 — 7 p. doi: 10.1186/1475-2891-14-13.
21. Zhijun Wang. Treating type 2 Diabetes mellitus with traditional chinese and indian medicinal herbs / Zhijun Wang, Jeffrey Wang, Patrick Chan // Hindawi Publishing Corporation Evidence-Based Complementary and Alternative Medicine. — Vol. 2013, Article ID 343594, 17 p. doi: 10.1155/2013/343594.

/33-1.jpg)
/34-1.jpg)
/35-1.jpg)