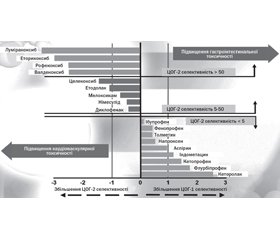
На сьогодні нестероїдні протизапальні препарати (НПЗП) залишаються одними з найбільш важливих симптоматичних лікарських засобів (ЛЗ) при лікуванні більшості ревматичних захворювань (РЗ). Основними показаннями для їх призначення є запальні процеси, гострий та хронічний біль, лихоманка, профілактика тромбозів. Ця група препаратів є унікальною, тому що вона поєднує протизапальні, аналгетичні, жарознижуючі й антитромботичні властивості, що дозволяє впливати на характерні симптоми. Жодна інша відома група ЛЗ не має такого поєднання позитивних впливів. Через це НПЗП широко використовуються як у ревматології, так і в кардіології, неврології, онкології тощо. До класу НПЗП входить близько 20 лікарських засобів, які залежно від хімічної структури розподіляються на декілька груп: похідні саліцилової, індолової, гетероарилоцитової, пропіонової й еноліокової кислоти тощо. Ця класифікація не дозволяє передбачити клінічну ефективність або токсичність того чи іншого НПЗП [4]. Механізмом, який визначає ефективність і токсичність НПЗП, є пригнічення активності циклооксигенази (ЦОГ) — фермента, що регулює біотрансформацію арахідонової кислоти в простагландини (ПГ), простациклін (ПЦ) та тромбоксан (ТБК) [15, 24]. ЦОГ-1 (одна з двох основних форм ЦОГ) постійно наявна в більшості тканин, належить до конститутивних (структурних) ферментів, регулює фізіологічні ефекти ПГ. ЦОГ-2 у нормі в більшості тканин відсутня, її рівень підвищується на фоні розвитку запалення. Пригнічення активності ЦОГ-2 становить собою механізм протизапальної та аналгетичної активності НПЗП, а пригнічення ЦОГ-1 — причину розвитку побічних явищ. Нові факти про роль ЦОГ-залежного синтезу ПГ у нормі та при патології дозволили переглянути думку про те, що ЦОГ-1 є фізіологічним, а ЦОГ-2 — патологічним ферментом. ЦОГ-1 бере участь у модуляції передачі нервового імпульсу в центральній нервовій системі (ЦНС), агрегації тромбоцитів, захисті слизової оболонки шлунково-кишкового тракту (ШКТ), розширенні судин нирок. ЦОГ-2 бере участь у передачі нервового імпульсу в ЦНС, активації терморегуляторного центру, вазодилатації (діє на ендотелій судин), спричиняє антиагрегантний вплив. У його функції входить регуляція проліферації клітин під час відновлення тканин, запалення чи неопластичного процесу в ШКТ, дія на нирки: регуляція водно-електролітного балансу й артеріального тиску. Установлена фізіологічна роль ЦОГ-2 залежного синтезу ПГ у репарації виразок ШКТ, адаптивній цитопротекції клітин ШКТ до токсичних речовин, стресу, в регуляції овуляції, функції нирок, синтезі ПГ ендотеліальними клітинами судинної стінки, репарації переломів кісток (табл. 1) [15]. Таким чином, розподіл ЦОГ на фізіологічну та патологічну є некоректним: обидва ферменти беруть участь у фізіологічних і патологічних процесах. Вважається доцільним при лікуванні запальних процесів будь-якої етіології використовувати так звані збалансовані інгібітори ЦОГ. Розподіл молекул за селективністю поданий на рис. 1.
/76-1.jpg)
Додаткові механізми протизапальної й аналгетичної дії НПЗП, які не пов’язані з пригніченням активності ЦОГ, включають пригнічення функції нейтрофілів, взаємодії лейкоцитів з ендотелієм судин, інгібіцію активації фактора транскрипції NF-κβ (регулятора синтезу прозапальних медіаторів), центральні антиноцицептивні й опіоїдоподібні ефекти, регуляцію апоптозу клітин. НПЗП умовно розподіляють на короткоживучі (Т1/2 < 6 год) і тривало живучі (Т1/2 > 6 год). Чіткого зв’язку між Т1/2 НПЗП у плазмі та клінічною ефективністю НПЗП при їх тривалому прийомі не встановлено. Короткоживучі препарати накопичуються і тривало перебувають у зоні запалення (наприклад, у порожнині суглоба). Основні представники групи НПЗП та їх фармакологічні властивості подані в табл. 1 [15].
З табл. 1 видно, що диклофенак калію, що накопичується в синовіальній оболонці і циркулює більше 12 годин, має переваги перед короткоживучими препаратами.
Велике значення для клінічної практики має розподіл НПЗП залежно від селективності щодо ЦОГ-2 на неселективні і селективні. Серед селективних деякі дослідники виділяють підгрупу високоселективних препаратів (так звані коксиби) (Насонов Е.Л. и соавт., 2010; табл. 2) [5, 13, 15].
До препаратів із найбільш вираженою протизапальною дією належать фенілбутазон, індометацин, диклофенак натрію, напроксен, аспірин (ацетилсаліцилова кислота (АСК)). Групу препаратів із переважним аналгетичним (надпротизапальним) ефектом становлять: неацетильовані саліцилати, фенамати, ібупрофен, кетопрофен, тіапрофенова кислота, диклофенак калію, темоксикам. Але протизапальний ефект диклофенаку калію має більше значення, ніж короткотривала аналгетична дія препаратів із коротким періодом напіввиведення. Однією з основних причин руйнування хряща є процес запалення в суглобі — синовіїт.
Системна дія НПЗП обумовлена прийомом per os, призначенням ректальних свічок і використанням ін’єкцій. Немає переконливих даних, що ректальні свічки мають переваги у швидкості настання або вираженості лікувальної дії перед прийомом НПЗП per os. Їх доцільно використовувати для зменшення ризику розвитку диспепсії, викликаної контактним подразнюючим ефектом НПЗП. Сучасні форми НПЗП для прийому per os завдяки високій біодоступності мають настільки ж виражений аналгетичний ефект, як і ін’єкційні. Мазі з НПЗП вірогідно перевершують за своєю дією плацебо, відносно рідко викликають місцеві та системні небажані ефекти, добре переносяться хворими, на практиці локальне призначення НПЗП використовують як метод допоміжної терапії. Ефективність системного призначення НПЗП є більш значною, ніж використання парацетамолу.
Побічні ефекти НПЗП. НПЗП мають виражену токсичну дію на багато органів і систем, що пов’язано з пригніченням синтезу ПГ. Прийом НПЗП може призводити до НПЗП-гастропатії, загострення і розвитку ускладнень гастроезофагеальної рефлюксної хвороби, викликати диспептичні симптоми, ураження тонкої і товстої кишки. Призначення НПЗП у свічках або у вигляді ін’єкцій не зменшує ризику розвитку НПЗП-гастропатій. Останні можуть розвиватися при використанні будь-яких лікарських форм. Застосування НПЗП у вигляді ретардних форм, кишково-розчинних таблеток і ректальних свічок не зменшує ризик розвитку серйозних ускладнень із боку ШКТ. Це доведено в ретроспективних когортних дослідженнях. Найбільш високий ризик розвитку НПЗП-гастропатій спостерігається до трьох місяців після початку прийому цих препаратів, при більш тривалому прийомі ймовірність подібного ускладнення значно знижується. Часто НПЗП-індуковані виразки протікають без суб’єктивних симптомів («німі виразки»). Цим самим вони стають ще більш небезпечними. Це так званий сурогатний маркер небезпечних ускладнень, таких як шлунково-кишкові кровотечі. Згідно з даними кількох популяційних досліджень у хворих, які пред’являють скарги на диспепсію і біль у шлунку, серйозні ускладнення з боку шлунково-кишкового тракту діагностуються частіше, ніж у тих, хто не має подібних неприємних відчуттів. Прийом НПЗП має знеболюючий ефект, тому саме ці скарги повинні насторожувати лікаря. Пацієнтам, які тривало приймають НПЗП (1–3 місяці) та мають основні фактори ризику, незалежно від того, чи наявні клінічні ознаки ураження шлунково-кишкового тракту, показано проведення ендоскопічного дослідження. Вони потребують періодичного обстеження ШКТ та захисту у вигляді паралельного прийому інгібіторів протонної помпи (ІПП). Найважливішими факторами ризику НПЗП-гастропатії є наявність в анамнезі виразок, особливо ускладнених кровотечею або перфорацією, вік 65 років і старше, прийом високих доз НПЗП, двох або більше препаратів цієї групи (включаючи низькі дози ацетилсаліцилової кислоти), супутній прийом антикоагулянтів і глюкокортикоїдів. Деякі автори виділяють також такі додаткові фактори ризику, як паління, прийом алкоголю, наявність тяжких супутніх захворювань із боку серцево-судинної системи (ССС), симптомів диспепсії, а також інфікованість H. руlory. При лікуванні НПЗП-гастропатій тривалість курсової терапії повинна бути не менше 4 тижнів, а при великих розмірах і локалізації виразок в шлунку — 8–12 тижнів. Припинення прийому НПЗП не призводить до рубцювання НПЗП-індукованих виразок, але підвищує ефективність противиразкової терапії. Омепразол, лансопразол, пантопразол, езомепразол є препаратами вибору для лікування НПЗП-гастропатії. Вони ефективні при НПЗП-індукованих виразках як дванадцятипалої кишки, так і шлунка, і перевершують за своєю лікувальною дією блокатори Н2-рецепторів гістаміну та мізопростол. ІПП використовуються в стандартних терапевтичних дозах (наприклад, омепразол 40 мг/добу), при цьому немає потреби у відміні НПЗП та інших протиревматичних препаратів. Супутній прийом високих доз ГК та цитотоксичних препаратів (наприклад, метотрексат) здатний уповільнити процес рубцювання НПЗП-індукованих виразок. На сьогодні немає даних про переваги якого-небудь окремого препарату з групи ІПП при лікуванні НПЗП-гастропатії. Результати низки рандомізованих клінічних досліджень свідчать, що ефективність ІПП може бути підвищена шляхом їх комбінації з препаратами вісмуту. Ерадикація H. руlory не прискорює загоєння НПЗП-індукованих виразок [13–15]. Проведення активних профілактичних заходів показане насамперед пацієнтам, які мають фактори ризику НПЗП-гастропатії. Найважливіше значення має раціональне використання НПЗП з урахуванням особливостей клінічної ситуації і фармакологічних властивостей ліків. НПЗП завжди слід призначати короткими курсами в мінімально оптимальних дозах, необхідних для досягнення терапевтичного ефекту, уникаючи, якщо є можливість, поєднань із препаратами, здатними збільшити ризик розвитку ускладнень із боку ШКТ (низькі дози АСК, антикоагулянти, глюкокортикоїди). Не слід перевищувати рекомендовані терапевтичні дози, а також комбінувати різні НПЗП (одночасно призначати пероральні і парентеральні форми). Немає даних про те, що запивання таблеток молоком, киселем і т.п., вживання фітопрепаратів здатні знизити ризик небезпечних ускладнень із боку шлунково-кишкового тракту. Перед призначенням НПЗП завжди необхідно оцінити гастроінтестинальний ризик. Якщо пацієнт має фактори ризику НПЗП-гастропатії та потребує протизапальної й аналгетичної терапії, то призначення селективних НПЗП значно зменшує ризик розвитку виразок, ерозій та їх ускладнень порівняно з неселективними НПЗП. Але ускладнення з боку ШКТ можуть виникати і при застосуванні селективних НПЗП, особливо у хворих, які мали в анамнезі серйозні ускладнення з боку ШКТ (кровотечі, перфорація, рецидивуючі виразки). Ризик розвитку шлунково-кишкових кровотеч у хворих, які мали цю патологію в анамнезі, на фоні прийому селективних НПЗП такий самий, як у тих, хто приймає неселективні НПЗП у комбінації з ІПП. При високому ризику ускладнень (у пацієнтів, які мали в анамнезі шлунково-кишкові кровотечі або перфорації виразки, при рецидивуючих НПЗП-індукованих виразках, при поєднанні двох і більше факторів ризику) навіть на тлі прийому селективних НПЗП слід проводити медикаментозну профілактику НПЗП-гастропатії з використанням ІПП. На сьогодні доведено, що комбінація селективних НПЗП і ІПП більш безпечна в групах високого ризику порівняно з комбінацією неселективних НПЗП і ІПП. Ерадикація H. руlory не прискорює загоєння НПЗП-індукованих виразок на тлі прийому антисекреторних противиразкових препаратів і не зменшує ризик розвитку НПЗП-індукованих виразок, якщо її проводять в осіб, які вже приймають НПЗП [13–15]. Тому профілактичний прийом ІПП є обов’язковим. НПЗП викликають диспепсію набагато частіше, ніж препарати інших фармакологічних груп. Вона виникає у 20–40 % хворих, які регулярно приймають НПЗП, при цьому близько 10 % хворих переривають прийом НПЗП. Патогенетично диспепсія пов’язана з контактною дією НПЗП.
Раціональне використання НПЗП — основний метод профілактики НПЗП-ентеропатій. Особливої обережності слід дотримуватись при призначенні НПЗП пацієнтам із хворобою Крона і виразковим колітом: прийом неселективних НПЗП може спровокувати тяжку кишкову кровотечу і перфорацію. Застосування високоселективних НПЗП вірогідно знижує ризик розвитку або рецидиву патології тонкої кишки. Відміна НПЗП зменшує ризик розвитку тяжких ускладнень і прискорює процес одужання, але не призводить до зникнення всіх симптомів НПЗП-ентеропатії. Слід пам’ятати, що ІПП не зменшують ризик розвитку НПЗП-ентеропатії. При тривалому прийомі НПЗП можливий розвиток ерозій, виразок, перфорації та стриктури товстої кишки, ускладнення перебігу дивертикульозу.
У 1–5 % хворих, які регулярно приймають НПЗП, спостерігається безсимптомне підвищення трансаміназ. Гострий гепатит виникає рідко, розвиток гепатотоксичних реакцій можуть викликати всі НПЗП, включаючи селективні. Гепатотоксичність може проявитися в будь-який період лікування (частіше в перші 6–24 тижні лікування). При виникненні клінічних ознак ураження печінки чи істотних змін лабораторних показників слід негайно відмінити НПЗП. При призначенні НПЗП необхідно завжди враховувати фактори ризику: жіночу стать, літній вік, патологію гепатобіліарної системи, тяжкі захворювання, що сприяють погіршенню кровотоку в печінці, поєднаний прийом препаратів, що впливають на метаболізм НПЗП, генетичні аномалії активності ферментів, що визначають біотрансформацію НПЗП та їх метаболітів, гіпоальбумінемію, підвищення активності аланінамінотрансферази й аспартатамінотрансферази в анамнезі на тлі медикаментозної терапії. Необхідність призначення спеціальної терапії (у тому числі гепатопротекторів) при безсимптомному підвищенні активності трансаміназ до сьогодні не доведена [1, 2, 9, 13, 14, 27]. Як свідчать результати дослідження SALT (10 000 хворих із 52 клінічних центрів 7 країн Європи), ризик розвитку гострої печінкової недостатності, що вимагає трансплантації печінки, для всіх НПЗП майже однаковий. Він значно підвищений тільки при використанні парацетамолу.
Прийом НПЗП може призводити до дестабілізації артеріальної гіпертензії (АГ), прогресування серцевої недостатності, асоціюватися з підвищенням ризику патологій серця і судин (інфаркт міокарда (ІМ), інсульт і раптова коронарна смерть) [36]. За результатами метааналізу 54 досліджень, прийом неселективних НПЗП призводить до вірогідного підвищення артеріального тиску в пацієнтів, які страждають від АГ. За даними 50 рандомізованих клінічних досліджень, прийом НПЗП призводить до збільшення артеріального тиску (у середньому на 5 мм рт.ст.). Цей ефект більш виражений у пацієнтів, які вже отримували антигіпертензивну терапію. Результати рандомізованих клінічних досліджень свідчать, що індометацин, піроксикам і напроксен у середніх дозах та ібупрофен у високій дозі здатні зменшувати ефективність b-адреноблокаторів, діуретиків, інгібіторів ангіотензинперетворюючого ферменту і меншою мірою — блокаторів повільних кальцієвих каналів. Надзвичайно важливим є вибір безпечного препарату, оскільки часто пацієнти літнього віку мають коморбідні стани, де поєднуються остеоартроз (ОА) й АГ. Спостерігається абсолютне збільшення частоти виникнення ІМ у пацієнтів, які отримували селективні НПЗП, порівняно з тими, хто отримував неселективні НПЗП, але ускладнення з боку шлунково-кишкового тракту зустрічаються значно частіше при прийомі неселективних НПЗП. Результати 62 досліджень (94 599 пацієнтів) показали, що загалом частота ІМ була вищою на фоні прийому селективних НПЗП, ніж неселективних НПЗП, але вірогідне збільшення ризику відзначено тільки при прийомі рофекоксибу. За результатами вивчення серцево-судинної безпеки НПЗП 07.04.2005 р. FDA дійшла висновку, що всі НПЗП можуть підвищувати ризик кардіоваскулярних захворювань. Підвищення ризику серцево-судинних захворювань розглядається як клас-специфічний побічний ефект всіх НПЗП. В офіційній заяві Американської асоціації серця від 26 лютого 2007 р. відмічено, що всі НПЗП (за виключенням АСК) підвищують ризик ІМ та інсульту. При лікуванні хронічного больового синдрому в пацієнтів із серцево-судинними захворюваннями або підвищеним ризиком їх розвитку селективні інгібітори ЦОГ-2 слід використовувати в останню чергу. НПЗП не слід призначати пацієнтам, які отримують антитромбоцитарну терапію аспірином, оскільки вони пригнічують антитромбоцитарний ефект АСК. Використання всіх НПЗП протипоказано хворим, які недавно перенесли аортокоронарні шунтування. Групами підвищеного ризику також є пацієнти з ішемічною хворобою серця (стенокардією або перенесеним ІМ) та цереброваскулярними захворюваннями (перенесеним інсультом або з епізодами коронаротромбозу). Всі селективні НПЗП та інгібітори ЦОГ-2 слід використовувати в найменших ефективних дозах протягом якомога більш короткого часу. Однак прийом НПЗП збільшує ймовірність розвитку зазначених патологій набагато менше, ніж інші традиційні фактори ризику кардіоваскулярних ускладнень [37, 38]. Рішення про призначення препаратів приймає лікар, обгрунтовуючи його результатами оцінки серцево-судинного ризику в конкретного пацієнта. Встановлено, що постійний прийом НПЗП (> 60 днів на рік) асоціюється з підвищенням ризику розвитку ІМ, нерегулярний прийом НПЗП (від 1 до 59 днів/рік) не призводить до підвищення ризику ІМ порівняно з групою пацієнтів, які не приймали НПЗП [36–38]. Використання НПЗП збільшує ризик розвитку та декомпенсації застійної серцевої недостатності [3, 13, 38].
У 2011 р. в журналі «British Medical Journal» опубліковані результати метааналізу безпеки НПЗП, згідно з якими жоден НПЗП не є безпечним для ССС. Тому при призначенні НПЗП необхідно оцінювати кардіо- та гастроінтестинальні (ГІ) ризики. Високоселективні інгібітори ЦОГ-2 (коксиби) доцільно призначати лише в пацієнтів із надзвичайно високим ступенем ризику ГІ-ускладнень за умови, що даний пацієнт не має кардіоваскулярних ризиків, не приймає АСК або інші дезагреганти, НПЗП доцільно приймати лише коротким курсом і в оптимальних дозах, також рекомендується призначення гастропротекторної терапії. За наявності інших тяжких супутніх захворювань можливість призначення НПЗП слід узгодити з лікарями відповідних спеціальностей.
В основі негативної дії НПЗП на функцію нирок лежать електролітні і водні порушення, розвиток інтерстиціального нефриту і папілярного некрозу. Порушувати функцію нирок однаковою мірою можуть селективні та неселективні НПЗП. Спостерігається зниження клубочкової фільтрації з виникненням набряків, невеликим збільшенням рівня креатиніну і сечовини в сироватці і гіперкаліємією. Фактори ризику ураження нирок внаслідок прийому НПЗП включають літній вік (старше 65 років), приховану ниркову недостатність, застійну серцеву недостатність, цироз печінки, використання діуретиків, дегідратацію і зниження артеріального тиску, а також застосування деяких лікарських засобів, включаючи діуретики, аміноглікозиди, циклоспорин А, інгібітори ангіотензинперетворюючого ферменту. Виникнення аналгетичної нефропатії пов’язують із тривалою ішемією, зумовленою інгібуванням синтезу простагландинів. Вона розвивається при багаторічному безперервному прийомі НПЗП, супроводжується повільно прогресуючим некрозом сосочків нирок, порушенням концентраційної функції нирок, розвитком хронічної ниркової недостатності [1, 3]. Пацієнтам із помірним і тяжким ступенем ниркової недостатності необхідно уникати прийому як неселективних НПЗП, так і селективних інгібіторів ЦОГ-2 [13, 14, 36, 38].
Тривале застосування НПЗП впливає на розвиток ускладнень із боку легеневої системи. У 10–20 % пацієнтів, які страждають від бронхіальної астми, спостерігається гіперчутливість до АСК та інших НПЗП (раніше цю патологію називали аспіриніндукованим респіраторним захворюванням). У хворих, в яких РЗ поєднуються з бронхіальною астмою, віддають перевагу німесуліду, мелоксикаму, целекоксибу, оскільки вони значно рідше викликають дане ускладнення [15, 16].
Сьогодні здійснюється пошук балансу між клінічною ефективністю та мінімізацією небажаних побічних явищ НПЗП. Останнім часом стало ясно, що подальше нарощування селективності НПЗП до ЦОГ-2 призводить до зростання побічних явищ. Тому є актуальним поглиблене вивчення засобів, які вже застосовуються сьогодні. Препарати з помірною селективністю до ЦОГ-2 на відміну від високоселективних інгібіторів не повністю пригнічують ЦОГ-2-залежний синтез простацикліну в ендотелії судин, справляють достатньо добрий протизапальний та знеболюючий ефекти. Вони не забезпечують одночасної блокади ЦОГ-1 та ЦОГ-2 при прийомі в комбінації з АСК, що важливо з практичної точки зору.
Вплив НПЗП на хрящову тканину не вивчався в жодному рандомізованому контрольованому дослідженні. Ex vivo та in vivo встановлено, що індометацин, напроксен, піроксикам, парацетамол пригнічують синтез протеогліканів хрящів, а диклофенак, німесулід, ібупрофен не справляють подібного ефекту. Тому диклофенак має хондронейтральну дію. Вважається, що ліки, що пригнічують синтез протеогліканів, знижують здатність хондроцитів відновлювати пошкоджений позаклітинний матрикс та можуть прискорювати розвиток порушень хрящової тканини. У літературі відмічається позитивний вплив на хрящ мелоксикаму й ацеклофенаку. Слід враховувати, що ліквідація НПЗП болю може призвести до надмірного фізичного навантаження уражених зв’язок та їх пошкодження. Згідно з результатами дослідження IMPROV (2001), частка пацієнтів з остеоартрозом, у яких зареєстровано позитивний ефект лікування упродовж 6 місяців, становила: для піроксикаму — 36,2 %, ібупрофену — 38,9 %, напроксену — 40,8 %, диклофенаку — 42,4 %, рофекоксибу — 53,6 %, целекоксибу — 62 %, мелоксикаму — 66,8 %. За даними результатами видно переваги диклофенаку над ібупрофеном.
Відповідно до рекомендацій Європейського товариства з клінічних та економічних аспектів остеопорозу та остеоартриту (Тhe European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis) та матеріалів Європейського конгресу ревматологів (European League Against Rheumatism), Міжнародного товариства з вивчення остеоартрозу (The Osteoarthritis Research Society International) для лікування ОА застосовують швидкодіючі симптоммодифікуючі (disease modifying osteoarthritis drugs) засоби — НПЗП, глюкокортикостероїди, анальгетики (переважно парацетамол), а також препарати сповільненої дії, які структурно модифікують хрящ (symptomatics low acting drugs in osteoarthritis) [4, 23, 27–29, 32, 35].
Загалом підбір хворому НПЗП повинен здійснюватися з урахуванням вихідних рівнів ризику з боку травної системи та ССС згідно з рекомендаціями Європейської мультидисциплінарної експертної групи стосовно зваженого використання НПЗП при ревматичних захворюваннях 2011 року, в яких визначено 6 категорій пацієнтів за ризиками з боку ССС та ШКТ. Серцево-судинний (СС) ризик кількісно оцінюється за шкалою Heart Score Європейської асоціації кардіологів, а шлунково-кишковий (ШК) ризик — залежно від кількості супутніх факторів ризику. Хворим без СС- та ШК-ризиків можна призначати класичні НПЗП та ЦОГ-2-специфічні інгібітори без ІПП. За наявності будь-якого ШК-фактора ризику класичні НПЗП не рекомендуються. Хворим із низьким СС- та помірним ШК-ризиком (в анамнезі відсутні чи неускладнені події з боку верхніх відділів ШТ) призначають інгібітори ЦОГ-2 (целекоксиб, еторикоксиб) або класичні НПЗП у поєднанні з ІПП. За наявності поєднання низького СС-ризику та помірного ШК-ризику (ускладнені події з боку верхніх відділів ШКТ раніше) застосовують інгібітори ЦОГ-2 разом з ІПП або ібупрофен/диклофенак у поєднанні з ІПП. Пацієнтам із високим СС-ризиком та низьким чи помірним ШК-ризиком рекомендується застосування напроксену в комбінації з ІПП, оскільки цей препарат має найкращий профіль СС-безпеки і несприятливий профіль ШК-безпеки. При поєднанні СС- та ШК-ризиків уникають призначення НПЗП, але при клінічній необхідності можливе застосування інгібіторів ЦОГ-2 або диклофенаку/напроксену в комбінації з ІПП. Результати метааналізу 31 рандомізованого клінічного дослідження (сумарно 116 426 хворих) показують, що жоден НПЗП не можна вважати повністю безпечним [22, 25, 26, 30].
Таким чином, при використанні препаратів із групи НПЗП дуже важливою їх властивістю повинно бути поєднання достатньо вираженого лікувального та мінімальних проявів побічних ефектів. Тобто лікарю необхідно знайти золоту середину між достатньою лікувальною дією та небажаними ефектами.
Одним із найбільш досліджених НПЗП, які використовують при лікуванні ОА, є диклофенак. Диклофенак (2-(2,6 дихлороаніліно) фенілацетилова кислота, CAS 15307-86-5) — НПЗП, що використовується для купірування болю і лікування запальних процесів різної локалізації [6]. Молекула диклофенаку була синтезована A. Sallmann і R. Pfister у вигляді натрієвої солі та впроваджена в клінічну практику в 1973 році. Диклофенак характеризується частковою розчинністю в гідрофільних і гідрофобних середовищах, має короткий період напіввиведення та швидко всмоктується при пероральному прийомі [10, 17]. Диклофенак чинить болезаспокійливу, жарознижувальну та протизапальну дії шляхом пригнічення синтезу простагландинів у периферичній нервовій системі та ЦНС. Препарат призводить до інактивації лізосомних ензимів, гальмуючі активність катепсину В1, пригнічує активність нейтральної протеази. Важливою складовою механізму знеболювальної дії диклофенаку є інгібування вивільнення фактора некрозу пухлин a, що призводить до запобігання гіпералгезії, спричиненої виділенням брадикініну і цитокінів.
Також існує дослідження щодо впливу диклофенаку на антиноцицептивну опіатну систему шляхом непрямої активації каппа-опіоїдних рецепторів за рахунок збільшення виділення ендогенних опіоїдів, таких як динорфіни. В дослідженнях A. Martini та ін. було встановлено, що диклофенак збільшує концентрацію бета-ендорфінів у плазмі крові. В інших клінічних дослідженнях сила знеболювальної дії диклофенаку наближалася до дії кодеїну, була в 3–8 разів сильнішою, ніж у напроксену, у 8–16 разів — ніж в ібупрофену, а також у 12–18 разів — ніж в ацетилсаліцилової кислоти. У дослідженнях S.R. Smith і співавт. наведено результати метааналізу 17 рандомізованих контрольованих досліджень за період з 1982 по 2015 рік. Установлено, що 27 НПЗП, у тому числі диклофенак, не поступалися за знеболювальною дією опіоїдним анальгетикам. Був зроблений висновок, що НПЗП й опіоїди надають аналогічне полегшення болю в пацієнтів з ОА. Терапевтичний ефект НПЗП, у тому числі й диклофенаку, може бути також частково зумовленим їх впливом на метаболізм ендогенних каннабіоїдів. Як відомо, ЦОГ-2 здатна окислювати ендоканнабіоїд N-арахідоноілетаноламін (АЕА) і 2-арахідоноїлгліцерол (2-АГ), які чинять анальгетичний, протизапальний і, можливо, анксіолітичний ефекти за рахунок зв’язування з рецепторами каннабіноїдів і прямої взаємодії з іонними каналами, беручі участь у сприйнятті болю. Окислення під впливом ЦОГ-2 є одним із метаболічних процесів, що блокують біологічну активність АЕА і 2-АГ, а простаноїди, що утворюються в результаті деградації цих сполук, можуть діяти як прозапальні медіатори. Зниження рівня ЦОГ-2 під впливом диклофенаку сприяє збереженню анальгетичної активності ендоканнабіоїдів за рахунок уповільнення їх деградації. Це також приводить до зменшення концентрації прозапальних простаноїдів. Експресія ЦОГ-2 на фоні запалення збільшується інколи більше ніж у 50 раз [10, 18]. Наприкінці ХХ — на початку ХХІ ст. в експериментальних дослідженнях, проведених in vitro та in vivo, були встановлені й інші механізми дії диклофенаку. У дослідженнях О.Є. Ядловського, проведених в ДУ «Інститут фармакології та токсикології НАМН України» (м. Київ), було вивчено вплив агоністів та антагоністів ванілоїдних рецепторів на антиноцицептивну дію диклофенаку [17]. Дослідниками встановлено наявність у антиноцицептивній дії диклофенаку ванілоїдного компонента. В результаті аналізу 74 рандомізованих клінічних досліджень було встановлено, що диклофенак у дозі 150 мг/добу виявився найбільш ефективним НПЗП як за знеболюючою дією, так і за поліпшенням функції суглоба при ОА колінного або тазостегнового суглоба. Його ефективність була вищою, ніж у максимально можливих доз ібупрофену, напроксену і целекоксибу. Дослідженнями встановлено, що при однаковій ефективності анальгетичної, жарознижувальної і протизапальної дії пероральна форма диклофенаку калію діє так само швидко, як і внутрішньом’язова ін’єкція диклофенаку натрію [2, 7, 10, 13, 17, 19].
Основними побічними ефектами неселективних НПЗП, у тому числі й диклофенаку, є ульцерогенна дія (переважно НПЗП-гастропатії, стоматит, нудота, блювання, гастралгія, діарея), астматична тріада, фотосенсибілізація, інтерстиціальний нефрит, кропивниця. Для запобігання НПЗП-гастропатії необхідно використовувати препарати «прикриття» з групи інгібіторів протонної помпи, Н2-блокаторів.
Кардіоваскулярні побічні ефекти НПЗП найбільш притаманні пацієнтам літнього віку та хворим, які страждають від супутніх захворювань (ішемічна хвороба серця, цукровий діабет). Як вважають, чим вище селективність НПЗП, тим більше вірогідний розвиток кардіоваскулярних і церебральних ускладнень. Результати аналізу 15 659 випадків інсультів у хворих, які раніше використовували НПЗП, показали, що відносний ризик ішемічного інсульту для рофекоксибу й індометацину становив 1,26; піроксикаму — 1,25; напроксену — 1,24; ібупрофену — 1,19; диклофенаку — 0,98; целекоксибу — 0,97 [13–15].
Однак застосування лише НПЗП не вирішує проблему лікування ОА. Необхідно також уповільнити дегенерацію хряща і сприяти відновленню (поліпшенню) функції суглобів. З цією задачею певною мірою справляються препарати з класу сповільненої дії, що структурно модифікують хрящ, — глюкозамін, хондроїтин, діацереїн, гіалуронова кислота та неомилені сполуки авокадо і сої [7, 8, 11, 12, 20, 21, 25, 27, 33, 34, 39, 40]. Одним із представників комбінованих препаратів, що містять глюкозамін сульфат, хондроїтин сульфат та диклофенак калію, є препарат Протекон фаст виробництва Organosyn Life Sciences.
Отже, використання препаратів комплексної дії, куди входить нестероїдний протизапальний препарат, при лікуванні ОА є ефективним та патогенетично обґрунтованим.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Бадокин В.В. Мультифакторность механизмов действия нестероидных противовоспалительных препаратов при остеоартрозе / В.В. Бадокин // Совpeменная ревматология. — 2009. — № 4. — С. 81-87.
2. Буров Н.Е. Нестероидные противовоспалительные препараты в анестезиологии и реаниматологии / Н.Е. Буров // Рус. мед. журнал. — 2007. — Т. 15, № 29. — С. 2206-2210.
3. Головач И.Ю. Стратегические решения в отношении безопасности и возможности длительной терапии нестероидными противовоспалительными препаратами при остеоартрите / И.Ю. Головач // Травма. — 2017. — Т. 18, № 4. — С. 27-34.
4. Головач И.Ю. Остеоартрит: фундаментальные и прикладные аспекты этиопатогенеза заболевания. Ничего не стоит на месте / И.Ю. Головач // Український ревматологічний журнал. — 2013. — № 2. — С. 4-11.
5. Давыдов О.С. Периферические и центральные механизмы перехода острой боли в хроническую и возможная роль ингибирования циклооксигеназы 2 в предотвращении хронизации болевого синдрома / О.С. Давыдов // Неврология, нейропсихиатрия, психосоматика. — 2016. — 8(2). — С. 10-16.
6. Денисов Л.Н. Место диклофенака калия в терапии болевых синдромов / Денисов Л.Н. // Русский медицинский журнал. — 2009. — № 21. — С. 13-34.
7. Деримедвідь Л.В. Роль препаратів, що впливають на метаболізм хряща, при комплексній терапії остеоартриту / Л.В. Деримедвідь // Семейная медицина. — 2016. — № 2(64). — С. 39-42.
8. Зупанец И.А. Феномен синергизма в современных хондропротекторах / И.А. Зупанец // Здоров’я України. — 2009. — № 6, 7. — С. 1-2.
9. Зупанец И.А., Андреева Е.А. К характеристике гастротоксического действия нестероидных противовоспалительных средств — неселективных, селективных и специфических ингибиторов ЦОГ-2 (экспериментальное исследование) / И.А. Зупанец, Е.А. Андреева // Сучасна гастроентерологія. — 2005. — № 2. — С. 39-43.
10. Козачок Н.Н., Селюк М.Н. Лидер ХХI века в лечении болевого синдрома / Н.Н. Козачок, М.Н. Селюк // Український медичний часопис. — 2010. — № 3(77). — С. 55-58.
11. Клиническая эффективность медленнодействующих препаратов у больных с деформирующим остеоартрозом / А.Н. Беловол, член-корреспондент АМН Украины, д.м.н., профессор, И.И. Князькова, д.м.н., Харьковский национальный медицинский университет, 27.03.2015.
12. Многоцентровое слепое рандомизированное плацебо-контролируемое исследование симптом- и структурно-модифицирующего действия препарата алфлутоп у больных остеоартрозом коленных суставов / Алексеева Л.И., Шарапова Е.П., Таскина Е.А.; Оценка симптом-модифицирующего действия препарата / Е.П. Шарапова, Е.А. Таскина // Научно-практическая ревматология. — 2013. — 51(5). — С. 532-538.
13. Насонов Е.Л. Ревматология: Клинические рекомендации / Под ред. акад. РАМН Е.Л. Насонова. — М.: ГЭОТАР-Медиа, 2011. — 752 с.
14. Нестероидные противовоспалительные препараты в практике врача: международный опыт // Здоров’я України. — 2012 (листопад). — С. 10.
15. Ревматология: национальное руководство / Под ред. Е.Л. Насонова, В.А. Насоновой. — М.: ГЭОТАР-Медиа, 2011. — 720 с.
16. Ревматические заболевания: В 3 т. Т. II. Заболевания костей и суставов: Глава 6. Остеоартроз / Под ред. Д.Х. Клиппела, Д.Х. Стоуна, Л.Дж. Кроуфорда, П.Х. Уайта; Пер. с англ. под ред. Е.Л. Насонова, В.А. Насоновой, Ю.А. Олюнина. — М.: ГЭОТАР-Медиа, 2012. — С. 201.
17. Ядловський О.Є. Роль ванілоїдного компонента в антиноцицептивній дії диклофенаку / О.Є. Ядловський // Фармакологія та лікарська токсикологія. — 2012. — № 1. — С. 60-64.
18. Azendt-Nilsen L., Hoeck H.C. Peripheral and Central Sensitisation in Osteoarthritis — Implication for Treatment // Eur. Musculoskeletal Review. — 2011. — 6(3). — Р. 158-161.
19. Bannuru R.R., Dasi U.R., McAlindon T.E. Reassessing the role of acetaminophen in osteoarthritis: systematic review and meta-analysis // Osteoarthritis Cartilage. — 2010. — 18(Suppl. 2). — S250.
20. Bannuru R.R., Natov N.S., Dasi U.R., Schmid C.H., McAlindon T.E. Therapeutic trajectory following intra-articular hyaluronic acid injection in knee osteoarthritis — meta-analysis // Osteoarthritis Cartilage. — 2011. — 19. — Р. 611-619.
21. Bijlsma J.W., Berenbaum F., Lafeber F.P. Osteoarthritis: an update with relevance for clinical practice // Lancet. — 2011. — 377. — Р. 2115-26.
22. Coxib and traditional NSAID Trialists’ (CNT) Collaboration / N. Bhala, J. Emberson, A. Merhi, S. Abramson, N. Arber et al. Vascular and upper gastrointestinal effects of non-steroidal anti-inflammatory drugs: meta-analyses of individual participant data from randomised trials // Lancet. — 2013. — 382. — Р. 769-779.
23. Fernandes L., Hagen K.B., Bijlsma J.W., Andreassen O., Christensen P., Conaghan P.G. et al. EULAR recommendations for the non-pharmacological core management of hip and knee osteoarthritis // Ann. Rheum. Dis. — 2013. — 72. — Р. 1125-35.
24. Fransen М., Agaliotis М., Nairn L., Votrubec М., Bridgett L., Su S. et al. Glucosamine and chondroitin for knee osteoarthritis: a double-blind randomised placebo-controlled clinical trial evaluating single and combination regimens // Ann. Rheum. Dis. — 2013.
25. Groves T. Effects of glucosamine, chondroitin, or placebo in patients with osteoarthritis of hip or knee: network meta-analysis. Report from post publication review meeting // Br. Med. J. — 2011.
26. Jones A., Silva P.G., Silva A.C., Colucci M., Tuffanin A., Jardim J.R. et al. Impact of cane use on pain, function, general health and energy expenditure duringgait in patients with knee osteoarthritis: a randomised controlled trial // Ann. Rheum. Dis. — 2012. — 71. — Р. 172-9.
27. Hiligsmann M., Cooper C., Arden N., Boers M., Branco J.C., Luisa Brandi M. et al. Health economics in the field of osteoarthritis: an expert’s consensus paper from the European Society for Clinical and Economic Aspects of Osteoporosisnd Osteoarthritis (ESCEO) // Semin Arthritis Rheum. — 2013. — 43. — Р. 303-13.
28. Hochberg M.C., Altman R.D., April K.T. et al. American College of Rheumatology 2012 recommendations for the use of nonpharmacologic and pharmacologic therapies in osteoarthritis of the hand, hip, and knee // Arthritis Care Res. — 2012. — 64(4). — Р. 455-474.
29. Hochberg M.C. Structure-modifying effects of chondroitin sulphate in knee osteoarthritis an updated meta-analysis of randomized placebo-controlled triаls of 2-year duration // Osteoarthritis Cartilage. — 2010. — S1. — ISSN 1063-4584.
30. Kang J.W., Lee M.S., Posadzki P., Ernst E. T’ai chi for the treatment of osteoarthritis: a systematic review and meta-analysis // BMJ Open. — 2011. — 1. — e000035 [PubMed PMID: 22021734. Pubmed Central PMCID: PMC3191392. Epub 2011/10/25].
31. Loeser R.F., Goldrina S.R., Scanzello C.R. et al. Osteoarthritis: A Disease of the Joint as an Organ // Arthritis Rheum. — 2012. — 64(6). — Р. 1697-1707.
32. McAlindon T.E., Bannuru R.R., Sullivan M.C. et al. OARSI guidelines for the non-surgical management of knee osteoarthritis // Osteoarthritis and Cartilage. — 2013. — 22(3). — Р. 363-388.
33. Malfait A.M. Osteoarthritis year in review 2015: biology [Text] / A.M. Malfait // Osteoarthritis and Cartilage. — 2016. — Vol. 24, Issue 1. — P. 21-26. — doi: 10.1016/j.joca.2015.09.010.
34. Martel-Pelletier J., Roubille C., Abram F., Hochberg M.C., Dorais M., Delorme P. et al. First-line analysis of the effects of treatment on progression of structural changes in knee osteoarthritis over 24 months: data from the osteoarthritis initiative progression cohort // Ann. Rheum. Dis. — 2013.
35. National Clinical Guideline Centre. Osteoarthritis: The care and management of osteoarthritis in adults // Clinical. guideline CG177. — 2013.
36. Olsen A.M., Fosbøl E.L., Lindhardsen J., Folke F., Charlot M., Selmer C. et al. Long-term cardiovascular risk of nonsteroidal anti-inflammatory drug use according to time passed after first-time myocardial infarction: a nationwide cohort study // Circulation. — 2012. — 126. — Р. 1955-1963.
37. Parkes M.J., Maricar N., Lunt M., LaValley M.P., Jones R.K., Segal N.A. et al. Lateral wedge insoles as a conservative treatment for pain in patients with medial knee osteoarthritis: a meta-analysis // J. Am. Med. Assoc. — 2013. — 310. — Р. 722-30.
38. The European Medicines Agency. Assessment report for non-steroidal anti-inflammatory drugs (NSAIDs) and cardiovascular risk. EMA/696137/2012. — 2012.
39. Wildi L.M., Raynauld J.P., Martel-Pelletier J., Beaulieu A., Bessette L., Morin F. et al. Chondroitin sulphate reduces both cartilage volume loss and bone marrow lesions in knee osteoarthritis patients starting as early as 6 months after initiation of therapy: a randomised, double-blind, placebo-controlled pilot study using MRI // Ann. Rheum. Dis. — 2011. — 70. — Р. 982-989.
40. Zegels B., Crozes P., Uebelhart D., Bruyère O., Reginster J.Y. Equivalence of a single dose (1200 mg) compared to a three-time a day dose (400 mg) of chondroitin 4&6 sulfate in patients with knee osteoarthritis. Results of a randomized double blind placebo controlled study // Osteoarthritis Cartilage. — 2013. — 21. — Р. 22-27.

/76-1.jpg)
/77-1.jpg)