Журнал «Боль. Суставы. Позвоночник» Том 9, №1, 2019
Вернуться к номеру
Рекомендації зі споживання вітаміну D для здорового населення Польщі й груп ризику дефіциту вітаміну D
Авторы: Agnieszka Rusińska (1), Paweł Płudowski (2), Mieczysław Walczak (3), Maria K. Borszewska-Kornacka (4), Artur Bossowski (5), Danuta Chlebna-Sokół (1), Justyna Czech-Kowalska (6), Anna Dobrzańska (6), Edward Franek (7), Ewa Helwich (8), Teresa Jackowska (9), Maria A. Kalina (10), Jerzy Konstantynowicz (11), Janusz Książyk (12), Andrzej Lewiński (13), Jacek Łukaszkiewicz (14), Ewa Marcinowska-Suchowierska (15), Artur Mazur (16), Izabela Michałus (1), Jarosław Peregud-Pogorzelski (17), Hanna Romanowska (3), Marek Ruchała (18), Piotr Socha (19), Mieczysław Szalecki (20, 21), Mirosław Wielgoś (22), Danuta Zwolińska (23) and Arkadiusz Zygmunt (13)
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
Рекомендації Польської асоціації педіатричної ендокринології й діабету,
Експертної групи за участі національних консультантів та представників
наукових асоціацій: редакція 2018 р.
Вступ
Кальцитріол [1,25-дигідроксихолекальциферол (1,25(OH)2D)] є активною (гормональною) формою вітаміну D. За своєю дією він належить до широкої групи гормональних речовин, транскрипційних факторів генів білків-мішеней. На відміну від інших гормонів, що належать до цієї групи (андрогенів, естрогенів, глюкокортикоїдів, мінералокортикоїдів та прогестерону), синтез кальцитріолу обмежується наявністю/відсутністю його субстрату, 25-гідроксивітаміну D (25(OH)D). 25(OH)D є найбільш поширеним метаболітом вітаміну D. Його концентрація в сироватці крові визначає статус вітаміну D в організмі. Тому вітамін D вважається прогормоном, а назва вживається як на позначення ергокальциферолу (вітамін D2), так і холекальциферолу (вітамін D3), продуктів перетворення ергостеролу й 7-дегідрохолестеролу (7-DHC). Біологічна дія кальцитріолу реалізується за посередництва внутрішньоклітинного, вузькоспецифічного рецептора вітаміну D (VDR), транскрипційного фактора, що модулюється лігандом із родини геномних рецепторів стероїдів, тиреоїдних гормонів і ретиноїдів.
Огляд літератури показує, що дефіцит вітаміну D є проблемою в усіх країнах та групах пацієнтів незалежно від місця їх проживання, віку, статі й расової належності [1–3]. У Польщі дефіцит вітаміну D різного ступеня тяжкості діагностований у 90 % дорослих, дітей та підлітків [4–7]. Дефіцит вітаміну D має як широко відомий кальціємічний ефект, так і більш різноманітний плейотропний. Останній став об’єктом безлічі сучасних досліджень. Таким чином, проблема дефіциту вітаміну D, а також забезпечення його оптимального рівня є актуальною для клінічної практики й загалом системи охорони здоров’я населення. Рекомендації щодо споживання вітаміну D редагують через кожні кілька років, бо результати новітніх досліджень змінюють парадигму наукового сприйняття даної проблеми. Опубліковані в 2016 р. Всесвітні рекомендації щодо профілактики й лікування аліментарного рахіту [8] викликали жваву дискусію через незбіг їх даних із рекомендаціями лікарів Центральної Європи [9] та більш ранніми польськими рекомендаціями [10] й були розкритиковані представниками багатьох спеціальностей, зокрема педіатрами-ендокринологами й діабетологами. Тому у 2017 р. Керівництво Польської асоціації педіатричної ендокринології й діабету запропонувало переглянути існуючі рекомендації щодо профілактики й лікування дефіциту вітаміну D у здорових осіб та груп ризику. Разом із Європейською асоціацією вітаміну D (EVIDAS) та іншими асоціаціями й національними консультативними осередками вони сформували експертну групу зі створення нової редакції рекомендацій щодо споживання вітаміну D, лікування його дефіциту згідно з найновішими даними літератури, клінічним досвідом й ухваленими під час дискусії рішеннями.
Методи
Експертна група за участі національних консультативних осередків і представників медичних асоціацій пропонує вашій увазі нову версію рекомендацій щодо лікування й профілактики дефіциту вітаміну D у здорових осіб та груп ризику, що заснована на найновіших теоретичних даних, підкріплених перевіреними й підтвердженими доказами.
Щодо кожного пункту рекомендацій пропонується свій рівень доказовості, який ми позначили так: 1 — рекомендації з високим рівнем доказовості (обов’язкові до застосування в більшості випадків будь-якими суб’єктами за умови, що користь набагато переважає ризик) та 2 — рекомендації з низьким рівнем доказовості (рішення робочої групи, що піддається змінам; оптимальність залежить від обставин; користь і ризик або приблизно рівні або недоведені). Оцінювалася також і якість доказів: ⊕⊕⊕ — висока якість (проспективна когорта, рандомізоване контрольоване дослідження (РКД) із низьким ризиком похибки); ⊕⊕ — середня якість (обсерваційні або клінічні дослідження, в яких наявні методологічні недоліки, непослідовність, недостатня доказовість); ⊕ — низька якість (опис клінічних випадків або їх серії, несистематизований клінічний підхід). Експертна група запевняє, що споживання вітаміну D, а також лікування його дефіциту не шкодять, а тільки покращують стан здоров’я, коли відбуваються згідно з рекомендаціями, що мають високий рівень доказовості. Рекомендації з низьким рівнем доказовості вимагають перегляду в кожному конкретному випадку застосування, проте загалом також не шкодять, а лише приносять користь.
Рекомендації: редакція 2018 р.
Загальні рекомендації
1. Профілактичні дози вітаміну D для здорового населення повинні підбиратися індивідуально з огляду на вік, масу тіла, інсоляцію (сезон, пори року), перебування на сонці, харчові звички, спосіб життя (1⊕⊕).
2. Профілактичні дози вітаміну D для груп ризику щодо його дефіциту (табл. 1) підбираються так само, як і для здорового населення; якщо немає спеціальних вказівок, максимально припустимою вважається найвища доза вітаміну D у відповідній віковій групі здорового населення (2⊕⊕).
3. Якщо результати лабораторних аналізів показують дефіцит, підбирати дозу вітаміну D необхідно з огляду на концентрацію 25(OH)D у сироватці крові, хронологічний (календарний) вік, а також масу тіла (2⊕⊕).
4. У групах ризику доза вітаміну D за наявного дефіциту, підтвердженого результатами лабораторних аналізів, визначатиметься згідно з концентрацією 25(OH)D у сироватці крові, віком, наявними захворюваннями, лікуванням, а також масою тіла (1⊕⊕).
5. Показання щодо перевірки концентрації 25(OH)D у здорового населення не розроблені, а тому така перевірка не рекомендується (1⊕⊕).
6. У групах ризику перевірка концентрації 25(OH)D задля оцінки статусу вітаміну D не рекомендована (1⊕⊕).
Рекомендації щодо споживання вітаміну D для здорового населення
Новонароджені (доношені) й немовлята
І. 0–6 місяців: 400 МО/добу з перших днів життя, незалежно від виду годування (1⊕⊕⊕).
ІІ. 6–12 місяців: 400–600 МО/добу, залежно від денного споживання вітаміну D з їжею (1⊕⊕⊕).
Діти (1–10 років)
І. Для здорових дітей, які перебувають на сонці з непокритими верхніми та нижніми кінцівками щонайменше протягом 15 хв між 10:00 і 15:00 й не користуються сонцезахисним кремом із травня до вересня, додаткове споживання вітаміну D є необов’язковим, хоча бажаним і безпечним (1⊕⊕⊕).
ІІ. Якщо вищенаведені норми інсоляції не виконуються, необхідне додаткове споживання 600–1000 МО/добу, залежно від маси тіла й кількості вітаміну D, що надходить із їжею, протягом усього року (1⊕⊕⊕).
Підлітки (11–18 років)
І. Для здорових підлітків, що перебувають на сонці з непокритими верхніми та нижніми кінцівками щонайменше протягом 15 хв між 10:00 і 15:00 й не користуються сонцезахисним кремом із травня до вересня, додаткове споживання вітаміну D є необов’язковим, хоча бажаним і безпечним (1⊕⊕⊕).
ІІ. Якщо вищенаведені норми інсоляції не виконуються, необхідне додаткове споживання 800–2000 МО/добу, залежно від маси тіла й кількості вітаміну D, що надходить із їжею, протягом усього року (1⊕⊕⊕).
Дорослі (19-65 років)
І. Для здорових дорослих, що перебувають на сонці з непокритими верхніми й нижніми кінцівками щонайменше протягом 15 хв. між 10.00 і 15.00 й не користуються сонцезахисним кремом з травня до вересня, додаткове споживання вітаміну D є необов’язковим, хоча бажаним і безпечним (1⊕⊕⊕).
ІІ. Якщо вищенаведені норми інсоляції не виконуються, необхідне додаткове споживання 800–2000 МО/добу, залежно від маси тіла й кількості вітаміну D, що надходять із їжею, протягом усього року (1⊕⊕⊕).
Особи літнього віку (> 65–75 років) і особи зі смаглявою шкірою
І. Оскільки синтез вітаміну D у шкірі знижений, необхідне додаткове споживання 800–2000 МО/добу, залежно від маси тіла й кількості вітаміну D, що надходить із їжею, протягом усього року (1⊕⊕⊕).
Особи старечого віку (> 75 років)
І. Оскільки синтез вітаміну D у шкірі знижений, існує ризик мальабсорбції й порушеного метаболізму вітаміну D, необхідне додаткове споживання 2000–4000 МО/добу, залежно від маси тіла й кількості вітаміну D, що надходить із їжею, протягом усього року (2⊕⊕⊕).
Вагітні жінки й жінки-годувальниці
І. Жінки, які планують вагітність, повинні споживати вітамін D в обсягах, адекватних тим, що вимагаються для здорового дорослого населення. Бажана також перевірка концентрації 25(OH)D у крові (1⊕⊕⊕).
ІІ. Коли отримане підтвердження вагітності, споживання вітаміну D повинне бути скориговане з урахуванням концентрації 25(OH)D у крові. Оптимальною є концентрація > 30–50 нг/мл (1⊕⊕⊕).
ІІІ. Якщо перевірка концентрації 25(OH)D у крові неможлива, рекомендується споживати 2000 МО вітаміну D на добу протягом вагітності й годування груддю (1⊕⊕⊕).
Недоношені немовлята
Народилися на ≤ 32-му тижні виношування
І. Рекомендується споживання 800 МО вітаміну D на добу з перших днів життя (якщо можливе ентеральне годування), незалежно від виду годування (1⊕⊕⊕).
ІІ. Додаткове споживання вітаміну D рекомендується за умови перевірки концентрації 25(OH)D у крові під час перебування в лікарні (перша перевірка через 4 тижні після додаткового споживання вітаміну D) або амбулаторії (1⊕⊕⊕).
ІІІ. Коли досягнута доза 1000 МО/добу шляхом поєднання доз, що надходять із харчуванням і препаратами, необхідно остерігатися передозування, особливо в новонароджених із масою тіла < 1000 г (1⊕⊕⊕).
Народилися на 33–36-му тижні виношування
І. 400 МО/добу з перших днів життя, незалежно від виду годування (1⊕⊕⊕).
ІІ. Немає потреби в регулярній перевірці концентрації 25(OH)D у крові (1⊕⊕⊕).
ІІІ. Додаткове споживання вітаміну D за умови перевірки концентрації 25(OH)D у крові рекомендується дітям, які належать до груп ризику (парентеральне годування > 2 тижні, лікування кетоконазолом > 2 тижні, антиконвульсантами, холестаз або маса тіла < 1500 г) (2⊕⊕).
Додаткове споживання вітаміну D у вигляді препаратів групами ризику
І. Окрема група ризику включає осіб з ожирінням, які потребують подвійної дози вітаміну D порівняно з особами того самого віку, проте нормальною масою (1⊕⊕⊕); ожиріння в дітей та підлітків діагностується в разі, якщо ІМТ > 90-го перцентилю віку й статі; ожиріння в дорослих і осіб літнього віку діагностується в разі, якщо ІМТ становить 30+ кг/м2.
ІІ. У груп ризику щодо дефіциту вітаміну D (табл. 1) споживання препаратів вітаміну D повин–не здійснюватися за умов перевірки концентрації 25(OH)D у крові. Метою є підтримання оптимальної концентрації > 30–50 нг/мл (2⊕⊕).
ІІІ. Якщо перевірка концентрації 25(OH)D у крові є неможливою, необхідно виходити з показників максимальної дози відповідної вікової групи здорового населення (2⊕⊕).
Додаткове споживання вітаміну D у вигляді препаратів групами ризику підвищеної чутливості до вітаміну D
І. Перш, ніж виписувати пацієнтові препарати вітаміну D, необхідно підтвердити (якщо це можливо) відсутність підвищеної чутливості (виникає внаслідок гіперкальціємії, гіперкальціурії, нефрокальцинозу, нефролітіазу, мутацій генів CYP24A1 та SLC34A1) або анамнезу інших форм підвищеної чутливості до вітаміну D у пацієнта та членів його родини. Ця рекомендація стосується усіх вікових груп, а також осіб із ризиком дефіциту вітаміну D (1⊕⊕⊕).
ІІ. У групі ризику підвищеної чутливості до вітаміну D прийом препаратів повинен відбуватися під наглядом лікаря, причому доза підбирається індивідуально, бажано з урахуванням кальцій-фосфорних змінних (зокрема, кальціємії, кальціурії, паратгормона (PTH), 25(OH)D та 1,25(OH)2D) (1⊕⊕).
Основні принципи призначення додаткового споживання вітаміну D у вигляді препаратів та біодобавок, а також вітамін-D-терапія залежно від концентрації 25(OH)D у крові
І. У Польщі не рекомендують призначати пацієнтам препарати вітаміну D у дозі насичення (2⊕⊕).
ІІ. Доза вітаміну D визначається залежно від концентрації 25(OH)D у крові й попередніх профілактичних заходів (2⊕⊕).
ІІІ. Діагностичні стандарти включають одночасну перевірку 25(OH)D2 і 25(OH)D3 [25(OH)D TOTAL], причому варіативність результатів < 5 % та < 10 % підлягає підтвердженню системою DEQAS (2⊕⊕).
Токсична концентрація > 100 нг/мл (1⊕⊕⊕)
І. При досягненні токсичної концентрації споживання вітаміну D повинне припинитися. Необхідно провести лабораторне дослідження на кальціємію й кальціурію, а потім щомісячно перевіряти концентрацію 25(OH)D, аж доки не буде досягнутий рівень ≤ 50 нг/мл (1⊕⊕⊕).
ІІ. Інтоксикація визначається як стан, за якого концентрація 25(OH)D > 100 нг/мл супроводжується кальціємією, кальціурією й значним пригніченням паратгормона (PTH) (1⊕⊕⊕).
ІІІ. У разі клінічних симптомів інтоксикації необхідно одразу ж розпочинати лікування (1⊕⊕⊕).
IV. Необхідно перевірити й скоригувати процес споживання вітаміну D (регулярність, дозу, препарат або шлях потрапляння в організм) (2⊕⊕).
V. Існує ймовірність поновленого споживання вітаміну D у дозах, рекомендованих здоровим представникам відповідної вікової групи, якщо буде досягнута нормокальціємія, нормокальціурія та концентрація 25(OH)D ≤ 50 нг/мл, а також підтверджена відсутність підвищеної чутливості до вітаміну D (2⊕⊕).
Висока концентрація > 50–100 нг/мл (1⊕⊕⊕)
І. Необхідно перевірити й скоригувати процес споживання вітаміну D (регулярність, дозу, препарат або шлях потрапляння в організм) (2⊕⊕).
Концентрація > 75–100 нг/мл (2⊕⊕)
І. Необхідно призупинити споживання вітаміну D на 1–2 місяці (2⊕⊕).
ІІ. У новонароджених, немовлят та маленьких дітей необхідно провести лабораторне дослідження на кальціємію й кальціурію, підтвердити відсутність підвищеної чутливості до вітаміну D, а також перевірити концентрацію 25(OH)D (2⊕⊕).
ІІІ. Існує ймовірність поновленого споживання вітаміну D у мінімальних дозах, рекомендованих здоровим представникам відповідної вікової групи, через 1–2 місяці або, як у випадку новонароджених, немовлят та маленьких дітей, по досягненні концентрації 25(OH)D ≤ 50 нг/мл (2⊕⊕).
Концентрація > 50–75 нг/мл (2⊕⊕)
І. Якщо споживання вітаміну D відбувається згідно до рекомендацій, необхідно зменшити дозу на 50 % і запропонувати пацієнтові повторну перевірку концентрації 25(OH)D через 3 місяці (2⊕⊕).
ІІ. Якщо доза вітаміну D перевищувала рекомендовану, споживання необхідно припинити на 1 місяць, а потім відновити дози вітаміну D, виписувані здоровим представникам відповідної вікової групи (2⊕⊕).
Оптимальна концентрація > 30–50 нг/мл (1⊕⊕⊕)
І. Продовжувати згідно з обраною стратегією (1⊕⊕⊕).
Субоптимальна концентрація > 20–30 нг/мл (1⊕⊕⊕)
І. Необхідно перевірити й скоригувати процес споживання вітаміну D (регулярність, дозу, препарат або шлях потрапляння в організм) (2⊕⊕).
ІІ. Якщо споживання вітаміну D відбувається згідно до рекомендацій, необхідно збільшити дозу на 50 % і запропонувати пацієнтові повторну перевірку концентрації 25(OH)D через 6 місяців (2⊕⊕).
ІІІ. Якщо пацієнт досі не отримував додатковий вітамін D, необхідно розпочати його споживання в дозах, що відповідають рекомендованим для відповідної вікової групи здорових суб’єктів (2⊕⊕).
Дефіцит > 10–20 нг/мл (1⊕⊕⊕)
І. Необхідно перевірити й скоригувати процес споживання вітаміну D (регулярність, дозу, препарат або шлях потрапляння в організм) (2⊕⊕).
ІІ. Якщо споживання вітаміну D відбувається згідно до рекомендацій, необхідно збільшити дозу на 100 % і запропонувати пацієнтові повторну перевірку концентрації 25(OH)D через 3 місяці (2⊕⊕).
ІІІ. Якщо пацієнт досі не отримував додатковий вітамін D, необхідно розпочати його споживання в дозах, що відповідають максимально рекомендованим для відповідної вікової групи здорових осіб, й перевірити концентрацію 25(OH)D через 3 місяці (2⊕⊕).
IV. У пацієнтів, які мають порушення скелетно-м’язового апарату (деформації кісток, біль у кістках, анамнез остеопоротичних переломів), рекомендується перевірити кальцій-фосфорний метаболізм [Ca, PO4, активність лужної фосфатази (ALPL), PTH, співвідношення Ca/креатинин у сечі], а також, якщо це можливо, мінеральну щільність кісток за допомогою двофотонної рентгенабсорбціометрії (DXA) (2⊕⊕).
Значний дефіцит 0–10 нг/мл (1⊕⊕⊕)
І. Необхідно перевірити й скоригувати процес споживання вітаміну D (регулярність, дозу, препарат або шлях потрапляння в організм) (2⊕⊕).
ІІ. Призначити терапевтичні дози вітаміну D з огляду на вік й масу тіла; провести повторну перевірку концентрації 25(OH)D через 1–3 місяці (2⊕⊕).
А. Від народження до року: 2000 МО/добу (1⊕⊕⊕).
Б. 1–10 років: 3000–6000 МО/добу (1⊕⊕⊕).
В. > 10 років: 6000 МО/добу (1⊕⊕⊕).
ІІІ. Лікування значного дефіциту вітаміну D повинне тривати 3 місяці або до того часу, як буде досягнута концентрація 25(OH)D > 30–50 нг/мл. Після цього рекомендується продовжити прийом підтримуючих доз вітаміну D, тобто профілактичних доз для здорового населення з огляду на вік й масу тіла (1⊕⊕⊕).
IV. У пацієнтів, які мають порушення скелетно-м’язового апарату (деформації кісток, біль у кістках, анамнез остеопоротичних переломів), рекомендується перевірити кальцій-фосфатний метаболізм [Ca, PO4, активність лужної фосфатази (ALPL), PTH, співвідношення Ca/креатинин у сечі], а також, якщо це можливо, мінеральну щільність кісток за допомогою двофотонної рентген-абсорбціометрії (DXA) (2⊕⊕).
Основні принципи споживання кальцію під час прийому вітаміну D у вигляді препаратів та біодобавок
І. Під час прийому вітаміну D у вигляді препаратів та біодобавок необхідно забезпечити адекватне надходження кальцію з продуктами харчування (табл. 2) (2⊕⊕).
ІІ. Якщо отримати достатню дозу кальцію з харчуванням не вдається, необхідно приймати біодобавку із солями кальцію, бажано кількома окремими дозами разом із їжею (2⊕⊕).
Доказова база нової редакції польських рекомендацій
Джерела вітаміну D
Синтез вітаміну D у шкірі
Більшість вітаміну D синтезується в шкірі, а саме в кератиноцитах епідермального зародкового шару, з 7-DHC під впливом сонячної радіації з хвилями довжиною 280–315 мм (ультрафіолетові промені типу B (UVB)). Під впливом отриманої сонячної енергії 7-DHC перетворюється на провітамін D3, а потім шляхом термоконверсії — на вітамін D3. Останній проникає в кров і вступає в реакцію з вітамін-D-зв’язуючим білком (DBP). Підраховано, що синтез вітаміну в шкірі забезпечує 80–100 % добових потреб організму. У Польщі синтез вітаміну D є ефективним лише навесні й улітку (з травня до вересня) з 10:00 до 15:00, тобто в таку пору року й такий час, коли сонячні промені падають під оптимальним кутом, температура дозволяє приймати сонячні ванни, а небо не затягнуте хмарами [12, 13]. Якщо за подібних умов мінімум 18 % тіла (а саме верхні й нижні кінцівки) залишати відкритими приблизно на 15 хвилин, внаслідок природного синтезу людина отримає 2000–4000 МО/добу [12–14]. Це половина мінімальної еритемної дози (MED; 1 MED викликає легке порожевіння шкіри). Відповідно, оголення майже 100 % людського тіла в дорослого суб’єкта призведе до отримання 10 000 МО/добу. Досі не було опубліковано досліджень, що доводили б ризик токсичних доз вітаміну D внаслідок надмірного перебування на сонці (принаймні в здорових суб’єктів). Надлишок вітаміну D і провітаміну D (безпосереднього попередника, що виробляється шляхом біосинтезу холестеролу), ймовірно, фоторозкладається (ізомерує) до неактивних метаболітів — тахистеролів, люмістеролів, супрастеролів і 5,6-транс-вітаміну D3. У період із жовтня до березня у місцевостях, що розміщені вище 35° північної широти (серед них і Польща: 49°N–54°N), синтез вітаміну D у шкірі вважається неефективним [12–15].
Властиві певній місцевості характеристики, такі як хмарність, забруднення повітря, інтенсивна пігментація шкіри корінного населення, переважання серед її жителів осіб літнього віку, популярність сонцезахисної косметики з фактором захисту вище 15, перешкоджають оптимальному споживанню вітаміну D. Так само вони можуть повністю блокувати його синтез, навіть у випадку достатнього перебування на сонці у весняний і літній час. Серед населення присутні суб’єкти, які уникають виконання рекомендацій або мають протипоказання до перебування на сонці. Діти й підлітки багато часу проводять у приміщенні, а не на дворі, те саме можна сказати й про працююче доросле населення. Новонародженим, немовлятам та маленьким дітям перебування на сонці без сонцезахисних засобів заборонене (http://pediatrics.aappublications.org/content/pediatrics/early/2011/02/28/peds.2010-3501.full.pdf). Серед інших причин уникання сонця можна назвати хронічні хвороби, що тримають людину прикутою до ліжка, онкофобію й страх передчасного старіння шкіри [6, 14, 15].
Харчування
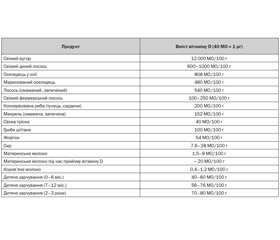
Харчові продукти є альтернативним джерелом вітаміну D, однак у природніх умовах, принаймні Польщі, це джерело є значно менш ефективним, аніж синтез вітаміну D у шкірі. Підраховано, що збалансована дієта компенсує до 20 % добової потреби у вітаміні D. Вітамін D наявний у харчових продуктах у двох формах: в продуктах тваринного походження у вигляді домінантної форми — холекальциферолу (або вітаміну D3), а в продуктах рослинного походження й грибах — ергохолекальциферолу (або вітаміну D2). Природним джерелом вітаміну D в основному вважається риба (вугор, дикий лосось, оселедець), меншою мірою — жовток, сир, молоко та деякі гриби (табл. 3). Дослідження аліментарних звичок і харчових продуктів різних груп населення показали, що за умови дефіциту вітаміну D, отриманого шляхом синтезу в шкірі, аліментарний вітамін D навіть у межах збалансованої й різноманітної дієти не компенсує дефіцит. У такому разі рекомендують доповнювати харчування прийомом біодобавок [3, 5, 16].
Задля профілактики дефіциту вітаміну D на рівні населення країни в деяких державах регулятивними актами обумовлене збагачення харчових продуктів (молоко, молочні продукти, сухі сніданки, помаранчевий сік, маргарин, паста) [17]. Ступінь збагачення відрізнятиметься на рівні регіонів, залежно від регулятивної політики й системи охорони здоров’я. Тим часом як на рівні світу, так і в ме–жах Польщі практика збагачення харчових продуктів достатньою мірою не прижилася, в результаті чого дефіцит вітаміну D набув характеру пандемії [1–3]. Виключенням є лише дитяче харчування, що стандартно збагачується вітаміном D (табл. 3). 1 літр молочного дитячого харчування компенсує добову потребу у вітаміні D, принаймні в межах програми профілактики дефіциту вітаміну D й аліментарного рахіту. Необхідно зазначити, що додаткове споживання біодобавок з вітаміном D є обов’язковим під час годування груддю. Вміст вітаміну D у материнському молоці невеликий (приблизно 40 МО/л), він постійно коливається. Для зростаючого організму його недостатньо, навіть якщо мати споживає вітамін D згідно з рекомендованою нормою [18, 19].
Фармакологічні препарати вітаміну D
Холекальциферол (або вітамін D3) є найбільш поширеною формою біодобавки й препарату для лікування дефіциту вітаміну D у Польщі та інших європейських країнах. Тим часом у США найчастіше застосовують ергохолекальциферол (або вітамін D2). У Польщі вітамін D3 відпускається без рецепта в дозах 400, 500, 800, 1000, 2000, 4000 МО/добу. Вітамін D3 також входить до складу мультивітамінних комплексів, кальцієвих біодобавок, риб’ячого жиру (печінка тріски) та, рідше, застосовується для збагачення харчових продуктів. Застосування його в комбінації з кальцієм або вітаміном К2 (MK7) останнім часом не рекомендується. Доведена ефективність одночасного прийому вітамінів К2 і D задля профілактики кальцифікації судин й м’яких тканин та оптимізації кісткової мінералізації. Вітамін D не можна споживати разом із зерновими, багатими клітковиною (овес, висівки), смолами, що зв’язують стероїди (холестирамін), проносними та пом’якшуючими випорожнення засобами.
Кальцифедіол (25(OH)D3) — це комплексний препарат для оптимізації споживання вітаміну D, проте його виписують переважно пацієнтам із порушеннями печінкового метаболізму вітаміну D, хронічними хворобами печінки, холестазом або пацієнтам, що довгий час приймають глюкокортикоїди й антиконвульсанти [9].
Активні метаболіти й аналоги вітаміну D, такі як альфакальцидол (1aOHD3), кальцитріол [1a,25(OH)2D3] й парикальцитріол [19nor1a25(OH)2D2], не повинні вживатися як альтернативи біодобавок вітаміну D. Відповідно, конт–роль дії активних метаболітів і аналогів, заснований на проспективному принципі регулярної перевірки концентрації 25(OH)D, має обмежену ефективність. Альфакальцидол найчастіше рекомендують у випадках порушення ниркового метаболізму вітаміну D, пригніченої активності 1a-гідроксилази внаслідок ниркової недостатності, нефротичного синдрому, хронічного захворювання нирок, гіпофосфатемного рахіту та інших форм вітамін-D-резистентного рахіту, а також гіпопаратиреозу. Кальцитріол застосовується в аналогічних випадках, хоч і рідше (в Польщі він майже недоступний). Парикальцитріол — це новостворений аналог вітаміну D, що застосовується для профілактики й лікування вторинного гіперпаратиреозу, що розвинувся внаслідок хронічної ниркової недостатності [20–22]. Необхідно ще раз підкреслити, що прийом аналогів й активних метаболітів вітаміну D не призводить до очікуваної зміни концентрації 25(OH)D й не може вважатися альтернативною опцією вітаміну D (а в деяких випадках і кальцифедіолу). Разом із ними необхідно застосовувати вітамін D, хоча б із плейотропною метою.
Метаболізм вітаміну D
Холекальциферол, що виробляється в шкірі, й холекальциферол (а також ергохолекальциферол), що абсорбується тонким кишечником із продуктів харчування й фармакологічних препаратів, потрапляють у печінку, де й приєднується до вітамін-D-зв’язуючого білка. Таким чином, у печінці розпочинається перший етап біосинтезу активного вітаміну D. Після цього під час ензимної гідроксилації вуглецю-25 утворюється 25-гідроксивітамін D — 25(OH)D. Каталізатором при цьому виступає 25-гідроксилаза, група гідроксилаз, що є частиною цито–хрому P450 (CYP27A1, CYP3A4 і CYP2R1) [23, 24]. Концентрація 25(OH)D у сироватці крові є найкращим індикатором статусу вітаміну D, переважним чином через більшу стабільність і довший напіврозпад 25(OH)D (2–3 тижні), так само як і досить значну концентрацію (що вимірюється в нг/мл або нмоль/л) порівняно з 1,25(OH)2D, що регулюється численними змінними й має набагато нижчу концентрацію (що вимірюється в пг/мл або пмоль/л).
25(OH)D, приєднавшись до вітамін-D-зв’язуючого білка, переноситься з печінки до нирок (а також інших тканини, органів і клітин), де активна форма вітаміну D, 1a25(OH)2D, утворюється завдяки наступному важливому ферменту — 1a-гідроксилазі (CYP27B1). Активність 1a-гідроксилази (CYP27B1) регулюється багатьма змінними, включаючи концентрацію кальцію, PTH, фактор росту фібробластів 23 (FGF-23) й Клото, а також самою 1a25(OH)2D шляхом негативної петлі зворотнього зв’язку [24, 25]. Обидві активні форми [1a,25(OH)2D2 й 1a,25(OH)2D3] позначені аналогічними властивостями. Через природні характеристики й доступність фармацевтичних препаратів на його основі в Польщі представлений лише холекальциферол (або вітамін D3). Таким чином, вимірюється в основному один циркулюючий активний метаболіт — 1a,25-дигідроксихолекальциферол або кальцитріол.
Концентрації 25(OH)D і 1,25(OH)2D чітко регулюються ферментативним розщепленням під час реакції 24-гідроксилази (CYP24A1), що виступає каталізатором гідроксилації кальцидіолу й кальцитріолу до метаболітів низької біологічної активності й у результаті перетворюється на 24,25(OH)2D й кальцитріонну кислоту відповідно. Кальцитріол індукує експресію 24-гідроксилази, що наявна практично в усіх клітинах-мішенях вітаміну D. Це система оберненого регулювання концентрації активних метаболітів, що запобігає гіпервітамінозу [25]. Вищеописаний метаболічний ланцюжок може бути порушеним внаслідок хибного катаболізму 25(OH)D і 1,25(OH)2D (мутацій гена CYP24A1, що кодує 24-гідроксилазу) [25] або надлишкового синтезу 1,25(OH)2D, викликаного мутацією гена SLC34A1, який кодує натрієво-фосфорний співтранспортер (NaPi-IIA) у нирках [26]. В обох випадках ризик гіпервітамінозу підвищується, навіть якщо вітамін D споживається в профілактичних дозах.
Кальціємічний ефект вітаміну D
Так само, як і PTH, кальцитонін, вітамін D відомий в основному своєю роллю регулювальника гомеостазу кальцію й фосфору. Основні ефекторні органи, задіяні в регулюванні гомеостазу кальцію й фосфору за допомогою вітаміну D, — це кишечник, кістки й нирки. В кишечнику під впливом 1,25(OH)2D відбувається синтез білку, що зв’язує кальцій, інтенсифікується абсорбція кальцію, в кістках вивільнюються кальцій і фосфати (у разі гіпокальціємії), а в нирках відбувається реабсорбція кальцію під впливом PTH. Основною прокальціємічною дією кальцитріолу є пригнічення секреції PTH під час реакції оберненого зв’язку, що призводить до збільшення вмісту кальцію й фосфатів у сироватці крові [27].
Вплив вітаміну D на кістковий метаболізм відбувається за посередництва рецептора-активатора ядерного фактора NF-kB (RANK)/RANK ліганд (RANKL), що викликає остеокластогенез. Кальцитріол збільшує експресію RANKL в остеобластах, що, зі свого боку, активує RANK рецептори в попередниках остеокластів і призводить до формування зрілих остеобластів. Резорбційна дія остеобластів вивільнює кальцій і фосфати зі скелета в кров [28].
Регулюючи кальцій-фосфорний метаболізм, вітамін D відіграє визначальну роль в основному в тих тканинах й органах, де ці мінерали переважають (скелетна система, зуби). Дефіцит вітаміну D у дитячому віці є класичним ризик-фактором виникнення аліментарного рахіту, хвороби, яка викликає кісткові деформації різного ступеня тяжкості, порушення мінералізації й зниження кісткової маси. В дорослих і підлітків після закриття зони росту дефіцит вітаміну D може призвести до остеомаляції та остеопорозу. В усіх вікових групах значний дефіцит викликає болі в кістках різного ступеня інтенсивності й різної локалізації (в основному це нижні кінцівки чи ступні) та підсилює схильність до переломів. Розвинений аліментарний рахіт і остеомаляція можуть загрожувати життю пацієнтів, оскільки викликають не тільки деформації кісток, а й гіпокальціємічні судоми [29, 30], правець [31, 32], сильні болі в кістках і слабкість м’язів [33, 34], гіпокальціємічну кардіоміопатію й потенційне порушення кровообігу [35–38], а також порушення психомоторного й фізичного розвитку [39], зокрема й низький зріст [4, 40].
У разі дефіциту вітаміну D вступає в дію триступінчатий регуляторний механізм. На першому етапі відбувається компенсаторне збільшення секреції PTH, аби підтримати нормокальціємію. Поза тим PTH схильний до саморегуляції, в організмі розвивається відносна резистентність до нього, внаслідок чого знижується концентрація кальцію й збільшується — фосфату (так само, як у разі резистентності до PTH за псевдогіпопаратиреозу). На цій стадії виникають типові симптоми гіпокальціємії, такі як правець і судоми. Остеопенія стає помітною на радіографі, хоч рахітні пошкодження ще відсутні. На наступній стадії, коли дефіцит продовжує посилюватися, а секреція PTH інтенсифікується, резистентність до PTH долається шляхом оптимізації кальціємії, а також гіпофосфатемією, клінічними та рентгенологічними появами рахіту. Рівень лужної фосфатази знижується, а концентрація 1,25(OH)2D залишається нормальною або підвищеною. На останній стадії, коли дефіцит вже дуже значний, а синтез 1,25(OH)2D помітно пригнічений, концентрація кальцитріолу знижується, абсорбція кальцію й фосфору поступово погіршується, а PTH разом із лужною фосфатазою продовжує прогресивно зростати [18].
Вищеописаний механізм доводить, що, зважаючи на тяжкість дефіциту, біохімічні аналізи можуть показувати різні результати. Таким чином, ізольоване вимірювання концентрації 1,25(OH)2D може дати хибний результат. При помірному дефіциті, а також під час лікування кальцитріол то збільшується, то перебуває в межах норми, а при передозуванні вітаміну D він може залишатися як нормальним, так і зменшуватися [41, 42]. Ці коливання мало що дають для клінічної картини, адже метаболіт є нестабільним і піддається численним впливам, зокрема гормонів.
Плейотропна дія вітаміну D
Молекулярні дослідження дозволили виявити вітамін-D-зв’язуючий білок у багатьох тканинах, які не беруть безпосередню участь у кальцій-фосфорному метаболізмі. Таким чином, розпочалася ера вивчення некласичних, позаскелетних функцій вітаміну D [43–46]. 1,25(OH)2D потрапляє до сироватки крові з нирок, запускаючи кілька ендокринних процесів. Ферментативна діяльність позаниркової 1-альфа-гідроксилази, зокрема, спрямована на перетворення 25(OH)D на 1,25(OH)2D в органах, тканинах та клітинах, уможливлює важливі локальні автокринні й паракринні дії «позаниркового» кальцитріолу. Позанирковий метаболізм вітаміну D (анаболізм і катаболізм) регулюється незалежно від PTH та фактора росту фібробластів 23 (FGF-23). Необхідно підкреслити, що експресія вітамін-D-зв’язуючого білка й позаниркової 1-альфа-гідроксилази в майже всіх тканинах людського тіла доводить важливість вітаміну D для загального стану здоров’я.
Діяльність вітаміну в ефекторних клітинах передбачає як геномні, так і позагеномні впливи. Активна форма приєднується до вітамін-D-зв’язуючого білка в ядрі клітин, утворюючи гетеродимер із рецептором 9-цисретиноєвої кислоти (RXR). Даний комплекс виявляє ознаки транскрипційного фактора, розпочинаючи геномну дію. Вважається, що таким чином кальцитріол регулює кілька сотень генів людського генома [47, 48]. Позагеномна дія передбачає активацію рецептора клітинної мембрани, що відрізняється від рецептора ядра й запускає внутрішньоклітинний метаболізм, модулюючи наслідки експресії гена [49, 50]. Швидка позагеномна реакція на кальцитріол уможливлює регулювання іонних каналів, фосфатази, фосфоліпази, кіназних сигнальних факторів, здатних регулювати генну експресію та її наслідки самотужки [49–52].
Результати досліджень свідчать про те, що кальци–тріол бере участь у численних фізіологічних процесах, активує проліферацію й диференціацію імунних клітин [52, 53]. Він також індукує апоптоз неопластичних клітин, пригнічуючи їх поділ [52, 53], посилює виділення кателіцидіну й бетадефенсину [51, 54–56], модулює діяльність лімфоцитів [51], співвідношення лімфоцитів Th-1 і -2 [51, 57], зменшує концентрацію прозапальних цитокінів (IL-1, TNF-a), одночасно збільшуючи кількість протизапальних цитокінів (IL-4, -5 і -10) [51, 58], зменшує секрецію реніну, таким чином послаблюючи ренін-ангіотензин-альдостеронову систему [59, 60], пригнічує ангіогенез [61–63] й позитивно впливає на процеси кальцифікації кровоносних судин [64–67], стимулює синтез нейротрофічних факторів [68, 69] і пригнічує фіброз нирок [70, 71]. Дефіцит вітаміну призводить до зменшень секреції інсуліну [72]. Також вітамін D має потужну імуномодулюючу дію [58, 73]. Велика кількість вітамін-D-зв’язуючого білка в клітинах імунокомпетентного зразка, зокрема в макрофагах, дендритах і лімфоцитах T і B, підтверджує гіпотезу про те, що вітамін D є активним чинником протиінфекційного імунітету в разі як гострих і хронічних запальних процесів, так і автоімунних захворювань [45, 46, 58, 73].
Плейотропна дія вітаміну була відзначена багатьма спостереженнями, що свідчить про існуючий зв’язок між низькою концентрацією 25(OH)D і підвищеним ризиком онкологічних (зокрема, раку кишечника, молочних залоз, яєчників, простати, підшлункової залози, шкіри, нирок, мозку, численних різновидів мієломи й лейкемії) [74–78], імунологічних захворювань (розсіяного склерозу [79–82], астми [83, 84], неспецифічного запального захворювання кишечника [85, 86] й системного червоного вовчака [87, 88]), автоімунних ендокринних порушень (діабет І типу [89, 90], хвороба Аддісона [91, 92], хвороба Хашімото [93, 94], Базедова хвороба, хвороба Грейвса [95, 96] й автоімунні поліендокринні синдроми [97]), імунодефіциту й рецидивуючих інфекцій [98] (зокрема, туберкульозу й грипу), компонентів метаболічного синдрому (артеріальної гіпертензії, серцево-судинних хвороб, атеросклерозу, ішемічної хвороби серця, діабету І типу, ожиріння) [99–105], психіатричних порушень (депресія [106], шизофренія [107, 108]), нейродегенеративних хвороб (деменція [109–111], хвороба Альцгеймера [112, 113], порушення когнітивної функції [109, 110, 114]). Дефіцит вітаміну асоціюється з підвищеним ризиком смертності в усіх групах населення [115–117], зокрема в пацієнтів відділень інтенсивної терапії [118–120] й пацієнтів із онкологічними захворюваннями [121]. Оптимізація споживання вітаміну, що виявляється в концентрації 25(OH)D, полегшує інвазивність неопластичного процесу, мікрометастазування й покращує загальний прогноз, обмежуючи ризик рецидивів [122]. Однак рандомізовані контрольовані дослідження (РКД) не показали послідовних результатів, ймовірно, через короткий період подальших спостережень, різні курси й рівні споживання вітаміну [123, 124]. Більшість учених погоджується з тим, що додаткове споживання вітаміну D чинить позитивний вплив на здоров’я людини. Однак однозначних доказів того, що дефіцит спричинює виникнення порушень не існує, а отже, на перший план виходить гіпотеза, продиктована системним метааналізом і РКД, щодо реверсивної каузації [125, 126]. Дослідження, що ведуться сьогодні, вказують на потенційну користь і мінімальний ризик додаткового споживання вітаміну, підтримання оптимальної й безпечної концентрації 25(OH)D, рекомендується проводити профілактику дефіциту в популяціях, які нездатні синтезувати достатньо вітаміну в шкірі.
Безпечність вітаміну D
Концентрація 25(OH)D у межах 100 нг/мл вважається безпечною для здорових дорослих і дітей, хоча у недоношених немовлят (особливої групи) підвищений ризик гіперкальціємії прогнозувався при рівні 25(OH)D > 80 нг/мл [127]. При цьому досі не доведена ймовірність перевищення дози за умови адекватного споживання вітаміну. Симптоми токсичності спостерігаються в реальному житті надзвичайно рідко. До них відносять гіперкальціємію й гіперкальціурію, пов’язані із надмірним і неконт–рольованим споживанням вітаміну D, у результаті чого концентрація 25(OH)D у сироватці крові сягала за 150–200 нг/мл [42, 128]. У виняткових випадках спостерігалися індивідуальна гіперчутливість до вітаміну D, а також ідіопатична дитяча гіперкальціємія (ІДГ) [24, 26], синдром Вільямса [129], гранульоматозні захворювання [130] та деякі різновиди лімфом. Підвищена чутливість до вітаміну D може розвинутися внаслідок порушення метаболізму кальцидіолу й кальцитріолу або надмірного синтезу кальцитріолу, що не врівноважується оберненою реакцією (на місцевому або системному рівні) [24]. Доведений взаємозв’язок між мутацією гена CYP24A1 й автосомною рецесивною ІДГ [25]. Також було показано, що втрата функцій 24-гідроксилази в дорослому віці може бути результатом ранньої мутації CYP24A1 [131, 132]. Гіпервітаміноз виникає також унаслідок надмірного синтезу 1,25(OH)2D, викликаного мутацією гена SLC34A1, що кодує нирковий натрієво-фосфатний співтранспортер –(NaPi-IIA) [26]. Відомо, що ендокринні процеси в нирках, синтез кальцитріолу за участі CYP27B1 та його розпад за участі CYP24A1 також регулюються фактором росту фібробластів 23 (FGF-23). Порушення гомеостазу фосфору внаслідок мутації SLC34A1 призводить до зниження активності –FGF-23; зі свого боку, FGF-23 за фізіологічної норми обмежує активність 1-альфа-гідроксилази (CYP27B1), стимулюючи 24-гідроксилазу (CYP24A1). Зниження активності FGF-23 внаслідок мутації SLC34A1, а також подальша гіперфосфатурія й гіпофосфатемія непрямо стимулюють синтез 1,25(OH)2D, що може призвести до гіперкальціємії, гіперкальціурії та нефрокальцинозу [133]. Якщо ж підвищена чутливість діагностована під час прийому препаратів для лікування дефіциту вітаміну D, бажано підтримувати концентрацію 25(OH)D на нижній межі норми (20–25 нг/мл), аніж на буцімто оптимальному рівні (30–50 нг/мл) [134].
Слід підкреслити, що в представників здорової популяції споживання вітаміну D в дозах, що відповідають рекомендаціям за віком і масою тіла, є розумним і безпечним, тоді як підвищена чутливість зустрічається лише в поодиноких випадках, які необхідно додатково вивчити. До того ж верхня межа норми (ВМ) була запропонована для обмеження неконтрольованого споживання вітаміну. Верхня межа норми — це не те саме, що рекомендована доза для лікування дефіциту. Вона була визнана безпечною усіма міжнародними асоціаціями (серед них Інститути медицини (IOM, США) [135], Ендокринологічна асоціація (США) [136] та Європейська агенція безпеки продуктів харчування (ЄС) [137]). У здоровій популяції новонароджених і немовлят ВМ становить 1000 О/л, дітей віком 1–10 років — 2000 О/л, у підлітків віком 11–18 років та дорослих — 4000 О/л.
Якщо ж спостерігаються симптоми отруєння, викликаного передозуванням, необхідно промити шлунок фізіологічним розчином, після чого вдатися до петльових сечогінних, а також глюкокортикоїдів, бісфосфонатів, кальцитоніну або кетоконазолу як препаратів другої лінії. Дієвими виявляють себе також антиконвульсанти. Антиконвульсанти/антиепілептичні засоби потужно індукують цитохром P450 та його ізоформу CYP3A4. Індукування даного ферменту печінки й кишечника призводить до прискореного розщеплення метаболітів вітаміну D — 25(OH)D та 1,25(OH)2D [138]. Полярні продукти вітаміну D, що формуються внаслідок надмірної гідроксилації, швидко виводяться з організму [138, 139]. Якщо статус вітаміну D нормальний, вище–описані процеси призводять до дефіциту й мінеральних порушень [138–140]. Керуючись даним принципом, здійснили дві успішні спроби виведення надлишкового вітаміну з організму новонароджених (7 та 1,5 місяця), що постраждали від помилкового передозування [128, 141]. В обох випадках, окрім інших препаратів, застосовувалися антиконвульсанти (фенітоїн у дозі 5 мг/кг/добу протягом 17 діб, фенобарбітал у дозі 5 мг/кг/добу протягом 133 діб у першому випадку й фенобарбітал у дозі 3 мг/кг/добу протягом 4 місяців у другому випадку). В обох випадках по закінченню лікування концентрація 25(OH)D знизилася з приблизно 400 до 40 нг/мл та зі 160 нг/мл до норми. Спроби відмінити фенобарбітал (на 14 діб після 44 діб прийому) призвели до повторної інтоксикації [128]. У подальшому в обох випадках показники мінерального метаболізму досягли норми.
Термінологія
Група запропонувала систематизувати терміни й номенклатуру, що застосовується в щоденній медичній практиці польськими лікарями. Згідно з учасниками групи не варто вживати термін «гіповітаміноз D» лише з огляду на концентрацію 25(OH)D у діапазоні показників дефіциту. Було зауважено, що клінічні симптоми можуть (або ні) виникати як за вищих (дефіцит), так і за нижчих (значний дефіцит) показників (< 10–20 і 0–10 нг/мл відповідно). Цей феномен може бути наслідком індивідуальної чутливості до вітаміну та його дефіциту, тривалості дефіциту, статусу мінерального метаболізму, включаючи кальцієвий обмін [8]. Терміни «симптоматичний вітамінодефіцит», «гіповітаміноз D» та «несимптоматичний (субклінічний) дефіцит вітаміну D» повинні вживатися з огляду на наявність/відсутність клінічних, біохімічних і/або радіологічних даних. Їх не можна обмежувати наявним статусом (концентрацією 25(OH)D), хоч клінічні симптоми спостерігаються й розвиваються разом із його погіршенням (зменшенням концентрації). Таким чином, відкритою клінічною формою «симптоматичного вітамінодефіциту» або «гіповітамінозу D» вважається стан, при якому клінічні симптоми супроводжуються зниженням концентрації 25(OH)D. «Симптоматичний гіпервітаміноз D» або «отруєння вітаміном D» визначаються за умови дуже високої концентрації 25(OH)D (зазвичай > 150 нг/мл), що супроводжується нормальним або трохи підвищеним рівнем 1,25(OH)2D, гіперкальціємією, гіперкальціурією й пригніченою секрецією PTH. Клінічними ознаками отруєння, окрім гіперкальціємії, є втомлюваність, ослабленість, сплутаність думок, складність концентрації уваги, сонливість, апатія, блювання, закреп, поліурія, полідипсія, порушення на кардіограмі (зменшення інтервалу Q–T) та ін.
Огляд існуючих рекомендацій
Серед наявних документів найбільш цитованими й обговорюваними вважаються рекомендації Інститутів медицини (IOM, США) 2010 р. [135], Ендокринологічної асоціації (США) 2011 р. [136].
Згідно із даними, зібраними на часі, рекомендації Інститутів медицини стосувалися в основному кальцієво-фосфорного метаболізму та користі для кісткової тканини. У результаті для здорового населення встановлено мету досягти концентрації 25(OH)D > 20 нг/мл [135]. На противагу рекомендації Ендокринологічної асоціації стосувалися як здорових, так і хворих з хронічними захворюваннями; до того ж ці рекомендації містили комплекс фактів щодо класичної й плейотропної дії вітаміну D. Мінімальна концентрація 25(OH)D згідно з цілями Ендокринологічної асоціації була 30 нг/мл, а показники < 30 та < 20 нг/мл відповідно вважалися недостатністю й дефіцитом [136].
Рекомендації щодо оптимальної концентрації 25(OH)D та додаткового споживання вітаміну D різняться у європейських країнах: так, скандинавські держави (Данія, Фінляндія, Ісландія, Норвегія, Швеція) взяли собі за мету досягти концентрації 25(OH)D ≥ 20 нг/мл [142]. Подібний рівень був визнаний оптимальним у Німеччині, Австрії, Швейцарії [3].
Рекомендації для Центральної Європи наслідували швидше пропозиції Ендокринологічної асоціації [9]. Вони ґрунтувалися на дослідженнях Європейської агенції безпеки продуктів харчування 2012 р., а також на результатах дискусії, проведеної даною організацією, щодо валідності й адаптації стандартів Інститутів медицини та Ендокринологічної асоціації. Рекомендації для Центральної Європи вважають оптимальною концентрацію 25(OH)D 30–50 нг/мл, бо вона приносить потенційну користь усьому організмові [9].
Оскільки метою додаткового споживання вітаміну D є досягнення й підтримання оптимальної концентрації 25(OH)D, субстрату ниркової й позаниркової 1a-гідроксилації (CYP27B1), а також у кінцевому підсумку синтезу кальцитріолу, рекомендації щодо ендокринної, паракринної й автокринної дії 1,25(OH)2D відображають універсальне бачення дефіциту вітаміну D і його впливу на людський організм. Підтримання оптимальної концентрації 25(OH)D (> 30–50 нг/мл) підтверджується результатами численних перехресних та епідеміологічних досліджень, а також кількох проспективних досліджень, що свідчать про безпечність даної концентрації, відсутність ризику гіперкальціємії та гіперкальціурії. Ще одним аргументом на користь концентрації (> 30–50 нг/мл) є кінетика 25-гідроксилази, 50 % активності якої виявляється з концентрацією 40 нг/мл [143, 144]. Важливим доказом також став гістоморфометричний аналіз біопсії клубового гребня 675 суб’єктів, здійснений Priemel et al., що показав остеомаляційні ушкодження в 26 % осіб, включаючи 21 % тих, у кого концентрація 25(OH)D перебувала в діапазоні 21–29 нг/мл [145]. Ознаки остеомаляції в осіб із концентрацією 25(OH)D > 30 нг/мл були відсутні [145]. Дослідження серед вагітних показали, що додаткове споживання вітаміну D є корисним як для матері, так і для дитини, а оптимальна концентрація 25(OH)D повин–на сягати 40 нг/мл [146–148].
Світові рекомендації 2016 р. встановили оптимальну концентрацію 25(OH)D на рівні > 20 нг/мл [8]. У всіх вікових групах пропонувалися значно нижчі дози препаратів вітаміну D порівняно з рекомендаціями Ендокринологічної асоціації [136] та нормами Центральної Європи [9]. У результаті, зокрема в Польщі, лікарі змушені обирати між світовими й локальними пропозиціями. Слід підкреслити, що світові рекомендації розглядають додаткове споживання вітаміну лише як засіб профілактики й лікування аліментарного рахіту й не описують інші шляхи застосування, хоч вони визнані повсюдно, про що й пишуть автори [8]. Цікаво, що доза, рекомендована світовим консенсусом для лікування дефіциту й підтверджена результатами лабораторних досліджень, практично не відрізняється від пропозицій для Центральної Європи. Для новонароджених дози навіть вищі (згідно з рекомендаціями для Центральної Європи — 1000 МО/добу, згідно зі світовими — 2000 МО/добу (табл. 4)). Світові рекомендації щодо споживання єдиної дози насичення (50 000–300 000 МО за один прийом) для лікування дефіциту в осіб, старших від 3 місяців, видаються сумнівними. Виникає питання: чи варто повертатися до історичної практики лікування однією мегадозою? Навряд. Доза насичення може бути виправданою лише в окремих ситуаціях, коли регулярне споживання вітаміну неможливе із соціоекономічних причин, обмежень системи охорони здоров’я й інфраструктури, що покликана забезпечувати споживання. Якщо рішення про дозу насичення все-таки прийняте, необхідно зважати на ризик гіперкальціємії, що спостерігався в дітей, які приймали велику дозу вітаміну [8].
Глобальний консенсус вимагає приділити основну увагу досить незначним дозам кальцію, що рекомендуються для споживання з їжею, оскільки його може не вистачити для профілактики аліментарного рахіту. Для дітей рекомендуються такі дози кальцію: до 6 місяців — 200 мг, 6–12 місяців — 260 мг, після року — 500 мг. Рекомендації для Центральної Європи 2013 р. не включали споживання кальцію, хоч у польських 2009 р. це питання фігурувало [10]. Тодішні рекомендовані дози були значно вищими, особливо в групі осіб літнього віку, й збільшувались з віком від 500 до 1300 мг/добу (табл. 4). Американські інститути медицини дають подібні рекомендації щодо дози кальцію 700–1300 мг/добу для осіб 1–18 років залежно від віку [135].
Обговорення
Рекомендації щодо споживання вітаміну D впродовж років змінювалися, слідуючи найостаннішим розробкам і клінічним спостереженням. Однак навіть у рекомендаціях наукових асоціацій, що були створені одночасно, поняття оптимальної дози відрізняється в діапазоні від 200 до 2000 МО/добу [149]. Це можна насамперед пояснити розбіжностями мінімальних цільових концентрацій 25(OH)D (від 10 до 40 нг/мл), поглядами наукової спільноти на важливість дії вітаміну D [135–137]. Більшість ендокринологічних асоціацій, зокрема Ендокринологічна асоціація США, а також спілок, що опікуються здоров’ям кісткової системи, зокрема Міжнародна асоціація остеопорозу, визнають концентрацію 25(OH)D понад 30 нг/мл корисною для здоров’я. Ця величина також була визнана мінімально оптимальною Рекомендаціями для Центральної Європи 2013 р. і прийнята як така польськими клініцистами [9, 134–137, 150].
Експертна група зважилася на перегляд рекомендованих добових доз для здорового населення й груп ризику щодо дефіциту, незважаючи на те, що вони діють у Польщі з 2013 р. Група також включила ряд новоутворених цільових осередків, що потребують додаткового споживання вітаміну D, серед яких підлітки 11–18 років, особи літнього віку > 75 років, і адаптувала попередні дози для недоношених немовлят, які фігурували в рекомендаціях для Центральної Європи.
Без сумніву, особи віком 11–18 років належать до групи підвищеного ризику дефіциту, оскільки швидко набирають масу, мають швидкий кістковий метаболізм та моделювання. Їх скелет прискорено росте, а кількість м’язової й жирової тканини переживає зміни, викликані біологічними й біхевіоральними проявами пубертату. Таким чином, низьке споживання вітаміну D стає для підлітків актуальною проблемою. Крім того, цей важливий період зростання ризику дефіциту й негативних наслідків для здоров’я супроводжується сидячим способом життя, тривалим перебуванням у приміщеннях, нездоровим харчуванням або застосуванням обмежувальних дієт. Усі перелічені фактори ризику вирізняють дану групу як особливо проблемну, потребуючу збільшення рекомендованої добової дози вітаміну D до 800–2000 МО, зважаючи на масу тіла й пору року. РКД, проведене у Великобританії, включало групу із 110 дітей і підлітків із нормальною масою тіла віком 14–18 років й оцінювало ефективність споживання вітаміну в дозах 0, 400 і 800 МО/добу з жовтня до березня (20 тижнів), аби розробити систему необхідних заходів для підтримання 25(OH)D концентрацій у межах > 10 й > 20 нг/мл. Аналіз отриманих даних показав, що в осіб європеоїдної раси для підтримання концентрацій у межах > 10 й > 20 нг/мл (97,5 % обстежених дітей) знадобилися дози вітаміну в 400 й 1200 МО/добу відповідно. Як не дивно, жоден учасник дослідження не досяг концентрації 25(OH)D у 40 нг/мл [151]. РКД, проведене в Пітсбурзі (США), включало 96 дітей і підлітків віком 8–18 років й показало, що для підтримання концентрації 25(OH)D на рівні > 20 нг/мл у період із жовтня до квітня 90 % осіб вимагали 1543 МО/добу, а для 97,5 % осіб знадобилося 2098 МО/добу [152]. Ще в одному РКД, спрямованому на порівняння ефективності доз 600, 1000 й 2000 МО/добу вітаміну D, які отримували протягом півроку 685 школярів, була показана найвища ефективність дози 2000 МО/добу, що, зі свого боку, призводила до підвищення рівня 25(OH)D на рівні ≥ 30 нг/мл. Даний показник концентрації був досягнутий у 60 % дітей вже через 3 місяці, а середня концентрація становила 33,1 нг/мл [153]. Останнє дослідження за участі 1007 польських дітей [6], госпіталізованих унаслідок наявності симптомів скелетних розладів, встановило, що дефіцит вітаміну D, включаючи тяжку його форму (< 10 нг/мл), частіше виникав у пубертатний період, аніж у дитинстві й препубертатному віці, незважаючи на наявні національні рекомендації.
В осіб літнього віку (> 75 років) вітамін D повинен споживатися протягом року в дозах 2000–4000 МО/добу залежно від маси тіла. Останній показник видається максимально придатним для досягнення цільової концентрації 25(OH)D на рівні > 30–50 нг/мл принаймні у 90 % польських осіб. Група осіб літнього віку є ще однією проблемною з точки зору дефіциту групою, що також має ризик падінь й остеопоротичних переломів. Наявні РКД й метааналізи свідчать, що концентрація 25(OH)D на рівні > 24–50 нг/мл, що є результатом додаткового споживання вітаміну D, асоціювалася зі значно зниженим ризиком падінь (на 19 %) [154] та переломів проксимального відділу стегнової кістки (на 37 %) [155], а також інших видів переломів (на 31 %) порівняно з контрольною групою. Хоча більшість досліджень пропонують дозу вітаміну D > 800 МО/добу, її виявилося недостатньо для понад половини осіб літнього й старечого віку. Тому після тривалих дискусій експертна група запропонувала для повного викорінення дефіциту дотримуватися дози в 2000–4000 МО/добу, аби досягти й утримати оптимальну концентрацію 25(OH)D й забезпечити плейотропний ефект вітаміну D. Описані вище рекомендації знайшли своє відображення в документі Американської геріатричної асоціації [156].
З огляду на теоретичні джерела і проведені РКД експертна група вирішила внести зміни до євро–пейських рекомендацій щодо доз вітаміну D для недоношених немовлят. Результати досліджень за останні 5 років свідчать про те, що діти, які народилися на ≤ 32-му тижні виношування, а також ті, які мають дуже низьку масу тіла (< 1500 г), отримали найбільшу користь від споживання вітаміну в обсязі 800–1000 МО/добу [157–159]. Дослідження, що порівнювало ефект різних доз вітаміну (1000, 800 та 400 МО/добу), показало, що відсоток недоношених малюків із дефіцитом на 36-му тижні постменструального віку становив 2,5, 9,8 та 22 % відповідно [159]. В групі ще більш недоношених немовлят (народилися на ≤ 28-му тижні виношування) через 4 тижні додаткового споживання вітаміну (800, 200 МО/добу проти плацебо) було відмічено дефіцит у 0, 16, 41 % відповідно [158]. Підгрупа, що отримувала 800 МО/добу, в основному досягла концентрації 25(OH)D > 60 нг/мл, незважаючи на те, що при народженні не менше 67 % малюків мали дефіцит. Спостереження за 66 недоношеними новонародженими (середня маса тіла при народженні — 970 г, термін виношування — 27 тижнів) дало такий результат: 800 МО/добу зменшували поширеність тяжкого дефіциту на 36-му тижні постменструального віку з 41 до 0 %, а відсоток дітей із концентрацією 25(OH)D > 30 нг/мл зріс з 10 до 72 % [160]. На жаль, дефіцит вітаміну D у недоношених новонароджених Польщі залишається актуальною проблемою [161]. Ризик дефіциту при народженні разом зі скороченням терміну вагітності й ризиком невиношування напряму залежить від тяжкості дефіциту у вагітних [146–148]. Відкориговані дози швидко оптимізують статус вітаміну D у недоношених новонароджених, однак через місяць, згідно з рекомендаціями групи, необхідно перевірити концентрацію 25(OH)D і, якщо це необхідно, змінити дозу. Через побоювання побічної дії й ризик передозування серед недоношених дітей ≤ 32-го тижня виношування також проводилося дослідження, де вітамін був представлений у менших дозах (200 МО/добу). На 36-му тижні пост–менструального віку доза 200 МО/добу виявилася недостатньою, а дефіцит був зафіксований у 40 % дітей, які народилися на < 28-му тижні, й 30 % дітей, які народилися на 28–32-му тижні [162]. Видається, що в більш зрілих недоношених (які мають менший ризик тяжкого дефіциту) доза 400 МО/добу забезпечує такий самий оптимальний статус, як і в доношених [163].
Експертна група вважає, що скринінг концентрації 25(OH)D у всього здорового населення проводити не варто, однак існують клінічні умови, за яких така перевірка оптимізує курс лікування і мінімізує ускладнення (табл. 1). Група долучається до висновку Ендокринологічної асоціації про те, що в груп із підвищеним ризиком дефіциту, зокрема жінок, які планують завагітніти, вагітних і годувальниць, а також недоношених немовлят (< 32-го тижня) додаткове споживання вітаміну D є необхідним, проте повинне надаватися з урахуванням концентрації 25(OH)D та її коливань [136]. Деякі дані свідчать про те, що дози 4000–6400 МО/добу є безпечними, ефективними й корисними як для вагітних і годувальниць, так і для їх дітей [146–148]. Натомість дослідження, проведені в Польщі й Канаді (Калгарі, 51°N), практично не показали жодного позитивного ефекту дози 600–800 МО/добу, якщо за точку відліку бралися успішні пологи [16, 164]. З огляду на безпечність вітаміну D для вагітних (меншою мірою — для годувальниць) та високу ймовірність того, що матері вже приймають мультивітамінні комплекси, де доза вітаміну D становить 200 МО в таблетці, експертна група рекомендує вагітним і годувальницям 2000 МО/добу, якщо концентрація 25(OH)D невідома. Деяким вагітним знадобиться більша доза для досягнення оптимальної концентрації, однак у такому разі необхідно спочатку зробити аналіз 25(OH)D. Група підкреслює, що дефіцит вітаміну під час вагітності асоціюється зі значним ризиком невиношування, прееклампсії, народження дитини з низькою масою тіла й бактеріальним вагінозом. Корекція дефіциту шляхом регулярного додаткового споживання вітаміну D під час вагітності, а також якомога більш ранній початок його прийому (бажано ще до зачаття) можуть значно зменшити ризик вищеописаних ускладнень і тому повсюдно рекомендуються [146–148, 165, 166].
Враховуючи результати досліджень серед представників польського населення, які мають генетичну схильність до симптоматичної гіперкальціємії (вони є носіями мутацій генів CYP24A1 або SLC34A1 зі зниженим катаболізмом або підвищеною здатністю до утворення активної форми вітаміну D відповідно) [26], експертна група запропонувала провести організоване дослідження анамнезу даних пацієнтів перед запланованим збільшенням дози вітаміну D порівняно із загальнорекомендованими, аби мінімізувати ризик побічної дії в осіб із підвищеною чутливістю. Було підраховано, що лише в Польщі проживає більше тисячі осіб із симптоматичною гіперкальціємією, а загальна поширеність даного стану сягає 1 : 33 000 новонароджених [26]. Якщо встановлено діагноз гіперкальціємії, гіперкальці–урії, нефролітіазу, нефрокальцинозу, спостерігається мутація генів CYP24A1 або SLC34A1 або інша форма гіперчутливості в пацієнта або членів його родини, доза призначається індивідуально з огляду на дані про кальцієво-фосфорний метаболізм, кальціємію, PTH, кальціурію, 25(OH)D і 1,25(OH)2D.
В контексті призначення терапевтичних доз вітаміну D експертна група вважає, що призначення єдиної дози насичення з інтервалом у 3 місяці є недоцільним у Польщі. Даний підхід був запропонований у 2016 р. світовим консенсусом щодо профілактики й лікування аліментарного рахіту як альтернативна терапія для пацієнтів із рахітом, що в силу якихось причин не можуть регулярно приймати вітамін D [8]. Існує підвищений ризик розвитку гіперкальціємії в результаті приймання насичувальної дози [8]. Крім того, клініцисти як у Польщі, так і в інших країнах Європи вже експериментували з призначенням єдиної дози [42] і з’ясували, що за умови доступності вітаміну й розвиненості медицини (як у Польщі) величина дози не повинна бути вирішальним фактором на користь її призначення.
Нещодавно в Польщі активно промотувався курс прийому 30 000 МО вітаміну D3 єдиною таблеткою раз на місяць. Ця доза виписувалася дорослим, літнім людям і підліткам, старшим за 12 років. Представники групи поділяють думку, що прийом вітаміну в дозі 30 000 МО, незважаючи на курс (раз на місяць згідно з інструкцією для медичного застосування препарату (ІМЗ) або частіше згідно з іншими рекомендаціями [167]) є недоцільним, якщо не враховувати результати лабораторних досліджень 25(OH)D та ризик підвищеної чутливості. Кумулятивний прийом 15–30-денних доз (2000 або 1000 МО/добу відповідно) із профілактичною метою для ліквідації дефіциту в здорового населення або груп ризику викликає багато пересторог. Найбільша зафіксована в Польщі кумулятивна доза (30 000 МО), тобто вдвічі або втричі більша за ту, що рекомендується представникам однієї вікової групи з нормальною масою тіла (тобто 60 000–90 000 МО відповідно), навіть у разі старших підлітків або дорослих з ожирінням вважається занадто небезпечною. Група вважає, що прийом 30 000 МО з порушенням ІМЗ (тобто раз на місяць) зашкодить проведенню лікування остеопорозу. РКД 200 осіб віком > 75 років довело підвищений ризик падінь, асоційований із прийомом 24 000 МО й 300 µг кальцифедіолу раз на місяць, так само як і з прийомом 60 000 МО раз на місяць [168].
Експертна група створила нову редакцію польських рекомендацій, що так само, як і інші документи (більш ранні рекомендації Ендокринологічної асоціації [136] й рекомендації для Центральної Європи [9]), визнає збільшену масу тіла змінною, яка впливає на статус вітаміну D. Тому вона рекомендує пацієнтам із ожирінням подвійну добову дозу вітаміну D. Існує незначна негативна кореляція концентрації 25(OH)D, маси тіла й ІМТ (кг/м2), відзначена в польських осіб [7]. Поза тим, дефіцит відзначається в пацієнтів з ожирінням частіше, ніж у осіб із нормальною масою тіла, які мають такий самий вік [169]. Ми рекомендуємо пацієнтам з ожирінням подвоїти добову дозу порівняно з їх ровесниками, які мають нормальну масу. Критерії підбору дози згідно з віком і масою допоможуть вирішити проблему дефіцитної маси. Згідно з рекомендаціями Ендокринологічної асоціації [136] і результатами широкомасштабних досліджень пропонується збільшити добову дозу вдвічі або втричі для пацієнтів з ожирінням, в 1,5 раза — для пацієнтів із надлишковою масою та зменшити добову дозу для осіб із дефіцитом маси порівняно з нормо–стенічними особами [170–172].
Експертна група рекомендує за умови перевірки концентрації 25(OH)D визначати статус вітаміну D згідно з концентрацією й пропонувати відповідні профілактичні заходи. Це положення випливає зі спостережень, що пацієнти часто не виконують рекомендації щодо додаткового споживання вітаміну D, а лікарі неправильно виписують їм дози препаратів [5, 6]. Так, в осіб із відміченими порушеннями концентрації 25(OH)D (підвищена, понижена, висока, низька тощо) перша лінія терапії повинна включати перевірку регулярності споживання вітаміну, дозу, препарат та спосіб прийому (в поєднанні з продуктами, що місять або не містять жири, згідно з інструкціями до препарату). Як правило, вистачає традиційних заходів профілактики дефіциту. Проте якщо пацієнт виконує рекомендації, а результат відсутній (концентрація 25(OH)D не відповідає оптимальній), необхідно збільшити добову дозу на 50–100 %, запровадити терапевтичну дозу з огляду на тяжкість дефіциту. Якщо пацієнт ще не приймає вітамін D, необхідно одразу ж починати прийом, а в осіб із тяжкою формою дефіциту (25(OH)D < 10 нг/мл) — ще й у терапевтичних дозах. Повторна перевірка концентрації 25(OH)D та подальші заходи залежатимуть від ступеня тяжкості.
Експертна група підкреслює важливість достатніх доз кальцію, що повинні супроводжувати додаткове споживання вітаміну D й лікування його дефіциту. Якщо пацієнт не може отримувати достатньо кальцію з харчових продуктів, необхідно приймати препарати солей кальцію, бажано кількома дозами, оскільки в такому разі абсорбція відбувається краще, а періодична кальціурія виникає рідше. На даному етапі ми пропонуємо дотримуватися існуючих рекомендацій щодо доз кальцію в польській популяції залежно від віку [10].
Анотація
Дефіцит вітаміну D є актуальною проблемою польської системи охорони здоров’я, що без адекватної профілактики може прогресувати внаслідок нездорового способу життя, хибної харчової поведінки й нестачі вітаміну D, що надходить в організм природним шляхом (через продукти харчування та УФ-промені класу B (UVB)) [4–7]. Нові досягнення в галузі профілактики й лікування дефіциту вітаміну D в усіх вікових групах спонукають нас переглянути існуючі рекомендації й запровадити нову їх редакцію. В узагальненому вигляді нові рекомендації подані на рис. 1. Боротьба з дефіцитом вітаміну D повинна стати ключовим завданням лікарів будь-якої спеціальності, проте найбільше — терапевтів, а також відповідальних за управління охороною здоров’я в Польщі. Сучасна наука забезпечує докази як кальціємічної, так і плейотропної дії вітаміну. Перелік класичних і некласичних застосувань, а також позитивних плейотропних аспектів прийому вітаміну D із кожним роком зростає. Оптимальна концентрація 25(OH)D також впливає на організм ендокринним, автокринним і паракринним шляхами, захищаючи від остеопорозу, переломів, рахіту й остеомаляції, а також від автоімунних хвороб, включаючи розсіяний склероз, діабет І типу, системний червоний вовчак, від інфекційних захворювань, серед яких туберкульоз, грип, від серцево-судинних та нейрокогнітивних розладів, до яких належать хвороба Альцгеймера, аутизм, від ускладненої вагітності, діабету ІІ типу. Знижується частота онкологічних захворювань і смертності, зростають шанси на виживання й покращання якості життя онкохворих. Незважаючи на те, що питання взаємозв’язку між дефіцитом вітаміну D й конкретними захворюваннями або ризиком їх розвитку залишається відкритим, а проблема дефіциту в здорового населення й пацієнтів медичних закладів лише зростає, експертна група впевнена, що вдосконалені рекомендації щодо профілактики й лікування дефіциту вітаміну D заслуговують впровадження в медичну й дієтологічну практику.
Індивідуальний внесок авторів
Усі автори брали участь у підготовці тексту, зборі даних, складанні попередньої версії рекомендацій, написанні й редагуванні рукопису. MWa — національний консультант із педіатричної ендокринології й діабету; президент Польської асоціації педіатричної ендокринології й діабету. MB-K — президент Польської асоціації неонатології. DCH-S очолює секцію метаболічних хвороб кісток в дітей і підлітків Польської асоціації педіатрів. EH — національний консультант із неонатології. TJ — національний консультант із педіатрії. JKs — президент Польської асоціації дитячої клінічної нутриціології. AL — національний консультант з ендокринології. JP-P — президент Польської асоціації педіатрів. MR — президент Польської асоціації ендокринології. MWi — національний консультант із перинатології; президент Польської асоціації гінекологів й акушерів. DZ — національний консультант із педіатричної нефрології. PP — президент Європейської асоціації вітаміну D (EVIDAS).
Конфлікт інтересів. Автори заявляють, що дослідження проводилися без будь-якої комерційної або фінансової участі, яку можна було б розглядати як потенційний конфлікт інтересів. Головний редактор наразі займається впровадженням дослідницької теми разом з авторами PP й JKo, заявляє про відсутність інших дослідницьких колаборацій.
Використані абревіатури й скорочення
1,25(OH)2D — 1,25-дигідроксихолекальциферол; UVB — ультрафіолетові промені класу B; DBP — вітамін-D-зв’язуючий білок; MED — мінімальна еритемна доза; 7-DHC — 7-дегідрохолестерол; D3 — вітамін D3, холекальциферол; D2 — вітамін D2, ергокальциферол; DXA — двофотонна рентгенівська абсорбціометрія; 25(OH)D — 25-гідроксивітамін D, кальцидіол, кальциферол; FGF-23 — фактор росту фібробластів 23, фосфатонін-23; RANK — рецептор-активатор ядерного фактора NF-kB; RANKL — RANK ліганд; РКД — рандомізоване контрольоване дослідження; PTH — паратгормон; VDR — вузькоспецифічний рецептор вітаміну D; ALPL — активність лужної фосфатази; PO4 — фосфат; Ca — кальцій.
1Department of Paediatric Propedeutics and Bone Metabolic Diseases, Medical University of Lodz, Lodz, Poland, 2Department of Biochemistry, Radioimmunology and Experimental Medicine, The Children’s Memorial Health Institute, Warsaw, Poland, 3Department of Pediatrics, Endocrinology, Diabetology, Metabolic Diseases and Cardiology of the Developmental Age, Pomeranian Medical University, Szczecin, Poland, 4Neonatal and Intensive Care Department, Medical University of Warsaw, Warsaw, Poland, 5Department of Pediatrics, Endocrinology and Diabetology with Cardiology Divisions, Medical University of Bialystok, Bialystok, Poland, 6Department of Neonatology and Neonatal Intensive Care Unit, The Children’s Memorial Health Institute, Warsaw, Poland, 7Mossakowski Medical Research Center, Polish Academy of Sciences, Department of Internal Diseases, Endocrinology and Diabetology, Central Hospital MSWiA, Warsaw, Poland, 8Department of Neonatology, Institute of Mother and Child, Warsaw, Poland, 9Department of Pediatrics, The Medical Centre of Postgraduate Education, Warsaw, Poland, 10Division of Clinical Genetics, Department of Molecular Biology and Genetics, School of Medicine in Katowice, Medical University of Silesia, Katowice, Poland, 11Department of Pediatric Rheumatology, Immunology, and Metabolic Bone Diseases, Medical University of Bialystok, Bialystok, Poland, 12Department of Pediatrics, Nutrition and Metabolic Diseases, The Children’s Memorial Health Institute, Warsaw, Poland, 13Department of Endocrinology and Metabolic Diseases, Medical University of Lodz, Polish Mother’s Memorial Hospital – Research Institute, Lodz, Poland, 14Faculty of Pharmacy with Laboratory Medicine, Medical University of Warsaw, Warsaw, Poland, 15Department of Geriatrics, The Centre of Postgraduate Medical Education, Warsaw, Poland, 162nd Department of Pediatrics, Endocrinology, Diabetology, University of Rzeszow, Rzeszow, Poland, 17Department of Pediatrics and Pediatric Oncology, Pomeranian Medical University, Szczecin, Poland, 18Department of Endocrinology, Metabolism and Internal Diseases, Poznan University of Medical Sciences, Poznan, Poland, 19Department of Gastroenterology, Hepatology, Nutritional Disorders and Pediatrics, The Children’s Memorial Health Institute, Warsaw, Poland, 20Clinic of Endocrinology and Diabetology, The Children’s Memorial Health Institute, Warsaw, Poland, 21Faculty of Medicine and Health Sciences, Jan Kochanowski Univeristy, Kielce, Poland, 221st Department of Obstetrics and Gynecology, Medical University of Warsaw, Warsaw, Poland, 23Department of Pediatric Nephrology, Wroclaw Medical University, Wroclaw, Poland

/4-1.jpg)
/6-1.jpg)
/8-1.jpg)
/14-1.jpg)
/17-1.jpg)
/18-1.jpg)