Журнал «Боль. Суставы. Позвоночник» Том 9, №1, 2019
Вернуться к номеру
Сучасні рекомендації щодо лікування псоріатичного артриту згідно з рекомендаціями Американського коледжу ревматологів і Національної організації з псоріазу 2018 року
Авторы: Головач І.Ю. (1), Єгудіна Є.Д.(2)
1 - Клінічна лікарня «Феофанія» Державного управління справами, м. Київ, Україна
2 - ДЗ «Дніпропетровська державна медична академія» МОЗ України, м. Дніпро, Україна
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
Псоріатичний артрит (ПсА) — це хронічне запальне скелетно-м’язове захворювання, асоційоване з псоріазом, яке маніфестує зазвичай з периферичного артриту, дактиліту, ентезиту та/чи спондиліту. Рання ідентифікація та діагностика ПсА, ранній початок терапії важливі для покращення довгострокових наслідків хвороби. Клінічна картина ПсА є гетерогенною, і лікарі досить часто стикаються з проблемами при визначенні стратегій лікування. Метою нашого огляду були надання й інтерпретація рекомендацій Американського коледжу ревматологів (ACR) і Національної організації з псоріазу (NFP) 2018 року з лікування активного ПсА у дорослих з використанням фармакологічних і нефармакологічних методів. Ці рекомендації щодо лікування ПсА можуть допомогти як клініцистам, так і пацієнтам досягти оптимальних рішень щодо менеджменту хвороби. У рекомендаціях наведені стратегії вибору препаратів для лікування активного ПсА при різних клінічних ситуаціях та залежно від проведеної попередньої терапії. Наявність або відсутність коморбідних станів, таких як запальне захворювання кишечника, увеїт, діабет або серйозні інфекції, а також знання попередніх методів лікування є факторами, що дозволяють зробити вибір оптимальної терапії для окремого пацієнта в даний момент часу, застосовуючи індивідуальний підхід. Рекомендації ACR/NFP щодо лікування активного ПсА рекомендують інгібітори фактора некрозу пухлини, а не пероральні низькомолекулярні препарати як препарати першої лінії, саме ці біологічні агенти запобігають прогресуванню захворювання та пошкодженню суглобів. Наголошується на необхідності ранньої та агресивної терапії у пацієнтів з вперше виявленим ПсА.
Псориатический артрит (ПсА) — это хроническое воспалительное скелетно-мышечное заболевание, ассоциированное с псориазом, которое манифестирует обычно как периферический артрит, дактилит, энтезит и/или спондилит. Ранняя идентификация и диагностика ПсА, раннее начало терапии важны для улучшения долгосрочных исходов болезни. Клиническая картина ПсА является неоднородной, и врачи довольно часто сталкиваются с проблемами при определении стратегий лечения. Целью нашего обзора были представление и интерпретация рекомендаций Американского колледжа ревматологов (ACR) и Национальной организации псориаза (NFP) 2018 года по лечению активного ПсА у взрослых с использованием фармакологических и нефармакологических методов. Эти рекомендации по лечению ПсА могут помочь как клиницистам, так и пациентам достичь оптимальных решений по менеджменту болезни. В рекомендациях представлены стратегии выбора препаратов для лечения активного ПсА при различных клинических ситуациях и в зависимости от проводимой предыдущей терапии. Наличие или отсутствие коморбидных состояний, таких как воспалительное заболевание кишечника, увеит, диабет или серьезные инфекции, а также знания предыдущих методов лечения являются факторами, которые позволяют сделать выбор оптимальной терапии для отдельного пациента в данный момент времени, используя индивидуальный подход. Рекомендации ACR/NFP по лечению активного ПсА рекомендуют ингибиторы фактора некроза опухоли, а не пероральные низкомолекулярные препараты как препараты первой линии, именно эти биологические агенты предупреждают прогрессирование заболевания и повреждение суставов. Отмечается необходимость ранней и агрессивной терапии у пациентов с впервые выявленным ПсА.
Psoriatic arthritis (PsA) is a chronic inflammatory skeletal and muscular disease associated with psoriasis, which usually manifests itself in the peripheral arthritis, dactylitis, enthesitis and/or spondylitis. Early identification and diagnosis of PsA, as well as early start of therapy is important for improving the long-term outcomes of the disease. Clinical picture of PsA is heterogeneous, and doctors often face problems while determining treatment strategies. The purpose of our review was to discuss and interpret 2018 American College of Rheumatologists (ACR) and National Psoriasis Foundation (NPF) guidelines for active PSA treatment in adults using pharmacological and non-pharmacological methods. These recommendations may help both clinicians and patients to make their best decisions about disease management. The presence or absence of comorbid conditions such as inflammatory bowel disease, uveitis, diabetes or serious infections, as well as knowledge of medical history are factors enabling choice of an optimal therapy for a particular patient at a given time using a customized treatment approach. ACR/NPF guidelines for active PsA treatment recommend tumor necrosis factor inhibitors rather than small molecule oral drugs as a first line therapy, precisely because these biological agents prevent progression of the disease and joint damage. Early and aggressive therapy is emphasized in patients with a newly diagnosed PsA.
псоріатичний артрит; псоріаз; активність процесу; рекомендації; лікування; менеджмент; інгібітори фактора некрозу пухлини; інгібітори інтерлейкіну-17; інгібітори інтерлейкінів-12/23; метотрексат; лікування до досягнення мети
псориатический артрит; псориаз; активность процесса; рекомендации; лечение; менеджмент; ингибиторы фактора некроза опухоли; ингибиторы интерлейкина-17; ингибиторы интерлейкинов-12/23; метотрексат; лечение до достижения цели
psoriatic arthritis; psoriasis; activity of the process; recommendations; treatment; management; tumor necrosis factor inhibitors; interleukin-17 inhibitors; interleukin-12/23 inhibitors; methotrexate; treat-to-target
Псоріатичний артрит (ПсА) — хронічне запальне скелетно–м’язове захворювання, асоційоване з псоріазом, яке маніфестує зазвичай з периферичного артриту, дактиліту, ентезиту та спондиліту. Крім того, у 80–90 % пацієнтів із ПсА зустрічається ураження нігтів, включаючи локальні поглиблення й оніхолізис [1]. Частота ПсА становить приблизно 6 випадків на 100 000 на рік, а поширеність — 1–2 випадки на 1000 у загальній популяції [2]. Щорічна захворюваність на ПсА у пацієнтів із псоріазом становить 2,7 % [3], а зареєстрована поширеність ПсА серед пацієнтів із псоріазом варіює від 6 до 41 % [2]. Частота виникнення ПсА у чоловіків і жінок однакова. ПсА асоціюється з негативним впливом на якість життя [4] та високими витратами на лікування [5]. Висока активність захворювання пов’язана з прогресуючим деструктивним артритом, функціональною недостатністю, інвалідизацією, коморбдністю та високим рівнем смертності [6].
Здебільшого симптоми ураження шкіри є первинно–маніфестними; артрити зазвичай розвиваються через деякий проміжок часу. Однак у певної частки хворих симптоми ураження шкіри та суглобів проявляються одночасно, а в 10–15 % артрит є першим клінічним проявом захворювання [3]. Саме ці випадки постають найбільш складними для ранньої діагностики ПсА.
Клінічні форми
Клінічні варіанти периферичного артриту варіюють від асиметричного олігоартриту (за участю ≤ 4 суглобів) до симетричного поліартриту (за участю ≥ 5 суглобів). Залучення дистальних міжфалангових суглобів (ДМФС) є найбільш патогномонічним клінічним симптомом, у деяких випадках вони є єдиними суглобами, які уражені. Аксіальний спондилоартрит зазвичай виникає разом із периферичним артритом. У деяких пацієнтів можна спостерігати швидко прогресуючий та деструктивний ПсА — мутилююча форма ПсА.
У табл. 1 наведені клінічні форми ПсА.
Критерії діагностики
Діагноз ПсА встановлюють на підставі критеріїв CASPAR (Classification Сriteria for Psoriatic Arthritis), що розроблені в 2006 році W. Taylor і співавт. [7]. Критерії мають високу чутливість та специфічність як на ранній, так і при розгорнутій стадії ПсА. Ці критерії дозволяють діагностувати хворобу, незважаючи на позитивний РФ і відсутність псоріазу, за наявності типових ознак ПсА.
Відповідно до критеріїв СASPAR, пацієнти повин–ні мати ознаки запального захворювання суглобів (артрит, спондиліт або ентезит) і ≥ 3 балів з наступних 5, що наведені в табл. 2.
Клінічна картина ПсА є достатньо гетерогенною, і лікарі досить часто стикаються з проблемами при розгляді різних варіантів лікування. Метою нашого огляду була інтерпретація та наведення рекомендацій Американського коледжу ревматологів (ACR) 2018 року з лікування активного ПсА у дорослих з використанням фармакологічних і нефармакологічних підходів. Ці рекомендації можуть допомогти як клініцистам, так і пацієнтам досягти оптимальних рішень у менеджменті хвороби.
Визначення активності, тяжкості ПсА й ефективності лікування
Рекомендації з лікування здебільшого наведені для активної форми ПсА. При встановленні активності ПсА слід урахувати наявність принаймні одного з наступних симптомів: наявність артриту, дактиліту, ентезиту, ураження осьового скелета, активне ураження шкіри та/або нігтів, наявність екстраартикулярних проявів, таких як увеїт або запальне захворювання кишечника (ЗЗК). Необхідно враховувати такі маркери запалення, як С–реактивний білок (СРБ) або швидкість осідання еритроцитів (ШОЕ) та результати зображень суглобів і кісток [8].
Для оцінки ефективності лікування, головним чином у рандомізованих контрольованих дослідженнях, використовують критерії, рекомендовані ACR [9]:
1. Число болючих суглобів (з 68).
2. Число припухлих суглобів (з 66).
3. Загальна оцінка активності захворювання лікарем за візуально–аналоговою шкалою (ВАШ), мм.
4. Загальна оцінка активності захворювання пацієнтом за ВАШ, мм.
5. Оцінка болю в суглобах пацієнтом за ВАШ, мм.
6. Оцінка порушення функціональних здатностей хворого (Health Assessment Questionnaire, HAQ).
7. Гострофазові показники (ШОЕ або СРБ).
Критерій ACR20 означає поліпшення на 20 % порівняно з вихідним рівнем принаймні 5 з 7 перерахованих вище показників (поліпшення перших двох параметрів є обов’язковим), що відповідає задовільному ефекту терапії; ACR50 — покращення на 50 %, добрий ефект, і ACR70 — на 70 %, відмінний ефект. Якщо критерії оцінки ефективності лікування EULAR застосовують у щоденній практиці лікаря, то критерії ACR використовують в основному у наукових роботах і клінічних дослідженнях [10]. Індекс DAS дозволяє встановити ступінь активності захворювання, а його динаміка при лікуванні — вираженість ефекту лікування, тоді як критерії ACR — тільки наявність або відсутність позитивної динаміки на фоні лікування [11].
Медичні працівники та пацієнти повинні оцінювати тяжкість ПcА та псоріазу в кожному конкретному випадку, для цих цілей необхідно визначати не тільки рівень активності захворювання в певний момент часу, але й наявність або відсутність негативних прогностичних факторів і довгостроковий прогноз. Прикладами тяжкого захворювання є наявність 1 або більше з таких прогнознегативних факторів:
— ерозивний процес;
— дактиліт;
— підвищені рівні запальних маркерів, таких як ШОЕ та СРБ, що пов’язані із ПсА;
— необоротне ураження суглобів;
— деформації суглобів, що порушують їх функцію;
— висока активність захворювання, що викликає серйозні порушення якості життя (наприклад, активне запалення в багатьох ділянках, включаючи дактиліт, ентезит або обмеження функції декількох суглобових груп);
— довгостроковий збиток (наприклад, втрата зору);
— швидке прогресування хвороби;
— активна інфільтрація псоріазу на багатьох ділянках.
Оскільки на даний час немає остаточно узгоджених визначень тяжкості псоріазу, вона повин–на встановлюватися медичним працівником і пацієнтом у кожному окремому випадку. У клінічних дослідженнях тяжкий псоріаз був визначений як індекс тяжкості та поширеності ураження псоріазом (PASI) ≥ 12 та оцінка площі ураженої поверхні тіла (BSA) ≥ 10 [12]. Приклади визначень тяжкого ПсА і тяжкого псоріазу наведені в табл. 3. Нарешті, оскільки Національна організація псоріазу (NFP) та Американська академія дерматології одночасно розробляють керівні принципи лікування псоріазу, лікування псоріазу шкіри окремо від запального артриту не включалося у поточному керівництві ACR з ПсА.
Перехід від рекомендацій до практики
Рекомендації ACR/NFP 2018 розроблені для допомоги медичним працівникам у виборі терапії для пацієнта з ПсА. Наявність або відсутність коморбідних станів, таких як ЗЗК, увеїт, діабет або серйозні інфекції, а також знання лікарських засобів, які використовувалися на попередніх етапах, впливають на рішення щодо вибору оптимального менеджменту пацієнта з ПсА. У контексті ПсА, для вибору терапії необхідно провести об’єктивне обстеження, яке включає оцінку стану периферичних суглобів (зокрема, для виявлення дактиліту), хребта, шкіри й нігтів, оцінку наявності ентезитів. Лікарі та пацієнти повинні враховувати супутні захворювання та функціональний стан пацієнта при виборі оптимальної терапії на даний момент.
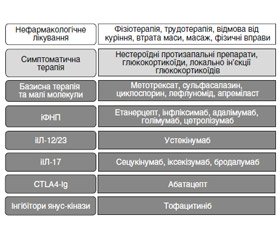
Рання ідентифікація та діагностика ПсА, а отже, ранній початок терапії надважливі для покращення довгострокових наслідків хвороби [13]. Як нефармакологічне, так і фармакологічне лікування (рис. 1) може зменшити симптоми та прояви ПсА і призвести до ремісії захворювання [14]. Зараз клініцисти та пацієнти можуть вибирати з широкого спектра фармакологічних методів лікування, включаючи симптоматичні, які включають нестероїдні протизапальні препарати (НПЗП), системні глюкокортикоїди (ГК), локальні (внутрішньосуглобові) ін’єкції ГК, а також імуномодулюючу терапію оральними препаратами малих молекул (ОПММ), інгібіторами фактора некрозу пухлини (іФНП), інгібіторами інтерлейкінів (iІЛ), імуноглобуліном та інгібіторами янус–кінази.
Фармакологічні методи лікування виділені темно–сірим кольором і включають базисну терапію та малі молекули, іФНП, іІЛ–17, іІЛ–12/23, CTLA4–Ig та інгібітор янус–кінази. Незважаючи на наявність численних нефармакологічних методів лікування, тільки 6 із них розглядають як найбільш ефективні: це фізіотерапія, трудотерапія, відмова від куріння, втрата маси, масаж, фізичні вправи.
Рекомендації щодо лікування ПсА згідно з настановами ACR/NFP 2018
Активний ПсА у пацієнтів, які не отримували лікування (рис. 2) [15–28]
У лікуванні ПсА у пацієнтів, які не отримували лікування на попередніх етапах (наївні), біологічні агенти, а саме іФНП, рекомендують як препарати першої лінії терапії. Базисні препарати (метотрексат (МТХ), сульфасалазин (ССЗ), лефлуномід (ЛЕФ), циклоспорин (ЦСА)) можуть бути використані замість іФНП у пацієнтів без тяжкого ПсА та без тяжкого псоріазу (як визначено у методах оцінки тяжкості та в табл. 3, остаточне визначення ступеня тяжкості має бути оцінено пацієнтом і лікарем), у тих пацієнтів, які віддають перевагу пероральній формі препарату замість парентеральної, або у тих, хто має протипоказання до лікування іФНП, включаючи застійну серцеву недостатність, попередні серйозні або рецидивуючі інфекції або демієлінізуючу хворобу та мають сумніви щодо початку терапії біологічними препаратами.
Для лікування пацієнтів з активним ПсА, які не отримували терапію з приводу ПсА, слід надати перевагу біологічним препаратам іФНП або базисній терапії й малим молекулам над використанням іІЛ–17 або іІЛ–12/23. Інгібітори ІЛ–17 або ІЛ–12/23 можуть використовуватися замість терапії іФНП у пацієнтів із тяжким псоріазом та протипоказаннями до призначення іФНП. При порівнянні ефективності використання таких біологічних препаратів, як іІЛ–17 та іІЛ–12/23, слід надати перевагу іІЛ–17, а біологічну терапію іІЛ–12/23 слід розглянути у разі супутнього ЗЗК та/або тяжкого псоріазу та/або тяжкого ПсА або при бажанні пацієнта рідше вводити препарат.
При порівнянні НПЗП і МТХ рекомендовано надати перевагу саме МТХ у хворих з активним ПсА або псоріазом. НПЗП можуть використовуватися замість МТХ після розгляду можливих протипоказань та оцінки профілів побічних ефектів у пацієнтів без ознак тяжкого ПсА або тяжкого псоріазу та у тих, у кого немає ризику розвитку кардіо– та нефротоксичних ефектів НПЗП.
Активний ПсА, незважаючи на лікування пероральними препаратами базисної терапії (рис. 3)
У пацієнтів, в яких зберігається активність ПсА, незважаючи на терапію препаратами базисного ряду (МТХ, ССЗ, ЛЕФ, ЦСА), необхідно розглянути перехід на іФНП, або іІЛ–17, або іІЛ–12/23, а не зміну базисного препарату на інший. Але для пацієнтів, які віддають перевагу оральному лікуванню, або тим, хто не має ознак тяжкого ПсА або тяжкого псоріазу, може використовуватися терапія іншим базисним препаратом, а не іФНП, іІЛ–17 або –іІЛ–12/23; також слід зауважити, що інший базисний препарат (МТХ, ССЗ, ЛЕФ, ЦСА) може застосовуватися в разі наявності протипоказань до використання біологічних препаратів.
Як вказувалося вище, серед біологічних препаратів насамперед слід надати перевагу іФНП на противагу іІЛ–17, іІЛ–12/23, абатацепту чи тофацитинібу [30]. Але в пацієнтів із протипоказаннями до призначення іФНП або тяжким псоріазом можна застосовувати іІЛ–12/23, іІЛ–17, абатацепт або тофацитиніб. При виборі серед них ефективність іІЛ–17 виявилася вищою, ніж іІЛ–12/23, абатацепту або тофацитинібу, а іІЛ–12/23 продемонстрували кращий результат лікування, ніж абатацепт або тофацитиніб [31]. Тофацитиніб може використовуватися замість іФНП у пацієнтів, які віддають перевагу пероральній формі лікувального засобу чи в яких немає тяжкого псоріазу [32].
Перехід на інший базисний препарат є кращою стратегією, ніж додавання препарату тієї ж самої групи до поточного лікування (за винятком апреміласту). Додавання іншого базисного препарату до поточного лікування може розглядатися у тих випадках, якщо пацієнт виявив часткову відповідь на поточну терапію пероральним базисним препаратом. Рекомендується додати апреміласт до поточної терапії базисними засобами, ніж перейти на монотерапію апреміластом, оскільки більшість доказів переваг у лікуванні апреміласту стосується його комбінованої терапії з препаратами базисного ряду (МТХ, ССЗ, ЛЕФ) [33]. Перехід на монотерапію апреміластом може розглядатися на противагу комбінованій терапії, тільки коли пацієнт має значні побічні ефекти внаслідок поточної терапії базисними препаратами (МТХ, ССЗ, ЛЕФ, ЦСА).
Цікаво, що біологічна монотерапія вважається більш ефективною, ніж комбінована терапія MTХ з біологічними агентами. При переході до біологічної монотерапії слід зупинити прийом базисних препаратів, що є обґрунтованим варіантом лікування й залежить від уподобань пацієнтів і медичних працівників [34]. Біологічний агент у комбінації з MTХ може використовуватися замість біологічної монотерапії, якщо пацієнт має тяжкий псоріаз, часткову відповідь на поточну терапію MTХ або супутній увеїт (оскільки увеїт добре реагує саме на терапію MTХ) або у пацієнтів, які отримують лікування іФНП, особливо інфліксимабом чи адалімумабом, для потенційної затримки або запобігання утворенню антитіл.
Активний ПсА, незважаючи на лікування іФНП, як у режимі монотерапії, так і в комбінованій терапії (рис. 4)
У пацієнтів з активним ПсА, незважаючи на монотерапію біологічним агентом іФНП, слід розглянути перехід на інший іФНП, а не перехід на іІЛ–12/23i, іІЛ–17, абатацепт або тофацитиніб чи додавання МТХ до поточного іФНП. У разі повної відсутності клінічного ефекту від попереднього іФНП або наявності його значних побічних ефектів рекомендовано лікування іІЛ–12/23, іІЛ–17, абатацептом або тофацитинібом замість монотерапії іншим іФНП [35]. Абатацепт може використовуватися замість іФНП у пацієнтів з рецидивуючою або серйозною інфекцією за відсутності тяжкого псоріазу, виходячи з даних щодо зменшення кількості інфекцій на тлі прийому з абатацепту порівняно з іФНП у популяції пацієнтів з ревматоїдним артритом [36]. Якщо пацієнт надає перевагу пероральній терапії, у цьому випадку лікар може використовувати тофацитиніб.
У пацієнтів з активним ПСА, незважаючи на терапію іФНП, другою лінією терапії є перш за все іІЛ–17, а не іІЛ–12/23, абатацепт або тофацитиніб. Серед перелічених груп препаратів іІЛ–12/23 в свою чергу більш ефективні, ніж абатацепт або тофацитиніб. ІІЛ–12/23 можуть розглядатися замість –іІЛ–17, якщо пацієнт має ЗЗК або бажає рідше вводити лікарський засіб. Абатацепт може розглядатися замість іІЛ–17 або іІЛ–12/23 у пацієнтів з рецидивуючою або серйозною інфекцією. Тофацитиніб може розглядатися замість біологічного препарату –іІЛ–17 або іІЛ–12/23 у пацієнтів, які віддають перевагу пероральній терапії або мають в анамнезі рецидивуючі або тяжкі інфекції, спричинені Candida [37]. Для кожного біологічного агента (іФНП, іІЛ–12/23 або іІЛ–17) монотерапія вважається більш доцільною, ніж поєднання з МТХ. Комбінована терапія біологічного агенту з МТХ може бути використана замість біологічної монотерапії за наявності тяжкого псоріазу, часткової відповіді на поточну терапію MTХ, наявності увеїту і якщо біологічним іФНП, що застосовується, є інфліксимаб або адалімумаб (для запобігання імуногенності) [38].
За обставин, коли для лікування ПсА використовують комбіновану терапію іФНП і МТХ, але зберігається активний ПсА, рекомендовано перехід на інший іФНП з МТХ, ніж монотерапія іншим іФНП. Продовження лікування MTХ під час прийому іФНП було визнано корисним, оскільки біологічні препарати можуть мати більш стійку ефективність при застосуванні в комбінації з MTХ [39]. Стратегія монотерапії іншим біологічним препаратом іФНП може бути використана, якщо пацієнт має побічні ефекти, пов’язані з MTХ, якщо він вважає за краще отримувати меншу кількість ліків або сприймає лікування МТХ як тягар. Комбінована терапія iІЛ–12/23 або iІЛ–17 з МТХ не рекомендується, бо монотерапія цими агентами вважається більш дієвою. Натомість, якщо на тлі лікування іІЛ–17 або іІЛ–12/23 спостерігається частковий ефект або пацієнт має супутній увеїт, можливо розглянути комбіновану терапію цих препаратів з МТХ [40].
Активний ПсА, незважаючи на монотерапію іІЛ-17 (рис. 5)
У пацієнтів з ПсА, в яких зберігається активність, незважаючи на лікування іІЛ–17, рекомендується перейти на іФНП, при цьому не рекомендується призначення іІЛ–12/23, додавання MTХ до –іІЛ–17, що використовується, або призначення іншого –іІЛ–17 [40].
Перехід на іІЛ–12/23 вважається більш ефективним, ніж додавання MTХ до іІЛ–17 або перехід на інший іІЛ–17. Якщо пацієнт має тяжкий псоріаз і протипоказання до терапії іФНП, іІЛ–17 слід замінити на іІЛ–12/23 [41].
Інший біологічний іІЛ–17 може бути використаний замість переходу на іФНП або іІЛ–12/23, якщо пацієнт має вторинну неефективність при використанні сучасного біологічного лікування, тяжкий псоріаз чи протипоказання до терапії іФНП [42]. MTХ може бути доданий до поточної терапії іІЛ–17 замість того, щоб перейти на іФНП або іІЛ–12/23 у пацієнтів, які мали часткову реакцію на іІЛ–17, яким вже лікувалися [42].
Активний ПсА, незважаючи на монотерапію іІЛ-12/23 (рис. 5)
У пацієнтів з активним ПсА, незважаючи на лікування іІЛ–12/23, рекомендується перейти на iФНП, додавання MTХ до поточного режиму або перехід на іІЛ–17. Перехід на іІЛ–17 є кращою стратегією, ніж додавання MTХ до існуючої терапії [43]. Лікування може бути замінено на іІЛ–17 замість іФНП, якщо пацієнт має тяжкий псоріаз або протипоказання до іФНП [42]. MTХ може бути доданий до біологічної терапії iІЛ–12/23 замість того, щоб перейти на iФНП або iІЛ–17 у пацієнтів з частковою реакцією на цю терапію; MTХ також може бути доданий до біологічної терапії iІЛ–12/23 замість заміни на іФНП за наявності протипоказань до іФНП [20].
Т2Т (Treat-to-target) терапія
У пацієнтів з активним ПсА рекомендується застосувати відому стратегію Т2Т (Treat–to–target) — лікування до досягнення мети. Відмова від даної стратегії можлива в пацієнтів, в яких виникають занепокоєння, пов’язані з посиленням і виникненням несприятливих і побічних подій, витратами на терапію та неможливістю контроля терапії біологічними агентами.
Активний ПсА зі спондилітом/осьовим ураженням, незважаючи на лікування НПЗП
Базисні пероральні препарати, на жаль,є неефективними при аксіальній формі ПсА [44]. У пацієнтів з активним осьовим ПсА, незважаючи на лікування НПЗП, рекомендується проводити терапію iФНП, препаратами наступної лінії є iІЛ–17, а далі — iІЛ–12/23. iІЛ–17 можуть використовуватися замість іФНП, якщо пацієнт має тяжкий псоріаз або протипоказання до лікування іФНП. ІІЛ–12/23 є найменш ефективними препаратами у цій клінічній ситуації, оскільки результати трьох рандомізованих досліджень з застосуванням устекінумабу демонструють відсутність досягнення первинних та вторинних кінцевих точок [45–47].
Активний ПсА з переважанням ентезитів у хворих, які не отримували лікування, й тих, хто отримував базисні пероральні препарати без ефекту
У пацієнтів з ентезитами, які не отримували лікування, як препарати першої лінії рекомендується використовувати біологічні агенти — іФНП [48]. У пацієнтів з активним ПсА з ентезитамим, незважаючи на лікування базисними пероральними препаратами (які застосувались в інших клінічних ситуаціях для інших проявів ПсА), рекомендується перейти на іФНП, iІЛ–17 або iІЛ–12/23, а не на інший препарат даної групи. Зазвичай іФНП є препаратами першої лінії, iІЛ–17 — другої, iІЛ–12/23 — третьої [48]. Якщо пацієнт має тяжкий псоріаз і протипоказання до терапії іФНП, слід почати лікування іІЛ–17. Якщо пацієнт надає перевагу менш частому введенню препарату, має ЗЗК, препаратом вибору є iІЛ–12/23. Апреміласт може використовуватися замість іФНП, якщо пацієнт надає перевагу пероральній терапії або має протипоказання до призначення іФНП [33]. Пероральні НПЗП за своєю ефективністю при ентезитах у пацієнтів із ПсА превалюють над базисними пероральними препаратами і можуть бути призначені, якщо у пацієнта немає серцево–судинних захворювань, виразкової хвороби, захворювання нирок (або порушення їх функції) або ж тяжкого псоріазу і ПсА. Тофацитиніб має більшу ефективність для лікування ПсА з переважанням ентезитів, ніж апреміласт [37]. Останній може мати переваги у використанні в пацієнтів з рецидивуючими інфекціями.
Активний ПсА у пацієнтів із супутнім активним ЗЗК
Для лікування пацієнтів з активним ПсА та супутнім активним ЗЗК, які не отримували лікування на попередніх етапах, препаратами вибору є іФНП (за виключенням етанерцепту, який є біологічною молекулою розчинних рецепторів та не виявляє ефективності при даній клінічній ситуації). Базисні пероральні препарати можуть використовуватися у пацієнтів без тяжкого ПсА, які надають перевагу оральній терапії або мають протипоказання до біологічної терапії іФНП [49].
У пацієнтів з активним ПсА і супутнім активним ЗЗК, незважаючи на лікування базисними препаратами, засобами вибору є моноклональні антитіла до ФНП або іІЛ–12/23. Перевагу потрібно віддавати моноклональним антитілам до ФНП–a, а не розчинному рецептору ФНП–a (етанерцепту). Моноклональні антітила до ФНП–a вважаються більш ефективними, ніж iІЛ–12/23. Останні можуть бути використані замість моноклональних антитіл до ФНП у пацієнтів з протипоказаннями до іФНП або у тих, хто надає перевагу менш частому введенню препарату [50].
Активний ПсА із супутніми захворюваннями
Активний ПсА у хворих з цукровим діабетом, які не отримували базисну пероральну терапію або біологічні агенти
Пацієнтам з активним ПсА та супутнім цукровим діабетом, які не отримували базисну пероральну терапію (МТХ, ЛЕФ, ССЗ, ЦСА) або біологічне лікування, рекомендується стартове призначення препаратів базисного ряду, за виключенням МТХ, а не біологічні агенти, у зв’язку із занепокоєнням щодо більш високої поширеності жирової хвороби печінки, високої гепатотоксичності МТХ та біологічних агентів у цієї групи пацієнтів [51, 52]. ІФНП може бути використаний замість базисної пероральної терапії при тяжкому ПсА або тяжкому псоріазі або при добре контрольованому діабеті (тобто з потенційно меншим ризиком інфекцій).
Активний ПсА у хворих з тяжкими інфекціями, які не отримували терапію базисними пероральними препаратами або біологічними агентами
У пацієнтів з активним ПсА та тяжкими інфекціями, які не отримували попередню терапію базисними пероральними препаратами або біологічними агентами, препаратами першої лінії є базисні препарати, а не іФНП, оскільки для іФНП серйозні інфекції є абсолютним протипоказанням до їх використання. Можливо розглядати такі біологічні агенти, як іІЛ–12/23 або іІЛ–17.
Проведення щеплень живими або інактивованими вакцинами пацієнтам з активним ПсА під час біологічного лікування
Рекомендується розпочати лікування біологічними агентами й вакцинувати вбитими інактивованими вакцинами на підставі віку пацієнта, статі та історії імунізації за рекомендаціями Центрів з контролю та профілактики захворювань у пацієнтів з активним ПсА, і не затримувати лікування. За необхідності щеплення живою ослабленою вакциною рекомендовано відстрочити початок біологічної терапії у пацієнтів з активним ПсА. Якщо прояви ПсА є тяжкими й затримка початку біологічної терапії є небажаною, може бути розглянута можливість початку лікування й введення живих ослаблених вакцин одночасно.
Рекомендації щодо нефармакологічних інтервенцій у пацієнтів з активним ПсА незалежно від фармакологічного лікування
Пацієнтам з активним ПсА рекомендуються певні фізичні вправи або їх комбінація, фізіотерапія, професійна терапія, масаж та акупунктура. Вправи з малим навантаженням (наприклад, тай–чи, йога, плавання) та вправи з високим навантаженням (наприклад, біг) треба обмежити. Вправи з високим навантаженням можуть виконуватися замість вправ з низьким навантаженням пацієнтами, які надають перевагу першим і не мають до них протипоказань. Клініцисти повинні заохочувати пацієнтів припинити куріння, пропонуючи різні засоби, через продемонстровану ефективність припинення куріння в рандомізованих дослідженнях [53, 54]. У пацієнтів з ПсА, які мають надлишкову масу тіла або ожиріння, рекомендується знизити масу, щоб потенційно збільшити фармакологічну реакцію лікарських засобів.
Висновки
Наведено рекомендації Американської колегії ревматологів 2018 року стосовно лікування псоріатичного артриту. Метою даних рекомендацій є надання медичним працівникам допомоги у менеджменті та оптимізації терапії ПсА у своїх пацієнтів. ПсА є гетерогенним і багатогранним запальним захворюванням, яке має різні клінічні особливості (периферичний артрит, псоріаз, ураження нігтів, ентезит, дактиліт, аксіальне захворювання), що потребують певного диференційного та поетапного підходу до терапії. Незважаючи на збільшення кількості нових методів терапії для ПсА, залишається обмеженим показник доказової ефективності для прийняття рішень щодо лікування. Рекомендації будуть оновлюватися, коли з’являться нові дані порівняльних досліджень.
ACR визнає, що переваги та вподобання пацієнтів є важливою частиною рекомендацій щодо лікування. Результати засідання групи пацієнтів обговорювалися на засіданнях групи спеціалістів для голосування, щоб переконатися, що погляд пацієнтів був включений до остаточних рекомендацій щодо ведення пацієнтів з ПсА. Приклади зворотного зв’язку з пацієнтами включали оцінку терапії, яка є ефективною (наприклад, запобігання подальшого ушкодження органів–мішеней, поліпшення якості життя, соціальної участі та функції) і безпечною (особливо з низькими профілями побічних подій). Зокрема, пацієнти обговорювали негативний вплив несприятливих явищ лікування (наприклад, втому, нудоту та нездужання) на якість життя та соціальну участь, і, отже, ризик цих небажаних подій сильно впливав на прийняття рішень пацієнтами та спеціалістами. Концепція лікування до цілі (Т2Т) була складною для пацієнтів. Хоча вони бачили цінність у поліпшенні результатів, але вважали, що ця стратегія може збільшити їх витрати: на лікування, подорожі для більш частих зустрічей з лікарем тощо і потенційно збільшити негативні ефекти терапії. Отже, для прий–няття рішень щодо лікування до цілі необхідно детально обговорити це з пацієнтом, забезпечити орієнтованість рекомендацій на пацієнтів.
Потенційними цілями лікування визначені шкали мінімальної активності захворювання (MDA) та активності при псоріатичному артриті (DAPSA) [55, 56]. ACR/NFP рекомендації щодо лікування активного ПсА пропонують не базисні пероральні засоби, а саме іФНП, як препарати першої лінії, окільки вони вірогідно запобігають прогресуванню захворювання та пошкодженню суглобів. У рекомендаціях Європейської протиревматичної ліги (EULAR) [11, 57] щодо ПсА члени колегії також не узгодили рішення з призначення базисних пероральних препаратів як засобів першої лінії. Наголошується на необхідності ранньої та агресивної терапії у пацієнтів з нововиявленим ПсА.
Проте рекомендації є умовними, і група експертів визнала декілька можливих винятків. Обставини, за яких пацієнт може вибрати базисні пероральні препарати (МТХ, ЛЕФ, ССЗ, ЦСА) замість біологічних агентів, — це хвороба легкого або помірного ступеня тяжкості, надання переваги оральній терапії або занепокоєння щодо несприятливих ефектів біологічних препаратів. ІФНП не є препаратами вибору у пацієнтів з протипоказаннями до них, включаючи серцеву недостатність, попередні серйозні інфекції, рецидивні інфекції або демієлінізуючі захворювання. У пацієнтів з супутнім ЗЗК група з голосування виступила з твердими рекомендаціями, що надає перевагу моноклональним антитілам до ФНП–a або іІЛ–12/23, а не іІЛ–17 або біологічним рецепторам ФНП (етанерцепт). Це ґрунтувалося на дослідженнях, які показали, що іФНП та устекінумаб (іІЛ–12/23) є ефективними для лікування ЗЗК, а етанерцепт (біологічний рецептор ФНП) і секукінумаб (іІЛ–17) — ні [49, 50].
Водночас було визнано, що ці рекомендації не враховують повну складність й гетерогенність ПсА або повний спектр можливої терапії (не розглядалися глюкокортикоїди). Високий ступінь неоднорідності в клінічній картині та перебігу ПсА, пов’язаних із залученням декількох доменів в одного пацієнта, не може бути врахований у єдиному алгоритмі. Крім того, звітування про заходи оцінки активності й тяжкості захворювання та відмінності в критеріях включення/виключення в клінічних випробуваннях ПсA ускладнюють порівняння методів терапії. Вплив альтернативної терапії на важливі наслідки, такі як пошкодження суглобів, ще має бути з’ясованим. Рекомендації щодо вакцинації на тлі лікування тофацитинібом не були включені до рекомендацій, оскільки вони ще не були схвалені для ПсА.
Оскільки на даний час Американська академія дерматології та Національная організація з псоріазу розробляють рекомендації з лікування псоріазу, наведені рекомендації не стосуються лікування ізольованого псоріазу.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів, при цьому автори не отримували від окремих осіб і організацій фінансової підтримки дослідження, гонорарів та інших форм винагород.
Інформація про внесок кожного автора: Головач І.Ю. — концепція і дизайн статті, огляд літератури з проблеми, написання й остаточна корекція тексту; Єгудіна Є.Д. — огляд літератури з проблеми, написання тексту, підготовка статті до друку.

/47-1.jpg)
/48-1.jpg)
/49-1.jpg)
/50-1.jpg)
/51-1.jpg)
/52-1.jpg)
/53-1.jpg)