Международный эндокринологический журнал Том 15, №2, 2019
Вернуться к номеру
Роль синдрома обструктивного апноэ сна в атеросклеротическом повреждении сонных артерий при сахарном диабете 2-го типа
Авторы: Дорошкевич И.П. (1), Мохорт Т.В. (2)
1 - УО «Гродненский государственный медицинский университет», г. Гродно, Беларусь
2 - УО «Белорусский государственный медицинский университет», г. Минск, Беларусь
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Актуальність. Синдром обструктивного апное сну є одним із найпоширеніших порушень сну. На цей час накопичено достатньо даних про негативний вплив синдрому обструктивного апное сну на розвиток хронічних ускладнень цукрового діабету (ЦД) 2го типу. Мета. Оцінювання стану ліпідного профілю крові та атеросклеротичних змін сонних артерій у пацієнтів із ЦД 2го типу залежно від наявності синдрому обструктивного апное сну. Матеріали та методи. У дослідженні взяли участь 55 чоловіків. Усім пацієнтам виконано полісомнографічне дослідження, ультразвукове дослідження сонних артерій, визначення показників глікованого гемоглобіну, загального холестерину, тригліцеридів, ліпопротеїнів високої і низької щільності, визначення антропометричних показників. Учасники дослідження розподілені на 3 групи: група 1 (n = 15) — пацієнти з ЦД 2го типу без синдрому обструктивного апное сну, група 2 — пацієнти з ЦД 2го типу та синдромом обструктивного апное сну, група 3 — пацієнти із синдромом обструктивного апное сну без порушень вуглеводного обміну. Результати. Аналіз результатів вказує на те, що синдром обструктивного апное сну відзначається у 73 % випадків у пацієнтів із ЦД 2го типу (у 28 % пацієнтів — синдром обструктивного апное сну середнього ступеня тяжкості та в 42 % — тяжкого ступеня). У групах пацієнтів із синдромом обструктивного апное сну відзначається зниження коефіцієнта ефективності сну, тривалості сну, подовження тривалості неспання після засипання. Збільшення індексу апное/гіпопное сну пов’язано зі збільшенням рівня загального холестерину, ліпопротеїнів низької щільності, тригліцеридів у пацієнтів із ЦД 2го типу та синдромом обструктивного апное сну. Значення товщини комплексу інтимамедіа сонної артерії у групах із синдромом обструктивного апное сну корелює з більшим навантаженням індексу апное/гіпопное і зниженням насичення крові киснем; збільшення товщини комплексу інтимамедіа в 100 % випадків пов’язано з наявністю хропіння. Висновки. Синдром обструктивного апное сну у пацієнтів із ЦД 2го типу і надмірною масою тіла у поєднанні з нічною гіпоксемією і хропінням пов’язаний із розвитком атеросклерозу сонних артерій.
Актуальность. Синдром обструктивного апноэ сна является одним из распространенных нарушений сна. В настоящий момент накоплено достаточно данных о негативном влиянии синдрома обструктивного апноэ сна на развитие хронических осложнений сахарного диабета (СД) 2-го типа. Цель. Оценка состояния липидного профиля крови и атеросклеротических изменений сонных артерий у пациентов с СД 2-го типа в зависимости от наличия синдрома обструктивного апноэ сна. Материалы и методы. В исследовании приняли участие 55 мужчин. Всем пациентам выполнено полисомнографическое исследование, ультразвуковое исследование сонных артерий, определение показателей гликированного гемоглобина, общего холестерина, триглицеридов, липопротеинов высокой и низкой плотности, антропометрических показателей. Участники исследования разделены на 3 группы: группа 1 (n = 15) — пациенты с СД 2-го типа без синдрома обструктивного апноэ сна, группа 2 — пациенты с СД 2-го типа и синдромом обструктивного апноэ сна, группа 3 — пациенты с синдромом обструктивного апноэ сна без нарушений углеводного обмена. Результаты. Анализ результатов указывает на то, что синдром обструктивного апноэ сна встречается в 73 % случаев у пациентов с СД 2-го типа (28 % пациентов — синдром обструктивного апноэ сна средней степени тяжести и 42 % — тяжелой степени). В группах пациентов с синдромом обструктивного апноэ сна отмечается снижение коэффициента эффективности сна, продолжительности сна, удлинение продолжительности бодрствования после засыпания. Увеличение индекса апноэ/гипопноэ сна связано с увеличением уровня общего холестерина, липопротеинов низкой плотности, триглицеридов у пациентов с СД 2-го типа и синдромом обструктивного апноэ сна. Значение толщины комплекса интима-медиа сонной артерии в группах с синдромом обструктивного апноэ сна коррелирует с увеличением индекса апноэ/гипопноэ и снижением насыщения крови кислородом; увеличение толщины комплекса интима-медиа в 100 % случаев связано с наличием храпа. Выводы. Синдром обструктивного апноэ сна у пациентов с СД 2-го типа и избыточной массой тела в сочетании с ночной гипоксемией и храпом связан с развитием атеросклероза сонных артерий.
Background. Obstructive sleep apnea syndrome is а common sleep disorders. There is now sufficient evidence of the negative impact of obstructive sleep apnea syndrome on the development of chronic complications of type 2 diabetes mellitus (DM). We investigated blood lipids and atherosclerotic changes in the carotid arteries in patients with type 2 DM depending on the presence of obstructive sleep apnea syndrome. Materials and methods. All participants with type 2 DM underwent polysomnography and ultrasound examination of the carotid arteries as well as the levels of glycated haemoglobin, highdensity lipoprotein cholesterol, lowdensity lipoprotein cholesterol, total cholesterol, triglycerides and anthropometric parameters were assessed. The participants were divided into 3 groups: group 1 included patients with type 2 DM without obstructive sleep apnea syndrome, group 2 consisted of patients with type 2 DM and obstructive sleep apnea syndrome, group 3 involved patients with obstructive sleep apnea syndrome without type 2 DM. Results. Seventythree percent patients with type 2 DM (28 % patients with moderate obstructive sleep apnea syndrome and 42 % — severe obstructive sleep apnea syndrome) experienced obstructive sleep apnea syndrome. The patients with obstructive sleep apnea syndrome were found to have reduced sleep efficiency, sleep duration, extension of hypnagogic state after falling asleep. The increased sleep apnea/hypopnea index is associated with an elevated total cholesterol, lowdensity lipoprotein, triglycerides in patients with type 2 DM and obstructive sleep apnea syndrome. In groups with obstructive sleep apnea syndrome, the carotid artery intimamedia thickness correlates with increased apnea/hypopnea index and the reduction in blood oxygen saturation; the increased carotid artery intimamedia thickness was associated with snoring in 100 % of cases. Conclusions. Obstructive sleep apnea syndrome in patients with type 2 DM and overweight in combination with nocturnal hypoxemia and snoring is associated with the development of carotid atherosclerosis.
цукровий діабет; апное сну; атеросклероз; індекс апное/гіпопное
сахарный диабет; апноэ сна; атеросклероз; индекс апноэ/гипопноэ
diabetes mellitus; sleep apnea; atherosclerosis; apnea/hypopnea index
Введение
Синдром обструктивного апноэ сна (СОАС) является одним из наиболее распространенных нарушений сна. Это состояние характеризуется периодическим спадением верхних дыхательных путей на уровне глотки и прекращением легочной вентиляции при сохраняющихся дыхательных усилиях, снижением степени насыщения крови кислородом, храпом, грубой фрагментацией сна и избыточной дневной сонливостью [1].
В настоящее время накоплено достаточно данных о СОАС как о независимом факторе риска развития артериальной гипертензии (АГ), нарушений ритма и проводимости сердца, ишемии миокарда, когнитивной дисфункции, нарушений мозгового кровообращения, патологии углеводного обмена, в частности — сахарного диабета (СД) 2–го типа [1–3]. Встречаемость сочетания СОАС и СД 2–го типа, по данным различных авторов, колеблется в диапазоне от 14,7 до 86 % [4–15]. Также накоплено достаточно информации о негативном влиянии СОАС на развитие хронических осложнений СД 2–го типа. Повреждение сосудов при СД 2–го типа связано с состоянием хронической гипергликемии, гиперинсулинемии, развитием дислипидемии, наличием сопутствующей патологии (например, АГ, ожирение и др.). Гипергликемия и гиперлипидемия приводят к повреждению эндотелия сосудов, провоцируют развитие оксидативного стресса с гиперпродукцией митохондриями активных форм кислорода [16, 17]. Определенная роль в развитии патологии сосудов отводится СОАС, сопровождающемуся снижением сатурации, и зависит от тяжести и продолжительности остановок дыхания во сне [18]. Эпизоды апноэ сна приводят к чередованию циклов гипоксемии и реоксигенации, продолжительной симпатической активности, колебаниям внутригрудного давления, вызывая повреждение сосудистой стенки и более раннее развитие атеросклероза [1, 19, 20].
Цель исследования: оценить состояние липидного профиля крови и атеросклеротические изменения сонных артерий у пациентов с СД 2–го типа в зависимости от СОАС.
Материалы и методы
В исследовании приняли участие 55 мужчин с диагнозом СД 2–го типа в возрасте от 37 до 48 лет, получивших в результате тестирования с использованием шкалы сонливости Эпворта [21] более 10 баллов. Нами использован элементарный опросник сна, состоящий из восьми вопросов и позволяющий оценить возможность наступления сна в определенной ситуации по трехбалльной шкале (от 0 до 3 баллов, где 0 баллов соответствуют ответу «не усну никогда», 3 балла — «усну обязательно»). У пациентов не было установлено по данным амбулаторной карты атеросклеротических заболеваний сердечно–сосудистой системы, и они не использовали гиполипидемическую терапию. Всем участникам исследования проведена оценка антропометрических показателей (рост, вес, расчет индекса массы тела (ИМТ)), измерение артериального давления, определение биохимических показателей гликированного гемоглобина (НbА1с); креатинина, общего холестерина (ОХС); липопротеинов низкой плотности (ЛПНП); липопротеинов высокой плотности (ЛПВП); триглицеридов (ТГ) в крови с использованием автоматического анализатора Architectc 8000 (Abbott, США). Для выявления нарушений дыхания во сне и определения некоторых сомнологических показателей проведено полисомнографическое (ПСГ) мониторирование с помощью аппарата SOMNOlab 2 (R & K) (Weinmann, Германия). Для выполнения данной работы использованы следующие показатели ПСГ: индекс апноэ/гипо–пноэ (ИАГ), степень насыщения крови кислородом (SpO2), средняя (ср) и максимальная (макс) продолжительность обструктивного апноэ (ОА) сна, коэффициент эффективности сна (КЭС), продолжительность бодрствования после засыпания (ПБПЗ), общее время сна (ОВС).
Для выявления атеросклеротического поражения сонных артерий проводилась оценка толщины комплекса интима–медиа (ТКИМ) правой и левой общих сонных артерий (ОСА) с получением среднего значения двух величин при помощи ультразвукового аппарата Toshiba SSA–790A (Япония) в В–режиме.
В процессе исследования по результатам ПСГ все пациенты были разделены на 3 группы в зависимости от наличия СОАС. Группу 1 (n = 15) составили пациенты с СД 2–го типа без СОАС, группу 2 (n = 25) — пациенты с СД 2–го типа и СОАС, в группу 3 вошли пациенты с СОАС без нарушений углеводного обмена (n = 15). Клиническая характеристика пациентов приведена в табл. 1.
Статистический анализ выполнялся с помощью компьютерных программ Statistiсa 10.0 (Stat Soft Inc., США), Excel for Windows (1997–2003) Stat Soft/Statistica 10.
Результаты
Участники исследования с СД 2–го типа в группах 1 и 2 достоверно различались по значению НbА1с с пациентами группы 3, что определено дизайном исследования (р < 0,05). Однако показатель НbА1с превышал допустимое целевое значение НbА1с в группах 1 и 2 (согласно рекомендациям Американской диабетической ассоциации 2019 г., показатель НbА1с менее 7,0 % необходим для поддержания адекватного гликемического контроля [22]).
Результаты анкетирования с использованием шкалы оценки сонливости Эпворта свидетельствуют о чрезмерной дневной сонливости у всех участников исследования. Кроме того, пациенты предъявляли жалобы на храп и имели избыточную массу тела или ожирение, факторы, позволяющие предположить наличие СОАС, поэтому с целью уточнения наличия патологии нами было выполнено ПСГ–исследование.
В табл. 2 приведены данные ПСГ–мониторирования, являющегося золотым стандартом в диагностике СОАС.
Анализ данных ПСГ свидетельствует о подтвержденном диагнозе СОАС у пациентов второй и третьей групп, а именно: преобладание ИАГ у пациентов группы 2 и группы 3 над группой 1 (34,60 и 29,60 эпизодов/ч против 4,80 эпизодов/ч в группе 2; p < 0,001); наименьшее значение SpO2 зарегистрировано во второй группе пациентов — 76,10 % при сравнении с группами 1 (94,50 %; р = 0,001) и 3 (82,00 %; р = 0,005) и является подтверждением наличия ночной гипоксемии у пациентов с СОАС. В группах 2 и 3 регистрируются наибольшие значения показателей средней и максимальной длительности ОА сна (34,30 и 24,50 с против 11,70 с (р = 0,001 и р = 0,002); 51,00 и 30,00 с против 16,00 с (р = 0,001 и р = 0,001)).
Оценка храпа, выраженная в процентном соотношении в зависимости от общего времени сна, резко различалась у пациентов с СОАС (группы 2 и 3) и без него (группа 1) — 54 и 42 % против 12 % (для всех групп сравнения р < 0,001). У пациентов с СД 2–го типа и СОАС, а также в группе пациентов только с наличием СОАС отмечается низкое значение КЭС (76 и 78 % против 83 %, p < 0,031 и р < 0,039) и наи–более длительная ПБПЗ (110,00 и 98 мин против 31 мин, р < 0,001 для всех групп сравнения). Общепризнано, что КЭС является индикатором качества сна и в норме его значение должно быть 85 % и более. Показатель КЭС зависит от значений ОВС, которые менее продолжительны в группах 2 и 3: 326 и 360 мин против 420 мин в группе 1 (р = 0,021, р = 0,031). В результате анализа отмечена отрицательная корреляционная зависимость между показателями ОВС и ИАГ, SpO2 (r = –0,438, r = 0,634) в группе 2 и группе 3 (r = –0,398, r = –0,574), что связано с продолжительными эпизодами апноэ сна и показателем SpO2, приводящими к пробуждению и, соответственно, удлинению ПБПЗ.
Таким образом, из всех обследованных пациентов с СД 2–го типа, принявших участие в исследовании, по результатам ПСГ установлено, что СОАС встречается в 73 % случаев у пациентов с СД 2–го типа, что согласуется с данными литературы [4–15]. Руководствуясь современной классификацией СОАС, предложенной Американской академией сна [23], среди всех пациентов с СД 2–го типа СОАС средней степени тяжести составляет 28 % (ИАГ от 15 до 30 эпизодов/ч) и тяжелой степени — 42 % (ИАГ свыше 30 эпизодов/ч).
Результаты исследования липидного профиля пациентов отражены в табл. 3.
Анализируя результаты исследования, авторы установили, что у пациентов второй группы показатель ОХС равен 6,6 ммоль/л, превышает на 1,45 ммоль/л показатель группы 1 (5,15 ммоль/л; р = 0,002) и выше показателя группы 3 на 1,39 ммоль/л (5,29 ммоль/л; р = 0,031). Значение ЛПНП в группе пациентов с СД 2–го типа — 1,89 ммоль/л против 3,59 ммоль/л в группе 2 и 2,54 ммоль/л в группе 3 (р = 0,001; р = 0,001). Достоверные различия между группами получены при сравнении показателя ТГ. Так, наибольшее значение зарегистрировано у пациентов с СД 2–го типа (2,79 ммоль/л) и в группе больных с сочетанием СД 2–го типа и СОАС (2,52 ммоль/л) в сравнении с группой 3 пациентов с СД 2–го типа (1,79 ммоль/л) и СОАС (р = 0,0189; р = 0,024).
Все пациенты с СД 2–го типа относятся к группе с очень высоким сердечно–сосудистым риском. Целевые значения липидограммы у этой категории лиц должны укладываться в рекомендованные рамки [24]. Результаты липидного спектра участников нашего исследования с СД 2–го типа не соответствуют указанным критериям. В литературе также отмечено, что для пациентов с СД 2–го типа характерны изменения в липидограмме, отражающие повышенный уровень ТГ или сниженный уровень ЛПВП при нормальном значении ЛПНП, а также при минимальной длительности СД 2–го типа [24].
Обсуждение
Результаты исследования свидетельствуют о повышении уровня ЛПНП у всех пациентов с СД 2–го типа, а увеличение длительности СД 2–го типа коррелирует со значением ЛПНП (r = 0,437 и r = 0,501). Оценка сердечно–сосудистого риска для пациентов группы 3 проводится с использованием шкалы SCORE (Systematic Cоronary Risk Evaluation); эти лица относятся к категории с низким риском развития сердечно–сосудистых заболеваний в ближайшие 10 лет. Целевые значения липидограммы, в зависимости от риска сердечно–сосудистых заболеваний, должны составлять: ОХС ≤ 5,5 ммоль/л, ЛПВП > 1,0 ммоль/л, ЛПНП ≤ 3,5 ммоль/л, ТГ < 1,7 ммоль/л. Опираясь на указанные критерии, мы установили, что у пациентов группы 3 показатель ТГ превышает допустимое значение, а уровень ЛПВП ниже 1,0 ммоль/л [25–27].
Оценивая достоверность различий в классах дислипидемий, мы определили, что в группе пациентов с СД 2–го типа и СОАС преобладает гиперлипидемия 2б типа по сравнению с группой пациентов с CД 2–го типа без СОАС и группой 3 (р = 0,001; р = 0,013). Также установлено, что значения ОХС, ЛПНП, ТГ коррелируют с показателем ИАГ в группе 2 (r = 0,587; r = 0,513, r = 0,691) и в группе 3 (r = 0,407; r = 0,398, r = 0,372).
Таким образом, увеличение значения ИАГ, а соответственно, повышение степени тяжести СОАС, ассоциировано с повышенным риском развития атеросклероза и развитием высокоатерогенного 2б типа гиперлипидемии [28] в группах пациентов с СОАС.
Все участники исследования не имели клинических признаков атеросклеротических повреждений сосудов, и для уточнения состояния стенки артерий проанализированы результаты ультразвукового исследования СА. Оценку повреждения артерий проводили по показателю ТКИМ, согласно нормам, предложенным Европейским обществом по гипертонии и Европейским обществом кардиологов [29]. Результаты интерпретировались следующим образом: увеличение показателя ТКИМ расценивали при результате от ≥ 0,9 до < 1,3 мм; критерий атеросклеротической бляшки (АБ) — ТКИМ ≥ 1,3 мм, или локальное увеличение ТКИМ на 0,5 мм (или на 50 %) по сравнению с величиной ТКИМ близких участков сосудистой стенки.
Анализ результатов исследования свидетельствует об увеличении ТКИМ в группах 2 и 3 по сравнению с группой 1 (1,10 [0,92; 1,20] и 0,95 [0,90; 0,98] против 0,83 [0,81; 0,87] (р = 0,001 для двух групп сравнения)).
Среди пациентов с СОАС и СД 2–го типа в 16 % случаев (4 человека из 25) ТКИМ составляет ≥ 1,3 мм, что является признаком АБ (СА).
Полученные результаты указывают на увеличение ТКИМ у пациентов с СОАС, являющимся ранним признаком атеросклеротического повреждения сосудистой стенки [15] и самостоятельным фактором риска развития транзиторных ишемических атак, мозговых инсультов и инфарктов миокарда [30, 31].
У лиц мужского пола ТКИМ общих сонных артерий более 1,17 мм в 2 раза увеличивает риск развития транзиторной ишемической атаки [32]. Увеличение данного показателя на 0,1 мм выше допустимых значений (более 0,9 мм) повышает шанс возникновения инфаркта миокарда на 11 % [33]. Показатель АБ является лучшим предиктором развития нарушений мозгового кровообращения, чем среднее значение ТКИМ [34].
Тесная взаимосвязь утолщения стенки сонной артерии и риска развития кардиальных и цереброваскулярных осложнений ассоциируется с высокой частотой встречаемости повышенных значений ТКИМ у бессимптомных пациентов с высоким риском сердечно–сосудистых осложнений [35, 36].
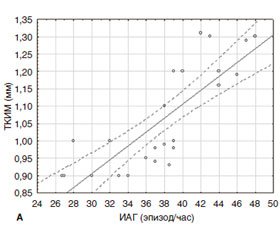
Оценку связи между ИАГ и показателем ТКИМ мы провели с помощью корреляционного анализа и установили положительную зависимость между утолщением ТКИМ (0,9–1,2 мм) и ИАГ в группе 2 и 3 (r = 0,819; r = 0,890) (рис. 2).
Полученные данные согласуются с данными других исследований, указывающими на связь между ИАГ и ТКИМ. M.M. Ciccone и др. описывают не только положительную взаимосвязь между значением ИАГ и ТКИМ у пациентов с ожирением, дислипидемией и СД 2–го типа, но и влияние длительности СОАС на ТКИМ [23]. B. Salepci и соавт. в результатах своей работы подтверждают, что ТКИМ сонной артерии является ранним признаком развития атеросклероза, а утолщение ТКИМ ассоциируется с СОАС и увеличивается с повышением степени его тяжести [37].
Также определена зависимость между SpO2 и ТКИМ в группах пациентов с СОАС 2 и 3 (r = –0,545; r = –0,496). Полученный результат находит подтверждение и в исследовании N. Sarioglu и соавт., в котором отмечена отрицательная корреляционная зависимость между ТКИМ и минимальным значением SpO2, а также положительная зависимость с индексом десатурации [38].
Как видим, СОАС, сопровождающийся снижением сатурации менее 90 %, является важным фактором повреждения сосудистой стенки [39–41].
Еще одним признаком наличия СОАС является храп. Распространенность атеросклеротического повреждения сосудов у пациентов с храпом, продолжительность которого составляет более 50 % от ОВС, встречается в 64 % случаев [42]. Результаты нашего исследования демонстрируют увеличение ТКИМ в 100 % случаев в группе пациентов с СОАС и СД 2–го типа, у которых доля храпа составляет 54 % от ОВС, и в 94 % случаев у пациентов только с СОАС, у которых доля храпа составляет 42 % от ОВС. Негативное действие храпа связывают с явлением вибрации, возникающей во время эпизодов апноэ сна и распространяющейся на сосуды шеи. Этот механизм приводит к повреждению эндотелиальных клеток, выстилающих СА, развитию эндотелиальной дисфункции, являющейся предшественником развития атеросклероза [43].
Таким образом, можно заключить, что СОАС тяжелой и средней степени тяжести в сочетании с ночной гипоксемией и храпом ассоциирован с развитием атеросклероза СА у пациентов с избыточной массой тела. Своевременное выявление данной патологии и назначение консервативной терапии дыхательных нарушений сна, возможно, сможет предотвратить повреждение сосудистой стенки СА у пациентов с СОАС.
Выводы
1. У пациентов в группах 2 и 3 отмечается снижение КЭС (76 и 78 % соответственно), что свидетельствует о снижении эффективности сна, плохом его качестве, сокращении ОВС и удлинении ПБПЗ.
2. СОАС средней и тяжелой степени встречается у пациентов с СД 2–го типа в 73 % случаев (28 % — СОАС средней степени тяжести и 42 % — тяжелой степени).
3. ИАГ ассоциирован с увеличением ОХС, ЛПНП, ТГ в группе 2 (r = 0,587; r = 0,513, r = 0,691) и группе 3 (r = 0,407; r = 0,398, r = 0,372). Таким образом, можно предположить, что увеличение ИАГ взаимосвязано с увеличением указанных значений липидограммы.
4. Наибольший показатель ТКИМ СА отмечен в группах 2 и 3 (1,10 и 0,95 мм соответственно). Повышение ТКИМ СА коррелирует с увеличением степени тяжести ИАГ (r = 0,819; r = 0,890) и со снижением SpO2 (r = –0,545; r = –0,496).
5. Увеличение значения ТКИМ СА в 100 % случаев связано с наличием храпа, продолжительность которого составляет 54 % от ОВС.
Конфликт интересов. Авторы заявляют об отсутствии какого–либо конфликта интересов при подготовке данной статьи.
Информация о вкладе каждого автора:
Мохорт Т.В. — концепция и дизайн исследования, написание и редактирование текста;
Дорошкевич И.П. — сбор и обработка материалов, написание и редактирование текста.

/74-1.jpg)
/75-1.jpg)
/76-1.jpg)
/77-1.jpg)