Международный эндокринологический журнал Том 15, №2, 2019
Вернуться к номеру
Особливості змін антикоагулянтної та згортальної ланок системи гемостазу в пацієнтів з ішемічною хворобою серця в поєднанні з цукровим діабетом 2-го типу
Авторы: Золотухіна Ю.О.
Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Київська клінічна лікарня на залізничному транспорті № 2 філії «Центр охорони здоров’я» Публічного акціонерного товариства «Українська залізниця», м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Актуальність. Вияв особливостей регуляторних механізмів плазмового гемостазу у хворих на ішемічну хворобу серця (ІХС) із супутнім цукровим діабетом (ЦД) 2-го типу викликає теоретичний та практичний інтерес, оскільки дасть змогу, з одного боку, встановити їх взаємозв’язок з клінічними проявами і таким чином прогнозувати виникнення і розвиток ускладнень, а з іншого — розробити додаткові діагностичні, лікувальні, профілактичні підходи до ведення цієї категорії хворих. Мета роботи: вивчити та проаналізувати стан антикоагулянтної та згортальної активності крові в пацієнтів з ІХС та ІХС із супутнім ЦД 2-го типу. Матеріали та методи. Обстежено 50 хворих, госпіталізованих у кардіологічне й ендокринологічне відділення Київської клінічної лікарні на залізничному транспорті № 2 з клінічними ознаками ІХС. Хворих розподілено на дві групи: 25 пацієнтів з ІХС, 25 — з ІХС та з ЦД 2-го типу. Результати. Коморбідний перебіг ІХС та ЦД 2-го типу характеризується активацією всіх ланок згортання крові з переважною активацією кінцевого етапу — утворення кров’яного згустка, про що свідчить статистичне значуще вкорочення тромбінового часу на 17,6 % (р < 0,001), а також підвищення рівня фібриногену на 39,6 % (р < 0,001) порівняно з контрольною групою. У вказаній групі хворих спостерігається суттєве зниження антикоагулянтного потенціалу. Гіперкоагуляційні зрушення в системі гемостазу відбувалися на фоні пригнічення власного антикоагулянтного потенціалу крові. Зміни згортального потенціалу при поєднанні ЦД 2-го типу характеризувалися пришвидшенням процесів згортання одразу в усіх трьох етапах згортання (протромбіназо-, тромбіно- та фібриноутворення). Висновки. У пацієнтів з ІХС без супутньої патології та у хворих на ІХС у поєднанні з ЦД 2-го типу спостерігаються пригнічення антикоагулянтної активності та збільшення згортального потенціалу крові, що, зі свого боку, сприяє збільшенню ризику судинних захворювань.
Актуальность. Проявление особенностей регуляторных механизмов плазменного гемостаза у больных ишемической болезнью легких (ИБС) с сопутствующим сахарным диабетом (СД) 2-го типа вызывает теоретический и практический интерес, поскольку дает возможность, с одной стороны, установить их взаимосвязь с клиническими проявлениями и, таким образом, прогнозировать возникновение и развитие осложнений, а с другой — разработать дополнительные диагностические, лечебные, профилактические подходы к ведению этой категории больных. Цель работы: изучить и проанализировать состояние аникоагулянтной и свертывающей активности крови у пациентов с ИБС и ИБС с сопутствующим СД 2-го типа. Материалы и методы. Обследованы 50 больных, которые были госпитализированы в кардиологическое и эндокринологическое отделение Киевской клинической больницы на железнодорожном транспорте № 2 с клиническими признаками ИБС. Больных разделили на две группы: 25 пациентов — с ИБС и 25 — с ИБС и с СД 2-го типа. Результаты. Коморбидное течение ИБС и СД 2-го типа характеризуется активацией всех звеньев свертывания крови с преимущественной активацией конечного этапа — образования кровяного сгустка, о чем свидетельствует статистическое значимое укорочение ТЧ на 17,6% (р < 0,001), а также повышения уровня фибриногена на 39,6 % (р < 0,001) относительно контрольной группы. Антикоагулянтный потенциал также был более выражен в этой группе больных. В указанной группе больных наблюдается существенное снижение антикоагулянтного потенциала. Гиперкоагуляционные сдвиги в системе гемостаза происходили на фоне угнетения собственного антикоагулянтного потенциала крови. Изменения свертывающего потенциала при сочетании СД 2-го типа характеризовались ускорением процессов свертывания сразу во всех трех этапах свертывания (протромбиназо-, тромбино- и фибринообразования). Выводы. Данные показали, что у пациентов с ИБС без сопутствующей патологии и у больных ИБС в сочетании с СД 2-го типа наблюдаются угнетение антикоагулянтной активности и активация свертывающего потенциала крови, что в свою очередь способствует увеличению риска сосудистых заболеваний.
Background. Determining the features of regulatory mechanisms of plasma hemostasis in patients with coronary artery disease (CAD) and concomitant type 2 diabetes mellitus (DM) is of theoretical and practical interest, as it gives an opportunity, on the one hand, to establish their correlation with clinical manifestations and, thus, to predict the occurrence and development of complications, and on the other — to work out the additional diagnostic, curative, preventive approaches to the management of these patients. The purpose of the work is to study and analyze the state of anticoagulant and coagulant activity in patients with CAD and CAD with concomitant type 2 DM. Materials and methods. During the study of the anticoagulant and coagulant system, 50 patients were hospitalized in the cardiology and endocrinology department of the Kyiv Railway Clinical Hospital No. 2 with clinical signs of coronary artery disease. We selected 25 patients with CAD, and 25 — with CAD and type 2 DM. Results. We found that the comorbidity of CAD and type 2 diabetes mellitus is characterized by activation of all blood coagulation units, with a predominant activation of the final stage — the formation of a blood clot, as evidenced by statistically significant shortening of prothrombin time by 17.6 % (p < 0.001), and an increase in fibrinogen level by 39.6 % (p < 0.001) compared to the control group. In this group of patients, there was a significant decrease in the anticoagulant potential. Hypercoagulation shifts in the hemostasis system occurred against the background of inhibition of its own anticoagulant blood potential. The changes of coagulant potential in case of combination with type 2 DM were characterized by the acceleration of coagulation processes in all three stages of coagulation (prothrombinase, thrombin and fibrin formation). Conclusions. Data have shown that in patients with coronary artery disease without comorbidity and in people with coronary artery disease combined with type 2 diabetes mellitus, there is an inhibition of anticoagulant activity and an increase in the coagulant potential of the blood, which, in turn, increases the risk of vascular diseases.
тромбоз; гемостаз; ішемічна хвороба серця; антикоагулянтна система; згортальна система; цукровий діабет 2-го типу
тромбоз; гемостаз; ишемическая болезнь сердца; антикоагулянтная система; свертывающая система; сахарный диабет 2-го типа
thrombosis; hemostasis; coronary artery disease; anticoagulant system; coagulant system; type 2 diabetes mellitus
Вступ
Як показує статистика, близько 15 % населення України страждає від хронічної форми ішемічної хвороби серця (ІХС). За результатами оцінки 10-річного ризику розвитку фатальних серцево-судинних захворювань (ССЗ), у європейській популяції з урахуванням усіх чинників Україна належить до країн найвищого ризику. Результати п’ятирічного спостереження за пацієнтами з ІХС з ураженням двох та більше коронарних судин, які отримували медикаментозне лікування, свідчать, що 51 % із них переносять повторний інфаркт міокарда (ІМ) або коронарну смерть [1].
ІХС — хронічне захворювання, обумовлене атеросклеротичними відкладеннями в коронарних артеріях, що призводять до звуження просвіту уражених судин, так званого коронарного стенозу. Коронарний стеноз, зі свого боку, викликає порушення кровопостачання серцевого м’яза.
Атеросклеротичні відкладення можуть вражати не тільки коронарні артерії, а й мікросудини, роблячи їх жорсткими і нееластичними, тому приплив збагаченої киснем крові до міокарда значно зменшується. Порушення кровопостачання серцевого м’яза може бути також обумовлено спазмом великих і закупоркою (мікроваскуляцією) дрібних кровоносних судин. До стенозу (звуження) одночасно можуть бути схильні одна або декілька коронарних судин [2].
На сьогодні цукровий діабет (ЦД) розглядається як надзвичайно важливий фактор ризику розвитку ССЗ [3]. У дослідженні MRFIT (Multiple Risk Factor Intervention Trial) було показано, що в пацієнтів із ЦД 2-го типу ризик смерті від інсульту збільшується у 2,8 раза [4]. За даними Asia-Pacific Cohort Studies Collaboration, в якому брали участь 3305 пацієнтів із ЦД 2-го типу та 88 257 хворих без цього захворювання, ризик смерті від серцево-судинних причин був вірогідно вищим за наявності ЦД 2-го типу [5].
Зі свого боку, ЦД 2-го типу асоціюється з підвищеним ризиком розвитку атеросклерозу та ІХС, що є основною причиною смерті пацієнтів із діабетом [6]. Тромбоз є основною причиною смерті у 80 % пацієнтів із ЦД. Тривала гіперглікемія призводить до пошкодження судин за допомогою декількох механізмів, один із них — оксидативний стрес [6]. Порушення функціонального стану ендотелію, порушення гемостазу та метаболічний синдром відіграють важливу роль у розвитку ІХС, чим обумовлюють тяжкість перебігу та прогноз захворювання [7].
Синдром інсулінорезистентності може бути одним з основних механізмів діабетичної дисфункції ендотелію [7]. У пацієнтів із ЦД 2-го типу спостерігається прокоагулянтний стан, що також сприяє розвитку ССЗ. При ЦД відзначають підвищення рівня фібриногену, факторів VII, IX, XII, калікреїну та фактора Віллебранда. Цей гіперкоагуляційний стан може бути викликаний дисбалансом між гемостатичними факторами в плазмі та поверхнею ендотеліальних клітин [11].
Саме дисфункція клітин ендотелію, що деякі дослідники визначають як початкову ланку виникнення ангіопатії, артеріо- та атеросклерозу, може бути самостійною причиною формування захворювань з ішемічними симптомами (ІМ, стенокардія, порушення мозкового та периферичного кровообігу). В їх основі лежить дисбаланс тонусу судин та розлади ендотеліальної регуляції гемостазу, який зумовлює активацію тромбоутворення, виникнення коагулопатії [8], в інших ситуаціях — інтенсивне виділення факторів росту та хронічні дегенеративно-дистрофічні процеси в деяких структурах стінки судин у відповідь на пошкодження, участь у реакціях запалення, що, як правило, мають прокоагулянтну спрямованість [9].
Добре відомо, що судинний ендотелій відіграє важливу роль у регуляції місцевих гемостатичних процесів. Він є складним органом, основними функціями якого є бар’єрна, вазотонічна, секреторна та гемостатична. В ендотеліальній клітині секретуються та акумулюються прокоагулянтні й антикоагулянтні фактори [10].
Вияв особливостей регуляторних механізмів плазмового гемостазу у хворих на ІХС із супутнім ЦД 2-го типу має теоретичний та практичний інте–рес, оскільки дасть змогу, з одного боку, встановити їх взаємозв’язок із клінічними проявами і таким чином прогнозувати виникнення і розвиток ускладнень, а з іншого — розробити додаткові діагностичні, лікувальні, профілактичні підходи до ведення цієї категорії хворих.
Проблема поєднання цих двох прогностично складних станів все частіше потрапляє до уваги клініцистів і науковців. Але в літературі недостатньо даних про стан коагуляційної ланки гемостазу в пацієнтів з ІХС, асоційованої з ЦД 2-го типу. Патогенез тромботичних ускладнень при цих патологіях до кінця не з’ясований.
Таким чином, розробка методів діагностики стану згортання крові пацієнтів на ІХС у поєднанні з ЦД 2-го типу є актуальною науковою проблемою сучасної терапії, вирішення якої є важливим питанням.
Мета дослідження: вивчити та проаналізувати стан аникоагулянтної та згортальної активності крові в пацієнтів з ІХС без супутнього цукрового діабету 2-го типу та з ним.
Матеріали та методи
Обстежено 50 хворих, яких було госпіталізовано в кардіологічне й ендокринологічне відділення Київської клінічної лікарні на залізничному транспорті № 2 філії «Центр охорони здоров’я» Публічного акціонерного товариства «Українська залізниця» (клінічної бази кафедри пропедевтики внутрішніх хвороб № 1 Національного медичного університету ім. О.О. Богомольця) із клінічними ознаками ІХС. Обстежені хворі були розподілені на дві групи: 25 пацієнтів — з ІХС, 25 — з ІХС та з ЦД 2-го типу. До контрольної групи увійшли 25 відносно здорових осіб, порівнянних за віком та статтю.
Діагноз ІХС було встановлено на основі підтверджуючих даних перенесеного ІМ чи із серцевою недостатністю та за допомогою стандартних опитувальників. До критеріїв виключення відносили відсутність згоди пацієнта на участь у дослідженні, призначення лікування антитромботичними засобами (окрім ацетилсаліцилової кислоти) впродовж попередніх кількох місяців. Пацієнтів із наявністю супутньої патології в стані декомпенсації (підозрою на гостре порушення мозкового кровообігу, тяжкою печінковою та нирковою недостатністю, онкологічними захворюваннями, із діагностованими раніше захворюваннями системи гемостазу) у дослідження не залучали. У всіх обстежуваних хворих була наявна артеріальна гіпертензія (АГ) ІІ стадії.
Аналіз даних проводили за допомогою контро–льних карт, в які вносили паспортні, антропометричні дані, фактори ризику, особливості розвитку та перебігу захворювання, в тому числі ускладнення, результати лабораторних та інструментальних обстежень, програми лікування та реабілітації. Всі дані з карт обстеження хворих заносили до бази даних, створеної в програмі Statistica 13.0. В дослідженні були використані дані, отримані в рамках клініко-інструментального обстеження пацієнтів (ЕКГ у 12 відведеннях; функціональний стан міокарда, ступінь гіпертрофії лівого шлуночка, а також показники внутрішньосерцевої та центральної гемодинаміки за даними ЕхоКГ на апараті Aloka-2000 (Японія)).
З метою виявлення особливостей змін гемокоагуляції досліджувалась венозна кров, взята з ліктьової вени при надходженні хворого у відділення до початку лікування. Забір крові здійснювали з дотриманням усіх вимог, що висувають для коагулогічних досліджень, тобто проводили полістироловим шприцом у полістиролові центрифужні градуйовані пробірки з пробкою, що містили 1 об’єм стабілізатора (3,8% розчину натрію цитрату) і 9 об’ємів крові. Дослідження, згідно із загальноприйнятими методиками, проводили у бідній на тромбоцити плазмі. Для отримання безтромбоцитної плазми цитратну кров центрифугували при швидкості 3000 обертів/хвилину (1500 g) протягом 20 хвилин [12].
Стан згортальної ланки гемостазу вивчали за допомогою визначення тромбінового часу (ТЧ), протромбінового часу (ПТЧ) й активованого частково протромбінового часу (АЧТЧ), що проводили за стандартними коагулогічними методиками [13], які ґрунтуються на визначенні часу утворення згустка в разі штучного внесення в плазму факторів згортання крові. Для ТЧ таким чинником був тромбін (кінцева концентрація — 10 Од), для ПТЧ — тромбопластин та кальцію хлорид (0,025 моль/л), для АЧТЧ — еритрофосфатидилкоаліновий реактив та кальцію хлорид (0,025 моль/л). Використовували реактиви фірми Human (Німеччина).
Рівень фібриногену визначали за допомогою хронометричного методу [12, 13], який заснований на визначенні часу згортання розведеної цитратної плазми надлишком високоактивного тромбіну –(реактиви фірми Human, Німеччина).
Антикоагулянтний потенціал крові оцінювали за допомогою визначення вмісту природних антикоагулянтів — АТ-ІІІ та протеїну С (ПС). Методики визначення природних антикоагулянтів проводили із застосуванням біохімічного аналізатора Humalyser Junior (фірма Human, Німеччина). Використовувались реагенти фірм «РЕНАМ» та «Технологія-Стандарт» (Росія).
Результати
Під час дослідження було вивчено стан згортальної, антикоагулянтної активності крові в пацієнтів з ІХС та в поєднанні з ЦД 2-го типу.
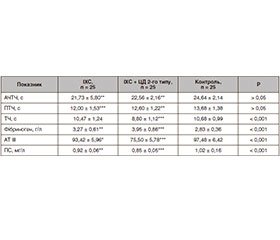
У групі хворих на ІХС АЧТЧ, який відповідає інтенсивності тромбогенезу за внутрішнім механізмом згортання крові, вкорочувався на 11,81 % порівняно з контролем (р < 0,01), ПТЧ — на 12,3 % (р < 0,001), рівень фібриногену підвищився — на 15,5 % (р < 0,01). З боку первинних антикоагулянтів відмічалось зниження їх рівня в плазмі АТ ІІІ на 4,2 % (р < 0,05), ПС — на 9,8 % (р < 0,01). Вірогідних змін ТЧ не виявлено.
У хворих на ІХС у поєднанні з ЦД 2-го типу спостерігалось скорочення всіх показників коагуляційного гемостазу: АЧТЧ — на 8,44 % (р < 0,01), ПТЧ — 7,89 % (р < 0,01), ТЧ — на 17,6 % (р < 0,001), а також підвищення рівня фібриногену на 39,6 % (р < 0,001), що свідчить про прискорення процесів згортання одразу в трьох ланках: скорочення періодів генерації активного тромбіну за внутрішнім та зовнішнім механізмами при одночасній активації процесів фіброгенезу (фактора ІІА і фібрину). Антикоагулянтний потенціал був знижений: АТ ІІІ — на 22,5 % (р < 0,001), а ПС — на 16,7 % (р < 0,001).
При порівнянні показників згортального й антикоагулянтного потенціалу крові між двома групами спостерігалась така ситуація. У пацієнтів із поєднаним перебігом ІХС та ЦД 2-го типу виявлено вірогідне скорочення останнього етапу утворення кров’яного згустка, ТЧ — на 16 % (р < 0,001), підвищення фібриногену — на 20,8 % (р < 0,001), а також пригнічення антикоагулянтної активності АТ ІІІ на 19,2 % (р < 0,001) та ПС на 7,6 % (р < 0,001) щодо хворих з ізольованою ІХС (табл. 1).
Слід зазначити, що гіперкоагуляційні зрушення в системі гемостазу відбувалися на тлі пригнічення власного антикоагулянтного потенціалу крові. Зміни згортального потенціалу при поєднанні ЦД 2-го типу відзначалися пришвидшенням процесів згортання одразу в усіх трьох етапах згортання (протромбіназо-, тромбіно- та фібриноутворення).
Обговорення
Останнім часом зростає кількість захворювань, при яких спостерігаються патологічні зміни системи гемостазу протромботичного або прогеморагічного характеру. Смертність від тромбоемболій становить 40–70 % від загальної смертності населення. У Європі частота тромбозів глибоких вен становить 160 випадків на 100 000 населення. У Франції на 55 млн населення щорічно відзначається 150 000 нових випадків тромбозів глибоких вен нижніх кінцівок, а у США з населенням більше 200 млн щорічно реєструється близько 600 000 пацієнтів із венозним тромбозом. В Англії 0,9 % від усіх госпіталізованих умирає від тромбоемболії легеневої артерії [14]. Значною залишається і захворюваність на геморагії.
Якщо їх причина неясна й адекватна терапія неможлива, кровотеча може призвести до тяжких ускладнень, інвалідизації хворого, а в деяких випадках — до смерті пацієнта [15]. Попри інтенсивні дослідження в галузі гемостазіології, проблема залишається невирішеною та на сьогодні з медичної перетворилася на медико-соціальну. Диференціальна діагностика порушень функціонального стану системи гемостазу за клінічними ознаками має низьку вірогідність. Для встановлення діагнозу необхідне проведення низки лабораторних тестів. Актуальним лабораторний контроль є і при проведенні моніторингу лікування препаратами, що впливають на систему гемостазу. Для досліджень системи гемостазу було розроблено ряд лабораторних методів.
Широко застосовується двохетапний підхід. Спочатку проводиться скринінг-дослідження окремих ланок реакцій тромбоутворення або тромболізу, а при виявленні змін вивчають активність реакцій ураженої ланки [16]. Лабораторна діагностика пов’язана з труднощами, які значно зменшують репрезентативність аналізу: система гемостазу відзначається високою варіабельністю — коливання активності окремих компонентів можуть змінюватися в нормі в широких межах під впливом чинників зовнішнього та внутрішнього середовища, а тому одним з основних завдань при діагностиці гемостазіопатій є створення репрезентативних референтних груп для порівняння показників пацієнтів з нормою та визначення типу і характеру перебігу патології [17]; лабораторіями часто приймається норма, що подається в довідниках або пропонується розробниками реагентів і встановлена на зразках крові представників популяції, відмінної від тієї, що обстежується цією лабораторією; особи для встановлення референтних інтервалів добираються емпірично, без урахування факторів, що можуть впливати на активність гемостатичних реакцій; методи, які включаються до скринінг-коагулограми, часто мають низьку аналітичну якість, не піддаються стандартизації; активність біологічних реагентів може змінюватися залежно від виробника та серії випуску, що при передачі результатів з однієї клініки до іншої або зміні серії реагенту може викликати похибки інтерпретації даних [18].
Висновки
1. Для пацієнтів з ІХС найбільші зміни в згортальній системі крові реєструються з боку внутрішнього та зовнішнього шляху згортання крові, а саме вкорочення АЧТЧ на 11,81 % (р < 0,01) та ПТЧ на 12,3 % (р < 0,001) та збільшення вмісту фібриногену на 39,6 % (р < 0,001) порівняно з контролем. З боку антикоагулянтної активності крові відзначається виснаження АТ ІІІ на 4,2 % (р < 0,05), ПС — на 9,8 % (р < 0,01).
2. У пацієнтів з ІХС із супутнім ЦД 2-го типу характерні активація всіх ланок згортання крові з переважною активацією кінцевого етапу, утворення кров’яного згустка, про що свідчить статистичне значуще вкорочення ТЧ на 17,6 % (р < 0,001), а також підвищення рівня фібриногену на 39,6 % (р < 0,001) щодо контрольної групи. У цій групі хворих антикоагулянтний потенціал також був більш вираженим: АТ ІІІ — на 22,5 % (р < 0,001), а ПС — на 16,7 % (р < 0,001).
3. Супутній до ІХС ЦД 2-го типу призводить до вірогідного пришвидшення останнього етапу утворення кров’яного згустка, на що вказує скорочення ТЧ на 16 % (р < 0,001), підвищення фібриногену — на 20,8 % (р < 0,001), а також пригнічення антикоагулянтної активності АТ ІІІ на 19,2 % (р < 0,001) та ПС — на 7,6 % (р < 0,001). Такі зміни свідчать про більш значне пригнічення антикоагулянтного потенціалу та гіперкоагуляційний стан у пацієнтів з ІХС у поєднанні з ЦД 2-го типу.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
- Roffi M, Patrono C, Collet JP, et al. 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: Task Force for the Management of Acute Coronary Syndromes in Patients Presenting without Persistent ST-Segment Elevation of the European Society of Cardiology (ESC). Eur Heart J. 2016 Jan 14;37(3):267-315. doi: 10.1093/eurheartj/ehv320.
- Steg PG, James SK, Atar D, et al. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J. 2012 Oct;33(20):2569-619. doi: 10.1093/eurheartj/ehs215.
- Levine GN, Bates ER, Bittl JA, et al. 2016 ACC/AHA Guideline Focused Update on Duration of Dual Antiplatelet Therapy in Patients With Coronary Artery Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. J Am Coll Cardiol. 2016 Sep 6;68(10):1082-115. doi: 10.1016/j.jacc.2016.03.513.
- Bhatt DL, Eagle KA, Ohman EM, et al. Comparative determinants of 4-year cardiovascular event rates in stable outpatients at risk of or with atherothrombosis. JAMA. 2010 Sep 22;304(12):1350-7. doi: 10.1001/jama.2010.1322.
- Jernberg T, Hasvold P, Henriksson M, Hjelm H, Thuresson M, Janzon M. Cardiovascular risk in post-myocardial infarction patients: nationwide real world data demonstrate the importance of a long-term perspective. Eur Heart J. 2015 May 14;36(19):1163-70. doi: 10.1093/eurheartj/ehu505.
- Scirica BM, Bonaca MP, Braunwald E, et al. Vorapaxar for secondary prevention of thrombotic events for patients with previous myocardial infarction: a prespecified subgroup analysis of the TRA 2°P-TIMI 50 trial. Lancet. 2012 Oct 13;380(9850):1317-24. doi: 10.1016/S0140-6736(12)61269-0.
- Bonaca MP, Bhatt DL, Cohen M, et al. Long-term use of ticagrelor in patients with prior myocardial infarction. N Engl J Med. 2015 May 7;372(19):1791-800. doi: 10.1056/NEJMoa1500857.
- Mauri L, Kereiakes DJ, Yeh RW, et al; DAPT Study Investigators. Twelve or 30 months of dual antiplatelet therapy after drug-eluting stents. N Engl J Med. 2014 Dec 4;371(23):2155-66. doi: 10.1056/NEJMoa1409312.
- Antonucci E, Poli D, Tosetto A, et al; START-Register. The Italian START-Register on Anticoagulation with Focus on Atrial Fibrillation. PLoS One. 2015 May 22;10(5):e0124719. doi: 10.1371/journal.pone.0124719.
- Bohula EA, Bonaca MP, Braunwald E, et al. Atherothrombotic Risk Stratification and the Efficacy and Safety of Vorapaxar in Patients With Stable Ischemic Heart Disease and Previous Myocardial Infarction. Circulation. 2016 Jul 26;134(4):304-13. doi: 10.1161/CIRCULATIONAHA.115.019861.
- Costa F, van Klaveren D, James S, et al. Derivation and validation of the predicting bleeding complications in patients undergoing stent implantation and subsequent dual antiplatelet therapy (PRECISE-DAPT) score: a pooled analysis of individual-patient datasets from clinical trials. Lancet. 2017 Mar 11;389(10073):1025-1034. doi: 10.1016/S0140-6736(17)30397-5.
- Stefanescu Schmidt AC, Kereiakes DJ, Cutlip DE, et al; DAPT Investigators. Myocardial Infarction Risk After Discontinuation of Thienopyridine Therapy in the Randomized DAPT Study (Dual Antiplatelet Therapy). Circulation. 2017 May 2;135(18):1720-1732. doi: 10.1161/CIRCULATIONAHA.116.024835.
- Patti G, Cavallari I. Extended duration dual antiplatelet therapy in patients with myocardial infarction: A study-level meta-analysis of controlled randomized trials. Am Heart J. 2016 Jun;176:36-43. doi: 10.1016/j.ahj.2016.03.005.
- Secemsky EA, Yeh RW, Kereiakes DJ, et al; Dual Antiplatelet Therapy Study Investigators. Extended Duration Dual Antiplatelet Therapy After Coronary Stenting Among Patients With Peripheral Arterial Disease: A Subanalysis of the Dual Antiplatelet Therapy Study. JACC Cardiovasc Interv. 2017 May 8;10(9):942-954. doi: 10.1016/j.jcin.2017.02.013.
- Bonaca MP, Bhatt DL, Storey RF, et al. Ticagrelor for Prevention of Ischemic Events After Myocardial Infarction in Patients With Peripheral Artery Disease. J Am Coll Cardiol. 2016 Jun 14;67(23):2719-2728. doi: 10.1016/j.jacc.2016.03.524.
- Mangiacapra F, Peace A, Barbato E, et al. Thresholds for platelet reactivity to predict clinical events after coronary intervention are different in patients with and without diabetes mellitus. Platelets. 2014;25(5):348-56. doi: 10.3109/09537104.2013.824562.
- Meredith IT, Tanguay JF, Kereiakes DJ, et al; DAPT Study Investigators. Diabetes Mellitus and Prevention of Late Myocardial Infarction After Coronary Stenting in the Randomized Dual Antiplatelet Therapy Study. Circulation. 2016 May 3;133(18):1772-82. doi: 10.1161/CIRCULATIONAHA.115.016783.
- Bhatt DL, Bonaca MP, Bansilal S, et al. Reduction in Ischemic Events With Ticagrelor in Diabetic Patients With Prior Myocardial Infarction in PEGASUS-TIMI 54. J Am Coll Cardiol. 2016 Jun 14;67(23):2732-2740. doi: 10.1016/j.jacc.2016.03.529.

/124-1.jpg)