Международный эндокринологический журнал Том 15, №3, 2019
Вернуться к номеру
Залежність літогенності жовчі від показників вуглеводного та ліпідного обмінів у хворих на цукровий діабет типу 2 із хронічним некалькульозним холециститом
Авторы: Марчук Ю.Ф., Пашковська Н.В., Андрійчук Д.Р., Федів О.І.
Вищий державний навчальний заклад України «Буковинський державний медичний університет», м. Чернівці, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Мета дослідження: виявити особливості зміни гомеостазу жовчі та основні каменеутворюючі субстрати при хронічному некалькульозному холециститі та цукровому діабеті (ЦД) типу 2. Матеріали та методи. Клінічне обстеження проведено в 60 осіб, хворих на ЦД типу 2 та хронічний некалькульозний холецистит, у 60 осіб, хворих на ізольований хронічний некалькульозний холецистит, та 20 практично здорових осіб. Проведено ретельне обстеження з використанням загальноприйнятих клінічних, лабораторних, біохімічних, інструментальних досліджень. Усім пацієнтам здійснено багатомоментне дуоденальне зондування. Визначено ліпідні спектри крові та міхурової порції жовчі. Результати. У хворих на хронічний некалькульозний холецистит, що перебігає на тлі ЦД типу 2, спостерігалися підвищення рівнів загальних ліпідів (у 1,61 раза в крові), холестеролу (у 2,04 раза у крові та 1,62 раза в жовчі), жовчних кислот (у 4,4 раза в крові) та зниження їх у жовчі (у 1,34 раза), тріацилгліцеролів (у 3,09 раза в крові), ліпопротеїнів низької щільності (у 1,2 раза в крові) і зниження вмісту ліпопротеїнів високої щільності (у 1,98 раза в крові) та фосфоліпідів (у 1,38 раза в крові та в 1,48 раза в жовчі), а також зниження двокомпонентних співвідношень «фосфоліпіди/холестерол» (у 1,8 раза) та «жовчні кислоти/холестерол» (у 1,9 раза), підвищення трикомпонентного індексу Ісаксона (у 1,85 раза), що свідчить про істотний дисбаланс ліпідного обміну як предиктора формування жовчних конкрементів у даної категорії хворих (р < 0,05). Висновки. У хворих на хронічний некалькульозний холецистит на тлі ЦД типу 2 спостерігаються вірогідно підвищені рівні загальних ліпідів, холестеролу, жовчних кислот, тріацилгліцеролів, ліпопротеїнів низької щільності на тлі зниження ліпопротеїнів високої щільності та фосфоліпідів у сироватці крові та жовчі. Встановлені кореляційні зв’язки між ліпідними спектрами сироватки крові та жовчі дають більш повну та детальну інформацію про порушення гомеостазу жовчі в різних групах пацієнтів. Основним каменеутворюючим субстратом в осіб першої групи виступав холестерол, а в осіб другої групи — знижений рівень ліпопротеїнів високої щільності.
Цель исследования: найти особенности изменения гомеостаза желчи и основные камнеобразующие субстраты при хроническом некалькулезном холецистите и сахарном диабете (СД) типа 2. Материалы и методы. Клиническое обследование проведено у 60 человек, больных СД типа 2 и хроническим некалькулезным холециститом, у 60 человек, больных изолированным хроническим некалькулезным холециститом, и у 20 практически здоровых лиц. Проведено тщательное обследование с использованием общепринятых клинических, лабораторных, биохимических, инструментальных исследований. Всем пациентам осуществлено многомоментное дуоденальное зондирование. Определены липидный спектр крови и пузырной порции желчи. Результаты. У больных хроническим некалькулезным холециститом на фоне СД типа 2 наблюдались повышение уровня общих липидов (в 1,61 раза в крови), холестерина (в 2,04 раза в крови и 1,62 раза в желчи), желчных кислот (в 4,4 раза в крови) и снижение их в желчи (в 1,34 раза), триацилглицеролов (в 3,09 раза в крови), липопротеинов низкой плотности (в 1,2 раза в крови) и снижение содержания липопротеинов высокой плотности (в 1,98 раза в крови) и фосфолипидов (в 1,38 раза в крови и в 1,48 раза в желчи), а также снижение двухкомпонентных соотношений «фософолипиды/холестерин» (в 1,8 раза) и «желчные кислоты/холестерин» (в 1,9 раза), повышение трехкомпонентного индекса Исаксона (в 1,85 раза), что свидетельствует о существенном дисбалансе липидного обмена как предиктора формирования желчных конкрементов у данной категории больных (р < 0,05). Выводы. У больных хроническим некалькулезным холециститом на фоне СД типа 2 наблюдаются достоверно повышенные уровни общих липидов, холестерина, желчных кислот, триацилглицеролов, липопротеинов низкой плотности на фоне снижения липопротеинов высокой плотности и фосфолипидов в сыворотке крови и желчи. Установленные корреляционные связи между липидным спектром сыворотки крови и желчи дают более полную и подробную информацию о нарушениях гомеостаза желчи в разных группах пациентов. Основным камнеобразующим субстратом у лиц первой группы выступал холестерол, а у лиц второй группы — сниженный уровень липопротеинов высокой плотности.
Background. The purpose of the study is to identify the features of changes in bile homeostasis and major stone-forming substrates in chronic acalculous cholecystitis and type 2 diabetes mellitus (DM). Materials and methods. The clinical examination was performed in 60 patients with type 2 DM and chronic acalculous cholecystitis, 60 individuals with chronic acalculous cholecystitis alone and 20 apparently healthy persons. A thorough examination was carried out using generally accepted clinical, laboratory, biochemical, instrumental methods. The blood lipids and the gallbladder portion of bile have been determined. Results. In patients with chronic acalculous cholecystitis on the background of type 2 DM, there was an increase in the levels of total lipids (by 1.61 times in the blood), cholesterol (by 2.04 times in the blood and 1.62 — in bile), bile acids (by 4.4 times in the blood) and their decrease in bile (by 1.34 times), an increase in triacylglycerols (by 3.09 times in the blood), low-density lipoproteins (by 1.2 times in the blood) and a decrease in the content of high-density lipoproteins (by 1.98 times in the blood) and phospholipids (by 1.38 times in the blood and 1.48 — in bile), as well as a decrease in the two-component ratio of phospholipids/cholesterol (by 1.8 times) and bile acids/cholesterol (by 1.9 times), an increase in the three-component Isaxone index (by 1.85 times), indicating a significant imbalance of lipid metabolism as a predictor of the gallstone formation in this category of patients (p < 0.05). Conclusions. In persons with chronic acalculous cholecystitis combined with type 2 DM, there are significantly increased levels of total lipids, cholesterol, bile acids, triacylglycerols, and low-density lipoproteins against the background of lowering high-density lipoproteins and phospholipids in the blood serum and bile. The established correlations between blood lipids and bile give more complete and detailed information on disturbances of bile homeostasis in different groups of patients. The main stone-forming substrate in persons of the first group was cholesterol, and in the second — a deceased level of high-density lipoproteins.
хронічний некалькульозний холецистит; цукровий діабет типу 2; ліпідний обмін; холестерол
хронический некалькульозный холецистит; сахарный диабет типа 2; липидный обмен; холестерин
chronic acalculous cholecystitis; type 2 diabetes mellitus; lipid metabolism; cholesterol
Вступ
Хронічний холецистит у хворих на цукровий діабет (ЦД) типу 2 виникає значно частіше, ніж у популяції загалом. Більше ніж у третини хворих на ЦД типу 2 спостерігаються прояви діабетичної шлунково–кишкової автономної нейропатії у вигляді дисфункції жовчних шляхів та зниження тонусу жовчного міхура, що вказує на її ранній розвиток при ЦД [1].
Ураження жовчних шляхів у хворих на ЦД типу 2 інколи супроводжується помірно вираженим больовим синдромом, але частіше його зовсім не буває, що створює певні складнощі в діагностиці. Під час проспективних сонографічних досліджень у хворих на ЦД виявляється істотне переважання в них субклінічного безсимтомного хронічного холециститу. Причиною розвитку хронічного холециститу у хворих на ЦД вважають інсулінорезистентність, порушення балансу інсуліну [2].
Порушення гомеостазу вуглеводів у хворих на ЦД зазвичай асоціюється з порушенням балансу ліпідів. ЦД типу 2 зумовлює найпомітніше підвищення потенційно літогенного показника — рівня тріацилгліцеролів (ТГ) у сироватці крові. ЦД типу 2 у поєднанні з хронічним холециститом спричиняє стійку гіперхолестеролемію — потенційно літогенні зміни балансу ліпідів. Оскільки білки ліпідтранс–портної системи однакові як для сироватки крові, так і для жовчі, низький рівень холестеролу (ХС) ліпопротеїнів високої щільності (ЛПВЩ) сироватки крові може опосередковано свідчити про дефіцит ліпідтранспортних білків у жовчі, що знижує здатність ліпідних інгредієнтів жовчі до розчинення у водному середовищі [3].
У хворих на хронічний холецистит та холелітіаз у поєднанні з ЦД спостерігається підвищення вмісту загального ХС, ТГ у сироватці крові та насичення жовчі ХС. З одного боку, це свідчить про комплекс–ний характер порушень ліпідного обміну при ЦД, з іншого — підкреслює значення порушень ліпідного метаболізму в пацієнтів із біліарною патологією. Не останню роль у патогенезі ураження гепатобіліарної системи при ЦД відіграє дисліпідемія. Збільшення ліпопротеїнів дуже низької щільності (ЛПДНЩ) зумов–лене як зниженням елімінації ТГ із крові (інсулін потрібний для продукції ліпопротеїнліпази), так і підвищенням швидкості секреції ЛПДНЩ –(гіперінсулінемія при ЦД типу 2 призводить до стимуляції літогенезу та секреції ЛПДНЩ). Водночас надлишкове гліколізування аполіпопротеїнів ЛПВЩ сприяє підвищенню рівня ХС у крові. Гліколізування аполіпопротеїнів високої щільності, що беруть участь в елімінації ХС, призводить до прискорення їх виведення з крові, у результаті чого підвищується атерогенний ефект ліпопротеїнів низької щільності (ЛПНЩ) [4].
Відомо, що атерогенні фракції ліпопротеїнів плазми крові чинять контрінсуліновий ефект, що пов’язано зі зниженням поглинання глюкози периферичними тканинами, насамперед м’язами. Крім того, ЛПНЩ та ЛПДНЩ знижують продукцію інсуліну β–клітинами острівців Лангерганса підшлункової залози. Носієм контрінсулінового ефекту виявився аполіпопротеїн В, що має з інсуліном загальні антигенні детермінанти та, можливо, конкурує з ним за спеціальні інсулінові рецептори [5].
Отже, у хворих на ЦД типу 2 закономірними є розвиток та прогресування уражень гепатобіліарної системи, зумовлених порушеннями всіх видів обміну речовин (переважно печінки) з чіткими проявами участі нервової та гуморальної диcрегуляції (переважно біліарної системи).
Мета дослідження: виявити особливості зміни гомеостазу жовчі та основні каменеутворюючі субстрати при хронічному некалькульозному холециститі (ХНХ) та цукровому діабеті типу 2.
Матеріали та методи
Детальне клінічне обстеження проведене в 120 осіб, хворих на ЦД типу 2 та ХНХ, та у 20 практично здорових осіб відповідного віку (група порівняння). Всі хворі були розподілені на дві групи, залежно від наявності ХНХ та поєднаної патології: перша група — 60 осіб, хворих на ЦД типу 2 та ХНХ, друга група — 60 осіб, хворих на ХНХ.
Середній вік осіб, хворих на ХНХ у поєднані з ЦД, становив у середньому 54,1 ± 8,5 року, а в групі здорових осіб — 51,8 ± 7,4 року, тобто за віковою структурою групи були практично однакові. При розподілі осіб основної групи за статтю встановлено, що кількість жінок переважала кількість чоловіків — 69,2 та 30,8 % відповідно. Схожа тенденція спостерігалася і в групі здорових осіб: кількість жінок переважала кількість чоловіків — 55,0 та 45,0 % відповідно.
Середня тривалість захворювання на ЦД в осіб основної групи становила 8,1 ± 5,6 року, а на ХНХ — 4,2 ± 2,1 року. В першій та другій групах середня тривалість захворювання на ХНХ була практично однаковою — 4,3 ± 2,5 та 4,1 ± 2,7 року відповідно.
Враховуючи важливу роль харчування в розвитку хронічного некалькульозного холециститу, виявили, що більшість осіб основної групи — 92,6 ± 5,2 % та 44,7 ± 5,3 % осіб групи здорових осіб відповідно харчувалася нерегулярно та незбалансовано (р < 0,05).
Переважна кількість хворих на ЦД отримувала монотерапію пероральними цукрознижувальними засобами, проте незначна частина пацієнтів використовувала комбіновану терапію інсуліном у поєднанні з пероральними цукрознижувальними засобами.
Усім хворим при надходженні до стаціонару проведено ретельне обстеження з використанням загальноприйнятих клінічних, лабораторних, біохімічних, інструментальних досліджень та оригінальних сучасних високоінформативних методів дослідження.
Кров для біохімічного дослідження брали із ліктьової вени вранці натще після 12–годинного голодування, у перші дні перебування в стаціонарі.
Ліпідний спектр крові вивчали за вмістом у крові загальних ліпідів (ЗЛ), ХС, ТГ, ЛПНЩ та ЛПВЩ за допомогою стандартних діагностичних наборів Simco Ltd. Вміст фосфоліпідів (ФЛ) визначали за методикою Зільверсміта та Девіса. Пігментний обмін досліджували за вмістом загального білірубіну та його фракцій (кон’югованої та некон’югованої) за стандартними методиками. Вміст жовчних кислот (ЖК) у крові та жовчі визначали за методикою Л.Л. Громашевської та співавт.
Багатомоментним дуоденальним зондуванням (БДЗ) отримували жовч, після чого проводили її біохімічне дослідження за такими показниками: загальний вміст ЖК, ХС, ФЛ. Визначались також відносні показники: співвідношення ЖК/ХС та ФЛ/ХС, індекс Ісаксона (відношення вмісту ХС до суми вмісту ФЛ та ЖК). УЗД органів черевної порожнини виконано у 100 % хворих.
Статистичний аналіз отриманих даних проводився за допомогою методів варіаційної статистики з визначенням середньої величини (М), середньої похибки (m) та ймовірністі можливої помилки кожного показника — за U–критерієм Уїлкоксона, а також методів епідеміологічної статистики — зниження відносного ризику та числа хворих, яких необхідно пролікувати для отримання одного позитивного результату при 95% довірчому інтервалі. Різницю вважали вірогідною при рівні значущості р < 0,05. Вірогідність змін варіацій у динаміці лікування в разі нормального розподілу у вибірках визначали за парним критерієм Стьюдента, в інших випадках — за непараметричним парним U–критерієм Уїлкоксона. Використовували кореляційний аналіз із визначенням коефіцієнта кореляції та критерію його вірогідності за ранговим коефіцієнтом кореляції Спірмена. Результати дослідження оцінювали за допомогою дескриптивного, дисперсійного та кореляційного аналізів.
Результати
Як при ХНХ, так і при ЦД типу 2 відбуваються відчутні зміни в організмі хворого. Особливо це стосується таких середовищ людини, як кров та жовч. В основному при вказаних захворюваннях відбуваються порушення ліпідного обміну в організмі хворих. При ЦД першою порушується ланка вуглеводного обміну, а внаслідок цього порушується ліпідний та білковий обміни [6]. Враховуючи тісний взаємозв’язок між складом вказаних біологічних рідин, провели лабораторне дослідження, спрямоване на виявлення порушень гомеостазу крові та жовчі при вказаних захворюваннях. Результати визначення ліпідного спектра крові наведені в табл. 1.
Нами встановлені вірогідні відмінності між показниками ліпідного спектра крові у хворих першої групи порівняно з групою порівняння (р < 0,05). У крові хворих на ХНХ та ЦД були вірогідно підвищені концентрації ЗЛ, ХС, ТГ, а рівні ЛПВЩ та ФЛ були знижені (р < 0,05). Це свідчить про значні порушення ліпідного обміну у хворих із поєднаною патологією. В осіб другої групи, які хворіють на ХНХ, було встановлені вірогідне підвищення рівня ЗЛ, ХС, ЖК, зниження рівня ЛПВЩ та ФЛ (р < 0,05), також спостерігалася тенденція до підвищення рівня ТГ та до зниження ФЛ. Ці порушення пов’язані з наявністю тривалого запального процесу в жовчовивідних шляхах та сладжу жовчі в жовчному міхурі (ЖМ).
Також проаналізовано зміни ліпідного спектра крові у хворих основної групи залежно від наявності патології. Встановлено вірогідне підвищення рівня ХС, ЖК, ТГ, ЛПНЩ та зниження рівня ЛПВЩ у хворих першої групи відносно показників хворих другої групи (р < 0,05), що свідчить про більш глибокі порушення ліпідного обміну у хворих із ХНХ на тлі ЦД та феномена взаємного обтяження патологій. Також такі рівні свідчать про порушення в регуляції діяльності ЖМ та жовчовивідних шляхів, а саме про наявність гіпотонічно–гіпокінетичної дискінезії, яка на тлі ЦД перебігає тяжче, ніж при ізольованому ХНХ.
При ХНХ основні кількісні та якісні зміни жовчі відбуваються також у ЖМ. Це проявляється змінами ліпідного спектра жовчі, збільшенням її літогенності, що в подальшому може призвести до розвитку такого ускладнення, як холелітіаз [7]. Тому нами була досліджена міхурова порція жовчі, що була отримана при проведенні БДЗ. Дані біохімічного аналізу жовчі в обстежених осіб наведені в табл. 2.
Нами було встановлено вірогідне підвищення концентрації ХС та зниження рівня ЖК і ФЛ в осіб першої та другої груп основної групи відносно показників групи порівняння (р < 0,05). Це свідчить про порушення ліпідного обміну при даних захворюваннях. Було встановлено, що в осіб першої групи було зафіксовано вірогідне зниження рівня ФЛ та ЖК, а також підвищення рівня ХС відносно аналогічних показників другої групи (р < 0,05). Це свідчить про глибший дисбаланс ліпідного гомеостазу при поєднаній патології порівняно з ізольованим перебігом захворювання. Особливо це стосується рівня ФЛ у жовчі. Важливе їх значення полягає в тому, що вони здатні підтримувати ХС у розчиненому стані, тим самим запобігаючи утворенню атеросклеротичних бляшок та холестеролових конкрементів [8].
Також нами були визначені кореляційні зв’язки між показниками ліпідного спектра крові та жовчі. Результати наведені в табл. 3.
У хворих другої групи було встановлено середній обернений кореляційний зв’язок між ХС сироватки крові та ЖК у жовчі (r = –0,63, р < 0,05). ЖК утворюються в гепатоцитах із ХС, який доставляється в печінку ЛПВЩ. Проте в даної категорії хворих спостерігається гіперхолестеролемія, надлишок ХС відкладається в патологічні утворення — бляшки, тому його буде недостатньо для синтезу ЖК. Також потрібно врахувати запалення ЖМ, яке також відіграє достатню роль у даному процесі [9].
Було встановлено середній обернений кореляційний зв’язок між ХС сироватки крові та ФЛ у жовчі (r = –0,46, р < 0,05). У плазмі крові практично здорових осіб на частку ФЛ припадає близько 1/3 загального вмісту ліпідів. Вони входять до складу ліпопротеїнів та хіломікронів. Одна з головних функцій ФЛ — сприяння підтримання ХС у розчиненому стані. При збільшенні рівня ХС та зменшенні ФЛ, що спостерігається в нашого контингенту хворих, частина ХС перестає бути в розчиненому вигляді та відкладається у вигляді бляшок та є предиктором формування холестеролових конкрементів [10]. У хворих другої групи нами було встановлено середній обернений кореляційний зв’язок між концентраціями ЛПВЩ у крові та ХС у жовчі (r = –0,54, р < 0,05). ЛПВЩ виконують захисну, антиатерогенну та антихолелітіазну функції. Згідно з даними літератури, вони є «тонким» критерієм, що відображає стан ліпідного обміну [11]. Особливістю їх функціонування є те, що вони здійснюють транспорт ХС від стінок судинної стінки, внутрішніх органів, у тому числі й ЖМ, у печінку, де ХС перетворюється в ЖК та виводиться з організму [12].
У даної категорії хворих внаслідок запального процесу в біліарній системі відбуваються зміни співвідношення основних компонентів ліпідного спектра крові та жовчі. Внаслідок збільшення концентрації ХС у біологічних рідинах відбувається зниження рівня ЛПВЩ, які не здатні виконати транспорт ХС у печінку. Також було виявлено прямий середній кореляційний зв’язок між рівнями ЛПНЩ у сироватці крові та ХС у жовчі (r = 0,49, р < 0,05). ЛПНЩ — основна транспортна форма ХС, вони здійснюють перенесення ліпідів від одної клітинної популяції до іншої. Саме ця фракція забезпечує притік ХС до судин та інших органів. При підвищенні рівня ХС та зменшенні концентрації ЛПВЩ у крові надлишок першого буде транспортуватися в інші органи. Анатомічно найближчим органом печінки, де відбувається даний процес, є саме ЖМ, тому внаслідок запалення в останньому відбуваються захоплення ЛПНЩ клітинами стінки жовчного міхура, їх модифікація під впливом місцевих факторів запалення та формування ядер холестеролових конкрементів [13].
У групі порівняння нами було встановлено такі кореляційні зв’язки: середній прямий кореляційний зв’язок між концентраціями ЗЛ у сироватці крові та ЖК у жовчі (r = 0,47, р < 0,05) та середній обернений кореляційний зв’язок між ЛПВЩ сироватки крові та ХС жовчі (r = –0,56, р < 0,05). Дані зв’язки вказують на нормальний ліпідний гомеостаз у даній групі осіб.
За допомогою окремих показників неможливо об’єктивно оцінити порушення гомеостазу жовчі та наявність у неї літогенних властивостей. Тому нами було обчислено та проаналізовано двокомпонентні індекси — ФЛ/ХС та ЖК/ХС та трикомпонентний — індекс Ісаксона. Індекс Ісаксона передбачає співвідношення ХС до суми ЖК та ФЛ жовчі. Згідно з даними літератури підвищення його значення в порції В при проведенні БДЗ більше 0,08 свідчить про підвищену літогенність жовчі [14]. Результати визначення вищезазначених індексів наведені в табл. 4.
Нами було виявлено вірогідне зниження співвідношень ФЛ/ХС та ЖК/ХС у хворих обох груп відносно групи порівняння (р < 0,05). Це свідчить про збільшення масової частки ХС та зниження ЖК і ФЛ, тобто жовч має підвищені літогенні властивості. У хворих першої групи співвідношення ЖК/ХС було вірогідно зниженим відносно хворих другої групи (р < 0,05). Це свідчить про те, що у хворих із поєднаною патологією схильність до літогенезу вища, ніж у хворих з ізольованим ХНХ, та підтверджує ще раз феномен взаємного обтяження даних патологій. Індекс Ісаксона був вірогідно підвищеним в осіб першої, другої груп відносно групи порівняння (р < 0,05). При внутрішньогруповому аналізі зафіксовано вірогідне підвищення індексу Ісаксона у хворих першої групи відносно показників другої групи (р < 0,05). Трикомпонентні індекси є більш точними, ніж двокомпонентні, оскільки дозволяють визначити відношення між трьома компонентами, що дозволяє покращити точність індексу.
Нами було проведено визначення кореляційних зв’язків між ліпідами сироватки крові та вищенаведеними індексами. Результати наведені в табл. 5.
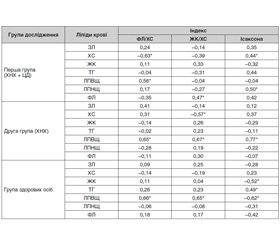
Установлено, що у хворих першої групи був наявний обернений кореляційний зв’язок середньої сили між рівнем ХС у сироватці крові та співвідношенням ФЛ/ХС у жовчі (r = –0,63, р < 0,05). Також встановлено прямий середній кореляційний зв’язок між рівнем ХС у сироватці крові та індексом Ісаксона (r = 0,44, р < 0,05). Виявлено прямі кореляційні середні зв’язки між ЛПВЩ у сироватці крові та співвідношенням ФЛ/ХС (r = 0,56, р < 0,05), ЛПНЩ у сироватці крові та індексом Ісаксона (r = 0,50, р < 0,05) та ФЛ крові та співвідношенням ЖК/ХС (r = 0,47, р < 0,05). Це свідчить, що літогенність жовчі у даної категорії хворих залежить від підвищеного рівня ХС у крові, що може використовуватися як маркер літогенезу, а також про глибші та суттєвіші порушення ліпідного гомеостазу в організмі.
У хворих другої групи виявлено обернений кореляційний зв’язок між ХС сироватки крові та співвідношенням ЖК/ХС (r = –0,57, р < 0,05), прямий середній кореляційний зв’язок між рівнем ЛПВЩ у сироватці крові та співвідношеннями ФЛ/ХС (r = 0,65, р < 0,05) та ЖК/ХС (r = 0,67, р < 0,05) у жовчі, а також рівнем ЛПВЩ та індексом Ісаксона (r = 0,77, р < 0,05).
Отримані дані свідчать про те, що в осіб, хворих на ХНХ, основна ланка порушення ліпідного обміну пов’язана зі зниженням вмісту ЛПВЩ. Це відбувається за рахунок того, що в зменшеній кількості вони не здатні виконувати транспортування ХС у печінку та перетворення його в ЖК із наступним виведенням з організму людини. Внаслідок цього відбувається збільшення рівня екзо– та ендогенного ХС в організмі, що й збільшує літогенність жовчі [15].
У групі порівняння були встановлені такі кореляційні зв’язки: обернений середній кореляційний зв’язок між ЖК сироватки крові та індексом Ісаксона (r = –0,52, р < 0,05); прямий середній кореляційний зв’язок між ТГ у сироватці крові та індексом Ісаксона (r = 0,49, р < 0,05); прямий середній кореляційний зв’язок між рівнем ЛПВЩ сироватки крові та співвідношеннями ФЛ/ХС (r = 0,66, р < 0,05) і ЖК/ХС (r = 0,65, р < 0,05), а також обернений середній кореляційний зв’язок з індексом Ісаксона (r = –0,62, р < 0,05).
Обговорення
У хворих із коморбідною патологією встановлено більш глибокі порушення ліпідного обміну (вірогідне підвищення рівня ХС, ЖК, ТГ, ЛПНЩ та зниження рівня ЛПВЩ у хворих першої групи відносно показників хворих другої групи, р < 0,05) та феномен взаємного обтяження цих нозологій. Також такі рівні свідчать про порушення в регуляції діяльності ЖМ, а саме наявність гіпотонічно–гіпокінетичної дискінезії, яка на тлі ЦД перебігає тяжче, ніж при ізольованому ХНХ, що підтверджується даними літератури [16].
Крім того, у всіх хворих спостерігалися вірогідне підвищення концентрації ХС та зниження рівня ЖК і ФЛ відносно показників групи здорових осіб (р < 0,05). Це свідчить про порушення ліпідного обміну при даних захворюваннях. В той же час у хворих із поєднаною патологією можна говорити про глибший дисбаланс ліпідного гомеостазу при поєднаній патології порівняно з ізольованим перебігом захворювання. Особливо це стосується рівня ФЛ у жовчі (вірогідне зниження рівня ФЛ та ЖК, а також підвищення рівня ХС відносно аналогічних показників другої групи, р < 0,05). Важливе їх значення полягає в тому, що вони здатні підтримувати ХС у розчиненому стані, тим самим запобігаючи утворенню атеросклеротичних бляшок та холестеролових конкрементів [17].
Окрім того, у хворих першої групи співвідношення ЖК/ХС було вірогідно зниженим відносно хворих другої групи (р < 0,05). Це свідчить про те, що у хворих із поєднаною патологією схильність до літогенезу вища та підтверджує ще раз феномен взаємного обтяження даних патологій. При внутрішньогруповому аналізі зафіксовано вірогідне підвищення індексу Ісаксона у хворих першої групи відносно показників другої групи (р < 0,05). Згідно з даними літератури [18], трикомпонентні індекси є більш точними, ніж двокомпонентні, оскільки дозволяють визначити відношення між трьома компонентами, що дозволяє покращити точність індексу.
На завершення встановлено, що у хворих першої групи був наявний обернений середній кореляційний зв’язок між рівнем ХС у сироватці крові та співвідношенням ФЛ/ХС у жовчі, прямий середній кореляційний зв’язок між рівнем ХС у сироватці крові та індексом Ісаксона, прямі кореляційні середньої сили зв’язки між ЛПВЩ у сироватці крові та співвідношенням ФЛ/ХС, ЛПНЩ у сироватці крові та індексом Ісаксона та ФЛ крові і співвідношенням ЖК/ХС. Це свідчить, що літогенність жовчі в даної категорії хворих залежить від підвищеного рівня ХС у крові, що може використовуватися як маркер літогенезу, а також про глибші та суттєвіші порушення ліпідного гомеостазу в організмі [18]. У хворих другої групи виявлено обернений кореляційний зв’язок між ХС сироватки крові та співвідношенням ЖК/ХС, прямий середній кореляційний зв’язок між рівнем ЛПВЩ у сироватці крові та співвідношеннями ФЛ/ХС та ЖК/ХС у жовчі, а також рівнем ЛПВЩ та індексом Ісаксона. В осіб, хворих на ХНХ, основна ланка порушення ліпідного обміну пов’язана зі зниженням вмісту ЛПВЩ [19]. Це відбувається за рахунок того, що в зменшеній кількості вони не здатні виконувати транспортування ХС у печінку та перетворення його в ЖК із наступним виведенням з організму людини. Внаслідок цього відбувається збільшення рівня екзо– та ендогенного ХС в організмі, що й збільшує літогенність жовчі [20].
Висновки
1. У хворих на хронічний некалькульозний холецистит на тлі цукрового діабету типу 2 спостерігаються вірогідно підвищені рівні загальних ліпідів, холестеролу, жовчних кислот, тріацилгліцеролів, ліпопротеїнів низької щільності на тлі зниження ліпопротеїнів високої щільності та фосфоліпідів у сироватці крові та жовчі.
2. Встановлені кореляційні зв’язки між ліпідними спектрами сироватки крові та жовчі дають більш повну та детальну інформацію про порушення гомео–стазу жовчі у різних групах пацієнтів.
3. Основним каменеутворюючим чинником в осіб із цукровим діабетом є холестерол, без діабету — знижений рівень ліпопротеїнів високої щільності.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.

/204-1.jpg)
/205-1.jpg)
/206-1.jpg)
/207-1.jpg)