Международный эндокринологический журнал Том 15, №3, 2019
Вернуться к номеру
Латентний автоімунний діабет у дорослих (LADA): сучасний погляд на проблему
Авторы: Пашковська Н.В.
ВДНЗ України «Буковинський державний медичний університет», м. Чернівці, Україна
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
У лекції подані сучасні відомості щодо латентного автоімунного діабету у дорослих (LADA). Наведені дані літератури щодо епідеміології, чинників і механізмів розвитку, клінічних особливостей цього захворювання. Виділені та охарактеризовані можливі варіанти перебігу LADA. Розкриті питання діагностичних особливостей, диференційної діагностики та зазначені перспективи лікування.
В лекции представлены современные сведения о латентном аутоиммунном диабете у взрослых (LADA). Приведены данные литературы относительно эпидемиологии, факторов и механизмов развития, клинических особенностей этого заболевания. Выделены и охарактеризованы возможные варианты течения LADA. Раскрыты вопросы диагностических особенностей, дифференциальной диагностики и обозначены перспективы лечения.
The lecture provides modern information on latent autoimmune diabetes in adults. Data of literature on the epidemiology, factors and mechanisms of development, clinical features of this disease are presented. The possible variants of latent autoimmune diabetes in adults course are identified and characterized. The questions of diagnostic features, differential diagnosis and the prospects of treatment are outlined.
латентний автоімунний діабет у дорослих; LADA; цукровий діабет
латентный аутоиммунный диабет у взрослых; LADA; сахарный диабет
latent autoimmune diabetes in adults; diabetes mellitus
Вступ
Останнім часом з’являється все більше доказів генетичної та фенотипової гетерогенності цукрового діабету (ЦД), яка виходить за межі двох основних класичних типів, що вказує на доцільність перегляду класифікації і розробки персоніфікованих підходів до діагностики та лікування цього захворювання [1]. Яскравим прикладом такої гетерогенності є латентний автоімунний діабет у дорослих.
Більше 30 років тому був відкритий незвичайний тип діабету, який не вписувався в картину ні 1-го (ЦД1), ні 2-го типу (ЦД2). Так, L.C. Groop et al. [2] в 1986 році повідомили про групу хворих на ЦД2, у яких, незважаючи на наявність підвищення антитіл до антигенів острівцевого апарату підшлункової залози, зберігалась функція β-клітин. Автори назвали захворювання латентним діабетом 1-го типу.
До цього в інших дослідженнях було показано, що майже кожен десятий пацієнт з ЦД2 є серопозитивним щодо антитіл до острівцевих антигенів, має незадовільні результати лікування пероральними гіпоглікемізуючими препаратами і потребує раннього призначення інсуліну [3].
Спочатку цей різновид захворювання назвали діабетом 3-го типу, але після детального вивчення дійшли висновку, що більш коректно було б назвати його діабетом 1,5 через наявність поєднання ознак як ЦД1, так і ЦД2. На сьогодні цей епонім продовжує періодично використовуватись, але є неформальним.
Пізніше T. Tuomi et al. [5] і P.Z. Zimmet et al. [6], зважаючи на особливості цієї повільно прогресуючої форми автоімунного діабету, що тривалий час не потребує інсуліну, запропонували термін «латентний автоімунний діабет у дорослих» (Latent Autoimmune Diabetes in Adults — LADA).
Було з’ясовано, що частка пацієнтів із ЦД2 та наявністю антитіл до острівцевих антигенів є досить високою. Зокрема, за результатами відомого дослідження UKPDS (United Kingdom Prospective Diabetes Study) [7], 12 % пацієнтів із перебігом захворювання, подібним до ЦД2, мали позитивні антитіла до антигенів β-клітин підшлункової залози.
Визначення
На сьогодні визначення LADA не є офіційно прийнятим і продовжує обговорюватись. Згідно з формулюванням, запропонованим L.C. Groop et al. [8], латентний автоімунний діабет у дорослих — автоімунний діабет, що характеризується наявністю в крові антитіл до декарбоксилази глутамінової кислоти (GADA), діагностованих у дорослих осіб віком старше 35 років.
LADA відносять до ЦД1, який розвивається в дорослому віці і має латентний перебіг [9]. Цей різновид діабету розглядається як гетерогенне захворювання, що характеризується менш інтенсивним автоімунним процесом і широким клінічним фенотипом порівняно з класичним ЦД1 і може мати клінічні ознаки двох основних типів діабету. LADA часто помилково діагностується як ЦД2, оскільки, по-перше, захворювання виникає в дорослому віці і, по-друге, пацієнти тривалий час не потребують інсулінотерапії, у той час як визначення автоантитіл до острівцевих антигенів у такої категорії хворих здійснюється рідко [10, 11].
Останніми роками науковці вказують на доцільність запровадження альтернативних назв для цього варіанту діабету. Зокрема, використовується термін «повільно прогресуючий інсулінозалежний діабет 1-го типу» (Slowly progressive insulin-dependent (type 1) diabetes mellitus — SPIDDM). З огляду на те, що не в усіх GADA-позитивних осіб з діабетом дорослих з часом виникає потреба в інсуліні, виділяють два підтипи захворювання: NIR-SPIDDM (Non Insulin Requiring SPIDDM) — для пацієнтів, які не потребують інсулінотерапії > 5 років, та IR-SPIDDM (Insulin Requiring SPIDDM) — для осіб, в яких із часом розвивається потреба в інсуліні [12].
Однак, незважаючи на те, що пацієнти із SPIDDM на відміну від LADA не завжди з часом потребують інсулінотерапії, на думку P. Pozzilli та S. Pieralice [13], ці терміни слід вважати синонімами, оскільки обидва вони ідентифікують тип діабету, що має автоімунну природу і вимагає призначення інсулінотерапії при виникненні потреби у подальшому.
Існують повідомлення про випадки латентного автоімунного діабету у дітей, у яких діагностовано антитіла до острівців без інсулінової залежності із повільним прогресуванням недостатності β-клітин у подальшому. Такий варіант захворювання одні автори називають LADY-подібним (Latent Autoimmune Diabetes In The Young), інші — LADC (Latent Autoimmune Diabetes In Children). При цьому зазначається, що, з огляду на факт зростаючої поширеності ожиріння серед дітей, оцінка антитіл до острівців для цієї вікової категорії буде набувати все більшої важливості [14].
Епідеміологія
Як показали результати епідеміологічних досліджень, проведених у різних країнах, LADA є достатньо поширеним різновидом діабету. На користь цього може свідчити висока частота ЦД1 в осіб старше 30 років. Зокрема, в Італії захворюваність на ЦД1 у пацієнтів віком від 30 до 49 років така сама, як і у підлітків від 15 до 19 років [15].
На сьогодні вважається, що поширеність LADA перебуває в межах від 2 до 12 % серед всіх випадків діабету у дорослого населення [13].
Особливо високою є частота LADA серед населення європейських країн. Зокрема, в дослідженні UKPDS25 майже у кожного десятого з 3672 хворих на ЦД віком від 25 до 65 років виявлені підвищені титри до GADA та/або антитіл до автоантигенів острівцевих клітин білкової тирозинфосфатази (IA-2) [7]. При цьому серед пацієнтів, у яких захворювання розпочалось у віці від 25 до 34 років, антитіл-позитивним виявився кожен третій пацієнт, у той час як частота реєстрації антитіл серед тих, хто захворів у віці від 55 до 65 років, становила тільки 7 %.
За результатами аналізу бази даних (майже 65 тис. осіб) норвезького масштабного дослідження HUNT (Nord-Trøndelag Health), частка GADA-позитивних осіб серед дорослих пацієнтів з діабетом досягає 10 % [16].
Натомість у великому популяційному дослідженні NIRAD (Non Insulin Requiring Autoimmune Diabetes), проведеному в Італії, до якого було залучено 5330 пацієнтів з ЦД, кількість GADA та/або IA-2-позитивних осіб становила лише 5 % від усіх випадків ЦД2 [17].
Серед населення азіатських країн частота LADA, за результатами популяційних досліджень, становить 5–6 % [18, 19], водночас є нижчою серед афроамериканців, латиноамериканців та жителів арабських регіонів [20, 21].
Таким чином, поширеність LADA відрізняється серед населення різних країн і, вочевидь, залежить від етнічної належності, способу життя і методичних підходів, які використовували різні дослідники [13].
Механізми розвитку
Про складний і специфічний механізм розвитку LADA свідчить його виражена гетерогенність за генетичними, фенотиповими та імунологічними ознаками.
Дослідження генетичної природи LADA показало, що він більше подібний до автоімунного ЦД1 (ЦД1а), але при цьому захворюванні також мають місце детермінанти, пов’язані з ЦД2. Зокрема, встановлено, що генетична подібність до ЦД1 пов’язана з HLA, генами INS VNTR (Variable Number Tandem Repeat) і PTPN22 (Protein Tyrosine Phosphatase, Non-Receptor Type 22) [22–24].
Показано, що LADA асоціюється з такими генами високого ризику ЦД1, як HLA-DR3, -DR4, та алелями DQB1*0302 і DQB1*0201 HLA, водночас частота їх зменшується із віком початку захворювання і є нижчою при LADA порівняно з ЦД1 [23, 24]. Схожі відмінності між LADA і ЦД1 встановлено для генів PTPN22 та INS VNTR [24, 25]. Також незалежним предиктором ризику LADA визнані CTLA-4 +49 GG- або AG-генотипи [26].
З іншого боку, гени DR2 і DQB1*0602, які вважаються протективними щодо розвитку автоімунного діабету, частіше виявляються при LADA, ніж при ЦД1. Вочевидь саме тому, на відміну від ЦД1, для LADA характерний латентний перебіг [27, 28].
Таким чином, особливості повільної автоімунної деструкції β-клітин при LADA зумовлені генетично. Водночас, на відміну від ЦД1, в патогенезі LADA відіграє роль спадково детермінована неавтоімунна дисфункція β-клітин. Зокрема, показано, що у пацієнтів з LADA підвищена частота генотипів, пов’язаних з ЦД2, а саме асоціація з CT/TT-поліморфним маркером rs7903146 гена TCF7L2 (Transcription Factor 7-Like 2) [29], що впливає на проліферацію, активність і диференціювання β-клітин. З іншого боку, з огляду на те, що для LADA характерна більша маса тіла, ніж при ЦД1, помірне системне запалення, зумовлене надлишком вісцеральної тканини, може спричиняти латентний автоімунний процес, що характеризується позитивністю автоантитіл IA-2 із втратою функції β-клітин та зниженням секреції інсуліну [13, 30] (рис. 1).
Отже, хворі з LADA можуть поділяти генетичні ознаки як ЦД1, так і ЦД2, з чим пов’язана велика варіабельність швидкості деструкції β-клітин підшлункової залози, інсулінорезистентності та автоімунітету [22]. Останній характеризується позитивністю автоантитіл до острівцевих антигенів підшлункової залози. При цьому лімфоїдна інфільтрація острівців (інсуліт) спричиняє прогресуючу загибель β-клітин, яка відбувається повільніше, ніж при ЦД1 [13, 22], на користь чого свідчить більш поступове та менш суттєве зниження рівня С-пептиду [31].
До основних імунологічних маркерів ЦД відносять GADA, антитіла до інсуліну, білкової тирозинфосфатази IA-2 (IA-2A) та автоантитіла ізоформи 8 (ZnT8). Водночас антитіла до острівцевих клітин, з якими пов’язують деструкцію β-клітин, виявляють в основному при ЦД1, у той час як для LADA у більшості випадків характерно підвищення GADA, що є маркерами інсуліту [7, 17, 32].
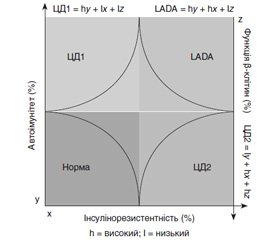
Таким чином, LADA притаманні патологічні ознаки як ЦД1, так і ЦД2. Розподіл чинників, таких як автоімунітет, інсулінорезистентність та функція β-клітин, при цих варіантах діабету наведений на рис. 2.
Клінічні і діагностичні особливості
Відповідно до рекомендацій Immunology of Diabetes Society [34], виділяють три основні критерії LADA:
— вік дебюту старше 30 років;
— наявність принаймні одного з наступних видів антитіл — GADA, ICA, IAA, IA-2 (незалежно від титру, числа або епітопної специфічності);
— відсутність потреби в інсуліні протягом перших шести місяців маніфестації.
До додаткових діагностичних критеріїв LADA відносять:
— низький базальний і стимульований рівень С-пептиду;
— поєднання LADA з іншими автоімунними захворюваннями;
— присутність HLA алелей високого ризику щодо ЦД1 [8].
Проте питання діагностичних критеріїв LADA залишається дискусійним через генетичну, фенотипову та імунологічну гетерогенність, високу варіабельність швидкості загибелі β-клітин та різні ступені резистентності до інсуліну та автоімунітету [13, 35]. Можливість чіткої діагностики LADA також обмежена через значну неоднорідність захворювання внаслідок перекриття ознак ЦД1 і ЦД2 з домінуванням тих чи інших симптомів (рис. 3).
При цьому деякі випадки захворювання можуть нагадувати ЦД1 (низький індекс маси тіла (ІМТ), асоціація з автоімунними захворюваннями), у той час як інші — мати багато спільних ознак з ЦД2 (абдомінальне ожиріння, артеріальна гіпертензія, дисліпідемія тощо).
З огляду на це на даний час немає чітких офіційних діагностичних рекомендацій для LADA, а зазначені вище критерії періодично ставляться під сумнів.
Дані щодо ускладнень LADA малочисельні, а результати досліджень, які були проведені для вивчення цієї проблеми, є доволі суперечливими.
Зокрема, за результатами одних досліджень, частота мікросудинних ускладнень (нефропатії, ретинопатії) при тривалості LADA < 5 років є меншою, ніж у відповідних пацієнтів з ЦД2 [44, 45]. Це пояснюється тим, що останній пізніше діагностується через менш виражену клінічну симптоматику. Також є дані, що в осіб з LADA, які хворіють понад 5 років, більший ризик розвитку та прогресування нейропатії, ніж при ЦД2 [46]. Натомість інші дослідники не встановили різниці у частоті мікросудинних ускладнень між LADA і ЦД2 [32, 47]. Також не виявлено статистично значущих відмінностей щодо макросудинних ускладнень (ішемічної хвороби серця, гострих порушень мозкового кровообігу, загальної смертності та серцево-судинної смертності) [48, 49], втратою кісткової маси і ризиком переломів [50].
Як вже зазначалося, за клінічним перебігом LADA більше подібний до ЦД2, водночас існують певні розбіжності, серед яких основними є: початок захворювання у віці до 50 років; виражена симптоматика ЦД (поліурія, полідипсія, втрата маси тіла); ІМТ < 25 кг/м2; наявність автоімунних захворювань у пацієнта або в його родині [36].
Відмінності клінічних та генетичних особливостей LADA і ЦД2 наведені у табл. 1.
Порівняно з ЦД2 у пацієнтів з LADA не тільки рідше реєструється надлишкова маса тіла та ожиріння, а й інші складові метаболічного синдрому, зокрема співвідношення окружності талії та окружності стегон, дисліпідемія, артеріальна гіпертензія тощо [32]. З іншого боку, як показують результати досліджень, LADA часто діагностується у пацієнтів з надлишковою масою тіла або навіть з морбідним (ІМТ > 40 кг/м2) ожирінням [37]. При цьому прояви метаболічного синдрому частіше трапляються у пацієнтів з LADA, ніж з класичним ЦД1 [38].
Таким чином, частота і ступінь прояву ожиріння, артеріальної гіпертензії, дисліпідемії при LADA посідають проміжні позиції, зокрема є вищими, ніж при ЦД 1, але нижчими, ніж при ЦД2 [39].
Основні розбіжності між LADA і ЦД2 наведені у табл. 2.
Як вже зазначалося, LADA характеризується великою фенотиповою неоднорідністю, що зумовлено різними ступенями автоімунітету й інсулінорезистентності.
З огляду на це деякі науковці виділяють 2 основні підтипи LADA:
— LADA 1 — більше подібний до ЦД1, характерні високі титри антитіл до острівцевих антигенів;
— LADA 2 — переважають ознаки ЦД2, низькі титри антитіл.
Показано, що пацієнти з високими (> 32 IU) титрами GADA (LADA 1) мають більше фенотипових ознак ЦД1: низькі рівні С-пептиду, вищі показники HbA1с, низкий ІМТ, схильність до кетозу, меншу поширеність метаболічного синдрому та його компонентів порівняно з пацієнтами з низькими титрами (≤ 32 IU) (LADA 2), у яких спостерігалася клінічна картина, характерна для ЦД2 [17].
Залежність фенотипу LADA від титру антитіл підтверджується результатами досліджень, в яких встановлено, що високі титри GADA асоціюються з інтенсивністю імунної відповіді [7], більш низькими рівнями C-пептиду [40] та вираженим дефіцитом інсуліну [17]. При цьому пацієнти з високими титрами GADA мають генетичні детермінанти ЦД1 (поліморфізм гена PTPN22 C1858T) [41], а з нижчими — ЦД2 (поліморфні маркери гена TCF7L2) [42]. Також показано, що високі титри GADA асоціюються з профілем більш тяжкого автоімунітету, зокрема у таких пацієнтів частіше реєструється носійство до інших органоспецифічних автоантитіл (тиреоїдної пероксидази, 21-гідроксилази, тканинної трансглутамінази та парієтальних клітин шлунка) [43].
Водночас не тільки титр, але й різні варіанти позитивності антитіл можуть впливати на клінічні особливості хворих на LADA. Існують докази того, що високі титри GADA асоціюються з варіантом LADA, фенотипово подібним до ЦД1, у той час як за носійства антитіл до IA-2A перебіг захворювання більш подібний до ЦД2 [21].
На переконання деяких авторів, встановлення підвищеного титру антитіл до острівцевих антигенів є визначальним в діагностиці LADA і в ідеалі разом з дослідженням С-пептиду плазми повинно здійснюватися всім пацієнтам з вперше виявленим ЦД2. Це дозволило б своєчасно визначитися з правильною тактикою лікування захворювання і запобігти розвитку ускладнень. Водночас, зважаючи на неможливість широкого запровадження подібного скринінгу, рекомендується визначення антитіл до GADA пацієнтам із вперше виявленим діабетом з високим ризиком LADA, а саме за наявності двох або більше з наступних ознак: вік < 50 років, ІМТ < 25 кг/м2, виражені симптоми гіперглікемії в дебюті, автоімунні захворювання у пацієнта або у членів його родини. Також рекомендується визначення С-пептиду з подальшим визначенням антитіл до GADA при встановленні його зниження особам з помірним ризиком LADA (за наявності однієї з вищезазначених ознак) [51] (рис. 4).
Лікування
Загальновизнаних рекомендацій щодо лікування пацієнтів з LADA на сьогодні не існує. Саме тому захворювання, як правило, лікують як ЦД2, що сприяє швидкому розвитку потреби в інсулінотерапії та є особливо небезпечним для пацієнтів з так званим LADA-1, у яких перебіг подібний до ЦД1 [30, 32].
На думку S. Pieralice та P. Pozzilli [51], правильна терапевтична стратегія для пацієнтів з LADA повинна бути спрямована на збереження залишкової β-клітинної функції, а також покращення метаболічного контролю для зменшення ризику хронічних ускладнень.
З огляду на розвиток інсулінової недостатності, логічним було б призначення пацієнтам з LADA секретагогів інсуліну. Проте застосування препаратів сульфонілсечовини при цьому різновиді діабету виявилось малоефективним і призводило до погіршення метаболічного контролю та поступового зниження функції β-клітин порівняно з хворими, які отримували інсулінотерапію [52, 53]. Зокрема, у 60 % пацієнтів з LADA, які отримували препарати сульфонілсечовини, упродовж двох років виникла потреба в інсуліні [54], тобто подібна терапія фактично прискорює прогресування виснаження β-клітин і необхідність ранньої ініціації інсуліну.
Оскільки частина пацієнтів з LADA мають певну ступінь резистентності до інсуліну та прояви метаболічного синдрому, аргументованою є також терапія сенситайзерами інсуліну, зокрема метформіном, який покращує периферичну дію інсуліну і тим самим опосередковано захищає β-клітини від безперервної гіперстимуляції його звільнення. Водночас можливий потенційний ризик лактацидозу у пацієнтів з прогресуючою недостатністю інсуліну [55].
На сьогодні найбільш патогенетично обґрунтованим і ефективним методом лікування LADA, що дозволяє покращити метаболічний контроль на тлі збереження β-клітинної функції, вважають інсулінотерапію, що демонструє ефективність незалежно від рівня ендогенної секреції інсуліну та зменшує ступінь прояву інсуліту [30, 56].
Останніми роками з’явились дослідження, які продемонстрували позитивні результати застосування інкретиномодуляторів в лікуванні LADA.
Так, продемонстрована ефективність інгібіторів дипептидилпептидази-4 (DPP-4), зокрема ситагліптину, лінгліптину та саксагліптину [57–59]. Зазначається, що однією з основних переваг такої терапії є збереження функції β-клітин і навіть підвищення рівня С-пептиду.
Також обговорюється питання ефективності застосування аналогів глюкагоноподібного пептиду 1 (GLP-1) у лікуванні LADA. Зокрема, P. Pozzilli et al. [60] у GADА-позитивних хворих на ЦД2 на тлі застосування дулогліптину встановили зменшення HbA1c на тлі відновлення β-клітинної функції. Автори відзначають безпечність такої терапії з огляду на низьку частоту епізодів гіпоглікемії.
На сьогодні вивчається питання ефективності комбінації препаратів інсуліну з інкретиномодуляторами. Зокрема, показано, що додавання до інсулінотерапії препаратів GLP-1 при LADA не тільки ефективно покращує показники вуглеводного обміну, але й дозволяє зменшити добові дози інсуліну і, на думку дослідників, може уповільнити прогресування автоімунного ЦД і подовжити ремісію [61].
Алгоритм лікування LADA, запропонований P. Pozzilli та S. Pieralice [13], наведений на рис. 5.
Також розглядаються можливості імуномодулювальної терапії LADA в аспекті збереження функціональної активності β-клітин протягом тривалого часу. Зокрема, встановлений певний позитивний ефект від застосування аналогів пептиду HSP60 (DiaPep277) та препаратів на основі анти-CD3-моноклональних антитіл [62, 63].
Важливим є той факт, що значна гетерогенність LADA вимагає персоніфікованого підходу до терапії даного варіанту діабету [30]. З огляду на це набуває особливої актуальності відомий принцип, проголошений Гіппократом, що «лікувати потрібно не хворобу, а хворого».
Таким чином, на сьогодні накопичено чимало відомостей щодо механізмів розвитку, клінічних особливостей, діагностики та лікування LADA, водночас відсутні офіційні рекомендації щодо ведення пацієнтів з цим різновидом діабету.
Більшість науковців наголошує на тому, що настав час для нового визначення LADA [10, 13, 33, 64]. На думку T. Koufakis et al. [10], завдання майбутніх досліджень у цій галузі полягає у розробці нових маркерів, здатних ефективно ідентифікувати різні кластери діабету, забезпечуючи раціональний вибір для індивідуалізованих методів лікування, які спрямовані на унікальні механізми порушення обміну речовин у кожного пацієнта, що, можливо, стане підґрунтям до створення нової системи класифікації діабету.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.

/274-1.jpg)
/274-2.jpg)
/275-1.jpg)
/275-2.jpg)
/276-1.jpg)
/277-1.jpg)