Международный эндокринологический журнал Том 15, №6, 2019
Вернуться к номеру
Можливості вілдагліптину в оптимальному контролі цукрового діабету 2-го типу
Авторы: Паньків В.І.
Український науково-практичний центр ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України, м. Київ, Україна
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
Інкретинові гормони мають важливе значення для нормального функціонування острівцевих клітин підшлункової залози й гомеостазу глюкози. При цукровому діабеті 2-го типу (ЦД2) відбувається порушення чутливості α- і β-клітин підшлункової залози, що призводить до прогресуючої недостатньої секреції інсуліну, резистентності до інсуліну внаслідок надмірної продукції глюкагону в періоди постпрандіальної гіперглікемії і зниження глюкагонової відповіді в періоди гіпоглікемії. Крім того, ЦД2 поєднується з наростанням ліпотоксичності, безпосередньо пов’язаної з інсулінорезистентністю. В огляді літератури наведено дані про безпеку та ефективність застосування вілдагліптину в пацієнтів із ЦД2, а також про позапанкреатичні ефекти інкретиноспрямованої терапії. Клінічно підтверджено, що вілдагліптин ефективно знижує рівень глікованого гемоглобіну, має мінімальний ризик гіпоглікемії і здатний підтримувати нормальну масу тіла. До того ж вілдагліптин пригнічує постпрандіальну продукцію тригліцеридів і знижує рівень ліполізу натще, імовірно, впливаючи на інгібування абсорбції ліпідів і запаси тригліцеридів у клітинах нежирових тканин.
Инкретиновые гормоны имеют важное значение для нормального функционирования островковых клеток поджелудочной железы и гомеостаза глюкозы. При сахарном диабете 2-го типа (СД2) происходит нарушение чувствительности α- и β-клеток поджелудочной железы, что приводит к прогрессирующей недостаточной секреции инсулина, резистентности к инсулину в результате избыточной продукции глюкагона в периоды постпрандиальной гипергликемии и снижения глюкагонового ответа в периоды гипогликемии. Кроме того, СД2 сочетается с нарастанием липотоксичности, непосредственно связанной с инсулинорезистентностью. В обзоре литературы приведены данные о безопасности и эффективности применения вилдаглиптина у пациентов с СД2, а также о внепанкреатических эффектах инкретиннаправленной терапии. Клинически подтверждено, что вилдаглиптин эффективно снижает уровень гликированного гемоглобина, обладает минимальным риском гипогликемии и способен поддерживать нормальную массу тела. К тому же вилдаглиптин подавляет постпрандиальную продукцию триглицеридов и снижает уровень липолиза натощак, вероятно влияя на ингибирование абсорбции липидов и запасы триглицеридов в клетках нежировых тканей.
Incretin hormones are important for the normal functioning of pancreatic islet cells and glucose homeostasis. In type 2 diabetes mellitus, there is a violation of the sensitivity of pancreatic α- and β-cells, which leads to progressive insufficient insulin secretion, insulin resistance due to excessive production of glucagon during periods of postprandial hyperglycemia. In addition, type 2 diabetes mellitus is associated with an increase in lipotoxicity directly related to insulin resistance. The literature review provides data on the safety and efficacy of vildagliptin in patients with type 2 diabetes mellitus, as well as on the pancreatic effects of incretin-targeted therapy. It is clinically confirmed that vildagliptin effectively reduces the level of glycated hemoglobin, has a minimal risk of hypoglycemia and is able to maintain a normal body weight. In addition, vildagliptin inhibits postprandial triglyceride production and decreases fasting lipolysis, possibly affecting the inhibition of lipid absorption and triglyceride stores in non-adipose tissue cells.
цукровий діабет 2-го типу; глюкагоноподібний пептид 1; глюкозозалежний інсулінотропний поліпептид; інсулінорезистентність; вілдагліптин; ефективність; безпека; огляд
сахарный диабет 2-го типа; глюкагоноподобный пептид-1; глюкозозависимый инсулинотропный полипептид; инсулинорезистентность; вилдаглиптин; эффективность; безопасность; обзор
type 2 diabetes mellitus; glucagon-like peptide-1; glucose-dependent insulinotropic polypeptide; insulin resistance; vildagliptin; efficiency; review
Пошук терапевтичних підходів, що торкалися б не лише питань обміну глюкози, але й інших ланок патогенезу системних змін при цукровому діабеті 2-го типу (ЦД2), стає все актуальнішим. Загальноприйнята на сьогодні концепція патогенезу ЦД2 поряд із центральним ефектом — прогресивною втратою маси і функціонування β-клітин містить ще принаймні 10 компонентів, одним із яких є дисфункція гастроінтестинальних чинників [1].
Інкретинові гормони, такі як глюкагоноподібний пептид 1 (ГПП-1) і глюкозозалежний інсулінотропний поліпептид (ГІП), мають найважливіше значення для нормального функціонування острівцевих клітин підшлункової залози й гомеостазу глюкози. Вони збільшують концентрацію інсуліну в плазмі за рахунок декількох механізмів, більшість із яких здійснюються опосередковано через рецептори до ГІП і ГПП-1. Інкретини, впливаючи безпосередньо на підшлункову залозу, стимулюють продукцію інсуліну, але також можуть діяти й на клітинному рівні, збільшуючи транскрипцію гена інсуліну та його біосинтез.
Обидва гормони покращують чутливість β-клітини до глюкози і таким чином підвищують глюкозозалежну секрецію інсуліну, збільшуючи плазмовий рівень інсуліну відразу після прийому їжі. Цей процес отримав назву «інкретиновий ефект». Крім того, під впливом інкретинів відбувається глюкозозалежна регуляція функції α-клітин: у періоди гіперглікемії під впливом ГПП-1 відбувається пригнічення вироблення глюкагону, що призводить до зменшення резистентності до інсуліну, а за умов низького рівня глюкози в крові ГІП активно стимулює секрецію глюкагону і таким чином мінімізує ризик гіпоглікемічних станів [1, 2].
Основний сплеск секреції ГПП-1 і ГІП відзначається відразу після прийому їжі, однак спільною властивістю обох інкретинів є той факт, що вони швидко (ГПП-1 — протягом двох хвилин, ГІП — протягом шести хвилин) інактивуються ферментом дипептидилпептидазою 4-го типу (ДПП-4) [3].
Упродовж тривалого часу відповідь на питання про повноцінність інкретинового ефекту у хворих на ЦД2 не була однозначною. У 1986 р. M.A. Nauck і співавт. вперше продемонстрували, що в осіб із ЦД2 відзначається зниження функціональної активності гормонів інкретинового ряду [4]. В осіб без ЦД інкретиновий ефект забезпечує підтримання фізіологічного рівня глюкози в крові після прийому вуглеводів незалежно від кількості прийнятої їжі, оскільки інкретини здатні посилювати секрецію інсуліну підшлунковою залозою відповідно до потреби організму. Однак у хворих на ЦД2 інкретиновий ефект слабшає або зовсім зникає [5].
При ЦД2 відбувається порушення чутливості α- і β-клітин підшлункової залози, що призводить до прогресуючої недостатньої секреції інсуліну, резистентності до інсуліну внаслідок надмірного вироблення глюкагону в періоди постпрандіальної гіперглікемії і зниження глюкагонової відповіді в періоди гіпоглікемії [1]. Спостерігається посилення ліпотоксичності, безпосередньо пов’язаної з інсулінорезистентністю [6].
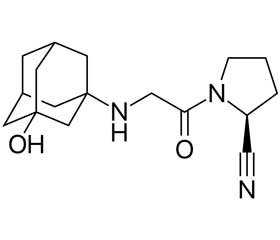
Вілдагліптін (LAF237) — високоселективний інгібітор ДПП-4, що перешкоджає швидкому руйнуванню ГПП-1 і ГІП, у результаті чого фізіологічна дія інкретинових гормонів на клітини острівцевого апарату підшлункової залози продовжується. Тривалість такої дії залежить в основному від того, наскільки повного пригнічення вдається досягнути [7].
З огляду на кристалічну структуру хімічно споріднених піролідинових нітрилів ігібіторів ДПП-4 є підстави вважати, що вілдагліптин є повільним субстратом для ДПП-4, який блокує інактивацію ГПП-1 і ГІП протягом 24 годин і утворює зворотну ковалентну імінефірну сполуку з активною сериновою ділянкою ДПП-4, що сприяє протонуванню сусіднього амінокислотного залишку й викликає морфологічні зміни ділянки зв’язування.
Це призводить до тривалого і стабільного інгібуючого ефекту. На відміну від вілдагліптину конкурентні інгібітори ДПП-4, такі як ситагліптин, зв’язуються з тією ж ділянкою білка, не викликаючи при цьому морфологічних змін ділянки зв’язування. Це може пояснити істотно більш сприятливий добовий профіль ГПП-1 і глюкагону при терапії вілдагліптином [8].
Також показано, що при терапії вілдагліптином збільшення концентрації ГПП-1, що спостерігається відразу після прийому їжі, зберігається на високому рівні протягом більш тривалого періоду часу порівняно з ситагліптином [8]. Крім того, різні фармакокінетичні профілі можуть обумовлювати різну активність протягом доби: після прийому однієї дози ситагліптину (100 мг) активність ДПП-4 в плазмі знижується на 100 % за 15–30 хв, після чого інгібуючий ефект зберігається на рівні понад 80 % протягом 14 год [28]; при прийомі вілдагліптину (50 мг двічі на добу) інгібування на рівні більше ніж 80 % зберігається протягом 24 год [9].
У клінічних дослідженнях із вивчення ефектів вілдагліптину на функцію острівцевих клітин підшлункової залози було продемонстровано поліпшення глюкозозалежної регуляції вуглеводного обміну. Так, у періоди гіперглікемії в результаті поліпшення чутливості α- і β-клітин до глюкози співвідношення інсуліну і глюкагону збільшується, знижуючи тим самим рівень глікемії, а також швидкість продукції глюкози в печінці. Зниження надмірного рівня глюкагону під час прийому їжі, у свою чергу, викликає зменшення інсулінорезистентності. При наростаючій тенденції до гіпоглікемії співвідношення інсуліну й глюкагону, навпаки, починає знижуватися, і під впливом цього процесу відбувається стимуляція вироблення глюкози печінкою, що дозволяє пацієнтові уникнути тяжкої гіпоглікемії. У дослідженнях у людей без ЦД2 вілдагліптин не стимулював секрецію інсуліну, а також не впливав на рівень глюкагону [10], що ще раз доводить фізіологічність дії цього препарату.
Сучасна оцінка ефективності інгібіторів ДПП-4 не обмежується розглядом безпосередньо лише цукрознижувальної дії, а має комплексний характер. Рецептори до ГПП-1 експресуються в екстрапанкреатичних тканинах — серці, судинах, головному мозку, печінці та інших. Так, останні дослідження інкретинів підтверджують не тільки ефективний вплив препаратів на глюкозотоксичність, а й додаткові механізми впливу на ліпотоксичність.
Уперше термін «ліпотоксичність» був запропонований R. Unger у 2003 р. для опису негативного впливу накопичення в тканинах вільних жирних кислот (ВЖК) на метаболізм глюкози. В організмі людини ліполіз активується під впливом глюкагону, адреналіну й норадреналіну, а пригнічується дією інсуліну. У результаті ліполізу в адипоцитах утворюються вільний гліцерин і ВЖК. Дослідження останніх років показали, що ВЖК виконують регуляторну функцію і входять до складу більшої частини ліпідів.
Підвищення ВЖК призводить до пригнічення глюкозозалежної секреції інсуліну, втрати чутливості β-клітин і подальшого їх апоптозу, а також розвитку інсулінорезистентності в печінці і м’язах. Інсулінорезистентність на рівні жирової тканини проявляється порушенням синтезу адипокінів, що, у свою чергу, призводить до порушення дії інсуліну у всьому організмі [11], а зниження антиліполітичної дії інсуліну на адипоцити вісцеральної жирової тканини, у свою чергу, підвищує продукцію ВЖК, які надходять в печінку через ворітну вену. Показано, що при ожирінні зростає як загальна жирова, так і нежирова маса [12]. При цьому кількість м’язових клітин не збільшується, а відбувається їх гіпертрофія з порушенням трофічних процесів. Експериментально доведено, що при дієті з великим умістом жиру тригліцериди накопичуються не в жировій тканині, а переважно в скелетних м’язах і печінці, що значно погіршує гіперглікемію у хворих на ЦД2, оскільки жирова тканина відповідальна за утилізацію лише 10 % від загальної кількості використовуваної організмом глюкози, а м’язи засвоюють 60–70 % плазмової глюкози.
Таким чином, вплив ВЖК на функцію підшлункової залози, ймовірно, є одним з основних факторів наростаючого зниження маси β-клітин і прогресування ЦД2, а менеджмент захворювання не може бути успішним без ефективного впливу як на глюкозотоксичність, так і на ліпотоксичність.
Нещодавно були опубліковані дані дослідження, метою якого було вивчити вплив терапії вілдагліптином на процеси ліполізу в печінці [13]. Це дослідження вперше продемонструвало, що призначення вілдагліптину дозволяє досягнути клінічно значущого зниження постпрандіального рівня тригліцеридів і корелює зі зменшенням рівня АЛТ у плазмі крові. Учасниками дослідження стали 44 пацієнти з ЦД2 (28 чоловіків і 16 жінок; HbA1c 6,4 ± 0,1 %) із тривалістю ЦД2 5,7 ± 0,7 року, які перебували на терапії метформіном. Пацієнтам першої групи (n = 22) було призначено вілдагліптин в дозуванні 50 мг двічі на день, пацієнти другої групи (n = 22) отримували плацебо.
Тривалість спостереження становила 6 місяців. Початково й на момент завершення дослідження оцінювалися такі показники: рівень тригліцеридів печінки (за даними магнітно-резонансної спектроскопії), продукція глюкози печінкою (еуглікемічний гіперінсулінемічний клемп), чутливість до інсуліну (індекс CARO, HOMA), рівень тригліцеридів плазми, глюкози плазми, інсуліну. Через 6 місяців дослідження були отримані вражаючі результати. Рівень тригліцеридів печінки, АСТ і АЛТ, ІМТ значуще знизилися в групі вілдагліптину порівняно з плацебо. Крім того, рівень АСТ і АЛТ позитивно корелював із рівнем тригліцеридів.
Середній рівень HbA1c знизився на 0,5 ± 0,1 % (р < 0,0001) порівняно з початковим рівнем 6,5 ± 0,1 % у групі вілдагліптину. У той же час спостерігалося незначне підвищення цього показника (0,2 ± 0,1 % від базового 6,4 ± 0,1%, р = 0,14) у групі плацебо, що призвело до вірогідної різниці показників між групами — 0,7 ± 0,1 % (р < 0,01) [13].
Відомо, що зниження маси тіла у хворих на ЦД2 і з надлишковою масою тіла або ожирінням сприяє поліпшенню глікемічного контролю і зниженню ризику прогресування серцево-судинних ускладнень. Ефект цукрознижувальних препаратів на масу тіла є важливим питанням при виборі терапії. Доведено, що препарати групи інгібіторів ДПП-4 чинять нейтральний вплив на вагу, а в комбінації з метформіном дозволяють досягнути значущого зниження маси тіла.
Так, у порівняльному дослідженні комбінованої терапії вілдагліптином з метформіном і глімепіридом з метформіном різниця між групами через 52 тижні становила 1,8 кг [14]. Це пояснюється фізіологічно обумовленою дією препарату, мінімальним ризиком гіпоглікемій і, як наслідок, відсутністю додаткового прийому їжі. Крім того, проведені клінічні дослідження виявили додаткові механізми дії, які пояснюють нейтральний вплив, а в деяких випадках і зниження маси тіла на тлі терапії вілдагліптином.
В одноцентровому рандомізованому дослідженні N. Matikainen і співавт. у пацієнтів із вперше виявленим ЦД2 вивчали вплив терапії вілдагліптином не лише на вуглеводний, а й на жировий обмін шляхом проведення тесту на толерантність до жирів на старті дослідження й через чотири тижні спостереження. Усі пацієнти були розділені на дві групи, в одній із яких був призначений вілдагліптин 50 мг двічі на день, а в іншій — плацебо. Даний тест проводився так: пацієнти натще вживали стандартизовану їжу, багату жирами, а в подальшому проводилася багаторазова оцінка ліпідів, ліпопротеїнів та аполіпопротеїну [15].
У результаті дослідження було продемонстровано статистично значуще зниження рівня HbA1c, глікемії натще і постпрандіальної глікемії. Крім того, були отримані важливі дані, що свідчать про зниження рівня циркулюючих в крові тригліцеридів на тлі терапії вілдагліптином. У групі плацебо такого ефекту не спостерігалося. Статистично значущим було зниження хіломікронів тригліцеридів, хіломікронів холестерину й аполіпопротеїну [15]. Оскільки хіломікрони належать до класу ліпопротеїнів, що утворюються в тонкому кишечнику в процесі всмоктування екзогенних ліпідів, зазначені результати можуть свідчити про гальмівну дію вілдагліптину на всмоктування жиру в кишечнику.
Враховуючи пригнічення вілдагліптином екстракції жирів у кишечнику, можна констатувати ще один механізм, завдяки якому цей препарат сприятливо впливає на масу тіла. Так, отримані дані, що вілдагліптин збільшує рівень норадреналіну і, таким чином, шляхом симпатичної стимуляції сприяє розщепленню жирів, що також дає тлумачення додаткових можливостей сприятливого впливу на вагу [16].
В одному з нещодавніх досліджень установлено, що в когорті хворих на ЦД2 ризики смертності та поєднання інфаркту міокарда та ішемічного інсульту були нижчими в пацієнтів, які отримували інгібітори ДПП-4, ніж в осіб без такого лікування. Застосування інгібіторів ДПП-4 не було пов’язане з більш високим ризиком госпіталізації з приводу серцевої недостатності (СН) навіть у пацієнтів з раніше існуючою СН [17].
Результати інших авторів також свідчать про те, що використання інгібіторів ДПП-4 не збільшувало ризик СН порівняно із використанням похідних сульфонілсечовини. Крім того, ризики виникнення серцево-судинних ускладнень не підвищувалися в пацієнтів на тлі прийому інгібіторів ДПП-4 порівняно із пацієнтами, які отримували похідні сульфонілсечовини [18].
Нещодавно встановлено, що інгібітори ДПП-4 покращують ендотеліальну функцію судин у пацієнтів з артеріальною гіпертензією за рахунок пригнічення запальної реакції та зменшення оксидативного стресу. До того ж інгібітори ДПП-4 також можуть регулювати артеріальний тиск, активуючи симпатичну нервову систему, утручаючись в ренін-ангіотензин-альдостеронову систему шляхом регуляції метаболізму натрію та послаблюючи резистентність до інсуліну [19].
В іншому дослідженні вперше розглянута активність мікробіоти кишечника як мішень інгібування ДПП-4. Установлено, що вілдагліптин сприятливо впливає на модуляцію мікробіоти кишечника з позитивними наслідками для імунної системи. Тому отримані результати можуть відкрити нові терапевтичні можливості інгібування ДПП-4 для корекції дисфункцій кишечника в різних патофізіологічних контекстах [20, 21].
Відомо, що діабетична нефропатія (ДН), як загрозливе життю ускладнення ЦД, підвищує інвалідизацію та смертність хворих. На сьогодні також установлено, що інгібітори ДПП-4 мають неглікемічні тканинні ефекти, включаючи нефропротективний. З метою вивчення ефективності вілдагліптину на глікемічні, метаболічні та ниркові параметри у 44 пацієнтів з ЦД 2-го типу та хронічною хворобою нирок I–II ст., які отримували інсулінотерапію, продовжували терапію інсуліном або додавали до інсуліну вілдагліптин в дозі 50 мг/добу, з оцінкою результатів через 6 місяців [22].
У групі терапії вілдагліптином відбулося вірогідне зниження HbA1c, постпрандіальної глікемії, діастолічного артеріального тиску, індексу HOMA-IR, потреби в інсуліні і зниження частоти гіпоглікемій. Також у цій групі відзначалася позитивна динаміка показників гломерулярної функції нирок — значуще зменшення альбумінурії, а також вірогідне підвищення швидкості клубочкової фільтрації (за цистатином С) і зниження екскреції колагену IV типу. Отримані дані свідчать як про раніше підтверджений у клінічних дослідженнях позитивний вплив вілдагліптину на метаболічний статус, показники глікемії й гемодинаміки, так і про незалежну від глікемічних ефектів здатність вілдагліптину гальмувати розвиток гломерулярної дисфункції у пацієнтів із ЦД 2-го типу й початковими проявами ДН.
Таким чином, результати згаданого вище дослідження продемонстрували глюкозонезалежний нефропротективний ефект додавання терапії вілдагліптином пацієнтам із ЦД 2-го типу з наближеними до цільових показниками глікемії на інсулінотерапії. Крім того, установлено позитивний вплив вілдагліптину на такі важливі фактори ризику прогресування кардіоренального синдрому, як артеріальна гіпертензія, дисліпідемія, інсулінорезистентність і системне запалення.
Отже, вілдагліптин є потужним високоселективним інгібітором ДПП-4, що при призначенні як монотерапії, так і в поєднанні з іншими цукро–знижувальними препаратами дозволяє досягнути ефективного глікемічного контролю, чинить протективний вплив на функцію α- і β-клітин, крім того, відкриває нові можливості управління ЦД2, знижуючи ліпотоксичність і резистентність до інсуліну [23]. Препарат добре переноситься, має мінімальний ризик гіпоглікемій і сприяє підтриманню нормальної маси тіла. Крім того, установлений нефропротективний ефект додавання терапії вілдагліптином не залежить від цукрознижувальної дії препарату. Отримані дані не тільки свідчать про наявність у вілдагліптину плейотропних ефектів щодо ниркової функції, але й дозволяють розглядати таку терапію як засіб для зниження загального серцево-судинного ризику в пацієнтів з ЦД2.
В Україні зареєстрований і використовується в клінічній практиці препарат Гліптар, таблетки, виробництва АТ «Київмедпрепарат» (вілдагліптин 50 мг в одній таблетці), для лікування дорослих пацієнтів із ЦД2. Препарат рекомендується для призначення у вигляді монотерапії для пацієнтів, у яких застосування тільки дієти та фізичних вправ не забезпечує достатнього контролю, а також для пацієнтів, у яких застосування метформіну вважається неприйнятним через наявність протипоказань або непереносимості. У складі подвійної пероральної терапії в комбінації з метформіном — для пацієнтів із недостатнім глікемічним контро–лем, незважаючи на застосування максимально переносимої дози при проведенні монотерапії метформіном; із похідними сульфонілсечовини — для пацієнтів із недостатнім глікемічним контролем, попри застосування максимальної переносимої їх дози, та для пацієнтів, для яких застосування метформіну вважається неприйнятним через наявність протипоказань або непереносимості; із тіазолідиндіоном — для пацієнтів із недостатнім глікемічним контролем, для яких застосування тіазолідиндіону вважається прийнятним. У складі потрійної пероральної терапії в комбінації з похідними сульфонілсечовини та метформіном — коли дієта й фізичні вправи разом із подвійною терапією цими лікарськими засобами не забезпечують адекватного глікемічного контролю. Крім того, доцільне призначення вілдагліптину в комбінації з інсуліном (з метформіном або без), коли дієта та фізичні вправи разом зі стабільною дозою інсуліну не забезпечують адекватного глікемічного контролю.
Конфлікт інтересів. Не заявлений.
- Ahrén B, Schweizer A, Dejager S, Villhauer EB, Dunning BE, Foley JE. Mechanisms of action of the dipeptidyl peptidase-4 inhibitor vildagliptin in humans. Diabetes Obes Metab. 2011 Sep;13(9):775-83. doi: 10.1111/j.1463-1326.2011.01414.x.
- Schweizer A, Foley JE, Kothny W, Ahrén B. Clinical evidence and mechanistic basis for vildagliptin’s effect in combination with insulin. Vasc Health Risk Manag. 2013;9:57-64. doi: 10.2147/VHRM.S40972.
- Ahren B, Carr RD, Deacon CF. Incretin hormone secretion over the day. Vitam Horm. 2010;84:203-20. doi: 10.1016/B978-0-12-381517-0.00007-2.
- Nauck M, Stockmann F, Ebert R, Creutzfeldt W. Reduced incretin effect in type 2 (non-insulin-dependent) diabetes. Diabetologia. 1986 Jan;29(1):46-52. doi: 10.1007/bf02427280.
- Drucker DJ, Nauck MA. The incretin system: glucagon-like peptide-1 receptor agonists and dipeptidyl peptidase-4 inhibitors in type 2 diabetes. Lancet. 2006 Nov 11;368(9548):1696-705. doi: 10.1016/S0140-6736(06)69705-5.
- He YL. Clinical pharmacokinetics and pharmacodynamics of vildagliptin. Clin Pharmacokinet. 2012 Mar 1;51(3):147-62. doi: 10.2165/11598080-000000000-00000.
- Xiaoyan C, Jing W, Xiaochun H, Yuyu T, Shunyou D, Yingyu F. Effects of vildagliptin versus saxagliptin on daily acute glucose fluctuations in Chinese patients with T2DM inadequately controlled with a combination of metformin and sulfonylurea. Curr Med Res Opin. 2016 Jun;32(6):1131-6. doi: 10.1185/03007995.2016.1162773.
- Rizzo MR, Barbieri M, Marfella R, Paolisso G. Reduction of Oxidative Stress and Inflammation by Blunting Daily Acute Glucose Fluctuations in Patients With Type 2 Diabetes: Role of dipeptidyl peptidase-IV inhibition. Diabetes Care. 2012 Oct;35(10):2076-82. doi: 10.2337/dc12-0199.
- He YL, Yamaguchi M, Ito H, Terao S, Sekiguchi K. Pharmacokinetics and pharmacodynamics of vildagliptin in Japanese patients with type 2 diabetes. Int J Clin Pharmacol Ther. 2010 Sep;48(9):582-95. doi: 10.5414/cpp48582.
- El-Ouaghlidi A, Rehring E, Holst JJ, et al. The dipeptidyl peptidase 4 inhibitor vildagliptin does not accentuate glibenclamide-induced hypoglycemia but reduces glucose-induced glucagon-like peptide 1 and gastric inhibitory polypeptide secretion. J Clin Endocrinol Metab. 2007 Nov;92(11):4165-71. doi: 10.1210/jc.2006-1932.
- Pittas AG, Joseph NA, Greenberg AS. Adipocytokines and insulin resistance. J Clin Endocrinol Metab. 2004 Feb;89(2):447-52. doi: 10.1210/jc.2003-031005.
- Abbott WG, Howard BV, Ruotolo G, Ravussin E. Energy expenditure in humans: effects of dietary fat and carbohydrate. Am J Physiol. 1990 Feb;258(2 Pt 1):E347-51. doi: 10.1152/ajpendo.1990.258.2.E347.
- Macauley M, Hollingsworth KG, Smith FE, et al. Effect of vildagliptin on hepatic steatosis. J Clin Endocrinol Metab. 2015 Apr;100(4):1578-85. doi: 10.1210/jc.2014-3794.
- Matthews DR, Dejager S, Ahren B, et al. Vildagliptin add-on to metformin produces similar efficacy and reduced hypoglycaemic risk compared with glimepiride, with no weight gain: results from a 2-year study. Diabetes Obes Metab. 2010 Sep;12(9):780-9. doi: 10.1111/j.1463-1326.2010.01233.x.
- Matikainen N, Manttari S, Schweizer A, et al. Vildagliptin therapy reduces postprandial intestinal triglyceride-rich lipoprotein particles in patients with type 2 diabetes. Diabetologia. 2006 Sep;49(9):2049-57. doi: 10.1007/s00125-006-0340-2.
- Boschmann M, Engeli S, Dobberstein K, et al. Dipeptidyl-peptidase-IV inhibition augments postprandial lipid mobilization and oxidation in type 2 diabetic patients. J Clin Endocrinol Metab. 2009 Mar;94(3):846-52. doi: 10.1210/jc.2008-1400.
- Ou SM, Chen HT, Kuo SC, Chen TJ, Shih CJ, Chen YT. Dipeptidyl peptidase-4 inhibitors and cardiovascular risks in patients with pre-existing heart failure. Heart. 2017 Mar;103(6):414-420. doi: 10.1136/heartjnl-2016-309687.
- Kim YG, Yoon D, Park S, et al. Dipeptidyl Peptidase-4 Inhibitors and Risk of Heart Failure in Patients With Type 2 Diabetes Mellitus: A Population-Based Cohort Study. Circ Heart Fail. 2017 Sep;10(9). pii: e003957. doi: 10.1161/CIRCHEARTFAILURE.117.003957.
- Zhang J, Chen Q, Zhong J, Liu C, Zheng B, Gong Q. DPP-4 Inhibitors as Potential Candidates for Antihypertensive Therapy: Improving Vascular Inflammation and Assisting the Action of Traditional Antihypertensive Drugs. Front Immunol. 2019 May 9;10:1050. doi: 10.3389/fimmu.2019.01050.
- Olivares M, Neyrinck AM, Pötgens SA, et al. The DPP-4 inhibitor vildagliptin impacts the gut microbiota and prevents disruption of intestinal homeostasis induced by a Western diet in mice. Diabetologia. 2018 Aug;61(8):1838-1848. doi: 10.1007/s00125-018-4647-6.
- Liao X, Song L, Zeng B, et al. Alteration of gut microbiota induced by DPP-4i treatment improves glucose homeostasis. EBioMedicine. 2019 Jun;44:665-674. doi: 10.1016/j.ebiom.2019.03.057.
- Bayrasheva VK, Babenko AY, Bayramov AA, et al. Prospects of nephroprotection against type 2 diabetes using the DPP-4 inhibitor vildagliptin. Medical Council. 2017;(3):8-16. doi: 10.21518/2079-701X-2017-3-8-16. (in Russian).
- Tsygankova OV, Veretyuk VV, Ametov AS. Incretins today: multiple effects and therapeutic potential. Diabetes mellitus. 2019;22(1):70-78. doi: 10.14341/DM9841. (in Russian).