Международный эндокринологический журнал Том 15, №6, 2019
Вернуться к номеру
Особенности лечения сахарного диабета 2-го типа у пожилых
Авторы: Эль Зейн В.А., Мохорт Т.В.
Белорусский государственный медицинский университет, г. Минск, Республика Беларусь
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
Цукровий діабет (ЦД) стає однією з найпоширеніших проблем людей похилого віку. Поширеність ЦД у всьому світі серед людей старше 65 років у 2017 році становила 123 мільйони осіб. Очікується, що в 2045 році чисельність таких хворих подвоїться. У літніх пацієнтів із ЦД виявляється підвищений ризик розвитку загальних геріатричних синдромів, зокрема слабкості, когнітивних порушень і деменції, нетримання сечі, травматичних захворювань, падінь і переломів, інвалідності, побічних ефектів поліпрагмазії, що мають неабиякий вплив на якість життя і можуть знизити ефективність лікування цукрового діабету. У цьому аналітичному огляді літератури розглянуто глікемічні мішені, а також кращі варіанти лікування людей похилого віку з ЦД 2-го типу на підставі сучасних міжнародних рекомендацій.
Сахарный диабет (СД) становится одной из наиболее распространенных проблем пожилых людей. Распространенность СД во всем мире среди лиц старше 65 лет в 2017 году составила 123 миллиона человек, и ожидается, что в 2045 году численность таких больных удвоится. У пожилых пациентов с СД повышен риск развития общих гериатрических синдромов, в том числе слабости, когнитивных нарушений и деменции, недержания мочи, травматических заболеваний, падения и переломов, инвалидности, побочных эффектов полипрагмазии, которые оказывают важное влияние на качество жизни и могут помешать лечению диабета. В этом аналитическом обзоре литературы рассмотрены гликемические мишени, а также лучшие варианты лечения пожилых людей с СД 2-го типа на основе современных международных рекомендаций.
Diabetes mellitus (DM) is becoming one of the most common health problems in the elderly. Worldwide prevalence of DM among subjects over 65 years of age was 123 million in 2017, and it is expected that in 2045 the number of such persons will double. Elderly patients with DM have a higher risk of common geriatric syndromes, including frailty, cognitive impairment and dementia, urinary incontinence, traumatic falls and fractures, disability, side effects of polypharmacy, which have an important impact on quality of life and may interfere with anti-diabetic treatment. This analytical review of the literature discusses glycemic targets, as well as the best treatment options for elderly people with type 2 diabetes mellitus based on current international guidelines.
цукровий діабет 2-го типу; похилий вік; супутні захворювання; пов’язані з цукровим діабетом; цільовий рівень глікемії; глюкозознижуючі препарати; огляд
сахарный диабет 2-го типа; пожилые; сопутствующие заболевания, связанные с диабетом; целевой уровень гликемии; глюкозоснижающие препараты; обзор
type 2 diabetes mellitus; elderly; co-morbidities associated with diabetes mellitus; target blood glucose levels; glucose-lowering drugs; review
Введение
Сахарный диабет (СД) признан важной причиной преждевременной смерти и инвалидности. За последние три десятилетия стандартизированная по возрасту распространенность заболевания значительно возросла в различных странах независимо от уровня дохода. По оценкам экспертов, до 40 % этого увеличения обусловлено ростом населения и его старением [1]. Сахарный диабет является одной из наиболее распространенных проблем, связанных со здоровьем, у пожилых людей, которые представляют собой гетерогенную и сложную популяцию, поскольку в нее входят недавно диагностированные пожилые пациенты с СД и пациенты с длительным течением заболевания с манифестацией в среднем или молодом возрасте. Это определяет сложности лечения СД для клиницистов из-за трудностей в индивидуализации гликемических целей, стратегий лечения, сопутствующих заболеваний, полипрагмазии и риска развития гипогликемических состояний.
Цель данного обзора — обсуждение оптимальных гликемических показателей и вариантов лечения для пожилых людей с СД 2-го типа на основе современных общих международных рекомендаций.
Обзор литературы проводился с использованием данных PubMed и Google Scholar. Для поиска использовались специфические словосочетания, такие как «СД 2-го типа», «пожилые», «сопутствующие заболевания, связанные с СД», «целевой уровень гликемии», «сахароснижающие препараты». Все найденные статьи были тщательно оценены, а полученные данные — проанализированы.
Эпидемиология
Среди пожилых людей с СД около 90 % больных имеют СД 2-го типа (СД-2). В США распространенность СД-2 у населения в возрасте 65 лет и старше составляет 33 %, а предиабета — 50 % [2]. Первичная заболеваемость СД-2 достигает максимальных значений среди лиц в возрасте от 65 до 79 лет. Важным фактом является то, что количество смертей, вы–званных СД, в возрасте 60–99 лет составляет около 60 % всех смертей, обусловленных этим заболева–нием, в возрастной группе от 18 до 99 лет [3].
Кроме того, пожилые пациенты с СД-2 имеют более высокий риск сердечно-сосудистых осложнений, включая заболевания периферических сосудов, болезни сердца и инсульт, а также многие гериатрические синдромы (от когнитивных нарушений до недержания мочи). Описанные факты определили разработку рекомендаций по особенностям ведения СД у пожилых [2].
Население Республики Беларусь стареет быстрее, чем население мира в целом. Ресурсный центр Фонда ООН в области народонаселения (United Nations Population Fund, UNFPA) отмечает, что средний возраст жителей нашей страны в начале 2011 года достиг 39,6 года, в то время как возраст среднестатистического жителя планеты составил только 28 лет. Если в 1980 г. белорусы в возрасте 60+ составляли 13,7 % населения, то к 2017 г. их доля возросла до 21 %, а прогнозный показатель к 2040 г. увеличится до 29,5 % [4]. Согласно данным национального регистра СД, на конец 2018 г. в Республике Беларусь среди общего количества почти 75,8 % составляли пациенты старше 60 лет (238 896 пациентов), а старше 75 лет — 23 % (70 112 пациентов), что актуализирует определение тактики лечения СД у пожилых.
Особенности патофизиологии СД у пожилых людей
Особенности патофизиологии СД в пожилом возрасте включают несколько факторов.
1. Хронологический возраст человека является фактором риска многих хронических заболеваний. Пожилой возраст приводит к активации системного хронического воспаления, окислительного стресса, повреждений ДНК, снижению митохондриальной функции, клеточному старению и дисфункции тканей. Старение ассоциировано с повышенным уровнем провоспалительных молекул, включая интерлейкины (IL) — IL-1, -6, -8, -13, -18, C-реактивный белок, интерфероны α и β, трансформирующий фактор роста β (TGF-β), фактор некроза опухоли α (TNF-α) и амилоид сыворотки [5]. Все указанные состояния способствуют возникновению метаболических нарушений [6].
2. Возрастные вариации композиции тела приводят к увеличению доли жировой массы, особенно висцерального ожирения, и одновременному снижению мышечной и скелетной массы. При старении наблюдается снижение репликации преадипоцитов и увеличение количества стареющих клеток в жировой ткани, которые усиливают липотоксичность и способствуют формированию провоспалительного статуса [7].
3. Некоторые исследования показали, что старение сопровождается:
— ухудшением секреции инсулина β-клетками в ответ на эндогенные инкретины (глюкагоноподобный полипептид-1 (ГПП-1) и глюкозозависимый инсулинотропный полипептид (ГИП)) и снижением их секреции;
— снижением чувствительности тканей к инсулину; гибели β-клеток, вызывая дисфункцию митохондрий и последующее снижение секреции инсулина [5].
У пожилых людей нарушения чувствительности к инсулину и его секреции постепенно приводят к нарушению толерантности к глюкозе и, как следствие, к клинически выраженному СД. Постпрандиальная гипергликемия является характерной чертой СД-2 для пожилых пациентов, что определяет целесообразность проведения орального теста на толерантность к глюкозе (ОТТГ) для раннего выявления заболевания в тех случаях, когда диагноз мог быть не установлен при тестировании тощаковых уровней глюкозы [8].
Скрининг диабета и предиабета и профилактика
Всемирная организация здравоохранения (ВОЗ), Американская диабетическая ассоциация (American Diabetes Association, АDА) и Американское общество эндокринологов и национальные клинические протоколы диагностики и лечения взрослого населения с заболеваниями эндокринной системы при оказании медицинской помощи в амбулаторных условиях (приказ Министерства здравоохранения Республики Беларусь от 2 июля 2013 г. № 764) рекомендуют диагностировать СД и предиабет на основе показателей глюкозы или гликированного гемоглобина (HbA1c) (табл. 1). Однако у многих людей старше 60 лет диагноз СД и предиабета не устанавливается, если не проводится ОТТГ [9]. Важно отметить, что не только манифестный СД, но и предиабет являются факторами повышения риска прогрессирования осложнений и развития сердечно-сосудистых заболеваний (ССЗ).
Оценка HbA1c является не лучшим методом диагностики СД для пожилых, что обусловлено снижением его образования с возрастом, а также влиянием на этот процесс других факторов (переливание крови, анемия, хроническая болезнь почек, дислипидемия, использование аспирина, витаминов С и Е, почечно-заместительная терапия и др.), частота которых с возрастом нарастает.
Для профилактики СД-2 в качестве основной стратегии рекомендуется программа коррекции образа жизни. У пациентов с избыточным весом изменение образа жизни в результате потери всего лишь 5 % массы тела может улучшить гликемический контроль и необходимость использования лекарственных препаратов для контроля гликемии. Тем не менее пожилые пациенты сталкиваются с рядом проблем, связанных с питанием и физической нагрузкой. К потере веса у пожилых людей следует подходить с осторожностью, так как преднамеренная и непреднамеренная потеря веса может привести к серьезному дефициту питательных веществ. Рекомендация сочетания физической активности и диетотерапии, включая рекомендуемое потребление кальция, витамина D и других витаминов, минералов и микроэлементов, является актуальной стратегией для этой группы населения. Увеличение физической активности у пожилых людей может быть обеспечено ограничениями сидячего положения за счет физических нагрузок умеренной интенсивности с аэробной активностью. При начале аэробных физических нагрузок у пожилых людей необходима оценка их потенциальных возможностей после общего осмотра, включая тестирование с физической нагрузкой и мониторинг сердечного ритма/артериального давления (АД). Обучение подсчету углеводов и калорий и планированию приема пищи может быть полезным для людей, ведущих активный образ жизни, для эффективного изменения дозировки инсулина и улучшения гликемического контроля. Более простой подход к планированию приема пищи при СД с акцентом на контроль порций и выбор здоровой пищи должен быть рекомендован для пожилых людей с когнитивными нарушениями или трудностями в обучении [2].
Обсуждаются интервенционные технологии превенции СД с использованием лекарственных средств. В то же время Американское общество эндокринологов не рекомендует использование метформина (наиболее используемого препарата) для профилактики, что обусловлено временным влиянием на предупреждение СД-2.
По результатам исследования STEPS, проведенного в Республике Беларусь при поддержке ВОЗ, оценивающего распространенность факторов риска неинфекционных заболеваний в 2016 г., было определено, что более 60 % лиц, включенных в исследование, имеют избыточную массу тела или ожирение (последнее выявлено у более чем 25 % респондентов). При этом подтверждены недостаточность использования в рационе овощей и фруктов и физической активности. Приведенные факты актуализируют необходимость превентивных мер, направленных на снижение заболеваемости СД в общей популяции.
Общие гериатрические синдромы, связанные с диабетом, и гликемические цели
Пожилые люди с СД страдают от избыточной заболеваемости и смертности по сравнению с пожилыми людьми без него [5]. Кроме того, они подвержены высокому риску полипрагмазии, функциональных нарушений и общих гериатрических синдромов, которые включают когнитивные нарушения, депрессию, недержание мочи, саркопению, падения и постоянный болевой синдром. Скрининг на гериатрические синдромы может быть полезен для отдельных пациентов, особенно когда идентификация и лечение могут помочь достичь лучшего контроля гликемии. В частности, когнитивные функции и возможность возникновения депрессии следует оценивать у пациентов старшего возраста с СД:
— при несоблюдении режима терапии;
— частых эпизодах гипогликемии;
— ухудшении гликемического контроля без явного объяснения.
Наличие гериатрических синдромов является фактором, оказывающим влияние на выбор цели гликемического контроля. Пожилые пациенты с СД-2 представляют собой разнородную и сложную группу населения в отношении ухода и лечения, поэтому необходимо помнить о поддержании их оптимального качества жизни. Ориентированные на пациента гликемические цели необходимы для достижения гликемического контроля, при этом необходимо избегать опасных или экстремальных колебаний уровня глюкозы. Пожилые пациенты очень уязвимы для гипогликемических явлений. Гипо–гликемия в пожилом возрасте ассоциируется с повышенным риском развития когнитивных нарушений, деменции, госпитализации по всем причинам и смертности от всех причин [2, 10]. Использование инсулина или стимуляторов секреции инсулина (в первую очередь производных сульфонилмочевины (ПСМ)), полипрагмазия, сопутствующие заболевания, почечная недостаточность, дегидратация, нарушение контррегуляторных реакций представляют собой основные предрасполагающие факторы развития эпизодов гипогликемии. Причины гипогликемии у пожилых включают также плохое питание, лекарственные препараты (не только антигипергликемические, но также аспирин, аллопуринол, варфарин, бета-блокаторы, ингибиторы АПФ, антагонисты рецепторов ангиотезина II и др.), не–обученность пациента и когнитивные нарушения, использование алкоголя. Также имеет значение прогрессирующее возрастное снижение функции β-адренергического рецептора и уменьшение мышечной массы (саркопения). Саркопения определяет не только снижение физической активности, но и влияние на метаболические процессы опосредованно через уменьшение количества мышечного гликогена и нарушения регуляции чувствительности к инсулину. Скелетная мускулатура, которая идентифицируется как эндокринный орган, продуцирующий цитокины и другие пептиды (миокины), оказывает паракринный, аутокринный или эндокринный эффекты, включая влияние на продукцию адипонектина, гликопротеин-фоллистатиноподобный фактор-1 с мощным ангио- и кардиопротективным действием [11].
Оценка потенциальных факторов риска гипо–гликемии является важной частью клинического ведения пациентов старшего возраста с СД-2. Кроме того, как пациенты, так и лица, обеспечивающие уход, должны быть обучены профилактике, выявлению и лечению гипогликемических состояний.
С одной стороны, следует избегать гипергликемических состояний, которые у пожилых повышают риск обезвоживания, головокружения, падений и долгосрочной смертности [12]. Недостаток рандомизированных контролируемых исследований (РКИ) по лечению СД у пожилых людей не позволяет четко определить наиболее подходящие терапевтические цели. Три крупных РКИ (ACCORD, VADT и ADVANCE) по лечению СД-2 у лиц в возрасте около 60 лет показали, что достижение строгого гликемического контроля (HbA1c < 6 % или < 6,5 %) не было связано с улучшениями сердечно-сосудистых исходов, а исследование ACCORD было досрочно прекращено из-за повышенной смертности в группе интенсивного контроля глюкозы (число смертей при интенсивной и стандартной терапии составило 257 против 203; р = 0,04), увеличения числа гипогликемических событий (538 против 179; р < 0,001).
С другой стороны, большое обсервационное исследование показало, что уровень HbA1c > 8 % ассоциирован с повышенным риском смертности от всех причин, ССЗ и раковых заболеваний у пожилых людей с сахарным диабетом [13]. Оптимальные гликемические цели для пожилых пациентов с СД остаются предметом дискуссий, тем не менее существует согласие относительно адаптации гликемических показателей в зависимости от ожидаемой продолжительности жизни пациента, длительности СД, функционального статуса, сопутствующих заболеваний и достижения умеренного (HbA1c 7–8 %), а не строгого контроля у пациентов с большой длительностью заболевания [2].
Стратегии лечения и цели, разработанные для пожилых людей, зависят от общего состояния здоровья пациента, включая сложность и функциональный статус, который определяется способностью выполнять обычные повседневные дела, необходимые для удовлетворения основных потребностей, поддержания здоровья и благополучия. Как старение, так и СД являются независимыми факторами риска нарушения функционального статуса, и взаимодействие этих двух факторов является уникальным для каждого пациента. По этой причине в последних руководствах по СД обычно делается вывод о том, что лечение стареющего пациента требует индивидуального, а не чисто алгоритмического подхода [2]. Тем не менее нет стандартного инструмента, рекомендуемого для оценки и документирования эффективности функционирования пожилых людей в их жизни. Функциональный статус чаще всего документируется с использованием различных видов деятельности, необходимых для самостоятельной жизни. Они включают повседневную деятельность (ПдД) (способность принимать ванну, одеваться, принимать пищу, пользоваться туалетом и перемещаться), а также инструментальную ПдД (ИПдД) (приготовление пищи, покупки, управление деньгами, использование телефона и управление приемом лекарств). У пациентов с СД дефицит ИПдД, выявленный при рутинной оценке, должен инициировать более глубокую оценку состояния пациента, включая гипогликемии и гипергликемии, микрососудистые и макрососудистые осложнения и когнитивную функцию.
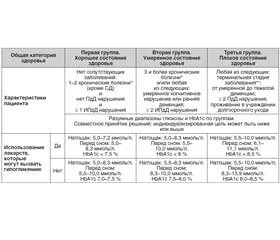
На протяжении многих лет различные объединения врачей (ADA; American Geriatric Society; California Health Care Foundation; European Diabetes Working Party for Older People; International Association of Gerontology and Geriatrics; International Diabetes Federation; Veterans Affairs/Department of Defense) предлагали схожие стандарты оценки функционального состояния пожилых людей, определяющие разделение их на 3 группы (табл. 2) [14]. В результате осмысления и адаптации приведенных предложений была сформирована концепция оценки общего состояния здоровья, которая делит пациентов на группы с хорошим здоровьем (группа 1), с промежуточным здоровьем (группа 2) и с плохим здоровьем (группа 3) (табл. 3). Аналогичные предложения определены в стандартах оказания помощи при СД, предложенных АDА (2019):
— целевой HbA1c < 7,5 % для здоровых пожилых людей с интактным когнитивным и функциональным статусом, уровень глюкозы натощак или перед приемом пищи между 5,0 и 7,2 ммоль/л;
— менее строгие цели (HbA1c < 8,0–8,5 %) для слабых пожилых людей с ограниченной продолжительностью жизни, уровнем глюкозы натощак от 5,6 до 10,0 ммоль/л [10].
Эти терапевтические цели соответствуют целям для взрослых старше 65 лет, указанным Американским обществом гериатрии, которое предлагает определять HbA1c не реже одного раза в 6 месяцев. Помимо целевых показателей гликемии подчеркивается важность контроля других факторов сердечно-сосудистого риска при помощи соответствующей гиполипидемической, антитромбоцитарной и антигипертензивной терапии. В отличие от ADA Американская ассоциация клинических эндокринологов (ААСЕ) рекомендует уровень HbA1c равный 6,5 % или ниже для большинства пациентов без ССЗ, так как он может быть безопасно достигнут, тогда как более широкая цель с уровнем HbA1c > 6,5 % рекомендуется для пожилых пациентов с сопутствующими серьезными заболеваниями, высоким риском гипогликемии и ограниченным сроком продолжительности жизни [15].
Сахарный диабет и гериатрические синдромы
Начало СД у пожилых обычно проявляется нечеткими и неспецифическими симптомами — обезвоживанием, сухостью во рту, спутанностью сознания, усталостью, вялостью, потерей веса и повышенной склонностью к инфекциям мочеполовой системы [5]. Было подсчитано, что у 60 % пожилых пациентов с СД-2 имеется по крайней мере еще одно сопутствующее заболевание, и у 40 % этих пациентов фактически имеется более четырех сопутствующих заболеваний [16]. Наиболее распространенные сопутствующие заболевания при СД-2, включающие когнитивные нарушения, депрессию, апатию, недержание мочи, нарушения слуха и зрения, падения и переломы, полипрагмазию, аналогичны стандартным гериатрическим синдромам. В пожилом возрасте учащаются недоедание, отсутствие физической активности и нежелательная потеря веса. Кроме того, у пожилых пациентов с СД с большей вероятностью могут иметь место гипер-/гипогликемические эпизоды, о которых пациент не знает, а также серьезные неблагоприятные сердечно-сосудистые события, обусловленные периферической и вегетативной невропатией.
Следовательно, комплексная гериатрическая оценка, включающая скрининг микрососудистых осложнений, сердечно-сосудистых факторов риска и гериатрических синдромов, должна проводиться при первоначальной диагностике СД у пожилых пациентов [2].
Когнитивная дисфункция, депрессия и хрупкость
Существуют неоспоримые доказательства связи когнитивной дисфункции и депрессии с СД-2, усугубляющиеся у пожилых пациентов. При этом регистрируется повышение риска развития умеренных когнитивных нарушений (УКН), деменции по различным причинам и болезни Альцгеймера [17]. Конкретные механизмы, лежащие в основе этой ассоциации, до сих пор неясны, однако вовлеченными факторами являются сосудистая дисфункция, артериальная гипертензия, гипергликемия, гипо–гликемические явления, резистентность к инсулину и нейровоспаление. Кроме того, депрессивные и апатические симптомы часто сосуществуют с СД, и некоторые исследования показали, что их сочетание может оказывать нейротоксическое воздействие на мозг, увеличивая риск развития деменции [5]. В связи с этим АDА и Американское общество эндокринологов рекомендуют для пациентов старше 65 лет проведение нейропсихологического скрининга, направленного на раннее выявление УКН и депрессии при первом посещении. Для этого наряду с оценкой жалоб рекомендуется использование специальных тестов (мини-исследование психического состояния, Монреальская когнитивная шкала и Гериатрическая шкала депрессии) и минимизация гипогликемических событий для снижения риска развития умеренных когнитивных нарушений. У пациентов без проявлений когнитивного дефицита скрининг должен повторяться через 2–3 года после первоначального нормального результата или через 1 год после пограничного или нормального результата теста.
Хрупкость (слабость) может быть определена как состояние повышенной уязвимости к физическим или психологическим стрессам из-за полиорганного уменьшения физиологических резервов, приводящих к ограничению способности поддерживать гомеостаз. Скрининг на гериатрические синдромы, включая хрупкость, должен быть частью поэтапного подхода к пожилым людям с СД, особенно в условиях первичной и социальной помощи. Любая информация об изменении подвижности, наличии падений, заметном уменьшении ИПдД после недавней выписки из стационара или наличии постоянной усталости должна побудить врача к выявлению хрупкости с использованием какого-либо специального теста (Fried score, Сlinical frailty scale or FRAIL score). Важность выявления слабости заключается в возможности рассмотреть специальные вмешательства, которые уменьшают функциональное снижение и риск инвалидности.
Инвалидность, переломы и недержание мочи
Сахарный диабет у пожилых является мощным фактором риска функциональных ограничений, слабости, потери независимости и инвалидности. По мере старения происходит постепенная потеря прочности скелетной и мышечной массы, что приводит к состоянию остео- и саркопении. Изменения в обмене белков скелетных мышц могут ускорить эти изменения, что приводит к увеличению рисков падения и переломов костей [2, 5]. Доказано, что пожилые пациенты с СД имеют повышенный риск переломов шейки бедра, особенно на фоне инсулинотерапии и травм, связанных с падением [18]. Поскольку уровень тестостерона снижается с возрастом, а при СД-2 повышается риск вторичного гипогонадизма, оценка уровня тестостерона может быть полезна в случае признаков и симптомов явного гипогонадизма для оптимальной оценки риска переломов в этой группе [19]. Умеренная, но регулярная физическая активность и высокая приверженность к средиземноморской диете продемонстрировали некоторые преимущества в снижении риска падений и физических нарушений у пациентов старше 75 лет [5]. Американское общество гериатрии предлагает опрашивать пожилых пациентов о падениях по крайней мере каждые 12 месяцев и изучать потенциально обратимые причины падений (лекарства, факторы окружающей среды, ограничивающие факторы — нарушения зрения, головокружения и др.) и проводить полную базовую оценку, когда происходит опасное падение.
Недержание мочи — частая проблема при СД, хотя пациенты обычно не сообщают о ней. Это диктует требования, сформулированные Американским обществом гериатрии, согласно которым врачи должны всегда проводить ежегодный скрининг на недержание мочи, которое может быть важной причиной социальной изоляции, депрессии, падений и переломов [20].
Чрезмерное лечение и полипрагмазия
Как чрезмерное лечение, так и полипрагмазия (прием более пяти препаратов) часто встречаются среди пожилых пациентов, в том числе и с сахарным диабетом. Распространенность режима полипрагмазии увеличивается с возрастом. Результаты голландского исследования показали, что до 20 % пациентов с СД в возрасте ≥ 70 лет получали чрезмерное лечение [5]. В другом исследовании указывается, что четверть людей с СД старше 65 лет в США получают потенциально избыточное лечение для обеспечения строгого контроля гликемии с использованием препаратов, снижающих уровень глюкозы с высоким риском гипогликемии [21]. В когорте из 8932 взрослых с СД-2 у 78 % отмечена полипрагмазия, причем указано увеличение частоты полипрагмазии в возрасте ≥ 60 лет, у пациентов женского пола и при сопутствующих хронических заболеваниях [22]. Полипраг–мазия у пациентов старшего возраста с СД может оказывать негативное влияние на качество жизни и здоровье в связи с повышением риска взаимодействия лекарств и побочных эффектов, включая риск развития гипогликемических эпизодов. В последние годы появился термин «депрескрайбинг», который определяет снижение интенсивности лечения, а категории пожилых пациентов являются целевой группой для снижения интенсивности лечения. Приведенные факты определяют необходимость внимания к качеству фармакологической терапии у пожилых пациентов с СД и обосновывают целесообразность уменьшения ее интенсивности, а не усиления, с учетом преимуществ и рисков, обусловленных сложными схемами лечения. Рекомендуется ежегодное обновление полного списка используемых лекарственных средств для анализа лечащим врачом их совместимости и потенциальной возможности минимизации лечения [2, 20].
Лечение сахарного диабета
Начальное лечение СД-2 у пожилых пациентов аналогично общепринятому и включает консультирование по вопросам здорового образа жизни (ЗОЖ), в том числе питание, физическую активность, оптимизацию метаболического контроля и профилактику осложнений. Снижение веса (при необходимости) с использованием рационального питания, физических упражнений и изменения поведения может быть применено для улучшения контроля гликемии, однако в большинстве случаев при лечении СД-2 требуется одновременное использование лекарственных средств.
Суммарные рекомендации могут быть кратко сформулированы следующим образом:
— при наличии когнитивных нарушений предлагается упростить схемы лечения и адаптировать более мягкие гликемические цели с целью минимизации гипогликемии;
— уровни гликемии, постоянно превышающие почечный порог для гликозурии (в большинстве случаев > 11,1 ммоль/л), обычно увеличивают риск дегидратации, электролитных нарушений, мочевых инфекций, головокружения и падений;
— развитие гипергликемических неотложных состояний (диабетический кетоацидоз, диабетическое гиперосмолярное состояние, лактатацидоз) сопровождается высокой смертностью;
— особенности ЗОЖ должны учитывать возрастное снижение массы тела (саркопения, остеопения), ограничения физической активности и передвижения, финансовые проблемы;
— рекомендуется метформин в качестве препарата первого выбора;
— при недостижении гликемических целей могут быть использованы другие препараты.
Исследования, сравнивающие эффективность антидиабетических препаратов у пожилых, отсутствуют, что обусловлено исключением пожилых из большинства РКИ из-за большого количества сопутствующих заболеваний и повышенного риска ССЗ. Однако индивидуальная терапевтическая стратегия должна быть сформирована с учетом возраста, состояния здоровья, способности к самообслуживанию, когнитивного и пищевого статуса и сопутствующих заболеваний. Важнейшим постулатом при разработке амбулаторных схем лечения СД-2 является необходимость минимизации гипогликемии, что обусловливает актуальность частого мониторинга уровня глюкозы любым методом (рутинный самоконтроль или непрерывный мониторинг уровня глюкозы) в дополнение к HbA1c у пациентов, которые лечатся инсулином. Кроме того, рекомендуется упростить полифармакологические схемы для минимизации побочных эффектов. В последнем консенсусе, достигнутом АDА и Европейской ассоциацией по изучению СД (2018), рекомендуется использовать препараты с доказанными преимуществами в отношении кардиоваскулярных рисков у пациентов с установленными клиническими ССЗ [2, 10].
Пероральные антигипер–гликемические препараты
Метформин — препарат первой линии, рекомендуемый для лечения СД-2 у взрослых, включая пожилых, — уменьшает резистентность к инсулину и глюконеогенез в печени, снижая гликемию без увеличения риска гипогликемических эпизодов. Начальная доза составляет 500 мг 1 или 2 раза в день при приеме пищи с постепенным увеличением дозы до 2500 мг/сут. В настоящее время существуют препараты метформина пролонгированного действия, которые принимаются 1 раз в день, что сопровож–дается улучшением профиля переносимости со стороны желудочно-кишечного тракта и соблюдения режима лечения. Поскольку метаболиты метформина выводятся с мочой, то для его безопасного использования необходима хорошая скорость клубочковой фильтрации (СКФ), а ее снижение определяет необходимость снижения дозы при СКФ от 30 до 45 мл/мин/1,73 м2 и прекращение лечения при СКФ менее 30 мл/мин/1,73 м2. Основными побочными эффектами обычно являются желудочно-кишечные симптомы и — редко — лактоацидоз. Это безопасный и эффективный антигипергликемический препарат, использующийся более 60 лет, имеющий низкую стоимость и прекрасный профиль безопасности, минимальный риск развития гипо–гликемии, не вызывающий увеличения массы тела. Однако его следует с осторожностью использовать в условиях застойной сердечной недостаточности (СН) и печеночной дисфункции, которые могут увеличить риск лактоацидоза [2]. Тем не менее в настоящее время доказаны преимущества использования метформина перед ПСМ и инсулинотерапией у пациентов с СН [23].
Доказано также, что длительное использование метформина обусловливает снижение обеспеченности витамином В12, что может негативно сказываться на развитии и течении анемий, нейропатий, нарушений когнитивной функции и др. В мета–анализе 15 исследований по оценке безопасности и эффективности использования метформина у пожилых людей отмечается, что качество и количество доказательств являются низкими, а данные о таких неблагоприятных явлениях, как желудочно-кишечные жалобы или хроническая болезнь почек (ХБП), — скудными, указывающими на необходимость исследований для более надежной оценки преимуществ и рисков метформина у лиц старше 80 лет, когнитивно и функционально ослабленных пожилых людей [24].
Тиазолидиндионы (пиоглитазон) также способствуют снижению инсулинорезистентности через влияние на процессы транскрипции путем активации γ-рецептора, активируемого пролифератором пероксисом γ (PPAR-γ). Пиоглитазон (от 15 до 45 мг во время еды) характеризуется хорошей эффективностью, низкой стоимостью и отсутствием риска гипогликемии при использовании в монотерапии, его можно применять даже в случае низкого значения СКФ и при ССЗ [2, 10]. Прием пиоглитазона сопровождается увеличением веса, задержкой жидкости, поэтому он противопоказан в случае застойной СН (NYHA, класс III, IV). Кроме того, не рекомендуется использовать препарат у пожилых людей с риском падений в связи с доказанным увеличением риска неостеопоротических переломов костей. Наконец, он противопоказан пациентам с раком мочевого пузыря или с высоким риском его развития. В настоящее время в Республике Беларусь не зарегистрирован.
Производные сульфонилмочевины — препараты, стимулирующие секрецию инсулина посредством деполяризации мембран β-клеток и экзоцитоза инсулина. Они характеризуются высокой эффективностью снижения глюкозы и низкой стоимостью, но их следует использовать с особой осторожностью из-за относительно высокого риска гипогликемии и увеличения веса. При неэффективности или непереносимости терапии метформином у пожилых пациентов с СД-2 следует отдавать предпочтение ПСМ с минимальным риском гипогликемий (гликлазид, глимепирид). Глибенкламид считается неподходящим для лечения СД-2 у пожилых [2].
Метиглиниды (репаглинид, натеглинид) являются агентами, стимулирующими секрецию инсулина короткого действия, усиливающими раннюю фазу секреции инсулина при приеме во время еды и обеспечивающими снижение постпрандиальных уровней глюкозы. По мнению некоторых авторов, они представляют меньший риск гипогликемии, чем ПСМ, поскольку их активность зависит от наличия глюкозы, а прием совмещен с приемом пищи [5]. Репаглинид является наиболее эффективным средством этого класса с умеренным влиянием на увеличение веса. Применение репаглинида может быть показано пожилым пациентам с СД-2 из-за низкого риска гипогликемии при регулярных приемах пищи, высокой эффективности для коррекции постпрандиальной гипергликемии и безопасности при ХБП. Препараты данного класса также не зарегистрированы в Республике Беларусь.
Ингибиторы дипептидилпептидазы 4 (И-ДПП-4) относятся к классу энхансерных агентов инкретинов (ГПП-1 и ГИП). Они ингибируют фермент ДПП-4, тем самым продлевая время жизни инкретинов и увеличивая секрецию инсулина глюкозозависимым образом, то есть после развития посталиментарной гипергликемии. Препараты этого класса обычно хорошо переносятся пожилыми людьми, не влияют на массу тела и имеют очень низкий риск гипогликемии, просты в использовании (прием 1 раз в сутки независимо от приема пищи, исключение составляет вилдаглиптин, который принимается 2 раза в сутки). И-ДПП-4 доказали свою эффективность в снижении базовых уровней HbA1c и уровня глюкозы в плазме натощак. Более того, исследование 80 пожилых пациентов с СД, получавших И-ДПП-4 или ПСМ в течение не менее 24 месяцев, показало, что пациенты, использующие И-ДПП-4, имели лучшие показатели состава тела — менее выраженные косвенные саркопенические показатели (масса без жира, масса скелетных мышц и связанные с ними индексы, мышечная сила и скорость походки) по сравнению с теми, кто получал ПСМ [25]. Сердечно-сосудистая безопасность этого класса агентов была подтверждена несколькими РКИ, в которых доказано, что алоглиптин, саксаглиптин, ситаглиптин и линаглиптин не увеличивают и не уменьшают риск сочетанных основных неблагоприятных сердечно-сосудистых событий (ССС) у пациентов с СД-2 с установленным ССЗ. Однако в исследовании SAVOR-TIMI было выявлено, что использование саксаглиптина привело к повышению риска госпитализации по поводу СН на 27 % у пациентов с повышенным уровнем натрийуретических пептидов, анамнезом предыдущей СН или ХБП [26]. В исследовании EXAMINE у пациентов с СД-2 и недавно перенесенным острым коронарным синдромом назначение алоглиптина не приводило к достоверному увеличению частоты госпитализации по причине СН [27]. Аналогичные результаты были получены в исследовании TECOS с использованием ситаглиптина у пациентов в возрасте ≥ 75 лет с хорошо контролируемым СД-2 и ССЗ. Более того, в исследовании TECOS продемонстрировано, что использование ситаглиптина не связано с более высоким риском переломов, основными остеопоротическими переломами или переломами бедра [28]. Позднее при использовании линаглиптина (исследование CARMELINA) у пациентов пожилого возраста (средний возраст 66,1 года) с высоким риском кардиоваскулярных событий и высокой долей лиц с СКФ менее 60 мл/мин/1,73 м2 (62,3 %), несмотря на выбор более тяжелой группы пациентов, были подтверждены кардиоваскулярная безопасность и отсутствие увеличения госпитализаций по причине сердечной недостаточности. Важно понимать, что И-ДПП-4 могут быть использованы при любой стадии ХБП, хотя ситаглиптин, саксаглиптин и алоглиптин подвергаются некоторому почечному клиренсу и требуют коррекции дозы у пациентов со сниженной СКФ, в то время как линаглиптин не элиминируется почками, поэтому коррекция дозы этого препарата при снижении СКФ не требуется.
Метаанализ 33 исследований с использованием И-ДПП-4 у пожилых подтвердил более низкий риск гипогликемических событий по сравнению с другими пероральными глюкозоснижающими препаратами и возможности использования при коморбидной патологии (при снижении СКФ, неалкогольной жировой болезни печени). Тем не менее подчеркивается ограниченность сопоставимых данных анализа [29]. Известные факты позволяют заключить, что И-ДПП-4 можно рассматривать как эффективный и безопасный вариант лечения для пожилых пациентов с СД-2. На отечественном рынке доступны ситаглиптин, вилдаглиптин и линаглиптин.
Ингибиторы натриево-глюкозного котранспортера-2 (ИНГКТ-2) являются новейшими пероральными антигипергликемическими агентами для лечения СД, механизм действия которых обу–словлен ингибированием Na/глюкозного почечного котранспортера-2 в проксимальных извитых канальцах почки, увеличением глюкозурии и осмотического диуреза (повышение диуреза в среднем на 375 мл в сутки). Помимо снижения уровня глюкозы, ИНГКТ-2 также оказывают положительное влияние на снижение массы тела и артериального давления. ИНГКТ-2, как правило, хорошо переносятся пожилыми людьми, за исключением повышенного риска возникновения генитальных грибковых инфекций у лиц обоих полов. Результаты исследований сердечно-сосудистых исходов, полученные в РКИ, свидетельствуют о снижении совокупной конечной точки сердечно-сосудистой смерти (нефатального инфаркта миокарда и нефатального инсульта) у пациентов с СД-2 и высоким уровнем ССЗ. Анализ подгруппы пациентов старше 65 лет в исследования EMPA-REG OUTCOME показал значительное снижение риска сердечно-сосудистых событий при использовании эмпаглифлозина [30]. Аналогичные данные продемонстрированы многонациональным обсервационным исследованием в реальной клинической практике CVD-REAL: у новых пользователей эмпаглифлозина, канаглифлозина и дапаглифлозина сообщено о более низком риске сердечно-сосудистой смертности, показателя MACE (Major Adverse Cardiac Events), включающего смерть, тромбоз стента, повторную реваскуляризацию, и госпитализации по поводу СН по сравнению с пользователями других препаратов, снижающих уровень глюкозы. Приведенные факты определили согласованное экспертами различных организаций мнение по рекомендации применения ИНГКТ-2 у пациентов с установленным или высоким риском ССЗ.
С учетом прямого действия препаратов на уровне почки в ряде РКИ проведен анализ эффективности и безопасности ИНГКТ-2 для почечных исходов. Доказано, что применение эмпаглифлозина, канаглифлозина и дапаглифлозина не сопровождается негативным влиянием на почечные исходы (увеличение устойчивой потери функции почек, ускорение снижения СКФ и увеличение альбуминурии), что позволило констатировать ренопротективное действие этих препаратов при СД-2 и замедление прогрессирования ХБП. Однако ИНГКТ-2 становятся менее эффективными при снижении СКФ. Из-за небольшого увеличения побочных эффектов, связанных с сокращением внутрисосудистого объема, пациентам с СКФ от 45 до 60 мл/мин/1,73 м2 следует использовать уменьшенные дозы ИНГКТ-2, хотя их применение разрешено до СКФ ≥ 30 мл/мин/1,73 м2. Особое внимание следует обратить на использование ИНГКТ-2 в сочетании с диуретиками. В таких случаях необходимо снижение дозы диуретиков для минимизации риска гипотензии и дегидратации. Описано повышение вероятности развития диабетического кетоацидоза при назначении ИНГКТ-2, что может быть связано с инсулиннезависимым клиренсом глюкозы, гиперглюкагонемией и истощением объема. Небольшое количество публикаций свидетельствует о том, что у пожилых пациентов при использовании ИНГКТ-2 частота побочных эффектов (обезвоживание, запор, жажда, поллакиурия, головокружение, цистит, высыпания, экзема, зуд) достаточно высока и достигает 9,09 %, а частота серьезных побочных эффектов (инфекция мочевыводящих путей, обезвоживание, гипогликемия и инфаркт мозга) составила 1,02 % [31, 32]. Поэтому, хотя данный класс препаратов оказывает много полезных эффектов на сердечно-сосудистые и почечные исходы, необходимо соблюдать осторожность при использовании ИНГКТ-2 у пожилых людей из-за повышенного риска развития урогенитальных инфекций, дегидратации, ортостатической гипотензии, ампутаций нижних конечностей и переломов костей [2]. Из класса ИНГКТ-2 на отечественном рынке доступен эмпаглифлозин.
Инъекционные антигипергликемические препараты являются последующей альтернативой в лечении СД-2 при недостижении целевых показателей гликемии или наличии ограничений в использовании вышеперечисленных классов лекарственных средств.
Агонисты рецептора глюкагоноподобного пептида-1 (АР ГЛП-1) являются инновационными лекарственными средствами, которые действуют, способствуя секреции инсулина и уменьшению секреции глюкагона зависимым от глюкозы способом, содействуют потере веса при минимальном риске гипогликемии и обладают плейотропными эффектами. Как в случае применения любых инъек–ционных препаратов, начало лечения АР ГЛП-1 требует психологической адаптации пациента и физического потенциала использования инъекций в ежедневной жизни. Бесспорно, доказано не только нейтральное влияние АР ГЛП-1, но и снижение кардиоваскулярных рисков на фоне пролонгированного лечения в различных РКИ с использованием эксенатида, ликсисенатида, дулаглутида, лираглутида, семаглутида в группах высокого сердечно-сосудистого риска в общей популяции пациентов с СД-2. В выборочной группе пациентов старше 70 лет было продемонстрировано превосходство ликсисенатида по сравнению с плацебо в снижении уровней HbA1c и постпрандиальной гипергликемии [33]. Важным дополнением к терапевтическому потенциалу в когорте пожилых являются результаты доклинических исследований, которые продемонстрировали благоприятное нейропротективное влияние АР ГЛП-1 [5]. Основными побочными эффектами, связанными с использованием препаратов этого класса, являются тошнота, рвота, диарея и увеличение частоты сердечных сокращений. Поскольку на С-клетках щитовидной железы экспрессированы рецепторы ГЛП-1, существует потенциальный, но не подтвержденный риск медуллярной карциномы, что определяет в качестве противопоказания отягощенный по этой патологии анамнез.
Клиренс АР ГЛП-1 уменьшается со снижением СКФ, что определяет ограничения по использованию при ХБП. Эксенатид не следует использовать, если СКФ составляет 30 мл/мин/1,73 м2, ликсисенатид допустим при СКФ до 15 мл/мин/1,73 м2, не требуется изменений дозы для лираглутида, семаглутида и дулаглутида при ухудшении почечной функции. Тошнота, которая является распространенным побочным эффектом для этого класса препаратов, потенциально может быть проблематичной для пожилых пациентов, особенно с прогрессирующей ХБП. Также следует учитывать, что АР ГЛП-1 ингибируют моторику желудочно-кишечного тракта, особенно у пациентов с ХБП 4–5-й ст., что может вызвать или усугубить явления гастропареза.
Кроме свободных форм лекарственных препаратов АР ГЛП-1 доступны и фиксированные комбинации АР ГЛП-1 и препаратов базального инсулина, одобренные регулирующими органами для усиления антигипергликемического эффекта и гликемического контроля у пациентов с СД-2 (гларгин плюс ликсисенатид (IGlarLixi) и инсулин деглудек плюс лираглутид (IDegLira)). В недавнем анализе сравнили эффективность комбинации IGlarLixi с фиксированным соотношением и последовательного введения двух отдельных препаратов в контроле глюкозы у пациентов с СД-2 [34]. В результате была продемонстрирована предпочтительность IGlarLixi, так как с достижением в группе фиксированной комбинации наблюдается более значимое снижение HbA1c, потеря веса у большего количества пациентов, достигших цели HbA1c, несмотря на более низкие дозы инсулина, при аналогичных показателях гипогликемических событий и более низких показателях побочных эффектов со стороны желудочно-кишечного тракта. Метаанализ 26 РКИ показал среднее снижение уровня HbA1c на 0,47 %, связанное со средней потерей веса на 2,5 кг в пользу комбинации инсулин/АР ГЛП-1, по сравнению с другими инъекционными антидиабетическими препаратами, без повышенного риска гипогликемических событий [35]. По сравнению с интенсивной терапией инсулином свободная либо фиксированная комбинация АР ГЛП-1 и базального инсулина приводила к большему среднему снижению (на 0,53 %) уровня HbA1c, к более высокой доле пациентов с целевым показателем HbA1c < 7 % и снижению массы тела. Основываясь на этих данных, можно заключить, что АР ГЛП-1 в виде монотерапии и при использовании фиксированных комбинаций представляют собой вариант для усиления базальной терапии инсулином без увеличения риска гипогликемии и увеличения веса.
Инсулин (любые препараты) остается наиболее эффективным средством для лечения СД-2. Основными ограничениями инсулиновой терапии являются высокий риск развития гипогликемий и увеличения веса, хотя ее можно проводить при любом значении СКФ. Также следует понимать, что у пожилых пациентов важно оценивать способность к автономному функционированию и их комплайент–ность с учетом когнитивного потенциала, зрительных и моторных функций. Необходимо учитывать, что снижение СКФ приводит к увеличению периода полувыведения инсулина и снижению потребности в инсулине, что диктует необходимость регулярного контроля гликемии.
С учетом высокой распространенности гастропареза, особенно у пожилых с СКФ менее 30 мл/мин/1,73 м2, может быть полезным введение инсулина короткого действия после еды для согласования пика инсулина со временем пика глюкозы в крови после приема пищи. Постпрандиальный быстродействующий инсулин с корректировкой дозы на потребляемое количество может помочь пациентам с нерегулярными приемами пищи. С момента его открытия в 1921 году было разработано несколько инновационных препаратов инсулина, производимых на основе генной инженерии (аналоги инсулина), которые имеют оптимальные фармакокинетические свойства. Инсулины гларгин (U100 или U300), детемир и деглудек (U100 или U200) представляют аналоги инсулина длительного действия, которые обеспечивают ежедневные базальные профили инсулина [36]. Недавний мета–анализ показал, что инсулин гларгин U300 у пациентов старше 65 лет обеспечивает снижение риска ночной гипогликемии по сравнению с гларгином U100 при равнозначной эффективности в снижении гликемии [37]. По сравнению с человеческим НПХ-инсулином аналоги инсулина длительного действия имеют большую продолжительность действия с более плавным профилем, что обеспечивает уменьшение риска гипогликемии. Следовательно, аналоги инсулина пролонгированного действия имеют преимущества в использовании у пожилых пациентов с СД-2.
Аналогичный подход распространяется на аналоги инсулина ультракороткого действия, используемые для коррекции постпрандиальной гипергликемии (аспарт, лизпро, глулизин) и сверх–быстрого действия (fast-action aspart) в сочетании с базальным инсулином. Однако как базальный, так и прандиальный инсулин требует частого титрования (коррекции дозы) для достижения наи–лучших антигипергликемических эффектов и контроля уровня гликемии. Пациентам, получающим энтеральное или парентеральное питание, может потребоваться частый мониторинг уровня глюкозы (с интервалом 4–6 часов) для лучшей титрации дозы инсулина и предупреждения гипо- и гипергликемических событий. В качестве альтернативы режим предварительно смешанного инсулина, устраняющий проблему смешивания инсулина, может играть роль у пожилых пациентов, имеющих регулярные привычки питания, с такой же эффективностью по сравнению с базис-болюс–ной терапией [38]. Сложности проведения инсулинотерапии у пожилых пациентов определяют необходимость максимально возможной деинтенсификации режима терапии и частую потребность в помощи лица, осуществляющего уход, если возможности пациентов ограниченны.
Заключение
Пожилые люди с СД представляют собой сложную и разнородную возрастную группу. Управление СД в пожилом возрасте остается важной клинической задачей для всех врачей на этапе как первичной медицинской, так и специализированной помощи. Необходим выбор индивидуальной, ориентированной на пациента гликемической цели, позволяющей достичь гликемического контроля при исключении опасных гипо- и гипергликемических событий. Комплекс–ная гериатрическая оценка должна проводиться при диагностике СД для понимания степени функциональных нарушений. При выборе антигипергликемических стратегий предпочтение следует отдавать лекарственным препаратам с доказанной переносимостью, безопасностью и минимальным риском гипогликемии. Схемы лечения СД у пожилых людей должны быть простыми, устойчивыми и безопасными, чтобы лучше отражать предпочтения, пожелания и потребности пациентов.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
- Roglic G. WHO Global report on diabetes: A summary. Int J Non-Commun Dis. 2016;1(1):3-8.
- LeRoith D, Biessels GJ, Braithwaite SS, et al. Treatment of diabetes in older adults: an endocrine society clinical practice guideline. J Clin Endocrinol Metab. 2019 May 1;104(5):1520-1574. doi: 10.1210/jc.2019-00198.
- International Diabetes Federation. IDF Diabetes Atlas. 8th Ed. 2017. Available from: https://www.idf.org/e-library/epidemiology-research/diabetes-atlas/134-idf-diabetes-atlas-8th-edition.html.
- The population of Belarus is aging faster than the population of the world as a whole. Available from: https://www.belta.by/society/view/naselenie-belarusi-stareet-bystree-chem-naselenie-mira-v-tselom-96430-2012. Accessed: Apr 2012. (in Russian).
- Longo M, Bellastella G, Maiorino MI, Meier JJ, Esposito K, Giugliano D. Diabetes and Aging: From Treatment Goals to Pharmacologic Therapy. Front Endocrinol (Lausanne). 2019 Feb 18;10:45. doi: 10.3389/fendo.2019.00045.
- Tchkonia T, Kirkland JL. Aging, Cell Senescence, and Chronic Disease: Emerging Therapeutic Strategies. JAMA. 2018 Oct 2;320(13):1319-1320. doi: 10.1001/jama.2018.12440.
- Tchkonia T, Morbeck DE, Von Zglinicki T, et al. Fat tissue, aging, and cellular senescence. Aging Cell. 2010 Oct;9(5):667-84. doi: 10.1111/j.1474-9726.2010.00608.x.
- Kalyani RR, Golden SH, Cefalu WT. Diabetes and Aging: Unique Considerations and Goals of Care. Diabetes Care. 2017 Apr;40(4):440-443. doi: 10.2337/dci17-0005.
- Menke A, Casagrande S, Geiss L, Cowie CC. Prevalence of and Trends in Diabetes Among Adults in the United States, 1988-2012. JAMA. 2015 Sep 8;314(10):1021-9. doi: 10.1001/jama.2015.10029.
- American Diabetes Association. Older Adults: Standards of Medical Care in Diabetes—2019. Diabetes Care 2019 Jan; 42(Supplement 1): S139-S147. doi: 10.2337/dc19-S012.
- Pedersen BK, Febbraio MA. Muscle as an endocrine organ: focus on muscle-derived interleukin-6. Physiol Rev. 2008 Oct;88(4):1379-406. doi: 10.1152/physrev.90100.2007.
- Huang CC, Weng SF, Tsai KT, et al. Long-term Mortality Risk After Hyperglycemic Crisis Episodes in Geriatric Patients With Diabetes: A National Population-Based Cohort Study. Diabetes Care. 2015 May;38(5):746-51. doi: 10.2337/dc14-1840.
- Palta P, Huang ES, Kalyani RR, Golden SH, Yeh HC. Hemoglobin A1c and Mortality in Older Adults With and Without Diabetes: Results From the National Health and Nutrition Examination Surveys (1988-2011). Diabetes Care. 2017 Apr;40(4):453-460. doi: 10.2337/dci16-0042.
- Du YF, Ou HY, Beverly EA, Chiu CJ. Achieving glycemic control in elderly patients with type 2 diabetes: a critical comparison of current options. Clin Interv Aging. 2014 Nov 18;9:1963-80. doi: 10.2147/CIA.S53482.
- Garber AJ, Abrahamson MJ, Barzilay JI, et al. Consensus statement by the American Association of Clinical Endocrinologists and American College of Endocrinology on the comprehensive type 2 diabetes management algorithm – 2018 executive summary. Endocr Pract. 2018 Jan;24(1):91-120. doi: 10.4158/CS-2017-0153.
- Huang ES. Management of diabetes mellitus in older people with comorbidities. BMJ. 2016 Jun 15;353:i2200. doi: 10.1136/bmj.i2200.
- Xu WL, von Strauss E, Qiu CX, Winblad B, Fratiglioni L. Uncontrolled diabetes increases the risk of Alzheimer’s disease: a population-based cohort study. Diabetologia. 2009 Jun;52(6):1031-9. doi: 10.1007/s00125-009-1323-x.
- Wallander M, Axelsson KF, Nilsson AG, Lundh D, Lorentzon M. Type 2 Diabetes and Risk of Hip Fractures and Non-Skeletal Fall Injuries in the Elderly: A Study From the Fractures and Fall Injuries in the Elderly Cohort (FRAILCO). J Bone Miner Res. 2017 Mar;32(3):449-460. doi: 10.1002/jbmr.3002.
- Bhasin S, Brito JP, Cunningham GR, et al. Testosterone Therapy in Men With Hypogonadism: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2018 May 1;103(5):1715-1744. doi: 10.1210/jc.2018-00229.
- American Geriatrics Society Expert Panel on Care of Older Adults with Diabetes Mellitus, Moreno G, Mangione CM, Kimbro L, Vaisberg E. Guidelines abstracted from the American Geriatrics Society Guidelines for Improving the Care of Older Adults with Diabetes Mellitus: 2013 update. J Am Geriatr Soc. 2013 Nov;61(11):2020-6. doi: 10.1111/jgs.12514.
- Longo M, Bellastella G, Maiorino MI, Meier JJ, Esposito K, Giugliano D. Diabetes and aging: from treatment goals to pharmacologic therapy. Front Endocrinol (Lausanne). 2019 Feb 18;10:45. doi: 10.3389/fendo.2019.00045.
- Abdelhafiz AH, Sinclair AJ. Deintensification of hypoglycaemic medications-use of a systematic review approach to highlight safety concerns in older people with type 2 diabetes. J Diabetes Complications. 2018 Apr;32(4):444-450. doi: 10.1016/j.jdiacomp.2017.11.011.
- Alwhaibi M, Balkhi B, Alhawassi TM, et al. Polypharmacy among patients with diabetes: a cross-sectional retrospective study in a tertiary hospital in Saudi Arabia. BMJ Open. 2018 May 24;8(5):e020852. doi: 10.1136/bmjopen-2017-020852.
- Aguilar D, Chan W, Bozkurt B, Ramasubbu K, Deswal A. Metformin use and mortality in ambulatory patients with diabetes and heart failure. Circ Heart Fail. 2011 Jan;4(1):53-8. doi: 10.1161/CIRCHEARTFAILURE.110.952556.
- Schlender L, Martinez YV, Adeniji C, et al. Efficacy and safety of metformin in the management of type 2 diabetes mellitus in older adults: a systematic review for the development of recommendations to reduce potentially inappropriate prescribing. BMC Geriatr. 2017 Oct 16;17(Suppl 1):227. doi: 10.1186/s12877-017-0574-5.
- Rizzo MR, Barbieri M, Fava I, et al. Sarcopenia in Elderly Diabetic Patients: Role of Dipeptidyl Peptidase 4 Inhibitors. J Am Med Dir Assoc. 2016 Oct 1;17(10):896-901. doi: 10.1016/j.jamda.2016.04.016.
- Scirica BM, Braunwald E, Raz I, et al. Heart failure, saxagliptin, and diabetes mellitus: observations from the SAVOR-TIMI 53 randomized trial. Circulation. 2014 Oct 28;130(18):1579-88. doi: 10.1161/CIRCULATIONAHA.114.010389.
- Zannad F, Cannon CP, Cushman WC, et al. Heart failure and mortality outcomes in patients with type 2 diabetes taking alogliptin versus placebo in EXAMINE: a multicentre, randomised, double-blind trial. Lancet. 2015 May 23;385(9982):2067-76. doi: 10.1016/S0140-6736(14)62225-X.
- Bethel MA, Engel SS, Green JB, et al. Assessing the Safety of Sitagliptin in Older Participants in the Trial Evaluating Cardiovascular Outcomes with Sitagliptin (TECOS). Diabetes Care. 2017 Apr;40(4):494-501. doi: 10.2337/dc16-1135.
- Schott G, Martinez YV, Ediriweera de Silva RE, et al. Effectiveness and safety of dipeptidyl peptidase 4 inhibitors in the management of type 2 diabetes in older adults: a systematic review and development of recommendations to reduce inappropriate prescribing. BMC Geriatr. 2017 Oct 16;17(Suppl 1):226. doi: 10.1186/s12877-017-0571-8.
- Zinman B, Wanner C, Lachin JM, et al. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med. 2015 Nov 26;373(22):2117-28. doi: 10.1056/NEJMoa1504720.
- Kambara T, Shibata R, Osanai H, et al. Use of sodium glucose cotransporter 2 inhibitors in older patients with type 2 diabetes mellitus. Geriatr Gerontol Int. 2018 Jan;18(1):108-114. doi: 10.1111/ggi.13149.
- Goda M, Yamakura T, Sasaki K, Tajima T, Ueno M. Safety and efficacy of canagliflozin in elderly patients with type 2 diabetes mellitus: a 1-year post-marketing surveillance in Japan. Curr Med Res Opin. 2018 Feb;34(2):319-327. doi: 10.1080/03007995.2017.1392293.
- Meneilly GS, Roy-Duval C, Alawi H, et al. Lixisenatide Therapy in Older Patients With Type 2 Diabetes Inadequately Controlled on Their Current Antidiabetic Treatment: The GetGoal-O Randomized Trial. Diabetes Care. 2017 Apr;40(4):485-493. doi: 10.2337/dc16-2143.
- Rosenstock J, Handelsman Y, Vidal J, et al. Propensity-score-matched comparative analyses of simultaneously administered fixed-ratio insulin glargine 100 U and lixisenatide (iGlarLixi) vs sequential administration of insulin glargine and lixisenatide in uncontrolled type 2 diabetes. Diabetes Obes Metab. 2018 Dec;20(12):2821-2829. doi: 10.1111/dom.13462.
- Maiorino MI, Chiodini P, Bellastella G, Capuano A, Esposito K, Giugliano D. Insulin and Glucagon-Like Peptide 1 Receptor Agonist Combination Therapy in Type 2 Diabetes: A Systematic Review and Meta-analysis of Randomized Controlled Trials. Diabetes Care. 2017 Apr;40(4):614-624. doi: 10.2337/dc16-1957.
- Maiorino MI, Petrizzo M, Capuano A, Giugliano D, Esposito K. The development of new basal insulins: is there any clinical advantage with their use in type 2 diabetes? Expert Opin Biol Ther. 2014 Jun;14(6):799-808. doi: 10.1517/14712598.2014.895812.
- Yale JF, Aroda VR, Charbonnel B, et al. Glycaemic control and hypoglycaemia risk with insulin glargine 300 U/mL versus glargine 100 U/mL: A patient-level meta-analysis examining older and younger adults with type 2 diabetes. Diabetes Metab. 2018 Oct 23. pii: S1262-3636(18)30196-4. doi: 10.1016/j.diabet.2018.10.002.
- Maiorino MI, Bellastella G, Esposito K, Giugliano D. Premixed insulin regimens in type 2 diabetes. Endocrine. 2017 Jan;55(1):45-50. doi: 10.1007/s12020-016-0917-6.

/489-1.jpg)
/492-1.jpg)
/493-1.jpg)