Международный эндокринологический журнал Том 15, №8, 2019
Вернуться к номеру
Особливості взаємозв’язків між вмістом тиреотропного гормону і деякими маркерами серцево-судинного ризику при субклінічному гіпотиреозі
Авторы: Пасєчко Н.В. (1), Євстратьєва Ю.В. (1, 2)
1 - Тернопільський національний медичний університет імені І.Я. Горбачевського, м. Тернопіль, Україна
2 - КП «Хмельницький міський лікувально-діагностичний центр», м. Хмельницький, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Вступ. Гіпотиреоз, у тому числі субклінічний, асоціюється з підвищенням ризику розвитку хронічної серцевої недостатності. Згідно з даними дослідження Cardiovascular Health Study, підвищений рівень тиреотропного гормона (ТТГ) можна розглядати як фактор ризику розвитку серцевої недостатності. Мета дослідження — вивчення взаємозв’язків між рівнем ТТГ і наявністю серцево-судинних порушень у пацієнток із субклінічним гіпотиреозом. Матеріали та методи. В одномоментне поперечне дослідження були включені 26 жінок репродуктивного віку (від 32 до 47 років) із субклінічним гіпотиреозом (група 1) і 25 жінок без порушення функціонального стану щитоподібної залози (ЩЗ) і кардіальної патології в анамнезі (група 2). У всіх жінок оцінювали наявність факторів і маркерів серцево-судинного ризику, ранніх ознак ураження міокарда. Для порівняння груп пацієнток із нормальною функцією ЩЗ та із субклінічним гіпотиреозом (групи 1 і 2) був застосований ROC-аналіз для ідентифікації рівнів ТТГ, асоційованих із найбільшою ймовірністю виявлення досліджуваних порушень. Результати. За даними ROC-аналізу, рівень ТТГ ≥ 4,67 мМО/л прогнозував розвиток діастолічної дисфункції лівого та/або правого шлуночків із чутливістю 70,6 (49,8; 89,1) % і специфічністю 69,3 (53,2; 80,6) % (AUC 0,672 (0,561; 0,787), p = 0,032). Аналогічно значення ТТГ ≥ 4,8 мМО/л вказувало на можливість виявлення сегментарних порушень релаксації з чутливістю 61,9 (46,2; 77,7) % і специфічністю 73,1 (42,9; 91,0) % (AUC 0,680 (0,543; 0,831), p = 0,042). Висновки. Початкові прояви серцево-судинних порушень частіше виникають при значеннях ТТГ у діапазоні 4,6–5,9 мМО/л. Рівень ТТГ понад 5,45 мМО/л може розглядатися як предиктор розвитку асоційованих із субклінічним гіпотиреозом кардіоваскулярних розладів.
Введение. Гипотиреоз, в том числе субклинический, ассоциируется с повышением риска развития хронической сердечной недостаточности. Согласно данным исследования Cardiovascular Health Study, повышенный уровень тиреотропного гормона (ТТГ) можно рассматривать как фактор риска развития сердечной недостаточности. Цель исследования — изучение взаимосвязей между уровнем ТТГ и наличием сердечно-сосудистых нарушений у пациенток с субклиническим гипотиреозом. Материалы и методы. В одномоментное поперечное исследование были включены 26 женщин репродуктивного возраста (от 32 до 47 лет) с субклиническим гипотиреозом (группа 1) и 25 женщин без нарушения функционального состояния щитовидной железы (ЩЖ) и кардиальной патологии в анамнезе (группа 2). У всех женщин оценивали наличие факторов и маркеров сердечно-сосудистого риска, ранних признаков поражения миокарда. Для сравнения групп пациенток с нормальной функцией ЩЖ и с субклиническим гипотиреозом (группы 1 и 2) был применен ROC-анализ для идентификации уровней ТТГ, ассоциированных с наибольшей вероятностью обнаружения исследуемых нарушений. Результаты. По данным ROC-анализа, уровень ТТГ ≥ 4,67 мМЕ/л прогнозировал развитие диастолической дисфункции левого и/или правого желудочков с чувствительностью 70,6 (49,8; 89,1) % и специфичностью 69,3 (53,2; 80,6) % (AUC 0,672 (0,561; 0,787), p = 0,032). Аналогично значение ТТГ ≥ 4,8 мМЕ/л указывало на возможность выявления сегментарных нарушений релаксации с чувствительностью 61,9 (46,2; 77,7) % и специфичностью 73,1 (42,9; 91,0) % (AUC 0,680 (0,543; 0,831), p = 0,042). Выводы. Начальные проявления сердечно-сосудистых нарушений чаще возникают при значениях ТТГ в диапазоне 4,6–5,9 мМЕ/л. Уровень ТТГ более 5,45 мМЕ/л может рассматриваться как предиктор развития ассоциированных с субклиническим гипотиреозом кардиоваскулярных расстройств.
Background. Hypothyroidism, including subclinical one, is associated with an increased risk of chronic heart failure. According to the Cardiovascular Health Study, an increased level of thyroid-stimulating hormone (TSH) can be considered as a risk factor for heart failure. The purpose of the study was to investigate the relationship between TSH levels and the presence of cardiovascular disorders in female patients with subclinical hypothyroidism. Materials and methods. Twenty-six women of reproductive age (32 to 47 years old) with subclinical hypothyroidism (group 1) and 25 women without a history of thyroid dysfunction and cardiac pathology (group 2) were included in a cross-sectional study. In all patients, the presence of factors and markers of cardiovascular risk, early signs of myocardial damage were evaluated. To compare groups of patients with normal thyroid function and with subclinical hypothyroidism (groups 1 and 2), the receiver operating characteristic (ROC) analysis was used to identify the TSH levels associated with the highest likelihood of detecting abnormalities. Results. According to the ROC analysis, TSH level ≥ 4.67 mIU/l predicted the development of diastolic dysfunction of the left and/or right ventricle with sensitivity of 70.6 (49.8; 89.1) % and specificity of 69.3 (53.2; 80.6) % (area under the ROC curve (AUC) 0.672 (0.561; 0.787); p = 0.032). Similarly, TSH value of ≥ 4.8 mIU/l indicated the possibility of detecting segmental relaxation disorders with sensitivity of 61.9 (46.2; 77.7) % and specificity of 73.1 (42.9; 91.0) % (AUC 0.680 (0.543; 0.831); p = 0.042). Conclusions. Initial manifestations of cardiovascular disorders more often occur with TSH values in the range of 4.6–5.9 mIU/l. TSH level of more than 5.45 mIU/l can be considered as a predictor of the development of cardiovascular disorders associated with subclinical hypothyroidism.
субклінічний гіпотиреоз; тиреотропний гормон; ROC-аналіз; серцево-судинні порушення
субклинический гипотиреоз; тиреотропный гормон; ROC-анализ; сердечно-сосудистые нарушения
subclinical hypothyroidism; thyroid-stimulating hormone; ROC analysis; cardiovascular disorders
Вступ
Гіпотиреоз, у тому числі субклінічний, асоціюється з підвищенням ризику розвитку хронічної серцевої недостатності (СН). Згідно з даними дослідження Cardiovascular Health Study, високий рівень тиреотропного гормона (ТТГ) можна розглядати як фактор ризику розвитку СН. У рамках цього дослідження вивчалася частота розвитку серцево-судинних ускладнень у більше ніж трьох тисяч хворих віком понад 65 років із субклінічним гіпотиреозом (СГ), але без СН [1]. Через 12 років спостереження СН розвинулася у 736 учасників дослідження, при цьому значно частіше вона зустрічалася у хворих із початково високим рівнем ТТГ (≥ 10 МО/л) порівняно з особами з нормальним або незначно підвищеним рівнем ТТГ (відповідно 4,2 і 2,3 % на рік; p = 0,01). Хворі з рівнем ТТГ ≥ 10 МО/л початково характеризувалися більш високою швидкістю раннього трансмітрального кровотоку (80 і 72 см/с відповідно; p = 0,002). Через 5 років у підгрупі осіб із високим рівнем ТТГ відзначалося збільшення маси міокарда лівого шлуночка. Важливо відзначити, що в разі менш вираженого підвищення рівня ТТГ (від 4,5 до 9,9 МО/л) ризик розвитку СН був таким же, як в осіб із нормальним вмістом ТТГ.
Для оцінки прогностичної значущості рівня ТТГ в умовах СН обстежено 338 хворих на хронічну СН і СГ. У дослідженні було показано, що навіть незначне підвищення вмісту ТТГ у сироватці крові хворих асоціювалося з несприятливим перебігом хронічної СН [2].
На особливу увагу клініцистів заслуговує той факт, що тиреоїдні гормони задіяні в синтезі маркера наявності і тяжкості перебігу хронічної СН — Ntpro-BNP. Так, гіпотиреозу притаманне зниження рівня Ntpro-BNP, а гіпертиреозу — підвищення концентрації Ntpro-BNP у сироватці крові хворих. Терапія левотироксином супроводжується підвищенням вмісту Ntpro-BNP у хворих на хронічну СН, тому оцінювати рівень Ntpro-BNP доцільно в стані еутиреозу [3].
Відомо, що маніфестний гіпотиреоз характеризується розвитком негативних серцево-судинних і метаболічних ефектів, включаючи зміни ліпідного профілю, дисфункцію міокарда та ендотелію, порушення гематологічних показників. У той же час дані про наявність та вираженість аналогічних зрушень при субклінічному гіпотиреозі залишаються супе–речливими [4–7]. Неоднозначні результати частково пояснюються неоднорідністю обстеженого контингенту за рівнем ТТГ й іншими показниками (вік, стать, наявність супутньої серцево-судинної патології та ін.). При цьому основну увагу звертають на показник ТТГ стосовно кардіоваскулярних порушень. За результатами досліджень, ризик ішемічної хвороби серця при СГ зростає паралельно збільшенню ТТГ (р < 0,001) незалежно від віку, статі, вже наявних серцево-судинних розладів [8]. Фактично вплив СГ на маркери серцево-судинного ризику може бути пропорційним ступеню підвищення ТТГ, зростаючи при прогресуванні СГ у маніфестну форму тиреоїдної недостатності [7]. До того ж відмінності вмісту ТТГ всередині референтного діапазону можуть асоціюватися з певними метаболічними зрушеннями [9].
Взаємозв’язки між рівнем ТТГ і метаболічними розладами підтверджуються і думкою експертів, які рекомендують замісну терапію при рівні ТТГ понад 10 мМО/л та індивідуальний підхід у разі менш вираженої тиреоїдної недостатності [10–13]. Однак фактичний рівень ТТГ, що асоціюється зі збільшеним ризиком основних серцево-судинних порушень, залишається нез’ясованим.
Метою дослідження було вивчення взаємо–зв’язків між рівнем ТТГ і деякими маркерами серцево-судинного ризику при субклінічному гіпо–тиреозі.
Матеріали та методи
В одномоментне поперечне дослідження були включені 26 жінок репродуктивного віку (від 32 до 47 років) із субклінічним гіпотиреозом (група 1) і 25 жінок без порушення функціонального стану щитоподібної залози (ЩЗ) і кардіальної патології в анамнезі (група 2). У всіх жінок оцінювали наявність факторів і маркерів серцево-судинного ризику, ранніх ознак ураження міокарда і певних станів, потенційно здатних зумовити більшу вираженість кардіоваскулярних порушень.
Для порівняння груп пацієнток із нормальною функцією ЩЗ та із СГ (групи 1 і 2) був застосований ROC-аналіз для ідентифікації рівнів ТТГ, асоційованих із найбільшою ймовірністю виявлення досліджуваних порушень.
Потім установлювали граничний рівень ТТГ, згідно з яким розподілили жінок на нові групи (А і Б). Факт виявлення виражених відмінностей між групами А і Б порівняно з групами 1 і 2 розглядали як підтвердження прогностичної значущості встановленого рівня ТТГ для виявлення серцево-судинних порушень у молодих осіб із СГ без супутньої кардіальної патології в анамнезі.
Діагноз СК був установлений на основі підвищеного рівня ТТГ і нормальних показників вільного тироксину.
Критеріями виключення були вузловий зоб, явний гіпотиреоз, субклінічний і явний гіпертиреоз, артеріальна гіпертензія, наявність в анамнезі вказівок на будь-які серцево-судинні захворювання, інша клінічно значуща соматична патологія.
Групи 1 і 2 не відрізнялися за віком (39,2 ± 7,3 і 38,4 ± 6,9 року, p = 0,46), індексом маси тіла (ІМТ) (27,3 ± 2,6 і 25,8 ± 2,3 кг/м2, р = 0,57). У жінок першої і другої груп не відрізнялися показники вільного тироксину (14,2 ± 3,1 і 14,3 ± 2,8 мкмоль/л, p = 0,78), однак рівень ТТГ був вищим при СГ (7,29 ± 2,80 і 2,14 ± 0,91 мМО/л відповідно, p < 0,05).
Під час дослідження вивчали показники, що пов’язані зі станом серцево-судинної системи і мають вплив на її функціонування. Насамперед оцінювали наявність таких загальновизнаних факторів серцево-судинного ризику, як дисліпідемії й ожиріння. Хоча в дослідження не включали жінок з АГ, були враховані рівень артеріального тиску (АТ) і його можливі відмінності від оптимального.
Крім того, оцінювали можливість розвитку анемій. Хоча такий стан сам по собі не розглядається як фактор чи маркер серцево-судинного ризику, негативний вплив анемії на стан міокарда та перебіг вже наявної кардіальної патології є загальновизнаним.
Діастолічна дисфункція серця є доказом наявності ураження міокарда, а її виявлення в молодих жінок із СГ без кардіологічного анамнезу не виключає початкових розладів серця на тлі мінімальної тиреоїдної недостатності. З аналогічних позицій оцінювали ендотеліальну функцію судин та її порушення. Діастолічну функцію серця досліджували методом тканинного допплерівського сканування на апараті Toshiba Aplio MX (Японія).
Ендотеліальну функцію оцінювали ультразвуковим методом за показником ендотелійзалежної вазодилатації (ЕЗВД). Дослідження ліпідного спектра містило оцінку загального холестерину (ЗХС), тригліцеридів (ТГ), ліпопротеїнів низької і високої щільності (ЛПНЩ і ЛПВЩ). Феритин визначали імуноферментним методом, вміст сироваткового заліза — з використанням набору «БіоТест».
При порівнянні незалежних вибірок використовували метод Манна — Уїтні для кількісних і критерій χ2 — для якісних показників. Побудова ROC-кривих застосовувалася для визначення порогового рівня ТТГ, який прогнозує виявлення серцево-судинних порушень. ROC-крива (англ. receiver operating characteristic, операційна характеристика приймача) — графік, що дозволяє оцінити якість бінарної класифікації та відображає співвідношення між часткою вірних позитивних класифікацій від загального числа позитивних класифікацій (англ. true positive rate — TPR) та часткою помилкових позитивних класифікацій від загального числа негативних класифікацій (англ. false positive rate — FPR) при змінних показниках порога визначального правила. При цьому TPR називають чутливістю (sensitivity) алгоритму класифікації, а FPR визначають як 1-специфічність (1-specificity). Відповідно специфічністю (specificity) алгоритму класифікації називають частку вірних негативних класифікацій (true negative rate — TNR) від загального числа негативних класифікацій. Інтерпретацію ROC відображає показник AUC (англ. area under ROC curve — площа під ROC-кривою) — площа, обмежена ROC-кривою і віссю частки помилкових позитивних класифікацій [14]. При інтерпретації результатів враховували показники площі під AUC, діагностичної специфічності і чутливості. Відмінності вважалися статистично значущими при p < 0,05.
Клінічне дослідження проводилось із дотриманням передбачених у таких випадках заходів безпеки для здоров’я пацієнта, захисту його прав, людської гідності та морально-етичних норм відповідно до принципів Гельсінської декларації прав людини, Конвенції Ради Європи про права людини і біомедицини, відповідних законів України; дозволу комісії з біоетики (протокол засідання комісії з питань етики при Тернопільському національному медичному університеті імені І.Я. Горбачевського № 4 від 23 квітня 2019 року).
Результати
Результати порівняльного аналізу в двох групах обстежених жінок наведені в табл. 1.
Як бачимо, у жінок із СГ виявлені статистично значущі несприятливі порушення в стані серцево-судинної системи. Насамперед це стосувалося показника ХС ЛПНЩ (р = 0,04). Хоча при цьому не було відзначено істотних міжгрупових відмінностей за рівнем артеріального тиску та ІМТ.
Нами не встановлено різниці в показниках ЕЗВД між групами обстежених жінок. Однак при СГ відзначалися вірогідно нижчі рівні феритину, що прогнозує більший ризик анемій, в тому числі залізодефіцитних.
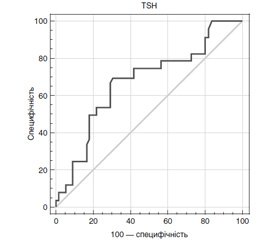
Для більш детального вивчення взаємозв’язків між концентрацією ТТГ і показниками серцево-судинного ризику у хворих на СГ був застосований ROC-аналіз. Визначали «пороги відсікання» ТТГ із точки зору ймовірності розвитку дисліпідемій, анемій, дисфункції серця і судин та ін. Фактично побудова характеристичних кривих мала на меті виявити той діапазон рівнів ТТГ, при яких у хворих на СГ можуть виникати серцево-судинні розлади або асоційовані до них стани. При побудові ROC-моделей, що стосуються взаємозв’язку між ТТГ і розвитком порушень діастолічної функції серця, були отримані характеристичні криві, які не перетинали конт–рольну діагональ, забезпечували чутливість і специфічність > 50 %, площу під кривою > 0,6 (принаймні задовільну якість моделі) при рівні статистичної значущості р < 0,05.
На рис. 1 видно, що рівень ТТГ ≥ 4,67 мМО/л прогнозував розвиток діастолічної дисфункції лівого та/або правого шлуночків із чутливістю 70,6 (49,8; 89,1) % і специфічністю 69,3 (53,2; 80,6) % (AUC 0,672 (0,561; 0,787), p = 0,032). Аналогічно значення ТТГ ≥ 4,8 мМО/л вказувало на можливість виявлення сегментарних порушень релаксації з чутливістю 61,9 (46,2; 77,7) % і специфічністю 73,1 (42,9; 91,0) % (AUC 0,680 (0,543; 0,831), p = 0,042). Крім того, були моделі, які забезпечували прийнятні показники чутливості, специфічності і площі під кривою, однак без належного рівня статистичної значущості. Так, концентрація ТТГ ≥ 5,35 мМО/л асоціювалася з наявністю анемії (чутливість — 53,8 (38,7; 69,1) %; специфічність — 54,6 (44,1; 65,4) %; AUC 0,601 (0,514; 0,668), p = 0,062).
Інші побудовані моделі характеризувалися меншою статистичної значущістю, хоча в окремих випадках показники чутливості, специфічності і площі під кривою залишалися доволі високими. Наприклад, рівень ТТГ ≥ 5,95 мМО/л прогнозував наявність ІМТ понад 30 кг/м2 з чутливістю 52,4 %, специфічністю 75,1 %, AUC 0,610 і р = 0,082. ТТГ ≥ 5,9 мМО/л вказував на рівень АТ, що перевищував оптимальний (> 120/80 мм рт.ст.), із чутливістю 50,6 %, специфічністю 69,2 %, AUC 0,603 і р = 0,36. Порогових рівнів ТТГ для порушень ЕЗВД і параметрів ліпідного спектра отримати не вдалося (AUC < 0,6 при р > 0,05).
Обговорення
Згідно з отриманими даними при СГ виявлені статистично значущі несприятливі порушення в стані серцево-судинної системи, які, однак, належать до обмеженого числа досліджуваних показників. Так, хоча загалом ліпідний профіль при СГ виглядав менш сприятливо, ніж у контрольній групі, статистично значущі відмінності виявлялися лише стосовно одного, хоча і дуже важливого показника (ХС ЛПНЩ, р = 0,04). Аналогічно не було відзначено істотних міжгрупових відмінностей за рівнем артеріального тиску та ІМТ.
Потенційно СГ може сприяти розвитку ендотеліальної дисфункції, в тому числі за рахунок дисліпідемій та їх негативного впливу на артеріальну стінку. Однак показник ЕЗВД був лише незначно нижчим при СГ, ніж у контролі (p = 092). У той же час при СГ відзначалися вірогідно нижчі показники феритину, що прогнозує більший ризик анемій, в тому числі залізодефіцитних.
Отже, пацієнтки репродуктивного віку із СГ без кардіологічного анамнезу та АГ можуть демонструвати деякі серцево-судинні порушення, однак їх вираженість мінімальна і вони належать до окремих параметрів.
У проведеному дослідженні не вдалося отримати порогових рівнів ТТГ для порушень ЕЗВД і параметрів ліпідного спектра. Однак це не виключає існування певних взаємозв’язків між СГ і станом ліпідного обміну й ендотеліальної функції. Наприклад, вираженого порогу ТТГ для явної гіпертригліцеридемії виявлено не було (AUC 0,580), але високонормальний і/або підвищений рівень міг бути прогнозований при ТТГ > 4,8 мМО/л з чутливістю 69,3 %, специфічністю 56,1 %, AUC 0,620 і р = 0,063.
Підсумовуючи результати ROC-аналізу, можна зробити висновок, що початкові зміни показників, які відображають, асоціюються або посилюють серцево-судинний ризик, виникають при значеннях ТТГ у діапазоні 4,6–5,9 мМО/л (у середньому 5,45 мМО/л).
Ураховуючи, що дотепер немає достатньої доказової бази для визначення верхньонормального рівня ТТГ із можливим його впливом на серцево-судинну і загальну смертність, назріла необхідність проведення великих досліджень, присвячених проблемам терапії субклінічного гіпотиреозу [15, 16]. Однак на сьогодні неможливо не враховувати факт гіпотиреозу вже на його субклінічній стадії, прогнозуючи ризик розвитку серцево-судинних захворювань.
Висновки
Жінки репродуктивного віку із субклінічним гіпотиреозом, в яких відсутній кардіальний анамнез, більшою мірою схильні до розвитку дисліпідемій, діастолічної та ендотеліальної дисфункцій, анемій і порушень обміну заліза.
Початкові прояви цих порушень частіше виникають при значеннях ТТГ у діапазоні 4,6–5,9 мМО/л. Рівень ТТГ понад 5,45 мМО/л може розглядатися як предиктор розвитку асоційованих із СГ кардіоваскулярних розладів.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
- Iacoviello M, Guida P, Guastamacchia E, et al. Prognostic role of sub-clinical hypothyroidism in chronic heart failure outpatients. Curr Pharm Des. 2008;14(26):2686-92. doi: 10.2174/138161208786264142.
- Biondi B, Cappola AR, Cooper DS. Subclinical Hypothyroidism: A Review. JAMA. 2019 Jul 9;322(2):153-160. doi: 10.1001/jama.2019.9052.
- Ozmen B, Ozmen D, Parildar Z, Mutaf I, Bayindir O. Serum N-terminal-pro-B-type natriuretic peptide (NT-pro-BNP) levels in hyperthyroidism and hypothyroidism. Endocr Res. 2007;32(1-2):1-8. doi: 10.1080/07435800701670047.
- Biondi B. Natural history, diagnosis and management of subclinical thyroid dysfunction. Best Pract Res Clin Endocrinol Metab. 2012 Aug;26(4):431-46. doi: 10.1016/j.beem.2011.12.004.
- Brenta G, Vaisman M, Sgarbi JA, et al. Clinical practice guidelines for the management of hypothyroidism. Arq Bras Endocrinol Metabol. 2013 Jun;57(4):265-91. doi: 10.1590/s0004-27302013000400003.
- Cooper DS, Biondi B. Subclinical thyroid disease. Lancet. 2012 Mar 24;379(9821):1142-54. doi: 10.1016/S0140-6736(11)60276-6.
- Duntas LH, Wartofsky L. Cardiovascular risk and subclinical hypothyroidism: focus on lipids and new emerging risk factors. What is the evidence? Thyroid. 2007 Nov;17(11):1075-84. doi: 10.1089/thy.2007.0116.
- Rodondi N, den Elzen WP, Bauer DC, et al. Subclinical hypothyroidism and the risk of coronary heart disease and mortality. JAMA. 2010 Sep 22;304(12):1365-74. doi: 10.1001/jama.2010.1361.
- Sviridonova MA, Fadeyev VV, Sych YP, Melnichenko GA. Clinical significance of TSH circadian variability in patients with hypothyroidism. Endocr Res. 2013;38(1):24-31. doi: 10.3109/07435800.2012.710696.
- Garber JR, Cobin RH, Gharib H, et al. Clinical Practice Guidelines for Hypothyroidism in Adults: Co-sponsored by the American Association of Clinical Endocrinologists and the American Thyroid Association. Endocr Pract. 2012 Nov-Dec;18(6):988-1028. doi: 10.4158/EP12280.GL.
- Mariotti S, Zoncu S, Pigliaru F, et al. Cardiac effects of L-thyroxine administration in borderline hypothyroidism. Int J Cardiol. 2008 May 23;126(2):190-5. doi: 10.1016/j.ijcard.2007.03.130.
- Pearce SH, Brabant G, Duntas LH, et al. 2013 ETA Guideline: Management of Subclinical Hypothyroidism. Eur Thyroid J. 2013 Dec;2(4):215-28. doi: 10.1159/000356507.
- Razvi S, Weaver JU, Butler TJ, Pearce SH. Levothyroxine treatment of subclinical hypothyroidism, fatal and nonfatal cardiovascular events, and mortality. Arch Intern Med. 2012 May 28;172(10):811-7. doi: 10.1001/archinternmed.2012.1159.
- Hilgers RA. Distribution-free confidence bounds for ROC curves. Methods Inf Med. 1991 Apr;30(2):96-101.
- Virgini V, Collet TH, Christ E, Aujesky D, Rodondi N. Should we screen and treat subclinical hypothyroidism? Rev Med Suisse. 2012 Mar 7;8(331):501-2, 504-6. (in French).
- Weiss IA, Bloomgarden N, Frishman WH. Subclinical hypothyroidism and cardiovascular risk: recommendations for treatment. Cardiol Rev. 2011 Nov-Dec;19(6):291-9. doi: 10.1097/CRD.0b013e318227df87.

/635-1.jpg)
/636-1.jpg)