Введение
Нарушения функции щитовидной железы (ЩЖ) являются распространенной эндокринной патологией среди пациентов с хронической болезнью почек (ХБП), в том числе получающих почечно-заместительную терапию (ПЗТ) [1–4]. Результаты the Third National Health and Nutrition Examination Survey продемонстрировали, что доля пациентов с гипотиреозом возрастает до 23 % при прогрессирующем нарушении функции почек при расчетной скорости клубочковой фильтрации (рСКФ) < 45 мл/мин/1,73 м2 по сравнению с 5 % при рСКФ ≥ 90 мл/мин/1,73 м2. При исследовании функционального состояния ЩЖ у пациентов на гемодиализе (ГД) также отмечался рост распространенности гипотиреоза по сравнению с общей популяцией (13–25 % vs ± 5 %) [5]. При терминальной ХБП возможными механизмами развития дистиреоидизма могут выступать эффекты Вольфа — Чайкова, характеризующиеся задержкой экскреции йода из-за нарушения ренальной функции, а также наличие метаболического ацидоза, который приводит к изменениям функциональных тестов ЩЖ (повышенный уровень ТТГ и низкий уровень свободных Т4 и Т3), частично компенсируемого при пероральной терапии цитратом натрия [6, 7].
Однако гипотиреоз все еще остается недодиагностированным состоянием у пациентов на терминальных стадиях ХБП ввиду отсутствия специфических симптомов и их мимикрии под проявления уремии и синдрома мальнутриции [3, 8].
Результаты больших когортных исследований по изучению гипотиреоза как нового фактора риска развития неблагоприятных сердечно-сосудистых осложнений в общей популяции являются противоречивыми и неоднозначными, но с учетом чрезвычайно высокой кардиоваскулярной смертности у пациентов на ГД (около 40 % случаев смерти) функция ЩЖ может оказывать значимое влияние на выживаемость данной категории пациентов [8–11]. В исследовании A.S. You et al., включавшем 15 335 пациентов, была продемонстрирована ассоциация повышенного уровня тиреотропного гормона (ТТГ) (> 5,0 мМЕ/л) в период одного года до начала ПЗТ с достоверно более высоким риском смертности от всех причин после инициации ГД [12].
В настоящее время количество исследований по изучению эффектов от заместительной гормональной терапии гипотиреоза при ХБП ограниченно, однако анализ результатов работы D.H. Shin et al. показал, что заместительная гормональная терапия левотироксином у пациентов с субклиническим гипотиреозом и ХБП может способствовать замедлению прогрессирования почечной недостаточности. Так, из 309 пациентов с субклиническим гипотиреозом и стадиями ХБП 2–4 у 58 % получающих лечение по сравнению с 42 % в группе наблюдения отмечалось более медленное снижение СКФ (–2 мл vs –6 мл/мин/1,73 м2/год соответственно), а также на 50 % меньше был риск выхода на терминальную стадию [13].
Аналогичным образом в двойном слепом рандомизированном контролируемом исследовании 136 пациентов с нефропатией на фоне СД 2-го типа и субклиническим гипотиреозом (определяемым как ТТГ 4,0–7,0 мМЕ/л) и наличием положительного титра сывороточных антител к тиреоидной пероксидазе (АТ к ТПО) лечение левотироксином в течение 48 недель привело к большему снижению экскреции альбумина с мочой, а также общего холестерина и липопротеидов низкой плотности (ЛПНП) по сравнению с плацебо [14].
Таким образом, наличие нарушений со стороны функции ЩЖ у пациентов с ХБП и их медико-социальная значимость, а также немногочисленные данные о состоянии проблемы у пациентов с СД обусловливают актуальность проведения исследований по данной тематике.
Цель исследования — изучить влияние ПЗТ на тиреоидную функцию пациентов с СД 1-го типа и ХБП.
Материалы и методы
В одномоментное поперечное исследование после получения письменного информированного согласия включены 155 пациентов: 59 пациентов с СД 1-го типа без ХБП, 77 пациентов с СД 1-го типа и ХБП, 19 пациентов с СД 1-го типа и ХБП, получающих ПЗТ (среди них 16 человек — при процедуре интермиттирующего гемодиализа 12 ч в неделю, 3 пациента — перитонеального диализа).
Процедуры ГД проводились на high-flux диализаторах фирмы «Fresenius» с высокопроницаемой мембраной из модифицированного диацетата целлюлозы. Поток диализирующего раствора был стандартизирован на уровне 500 мл/мин, а скорость потока крови — 260–350 мл/мин. Пациенты находились на амбулаторном лечении и придерживались гипофосфатной диеты с достаточным содержанием белка и ограничением водно-солевой нагрузки. Во время процедуры ГД пациенты получали индивидуально подобранную болюсную и непрерывную антикоагулянтную терапию. Образцы сыворотки для исследования были получены путем забора крови из периферической вены непосредственно перед процедурой гемодиализа до введения антикоагулянтов и сразу после 4 ч сеанса.
Процедуры перитонеального диализа проводились в амбулаторных условиях с заливками 2 л диализирующего раствора с низким содержанием глюкозы (1,36 %) 3–5 раз в день с шестичасовыми интервалами через перитонеальный катетер в брюшной полости.
Критерии включения: наличие СД 1-го типа и ХБП.
Критерии исключения: возраст старше 70 лет, наличие психических заболеваний, беременность, наличие тиреоидной патологии по данным анамнеза до начала манифестации ХБП.
Клиническая характеристика групп пациентов, включенных в исследование, представлена в табл. 1.
/20.jpg)
Всем пациентам проводилось общеклиническое обследование с анализом анамнестических и антропометрических данных. Гормональные показатели ТТГ, свободный Т3, свободный Т4, общий Т4, общий Т3 и АТ к ТПО, антитела к рецептору ТТГ, тиреоглобулин определяли иммунохемилюминесцентным методом на анализаторе Cobas 6000 производства Roche Diagnostics (Япония) лабораторными наборами Roche Diagnostics. Уровень гликированного гемоглобина (HbA1c) определен методом высокоэффективной жидкостной хроматографии на анализаторе Bio-Rad D-10 производства Bio-Rad Laboratories, Inc. (США). Cтадия ХБП выставлена в соответствии с рекомендациями National Kidney Foundation в зависимости от СКФ, рассчитанной по формуле Modification of Diet in Renal Disease 4 [15]. Биохимическое исследование сыворотки крови осуществлялось на автоматическом биохимическом анализаторе BS-200 производства Shenzhen Mindray Bio-Medical Electronics Co. Ltd. (Китай). Для исследования сывороточного уровня NGAL иммуноферментным методом использовались диагностические наборы производства Cloud-Clone Corp. (США). Лабораторные исследования выполнялись на базе клинико-диагностических лабораторий УЗ «Городской эндокринологический диспансер» и ГУ «Республиканский центр медицинской реабилитации и бальнеолечения».
В оценке функционального статуса ЩЖ использовались расчетные показатели: индекс периферической конверсии (ИПК) и интегральный тиреоидный индекс (ИТИ). ИПК рассчитывался как отношение свободного Т4 к свободному Т3, референсный интервал определялся исходя из норм для используемых диагностических наборов и составил 1,79–5,64. ИТИ рассчитывался по формуле: ИТИ = (свТ3 + свТ4)/ТТГ.
Референсный интервал для ИТИ составил 3,79–106,30 [16].
Протокол исследования был одобрен Комитетом по биомедицинской этике учреждения образования «Белорусский государственный медицинский университет» (протокол № 4 от 05.03.2019).
Статистическая обработка результатов исследования проводилась с помощью программ Microsoft Office Excel 2010 и Statistica 10.0 с использованием параметрических и непараметрических методов. Для определения связи между явлениями использовали коэффициенты корреляции Пирсона (r), Спирмена (p). Влияние фактора на величину показателя определяли методом однофакторного дисперсионного анализа Краскела — Уоллиса. Результаты исследования считали достоверными, различия между показателями — значимыми при вероятности безошибочного прогноза не менее 95 % (р < 0,05) [17].
Результаты
Группы исследования были сопоставимы по половозрастной структуре, наличию вредных привычек (курение), отягощенному наследственному анамнезу у родственников первой степени родства по СД, ИМТ, возрасту манифестации СД 1-го типа и возрасту выявления нарушения почечной функции, уровню компенсации СД. Не выявлено различий по стажу ХБП между группами 2 и 3, что имеет значение при оценке анализируемых параметров функционального статуса ЩЖ в дальнейшем.
Различия исследуемых групп по длительности СД 1-го типа и наличию артериальной гипертензии (АГ) обусловлены патогенетическими особенностями прогрессирования ХБП. Уровень липокалина, ассоциированного с желатиназой нейтрофилов-2 (NGAL), был достоверно выше в группах с наличием ХБП, с достижением наибольших значений у пациентов, получающих ПЗТ.
Характеристика метаболических параметров, изменения которых наблюдаются у пациентов как при наличии и прогрессировании ХБП, так и при СД 1-го типа, а также в наибольшей мере могут затрагивать показатели тиреоидного статуса, представлена в табл. 2.
В исследуемых группах отмечены различия по уровням сывороточных калия и фосфора, что обусловлено естественным течением ХБП.
Нами выявлены различия у пациентов групп 2 и 3 по гематологическим показателям, в частности количеству эритроцитов, уровню гемоглобина, трансферрина и ферритина. Они отражают наибольшую чувствительность данных показателей к снижению почечной функции.
Несмотря на отсутствие различий по уровню ЛПНП между группами, значения данного показателя у исследуемых пациентов с СД 1-го типа и коморбидной ХБП, относящихся к группам высокого и крайне высокого риска по развитию сердечно-сосудистых событий, не соответствовали целевому [21].
Показатели тиреоидного статуса пациентов в исследуемых группах представлены в табл. 3.
Не было обнаружено достоверных различий в исследуемых группах, в частности у пациентов, получающих ПЗТ, по уровням общих Т4 и Т3, ТГ, АТ к ТГ, АТ к ТПО.
Различия по уровням ТТГ были получены только между пациентами из первой и второй группы, однако в целом по выборке и у пациентов, получающих ПЗТ, его уровни сохранялись в пределах референсного интервала.
В группах пациентов с СД 1-го типа и ХБП отмечались достоверно более низкие показатели свТ4 и свТ3 с тенденцией к максимальному снижению при получении ПЗТ. При этом уровни свТ4 находились в диапазоне низконормальных значений, а уровни свТ3 опускались значительно ниже референсных значений для используемых диагностических наборов, несмотря на отсутствие белкового дефицита в исследуемых группах (табл. 2). Выявленные изменения предопределяют необходимость оценки уровней сывороточных свободных фракций периферических гормонов ЩЖ с целью диагностики нарушений тиреоидной функции у пациентов с диабетическим генезом ХБП и получающих ПЗТ.
ИТИ представляет собой отражение ответа тиреоидных гормонов на периферии по отношению к гипофизарному регулятору. В настоящем исследовании группы достоверно различались по уровню ИТИ (р = 0,027), однако при межгрупповом сравнении эти различия нивелировались. Данную ситуацию можно объяснить компенсаторно нормальными уровнями ТТГ, а также низконормальными значениями свТ4. При этом максимальное снижение данного показателя у пациентов на ПЗТ также косвенно может свидетельствовать о наличии гипотиреоза.
При прогрессировании ХБП выявленные различия между группами пациентов 1 и 2, а также 1 и 3 в уровнях ИПК, отражающего процессы дейодирования и конверсии Т4 в Т3, свидетельствуют об адаптативной реакции организма в условиях энергетического дефицита. При этом снижение ИПК в группе пациентов, получающих ПЗТ, по сравнению с пациентами из группы 1, может характеризовать наличие относительного йодного дефицита из-за процессов мальнутриции при уремии.
Достоверное снижение уровней АТ к рецепторам ТТГ подтверждает отсутствие влияния аутоиммунного компонента на генез тиреоидных нарушений у пациентов с ХБП и ПЗТ.
С целью оценки влияния методов почечно-заместительной терапии на показатели тиреоидного статуса было проведено гормональное обследование функции ЩЖ до и после процедуры гемодиализа у 9 пациентов с СД 1-го типа (3 мужчин и 6 женщин). Средний возраст пациентов составил 41,21 ± 11,09 года, длительность СД — 28,17 ± 9,64 года, а медиана длительности ХБП — 12,98 (4,41–14,98) года. Сроки нахождения в листе ожидания донорской почки и получения ПЗТ на момент включения в исследование составили 16,8 (8,25–59,34) мес. Отмечалась декомпенсация СД по уровням НbА1с 8,28 ± 1,57 %. Характеристика исследуемых параметров представлена в табл. 4.
Медианы значений уровней общих Т4 и Т3 в междиализный период составили 64,57 (50,83–66,98) и 1,45 (1,20–1,57) нмоль/л соответственно, что находится в диапазоне низконормальных значений для используемых тест-систем, однако в анализе клиренса данные показатели не оценивались.
Группы пациентов до и после процедуры ГД не различались по уровням ТТГ, что имеет принципиальное значение, так как для скрининга тиреоидных нарушений в обычных ситуациях используется только данный показатель. В условиях, возникающих при прогрессировании ХБП до терминальной стадии, ТТГ не может исключать наличие изменений функции ЩЖ, что требует облигатного определения свободных фракций периферических гормонов ЩЖ.
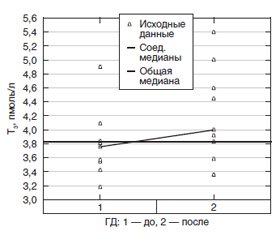
Уровни свободного Т4 до проведения процедуры ГД находились в диапазоне низконормальных значений для используемых диагностических наборов (12,0–22,0 пмоль/л) и достоверно увеличивались в сторону нормализации после ГД. У исследуемых пациентов уровни свободного Т3 до ГД находились ниже нижней границы референсного интервала (3,9–6,7 пмоль/л) и достоверно повышались после процедуры ГД, однако значения показателя соответствовали диапазону низконормальных значений. В группе пациентов до проведения ГД 78 % имели низкий свТ3 и 33 % низкий свТ4 с изменением после ГД доли пациентов с низкими значениями свТ3 до 33 % и свТ4 до 11 % (рис. 1, 2). Полученные данные указывают на целесообразность мониторинга функциональных нарушений непосредственно после проведения процедуры ГД с целью исключения влияния метаболических нарушений, наблюдаемых при терминальной ХБП, и уремии на показатели тиреоидного статуса для достоверной оценки результатов гормональных тестов.
/23.jpg)
До проведения ГД по значениям медианы уровней АТПО до ГД пациенты относились к лицам с положительным уровнем антитиреоидных антител, однако после процедуры ГД эти изменения нивелировались.
Сравнительный анализ групп пациентов до и после ГД показал различия по уровням АТ к рецепторам ТТГ в сторону их уменьшения, что может обусловливать снижение свободных фракций тиреоидных гормонов в целом по выборке.
Несмотря на то что уровни такого аутоиммунного маркера ЩЖ, как АТ к ТГ, достоверно снижались после процедуры ГД, медиана значений данного показателя оставалась в диагностическом интервале, подтверждающем наличие аутоиммунной патологии (норма < 115,0 МЕ/л). Учитывая отсутствие диагностической ценности АТ к ТГ в проведении дифференциальной диагностики аутоиммунных заболеваний ЩЖ и возможное носительство антител здоровыми лицами, тем не менее в группе пациентов на ПЗТ положительные титры данного параметра могут вносить вклад в нарушение реализации биологического действия ТГ и тем самым обусловливать низкие значения свободных Т4 и Т3 [28].
При проведении корреляционного анализа в выборке пациентов, получающих ПЗТ, статистически значимых корреляций между показателями тиреоидного статуса и уровнем компенсации СД 1-го типа выявлено не было.
Возраст манифестации СД 1-го типа коррелировал с уровнями общего Т3 (ρ = 0,536), свТ3 (ρ = 0,493), АТ ТПО (ρ = –0,565). Длительность СД 1-го типа имела ассоциацию с уровнем ТГ (ρ = 0,627).
Не выявлено взаимосвязи длительности ХБП и сроков проведения ПЗТ с показателями тиреоидного профиля у пациентов с СД 1-го типа. Возраст появления нарушений почечной функции коррелировал с АТ к рТТГ (ρ = –0,546). Возраст пациентов на ПЗТ коррелировал с АТ к рТТГ (ρ = –0,531).
Были получены корреляции метаболических параметров у пациентов с СД 1-го типа на ПЗТ с показателями тиреоидной функции. Несмотря на отсутствие различий по белковому обмену между группами (табл. 2), уровень общего белка коррелировал со свТ3 (ρ = 0,473), а уровень альбумина сыворотки — с АТ ТПО (ρ = –0,551).
Отмечена взаимосвязь уровней магния и общего Т4 (ρ = 0,679), свТ4 (ρ = 0,538), АТ к рТТГ (ρ = –0,551), а также уровней калия с общим Т4 (ρ = 0,714).
Уровень NGAL коррелировал с расчетным ИТИ (ρ = –0,837). Значение ЛПНП было связано с АТ ТПО (ρ = –0,617).
Обсуждение
В проведенном исследовании установлено отсутствие различий между группами пациентов, получающих ПЗТ, и пациентами с СД 1-го типа с коморбидной ХБП и без нее по уровням общих Т4 и Т3, ТГ, АТ к ТГ, АТ к ТПО. Уровни ТТГ не различались в исследуемых группах, а также до и после процедуры ГД и сохранялись в пределах референсного интервала, что свидетельствует о снижении диагностической значимости ТТГ в оценке тиреоидных нарушений.
Выявленные различия у пациентов групп 2 и 3 по гематологическим показателям, в частности количеству эритроцитов, уровню гемоглобина, трансферрина и ферритина, отражают наибольшую чувствительность данных показателей к снижению почечной функции.
Несмотря на отсутствие различий по уровню ЛПНП между группами, значения данного показателя у исследуемых пациентов с СД 1-го типа и коморбидной ХБП, относящихся к группам высокого и крайне высокого риска по развитию сердечно-сосудистых событий, не соответствовали целевому [21].
Наличие достоверных различий по уровням магния в сторону его увеличения при снижении рСКФ сопоставимо с имеющимися литературными данными. Магний является кофактором для множества ферментативных реакций, в том числе обеспечивающих трансмембранный транспорт кальция и фосфора [22]. У пациентов с СД 1-го типа отмечена тенденция к гипомагниемии и на этом фоне к ухудшению гликемического контроля из-за влияния на инсулинорезистентность, однако в настоящем исследовании на уровень магния основное влияние имели эффекты ХБП [23]. В условиях снижения почечной функции регуляторные механизмы могут быть недостаточными для обеспечения баланса кишечной абсорбции магния с целью поддержания его уровня в пределах референсного интервала. Низкое содержание магния может быть связано с кальцификацией сосудов и повышенным риском сердечно-сосудистой смертности. Вместе с тем тяжелая гипермагниемия может вызывать нарушения сердечной проводимости. Предполагается, что умеренное повышение уровня магния при ПЗТ может оказывать позитивное воздействие на минерально-костный обмен и сердечно-сосудистые риски, однако точные механизмы в настоящее время не ясны [24].
В общей популяции сывороточный ТТГ обычно используется для скрининга, диагностики и мониторинга лечения при первичном гипотиреозе. С учетом его обратной логарифмической связи с уровнями Т4 и T3 ТТГ считается наиболее чувствительным и специфическим биохимическим показателем функции ЩЖ [25, 29]. При ХБП в условиях снижения почечной функции может наблюдаться изменение биологической активности ТТГ, тем не менее это практически не сказывается на его сывороточных значениях до терминальной стадии [26, 27]. Отсутствие изменений со стороны ТТГ в настоящем исследовании также свидетельствует в пользу снижения его ценности как достоверного диагностического маркера нарушений функции ЩЖ у пациентов с СД 1-го типа при ХБП и ПЗТ.
Лимитирующим фактором настоящего исследования является малый объем выборок, что обусловлено относительной доступностью и высоким уровнем оказания высокотехнологичной медицинской помощи, в частности трансплантации почки, короткими сроками нахождения в листе ожидания донорской почки.
Выводы
1. Установлено отсутствие различий между группами пациентов, получающих ПЗТ, и пациентами с СД 1-го типа с коморбидной ХБП и без нее по уровням общих Т4 и Т3, ТГ, АТ к ТГ, АТ к ТПО. Уровни ТТГ не различались в исследуемых группах, а также до и после процедуры ГД и сохранялись в пределах референсного интервала, что свидетельствует о снижении диагностической значимости ТТГ в оценке тиреоидных нарушений.
2. Отмечены достоверно более низкие показатели свТ4 и свТ3 с максимальным снижением при получении ПЗТ. При этом уровни свТ4 находились в диапазоне низконормальных значений, а уровни свТ3 опускались значительно ниже референсных значений для используемых диагностических наборов. Уровни свТ4 и свТ3 достоверно повышались в сторону нормализации после процедуры ГД. Выявленные изменения предопределяют необходимость оценки уровней сывороточных свободных фракций периферических гормонов ЩЖ, а также проведение гормонального исследования непосредственно после процедуры ГД, а не в междиализный период с целью диагностики нарушений тиреоидной функции у пациентов с диабетическим генезом ХБП и получающих ПЗТ.
3. У пациентов на ПЗТ отмечено снижение ИПК по сравнению с пациентами с СД 1-го типа и нормальной функцией почек. Не выявлено различий по уровню ИТИ.
4. Достоверное снижение уровней АТ к рецепторам ТТГ в группе пациентов на ПЗТ в целом, а также после проведения процедуры ГД подтверждает отсутствие влияния аутоиммунного компонента на генез тиреоидных нарушений у пациентов с ХБП и ПЗТ.
5. Определено отсутствие связи между показателями тиреоидного статуса и уровнем компенсации СД 1-го типа у пациентов на ПЗТ, а также между длительностью ХБП и сроками проведения ПЗТ и показателями тиреоидного профиля у пациентов с СД 1-го типа.
Информация о вкладе авторов. Е.Г. Сазонова — концепция и дизайн исследования. Сбор и обработка материалов. Анализ полученных данных, написание текста; Т.В. Мохорт — концепция и дизайн исследования. Анализ полученных данных, написание текста; Н.В. Карлович — сбор и обработка материалов. Анализ полученных данных; В.С. Снапков — сбор и обработка материалов. Выполнение лабораторных исследований; О.Э. Валовик — сбор и обработка материалов; О.В. Ильинчик — сбор и обработка материалов.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
Список литературы
1. Kaptein E.M. Thyroid hormone metabolism and thyroid diseases in chronic renal failure. Endocrine reviews. 1996. 17. 454-63.
2. Iglesias P., Díez J.J. Thyroid dysfunction and kidney disease. Eur. J. Endocrinol. 2009. 160. 503-15. PubMed: 19095779.
3. Lo J.C., Chertow G.M., Go A.S., Hsu C.Y. Increased prevalence of subclinical and clinical hypothyroidism in persons with chronic kidney disease. Kidney Int. 2005. 67. 1047-1052. DOI: 10.1111/j.1523-1755.2005.00169.x
4. Chonchol M., Lippi G., Salvagno G. et al. Prevalence of Subclinical Hypothyroidism in Patients with Chronic Kidney Disease. Clin. J. Am. Soc. Nephrol. 2008. 3. 1296-1300. doi: 10.2215/CJN.00800208
5. Hollowell J.G., Staehling N.W., Flanders W.D., Hannon W.H., Gunter E.W., Spencer C.A., Braverman L.E. Serum TSH, T(4), and thyroid antibodies in the United States population (1988 to 1994): National Health and Nutrition Examination Survey (NHANES III). J. Clin. Endocrinol. Metab. 2002. 87 (2). 489-499. PubMed: 11836274
6. Brungger M., Hulter H.N., Krapf R. Effect of chronic metabolic acidosis on thyroid hormone homeostasis in humans. The American journal of physiology. 1997. 272. 6484-653. DOI: 10.1152/ajprenal.1997.272.5.F648
7. Wiederkehr M.R., Kalogiros J., Krapf R. Correction of metabolic acidosis improves thyroid and growth hormone axes in haemodialysis patients. Nephrology, dialysis, transplantation: official publication of the European Dialysis and Transplant Association — European Renal Association. 2004. 19. 11904-1197. DOI: 10.1093/ndt/gfh096
8. Rhee C.M., Brent G.A., Kovesdy C.P., Soldin O.P., Nguyen D., Budoff M.J., Brunelli S.M., Kalantar-Zadeh K. Thyroid functional disease: an under-recognized cardiovascular risk factor in kidney disease patients. Nephrol. Dial. Transplant. 2015. 30 (5). 724-737. PMCID: PMC4425477
9. Gencer B., Collet T.H., Virgini V. et al. Thyroid Studies Collaboration. Subclinical thyroid dysfunction and the risk of heart failure events: an individual participant data analysis from 6 prospective cohorts. Circulation. 2012. 126 (9). 1040-1049. PMCID: PMC3884576
10. Hak A.E., Pols H.A., Visser T.J., Drexhage H.A., Hofman A., Witteman J.C. Subclinical hypothyroidism is an independent risk factor for atherosclerosis and myocardial infarction in elderly women: the Rotterdam Study. Ann. Intern. Med. 2000. 132 (4). 270-278. PubMed: 10681281
11. US Renal Data System. USRDS 2014 Annual Data Report: Volume 2 — End-Stage Renal Disease (ESRD) in the United States. Bethesda, MD; US Renal Data System, 2014.
12. You A.S., Sim J.J., Kovesdy C.P. Association of thyroid status prior to transition to end-stage renal disease with early dialysis mortality. Nephrol. Dial. Transplant. 2018. doi: 10.1093/ndt/gfy289
13. Shin D.H., Lee M.J., Kim S.J. et al. Preservation of renal function by thyroid hormone replacement therapy in chronic kidney disease patients with subclinical hypothyroidism. The Journal of clinical endocrinology and metabolism. 2012. 97. 27324-2740. DOI: 10.1210/jc.2012-1663
14. Liu P., Liu R., Chen X. et al. Can levothyroxine treatment reduce urinary albumin excretion rate in patients with early type 2 diabetic nephropathy and subclinical hypothyroidism? A randomized double-blind and placebo-controlled study. Current medical research and opinion. 2015. 31. 22334-2240. doi: 10.1185/03007995.2015.1094044
15. K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification. Am. J. of Kidney Diseases. 2000. 39 (2). 1-266.
16. Kandor V.I. Synthesis, secretion and metabolism of thyroid hormones: Clinical endocrinology. SPb.: Piter, 2002. 122-127. (in Russian)
17. Rebrova O. Statistical analysis of medical data. Application software package Statistica. M.: Media Sphere, 2002. 312 p. (in Russian)
18. Zha Y., Qian Q. Protein Nutrition and Malnutrition in CKD and ESRD. Nutrients. 2017. 9 (3). pii: E208. doi: 10.3390/nu9030208
19. Gaweda A.E.. Markers of iron status in chronic kidney disease. Hemodial Int. 2017. 21 (1). 21-27. doi: 10.1111/hdi.12556
20. Hamano N., Komaba H., Fukagawa M. Magnesium as a new player in CKD: too little is as bad as too much? Kidney Int. 2017. 92 (5). 1034-1036. doi: 10.1016/j.kint.2017.05.032
21. Mach F., Baigent C., Catapano A.L., Koskinas K.C., Casula M., Badimon M. et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk: The Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and European Atherosclerosis Society (EAS). European Heart Journal, ehz455, https. //doi.org/10.1093/eurheartj/ehz455
22. Coburn J.W., Popovtzer M.M., Massry S.G., Kleeman C.R. The physicochemical state and renal handling of divalent ions in chronic renal failure. Arch. Intern. Med. 1969. 124. 302-311. PMID: 5806042
23. Lin C.C., Huang Y.L. Chromium, zinc and magnesium status in type 1 diabetes. Curr. Opin. Clin. Nutr. Metab. Care. 2015. 18 (6). 588-92. doi: 10.1097/MCO.0000000000000225
24. Van de Wal-Visscher E.R., Kooman J.P., van der Sande F.M. Magnesium in Chronic Kidney Disease: Should We Care? Blood Purif. 2018. 45 (1–3). 173-178. doi: 10.1159/000485212: 10.1159/000485212
25. Ladenson P.W. Diagnosis of Hypothyroidism. In: Braverman L.E.; Cooper D.S., ed. Werner and Ingbar’s the Thyroid. 10th Philadelphia: Lippincott Williams and Wilkins, 2013. 6064-611.
26. Carrero J.J., Stenvinkel P., Lindholm B. Endocrine Aspects of Chronic Kidney Disease. In: Taal M.W., Chertow G.M., Marsden P.A., Skorecki K., Brenner BM., ed. Taal: Brenner and Rector’s The Kidney. 9th. Philadelphia: Elsevier Saunders, 2012. 21224-2137.
27. Wiersinga W.M., van den Berghe G. Nonthyroidal Illness Syndrome. In: Braverman L.E., Cooper D.S., ed. Werner and Ingbar’s The Thyroid. 10th. Philadelphia: Lippincott Williams and Wilkins, 2013. 2034-216.
28. Esfandiari N.H., Papaleontiou M. Biochemical Testing in Thyroid Disorders. Endocrinol. Metab. Clin. North Am. 2017. 46 (3). 631-648. doi: 10.1016/j.ecl.2017.04.002
29. Pankiv V.I., Yuzvenko T.Yu., Pankiv I.V. Type 2 diabetes mellitus and subclinical hypothyroidism: focusing on the role of cholecalciferol. Problems of endocrine pathology. 2019. 2. 46-51. Doi: 10.21856/j-PEP.2019.2.07

/20.jpg)
/21.jpg)
/22.jpg)
/23.jpg)