Актуальность изучения гигантоклеточного артериита (ГКA) связана с постарением популяции и наибольшей распространенностью этого системного васкулита среди лиц старше 50 и особенно 70–79 лет. Согласно прогнозам, в 2014–2050 гг. диагноз ГКА будет установлен более чем у 3 млн людей в Европе, Северной Америке и Океании [1, 2].
С целью характеристики рисков, стратегий, средств и исходов лечения ГКА нами изучены данные специальной литературы, опубликованные на английском, русском и немецком языках, найденные с помощью электронного и ручного поисков, проверенные на предмет индексации в основных компьютерных базах данных доказательной медицины (Cochrane Library и Medline) и отобранные без ограничений во времени.
Обсуждая подходы к лечению ГКA, следует отметить его неизвестную этиологию, развитие у генетически предрасположенных лиц (обычно носителей HLA-DRB1*04), триггерную роль инфекций (парвовируса B19, Varicella zoster и пр.) и токсинов [3, 4], ведущую роль в патогенезе нарушений взаимодействия систем врожденного и приобретенного иммунитета, стромальных и эндотелиальных клеток, осей «интерлейкин (ИЛ)-12 — T-хелперы (Th) 1 — γ-интерферон» и –«ИЛ-6 — Th17 — ИЛ-12 или ИЛ-21»), а в развитии симптомов — ишемии и дисбаланса цитокинов [5–8].
Итак, этиотропной терапии ГКА не существует. Что касается коррекции модифицируемых факторов риска (ФР), то в 2018 г. представителями клиники Мейо в систематическом обзоре и метаанализе доказана связь развития ГКА с курением. Проведя поиск в компьютерных базах данных Medline и Embase с использованием поисковых терминов «гигантоклеточный артериит», «темпоральный артериит», «краниальный артериит» и «болезнь Хортона», D. Brennan и соавт. отобрали из 3312 релевантных исследований 13 (8 проспективных и 5 ретроспективных) и установили, что больные ГКА по сравнению с не имеющими этого заболевания чаще курили в прошлом (отношение шансов (ОШ) 1,19; 95% доверительный интервал (ДИ) 1,01–1,39) или в настоящий момент (ОШ 1,18; 95% ДИ 1,01–1,38). При этом отмечали значительную гетерогенность первоисточников [9].
В свою очередь, мы не нашли доказательств влияния прекращения курения на исходы при ГКА. В перспективе эта связь может быть доказана в регионах с высокой распространенностью ГКА (Северной Европе) и эффективной массовой профилактикой курения — сокращением количества курящих, которое наблюдают, например, в Швеции [10]. По данным популяционных исследований, в Норвегии отмечается стабилизация уровня заболеваемости ГКА, сохранение роста заболеваемости с возрастом и преобладание женщин среди заболевших. Так, L.K. Brekke и соавт. (2017) представили итоги ретроспективного 41-летнего (1972–2012) наблюдения больничной когорты лиц с ГКА «в регионе с ожидаемой высокой заболеваемостью» — Бергене. Средняя кумулятивная заболеваемость ГКА составила 16,7 (95% ДИ 15,5–18,0) на 100 тыс. населения в возрасте ≥ 50 лет (для диагноза, подтвержденного биопсией височной артерии (БВА), — 11,2; 95% ДИ 10,2–12,3). У женщин показатели заболеваемости ГКА превысили таковые у мужчин в 2–3 раза, достигнув 37,7 (95% ДИ 35,8–39,6) против 14,3 (95% ДИ 13,2–15,5). Независимо от пола заболеваемость повышалась с возрастом до достижения 70 лет: для лиц моложе 60 показатель составил 2,8 (95% ДИ 2,3–3,3), 60–69 лет — 15,5 (95% ДИ 14,4–16,8), 70–79 лет — 34,5 (95% ДИ 32,8–36,4), старше 80 лет — 26,8 (95% ДИ 25,3–28,4). Рост заболеваемости наблюдался с 1972 до 1992 г., затем прекратился [11].
Ранняя диагностика и начало лечения ГКА особенно важны в свете возможного предупреждения не–обратимой слепоты и угрожающих жизни аортальных осложнений (расслаивающей аневризмы аорты, ее разрыва) [12], а также инсультов [13].
Преимущества раннего выявления ГКА у пожилых описаны в литературном обзоре I.F. Baig и соавт. (2019): «С позиций офтальмологии, диагноз ГКА является неотложным состоянием, ибо отсутствие раннего распо–знавания и лечения чревато развитием ишемических осложнений с возможной стойкой потерей зрения (в 15–25 % случаев)» [14]. Ссылаясь на данные S.S. Hayreh и соавт. (2003) [15], авторы обзора указали, что «35 % пациентов имеют симптомы системного заболевания в течение 10,8 мес. до утраты зрения, а 65 % отмечают преходящие зрительные симптомы в предшествующие 8,5 дня» [16]. Особенно важным представляется знание этих фактов врачами первичного звена. Как известно, в 2010 г. британские общества ревматологов и специалистов здравоохранения в ревматологии (BSR/BHPR) определили предикторы развития ишемических нейроофтальмологических осложнений (перемежающаяся боль в челюсти, или «жевательная хромота», диплопия и аномалии височной артерии) и рекомендовали «уделять им особое внимание» [17]. Тем не менее, по данным Research Institute for Primary Care and Health Science, даже при наличии краниальных симптомов задержка диагностики ГКА (т.е. период времени от их появления) в Великобритании составляет 7,7 нед. (95% ДИ 2,7–12,8), при их отсутствии — 17,6 нед. (95% ДИ 9,7–25,5), достигая в среднем 9 нед. (95% ДИ 6,5–11,4), что было установлено в систематическом обзоре и метаанализе J.A. Prior и соавт. (2017) и подтвердило «необходимость повышения информированности общественности и ускорения… диагностики» этого заболевания [18].
В целом стойкая потеря зрения развивается у 6–19 % больных ГКА [15, 19, 20]. Наряду с необратимой слепотой вследствие ишемической зрительной нейропатии важна и такая клиническая ассоциация ГКА, вероятно обусловленная приемом глюкокортикоидов (ГК), как глаукома. Повышенный риск ее развития сопряжен с применением высоких доз ГК [21].
Говоря о доктрине раннего распознавания ГКА, отметим, что классификационные критерии Американской коллегии ревматологов (ACR) 1990 г. используются прежде всего в клинических исследованиях и остаются основой диагностики болезни в клинической практике, но с тех пор предложен ряд новых диагностических подходов и инструментов («классификационное дерево» ACR, концепция «трех китов» D. Lariviere и соавт., диагностический алгоритм клиники Мейо и пр.) [12]. Так, I. Salehi-Abari (2016) предложил новые критерии ранней диагностики ГКА — для использования их «при начальных клинико-лабораторных проявлениях болезни, когда раннее установление диагноза возможно на основе суждения эксперта-ревматолога». Эти критерии (включения, исключения, доменов I и II) приведены в табл. 1. Заслуживает внимания высокая диагностическая ценность симптомов ревматической полимиалгии (РП) и аномалий височной артерии [22].
/19.jpg)
Годом ранее M.A. El-Dairi и соавт. предложили клинический алгоритм, «прогностически ценный в отношении позитивного БВА-теста… и потенциально ценный при подозрении на ГКА». Они повторно изучили 213 образцов БВА, исследованных в том же научном центре в 2000–2009 гг., и разработали комплексную клиническую шкалу, согласно которой в 1 балл оценивали каждый из следующих критериев: 1) передняя внечерепная ишемия; 2) новая головная боль; 3) «жевательная хромота»; 4) аномалии или чувствительность поверхностной височной артерии; 5) конституциональные симптомы; 6) РП; 7) аномалии лабораторных тестов (скорости оседания эритроцитов (СОЭ), уровня С-реактивного белка (СРБ) или тромбоцитов). Балл изымали, если критерий мог быть связан с сопутствующим заболеванием. Результаты показали следующее: 1) симптомы и аномальные лабораторные тесты, сопровождавшиеся негативным БВА-тестом, часто были обусловлены сахарным диабетом (СД) и болезнями почек; 2) БВА-позитивные пациенты были старше и чаще имели «жевательную хромоту», тромбоцитоз и повышенную СОЭ; 3) низкий счет по клинической шкале (< 2 баллов) во всех случаях сочетался с негативным БВА-тестом [23].
Раннему распознаванию ГКА и «своевременному началу лечения, способному предотвратить сосудистые катастрофы», призвана содействовать и классификация вариантов его дебюта. Н.В. Бунчук (2010) различает 8 вариантов начала ГКА:
— классический — с клинически яркими признаками височного артериита;
— с клинически скрыто протекающими признаками височного артериита (при этом биопсия «всегда выявляет гистологические изменения»);
— с преобладающими признаками РП;
— с преобладающими признаками поражения артерий внечерепной локализации;
— с преобладающими нарушениями зрения;
— с преобладающими признаками поражения аорты или ее магистральных ветвей;
— с преимущественно общими симптомами («оккультный» ГКА);
— с отсутствием как клинических, так и морфологических признаков височного артериита («обезглавленный» ГКА) [24, с. 47].
По данным автора, в 50 % случаев ГКА дебютирует яркими признаками височного артериита (часто в сочетании с перемежающейся болью в челюсти при жевании), в 30 % — «изолированной» РП. В остальных случаях важны результаты целенаправленного расспроса (насчет боли в висках, затруднений при жевании и преходящих нарушений зрения) и внимательного изучения состояния артериального русла (выявление болезненности височных артерий, асимметрии, снижения или отсутствия пульса на них и/или магистральных артериях, а также сосудистых шумов); при этом «выручает правило, в соответствии с которым у лиц пожилого возраста при наличии лихорадки и/или значительно повышенной СОЭ всегда нужно иметь в виду возможность скрыто протекающей болезни Хортона». Отмечая возможность спонтанного стихания жалоб, обусловленных поражением височных артерий, Н.В. Бунчук назвал длительное отсутствие пульса на них «визитной карточкой» ГКА [24, c. 48-49]. Что касается «оккультного» дебюта, то единственным признаком ГКА в течение от 3 мес. до 3 лет может быть лихорадка — чаще субфебрильная, «не более 39 °С… и не имеющая каких-либо закономерностей»; возможны ухудшение аппетита и похудение — до 10 кг за 1–2 мес. [24, с. 42-43] или снижение настроения и депрессия (сочетающиеся с головной болью и отвечающие на ГК-терапию), что подтверждают B. Kumar и соавт. (2013) [25].
Наряду с попытками разработать новые клинические критерии, шкалы, алгоритмы и классификации, важными инструментами ранней диагностики ГКА на сегодня являются визуализирующие методы (а именно рекомендованные в 2018 г. Европейской противоревматической лигой (EULAR) и клиникой Мейо ультразвуковое исследование (УЗИ) височных ± подмышечных артерий как тест 1-й линии при клиническом подозрении на краниальный ГКА, а при подозрении на вовлечение крупных сосудов — их УЗИ, магнитно-резонансная томография (МРТ), компьютерная томография (КТ) или позитронно-эмиссионная томография (ПЭТ)) [26, 27], а также гистологические исследования биоптатов сосудов — согласно рекомендациям BSR/BHPR (2010) [17] и Французской группы по изучению системных васкулитов крупных сосудов (GEFA, 2015) [28]. Гистологическую верификацию связи аортита с ГКА проводят в соответствии с рекомендациями Общества сердечно-сосудистых патологов и Ассоциации европейских сердечно-сосудистых патологов 2015 г. [29].
Говоря о доказательной организации первичной медицинской помощи при подозрении на ГКА, сошлемся на итоги трех исследований, недавно проведенных в Великобритании [14], Норвегии [20] и Словении [30]. В 2015 г. P. Patil и соавт. доказали эффективность ведения таких пациентов по «ускоренному маршруту» (fast track pathway): при этом консультацию врача-ревматолога в течение первого рабочего дня обеспечивали в большей части обращений (79 %), чем при использовании «обычного маршрута» (64,6 %), частота случаев развития необратимой слепоты уменьшилась и составила 9 % против 37 %. Авторы отметили важность подготовки врачей общей практики по вопросам ранней диагностики и лечения ГКА [14], что позже поддержали J.A. Prior и соавт. [18].
Через год A.P. Diamantopoulos и соавт. сообщили о внедрении в норвежской ревматологической клинике «ускоренного маршрута пациента с подозрением на ГКА» [20]. В «быстрой клинике ГКА» обеспечивали проведение цветовой допплерографии височных, подмышечных, сонных артерий в течение суток и неотложное лечение при необходимости. На рис. 1 представлен предложенный авторами алгоритм ускоренного выполнения УЗИ (цветовой допплерографии) указанных артерий амбулаторным пациентам с предполагаемым диагнозом ГКА.
Изученная A.P. Diamantopoulos и соавт. когорта была набрана в 2010–2014 гг. и включила 75 пациентов, из которых 43 прошли маршрут «быстрой клиники ГКА», 32 — традиционный маршрут. Подтвердилась высокая частота развития слепоты во второй группе (21,5 %) и ее повышенный риск — на 88 % по сравнению с группой «быстрой клиники ГКА», в которой относительный риск (ОР) развития этого осложнения составил 0,12 (95% ДИ 0,01–0,97). Среди пациентов «быстрой клиники ГКА» каждый пятый (20,9 %) имел преходящие зрительные расстройства (переднюю ишемическую зрительную нейропатию — 38 %, молниеносную монокулярную слепоту — 22 %, нечеткость зрения — 16 %, диплопию и «неопределенное нарушение» — по 12 %), в 2,4 % случаев возникла стойкая слепота на один глаз. Среднее количество дней стационарного лечения составило 0,6, тогда как при традиционном ведении — 3,6; таким образом, внедрение «быстрой клиники ГКА» сократило срок госпитализации на 3 дня. Полученные доказательства клинической и экономической эффективности такого подхода в отношении снижения риска потери зрения и потребности в госпитализации открыли перспективу применения новой стратегии ведения пациентов с подозрением на ГКА в первичном звене [20].
Целью проспективного моноцентрового исследования A. Hocevar и соавт. (2016), проведенного в 2011–2014 гг., было установление частоты стойкой утраты зрения и развития рецидивов в зависимости от «раннего» и «позднего» выявления ГКА и начала ГК-терапии. Отметим, что использованные авторами термины не являются общепринятыми; так, E. Liozon и соавт. (2018) называют «поздним» ГКA, симптомы которого развились на фоне РП и ее лечения низкими дозами ГК [31]. A. Hocevar и соавт. учитывали длительность симптомов ГКА до установления диагноза и подразумевали под «ранним» ГКА их наличие в течение < 31 дня, под «поздним» — более длительное. Ими исследовано 68 пациентов (доля женщин — 72 %, средний возраст — 73,2 года); при «раннем» ГКА (n = 39) симптомы болезни отмечались от 10 до 28 дней до установления диагноза, при «позднем» (n = 29) — до 120 дней. Длительность наблюдения составила от 53 до 126 нед. В итоге потеря зрения развилась у 5,9 % участников и отмечалась как при «позднем» выявлении ГКА (n = 3), так и в случае «раннего» диагноза; частота рецидивов была сопоставима — 43,6 и 48,3 % при «раннем» и «позднем» диагнозе и лечении соответственно. Интересно, что срок до первого рецидива составил в среднем 14 нед. (от 13 дo 34) при «раннем» диагнозе и 25 нед. (от 22 дo 48) — при «позднем». Рецидивы возникали на фоне приема метилпреднизолона (МП) в дозе 6,0 мг/сут (от 4 дo 12). Авторы писали, что «раннее выявление ГКА и быстрое начало лечения снижают частоту стойкой утраты зрения… но представляются не влияющими на частоту рецидивов, которые можно прогнозировать… на основе значительно повышенных исходных маркеров воспаления» [30].
Данные литературы подтверждают прогностическую ценность в отношении развития рецидивов ГКА не только характеристик его дебюта, но и профиля коморбидности (наличия РП, анемии, СД, артериальной гипертензии (АГ), остеопороза); также доказана связь ГКА или высокой кумулятивной дозы применяемых при нем ГК с повышенным риском развития ряда заболеваний [12]. Так, H. Petri и соавт. (2015), изучив данные 4671 пациента из реестра UK Clinical Practice Research Datalink и рассчитав показатели ОР (с 95% ДИ), установили сильную связь ГКА с РП (14,9; 11,9–18,7), расстройствами зрения (4,6; 2,7–7,8), кандидозом ротовой полости и пищевода (3,7; 2,2–6,0), лицевой болью (3,3; 2,1–5,3), остеопорозом (2,9; 2,3–3,7), опоясывающим лишаем (2,6; 1,6–4,1) и гипокалиемией (2,5; 1,6–3,9) [32].
Идентичный показатель риска развития остеопороза в связи с ГКА получен в крупном когортном исследовании, проведенном A.J. Mohammad и соавт. (2017) в Швеции. По сравнению с общей популяцией (n = 3066) больные ГКА, верифицированным с помощью БВА (n = 768, доля женщин — 74,3 %), имели повышенный риск развития остеопороза, венозных тромбоэмболий, тяжелых инфекций (требующих госпитализации), болезней щитовидной железы, мозговых инсультов и СД. Как видно из табл. 2, повышение риска развития коронарной болезни сердца (КБС) при ГКА не достигло статистически значимого уровня. Авторы писали: «Некоторые из этих болезней могут быть связаны с применением ГК, что подтверждает необходимость продолжить поиск альтернативного лечения ГКА» [33].
/21.jpg)
Комментируя табл. 2, отметим, что наличие ГКА можно считать ФР развития указанных в ней болезней, поскольку расчет коэффициента заболеваемости ОШ в аналитических эпидемиологических исследованиях производят для установления причинной связи. Однако полученные A.J. Mohammad и соавт. факты в отношении КБС и СД не вполне согласуются с данными экспертов клиники Мейо (Ungprasert Р. и соавт., 2014–2015), приведенными нами ранее [12].
Гетерогенность доказательств связи ГКА с сердечно-сосудистыми заболеваниями (ССЗ), СД и злокачественными опухолями отмечают и другие исследователи [34–40].
К примеру, M. Pujades-Rodriguez и соавт. (2016) оценили ассоциации ГКА и РП с 12 ССЗ, изучив данные реестров исследований и пациентов первичного звена и стационаров Великобритании за период 1997–2010 гг. В исследование включили мужчин и женщин, исходно не имевших ССЗ, в том числе всех пациентов с РП (n = 9776), ГКА (n = 1164), их сочетанием (n = 627) и 105 504 лица без этих ревматических заболеваний. Было показано, что в течение трех лет наблюдения ССЗ развились у 24,1 и 20,4 % лиц с РП/ГКА и без соответственно. Приведенные в табл. 3 фатальные и нефатальные коронарные события реже развивались на фоне РП и/или ГКА, чем в их отсутствие. Связи наличия РП/ГКА с другими ССЗ и цереброваскулярными болезнями не выявили, как и зависимости от пола и возраста. Авторы писали: «Это современное крупное популяционное исследование показало отсутствие связи между наличием РП и/или ГКА… и повышенным риском развития ССЗ или цереброваскулярных заболеваний независимо от длительности РП/ГКА» [34].
Тогда же J.C. Wilson и соавт. (2017) опубликовали две статьи, посвященные исходам ГКА, потенциально связанным с ГК-терапией, и серьезным побочным эффектам (ПЭ) этих лекарственных средств [41, 42]. Эпидемиологические параметры остеопороза, костных переломов, диабета, глаукомы, серьезных инфекций и смертей были рассчитаны ими в ретроспективном исследовании реестра UK Clinical Practice Research Datalink. Изучены данные 5011 лиц с ГКА, выявленным в возрасте ≥ 50 лет (доля женщин — 74 %, средний возраст при установлении диагноза — 72,9 года), получивших хотя бы один рецепт на преднизолон; сравнительный анализ проведен с данными 5011 лиц без ГКА, сопоставимых «по полу, общей практике и календарному периоду». Сравнивали частоты встречаемости исходов (incidence rates), в том числе госпитализаций, и коэффициенты заболеваемости (incidence rate ratios). Результаты, приведенные в табл. 4, подтверждают повышенный риск развития указанных потенциальных ПЭ ГК-терапии при ГКА. Вывод авторов состоял также в наличии «погранично повышенного» риска смерти у больных ГКА по сравнению со здоровыми лицами того же пола и возраста [41].
Для оценки связей между дозами преднизолона и возникновением указанных выше ПЭ были рассчитаны коэффициенты ОШ. В результате J.C. Wilson и соавт. установили «тенденцию к повышению риска развития диабета и остеопороза при повышении кумулятивной дозы преднизолона». Как видно из табл. 5, больные ГКА, принимавшие наибольшие суточные дозы ГК (в среднем 30 мг/сут), по сравнению с получавшими низкие дозы (5 мг/сут) имели повышенные риски развития диабета, остеопороза, переломов костей, глаукомы, серьезных инфекций и смерти [42].
/22.jpg)
Как видно из табл. 4 и 5, в порядке снижения повышенного риска их развития клинические исходы при ГКА, вероятно связанные с ГК-терапией, образуют такую последовательность: остеопороз, глаукомa, серьезные инфекции, диабет, переломы костей. Лечение более высокими дозами преднизолона (30 мг/сут внутрь) сопряжено с таким ранжированием рисков осложнений (в порядке убывания): диабет, глаукома, серьезные инфекции, переломы и смерть, риск которой повышен даже больше, чем риск развития остеопороза.
Таким образом, доказательства последовательно подтвердили связь повышенного риска развития серьезных неблагоприятных исходов при ГКА с приемом более высоких суточных доз преднизолона и большую безопасность его низких доз [42].
Следует, однако, отметить противоречивость доказательств связи развития тяжелых инфекций с приемом ГК при ГКА, полученных в последние годы в Канаде (Durand М. и соавт., 2012) [43], США (Udayakumar P.D. и соавт., 2014) [44] и Франции (Schmidt J. и соавт., 2016; Chazal Т. и соавт., 2018) [35, 45].
Так, M. Durand и соавт. установили «повышенный риск инфекций в связи с ГКА и его лечением», особенно в первые 6 мес. после выявления васкулита и у лиц моложе 75 лет — независимо от пола [43]. В их исследовании с историческим контролем были изучены данные когорты Health Improvement Research Network и рассчитаны уровни и коэффициенты заболеваемости для инфекций нижних дыхательных путей, мочевыводящих путей, сепсиса и их подтипов. 1664 больных ГКА были сопоставлены с 8078 пациентами без ГКА; среди них 48 и 37 % соответственно имели хотя бы один эпизод системной инфекции за период наблюдения. В табл. 6 отражены скорректированные коэффициенты заболеваемости. Повышение рисков развития указанных инфекций (кроме сепсиса) при ГКА оказалось статистически значимым. Авторы писали: «Исследование впервые показало, что больные ГКА имеют повышенный риск развития системных инфекций, особенно в первые месяцы после установления диагноза. Для лечения болезни необходимы новые средства, обладающие стероидсберегающим эффектом» [43].
Двумя годами позже P.D. Udayakumar и другие сотрудники клиники Мейо провели ретроспективное исследование 245 пациентов с диагнозом ГКА, установленным между 1950 и 2009 гг., и изучили заболеваемость в этой когорте и среди 245 лиц без ГКА из той же популяции, сопоставимых по возрасту и полу. Получив подобные данные об инфекционных эпизодах, повлекших госпитализации или возникших в период стационарного лечения (ОШ 0,94; 95% ДИ 0,74–1,18), а также об инфекционных эпизодах, обусловивших вторичные госпитализации (ОШ 1,04; 95% ДИ 0,80–1,36), авторы отметили, что среди «инфекций, повлекших госпитализации в первые 6 мес. заболевания ГКА, большинство составили инфекции нижних дыхательных путей, мочевыводящих путей, кожи и мягких тканей (ОШ 3,93; 95% ДИ 0,85–56,52)… По количеству госпитальных инфекций разницы между когортами не отмечалось (ОШ 0,68; 95% ДИ 0,41–1,08)». Был сделан вывод об отсутствии у больных ГКА, получающих ГК, повышенного риска серьезных или госпитальных инфекций и о «возможно повышенном риске инфекций, требующих госпитализации, особенно инфекций мочевыводящих путей, в первые 6 мес. болезни, хотя он не достиг статистически значимого уровня» в данном исследовании [44].
В 2016 г. в проспективном 5-летнем обсервационном исследовании J. Schmidt и соавт. оценили заболеваемость серьезными инфекциями, связанную с инфекциями смертность и ФР их развития при ГКА [45]. На этапе установления диагноза ГКА участниками исследования стали 486 пациентов (из них 75 % женщин); в контрольную группу вошли сопоставимые по полу и возрасту лица, отобранные из общей популяции случайным образом. Как и в описанном канадском исследовании [43], серьезные инфекции у больных ГКА встречались чаще, чем в контроле, именно в первые 6 мес. после установления диагноза: коэффициент заболеваемости составил 2,1 (95% ДИ 1,2–3,4). Уровни заболеваемости (на 100 пациенто-лет) были таковы: при ГКA — 11 (95% ДИ 8,3–14), без ГКА — 5,9 (95% ДИ 4,0–8,4). Авторы писали, что «у больных ГКА чаще встречались септический шок и инфекционный колит. Смертность, обусловленная инфекциями, была у них выше, чем в группе контроля» (табл. 7).
/23.jpg)
Результаты расчетов позволили установить ФР инфекционной смертности при ГКА: независимо от возраста больных, ими оказались прием ГК в дозах > 10 мг/сут после 12 мес. лечения (коэффициент риска (отношение рисков — ОР) 4,61; 95% ДИ 1,38–15,36) и наличие СД (ОР 3,3; 95% ДИ 1,4–7,7). В течение 1-го года исследования наблюдали рост смертности, в дальнейшем ее уровень стабилизировался. Вывод J. Schmidt и соавт. состоял в том, что «риск развития инфекций у больных ГКА повышается с возрастом, при наличии СД и приеме ГК в дозе > 10 мг/сут после 12 мес. лечения» [45].
Следующие недавно представленные исследования касаются смертности при ГКА. Анализ 4628 свидетельств о смерти, выданных во Франции в 2005–2014 гг. и содержащих упоминание ГКA, позволил T. Chazal и соавт. (2018) рассчитать скорректированные по возрасту уровни смертности для этого васкулита. Установлены стабильность уровня стандартизированной смертности (7,2 на 1 млн населения), средний возраст наступления смерти у больных ГКА (86,0 ± 6,8 года), его значительное повышение в течение всего периода исследования (независимо от пола пациентов), а также наиболее частые ассоциации ГКА — ССЗ и инфекции. Они были отмечены соответственно в 79 и 39 % свидетельств о смерти, в которых ГКА указывался как первопричина смерти, но когда ею было названо другое, это были ССЗ (40 % случаев), рак (13 %), нейродегенеративные болезни (11 %) и инфекции (10 %). У больных ГКА чаще, чем в общей популяции, превышали единицу скорректированные по возрасту соотношения реальной и ожидаемой смертности в связи с туберкулезом, пневмонией и ССЗ [35].
В 2019 г., ретроспективно изучив медицинскую документацию и причины смерти госпитальной когорты норвежцев с диагнозом ГКА, установленным в 1972–2012 гг., L.K. Brekke и соавт. сообщили об отсутствии различий в их общей выживаемости по сравнению с общей популяцией. Исследователи сравнили данные 792 больных ГКА (удовлетворявших критериям ACR, в том числе 528 с диагнозом, верифицированным с помощью БВА) с «сопоставимым популяционным контролем» — данными 2577 пациентов без ГКА. Наиболее частой первопричиной смерти в обеих группах были ССЗ, а также разные формы рака. Интересен тот факт, что, имея повышенный риск смерти от ССЗ (ОР 1,31; 95% ДИ 1,13–1,51), больные ГКА имели меньший риск смерти от рака, чем в контрольной группе (ОР 0,56; 95% ДИ 0,42–0,73) [36].
Итак, доказательное лечение больных ГКА подразумевает организацию ускоренного маршрута амбулаторного пациента с подозрением на этот васкулит (или «быстрой клиники ГКА», включающей консультацию ревматолога и проведение цветовой допплерографии височных, а также подмышечных и сонных артерий, что соответствует рекомендациям EULAR 2018 г.) [26] и безотлагательное применение высоких доз ГК — для снижения риска необратимой потери зрения, что отражено в британских, французских и финских рекомендациях 2010, 2015 и 2017 г. соответственно [17, 28, 46], а также новых рекомендациях BSR 2020 г. [2].
Нельзя не отметить гетерогенность эпидемиологических доказательств связи ГКА с СД и злокачественными опухолями. Риск развития последних при ГКА пересматривают в Северной Европе и Америке (Myklebust G. и соавт., 2002; Ungprasert Р. и соавт., 2014), а также изучают в Италии (Bellan М. и соавт., 2017).
В 2002 г. G. Myklebust и соавт. опубликовали итоги проведенного ранее (1987–1997) проспективного исследования 398 пациентов с ГКА или РП и 1592 лиц контрольной группы такого же возраста и пола, в сопоставлении их с данными Норвежского онкологического реестра. До включения в исследование рак был диагностирован у 8 % лиц с ГКА/РП, после включения — у 9,3 %, тогда как в контрольной группе — у 10,8 % (OP 0,86; 95% ДИ 0,59–1,26). Таким образом, не наблюдали разницы с контрольной группой по частоте сочетания с опухолями, их формами и сроками выявления [37].
В 2014 г. P. Ungprasert и соавт. опубликовали систематический обзор и метаанализ шести когортных исследований, в которых связь ГКА/РП со злокачественными опухолями оценивали по показателям ОР, ОШ и стандартизированному уровню заболеваемости, сравнивая с лицами без ГКА/РП. Объединенный коэффициент риска pooled risk ratio (PRR) развития рака у больных ГКА/РП составил 1,14 (95% ДИ 1,05–1,22), что свидетельствовало о повышенном риске, особенно в первые 6–12 мес. после установления диагноза (PRR 2,16; 95% ДИ 1,85–2,53). Однако в результате проведения анализа чувствительности с исключением исследования, потенциально содержащего систематическую ошибку отбора, показатель стал меньше статистически значимого [38]. В связи с этим уместно привести слова Н.В. Бунчука (2010): «Можно уверенно сказать, что при РП частота злокачественных опухолей не повышена и соответствует популяционной для лиц пожилого возраста… Поводом к углубленному обследованию больных РП, в том числе в онкологическом плане, является только нетипичность клинической картины, неадекватный ответ кортикостероидов» [24, c. 115-116].
Наконец, M. Bellan и соавт. (2017), исследовав когорту пациентов ревматологической клиники (n = 1750, в том числе 100 больных РП), наблюдавшихся в течение 2005–2012 гг., и контрольную группу (702 больных остеоартритом), установили такие независимые предикторы паранеопластического характера РП, как старший возраст, мужской пол и полиартикулярный тип суставного синдрома (вовлечение ≥ 6 суставов). Ревматическое заболевание считали паранеопластическим, если опухоль диагностировали в течение 2 лет до или после появления его симптомов. Вероятность связи с опухолью при РП оказалась сильной (ОШ 5,1; 95% ДИ 2,9–8,9), уступив лишь дерматомиозиту/полимиозиту (ОШ 12,09; 95% ДИ 2,6–55,8); реже отмечали паранеопластический характер васкулитов (ОШ 3,7; 95% ДИ 1,81–7,52) и синдрома Шегрена (ОШ 3,6; 95% ДИ 1,7–7,5) [39].
В контексте безопасности ГК-терапии важна и переоценка риска развития переломов костей при ГКА. В 2018 г. Z. Paskins и соавт. представили результаты ретроспективного исследования данных когорты пациентов учреждений первичного звена Великобритании (в возрасте ≥ 40 лет, c диагнозом РП (n = 12 136) или ГКА (n = 2673), установленным в 1990–2004 гг. и наблюдаемым до 2015 г.), включенных в реестр UK based Clinical Practice Research Datalink. Контрольные подобранные пары (по 4 человека на каждого пациента основной группы) были сопоставимы «по полу, возрасту и практике». В расчете на 10 000 пациенто-лет уровень заболеваемости переломами при ГКА составил 147,15 (95% ДИ 132,91–162,91), при РП — 148,05 (95% ДИ 141,16–155,28); по сравнению с контролем риск переломов оказался повышен на 67 % при ГКА (ОР 1,67; 95% ДИ 1,49–1,88) и на 63 % при РП (ОР 1,63; 95% ДИ 1,54–1,73). Помимо одинаково высокого риска развития переломов при ГКА и РП, была установлена низкая приверженность рекомендации о назначении бисфосфонатов при ГК-терапии — их принимали менее чем в 13 % случаев. Перспективой дальнейших исследований авторы считают определение влияния на риск переломов «более низких стартовых доз ГК и/или агрессивного снижения доз» [47].
Анализ данных немецкого национального реестра National Database of the German Collaborative Arthritis Center, проведенный K. Albrecht и соавт. в том же году, позволил оценить эффекты длительной ГК-терапии при РП (n = 1420), ГКА (177) и их сочетании (n = 261) в отношении развития остеопороза, диабета и ССЗ. Данные за 3 года были доступны для 256 лиц. Установлено, что ГК получали 76 % пациентов, метотрексат (MT) — 19 % больных РП и 40 % больных ГКА. В первые 6 мес. заболевания средняя суточная доза ГК составляла 12,5 мг при РП, 11,3 мг — при ГКА и 20,0 мг — при ГКА/РП. Средней суточной дозы ГК ≤ 5 мг пациенты с РП достигали за 13–18 мес., пациенты с ГКА или ГКА/РП — за 19–24 мес. В четверти случаев прием ГК длился ≥ 3 лет. По итогам многовариантного анализа, прогностическое значение при этом имели такие исходные данные (ОР с 95% ДИ): применение MT (2,03; 1,27–3,24), доза ГК > 10 мг/сут (1,65; 1,07–2,55), высокая активность болезни (1,12; 1,02–1,23), а также женский пол (1,63; 1,09–2,43). Именно неконтролируемая активность болезни на первом году была названа «хорошим предиктором» потребности в длительной ГК-терапии. Что касается сопутствующих заболеваний, то за три года возросла только частота остеопороза [40].
Изложенное позволяет сделать вывод о том, что коморбидность присуща пациентам с ГКА (по ряду причин), вероятно, связана с риском развития рецидивов (независимо от сроков диагностики васкулита) и риском развития ПЭ ГК-терапии.
Перейдем к рассмотрению международных клинических рекомендаций как основы доказательного ведения больных ГКА в клинической практике.
В разработке BSR/BHPR (2010) лечения ГКА касались пять из девяти положений. Положение № 4 гласило, что «при клиническом подозрении на ГКА надо немедленно начать лечение высокими дозами ГК; снижение дозы ГК следует обсуждать лишь в отсутствие клинических проявлений, симптомов и лабораторных признаков активного заболевания», и было дополнено описанием стартовых доз (40–60 мг преднизолона ежедневно — при неосложненном ГКA (без «жевательной хромоты» и нарушений зрения); 0,5–1 г МП внутривенно в течение 3 дней перед приемом ГК внутрь — при ГКА с нарушениями зрения или внезапной слепотой; 60 мг преднизолона ежедневно — «при установленной потере зрения для защиты второго глаза») [17]. Отметим, что именно выявлению «жевательной хромоты» у пожилых, ее диагностической и прогностической ценности в аспекте ГКА уделяют большое внимание [20, 24, 48, 49].
Следующие положения гласили: «В отсутствие противопоказаний у больных ГКА следует рассмотреть применение низких доз аспирина. Необходим клинический мониторинг терапии с оценкой воспалительных маркеров. В качестве адъювантной терапии следует рассмотреть раннее назначение MT или альтернативных иммуносупрессантов». Отдельным пунктом рекомендовали обучение пациента. Указывали на присущий ГКА «быстрый ответ симптомов на прием высоких доз ГК с последующим разрешением воспалительной реакции. Если этого не происходит, следует обсуждать альтернативный диагноз… Необходимо соблюдать баланс между необходимостью применения наименьшей эффективной дозы, пожеланиями пациента и ПЭ ГК. Снижение дозы ГК также является правильным, если острофазовая реакция обусловлена другой причиной» [17]. Примечательно, что хороший эффект ГК также наблюдается в случае дебюта ГКА с депрессии (в сочетании с головной болью) [25].
Предложенная в британских рекомендациях схема титрования доз ГК была такой: «Прием 40–60 мг преднизолона продолжают до разрешения симптомов и лабораторных признаков воспаления (по меньшей мере 3–4 нед.), затем дозу снижают на 10 мг каждые 2 нед. дo 20 мг; затем на 2,5 мг каждые 2–4 нед. дo 10 мг; и затем на 1 мг каждые 1–2 мес. при условии отсутствия рецидивов» [17]. Подобную схему содержит клинический протокол, утвержденный приказом Министерства здравоохранения Украины в 2017 г. [46]. BSR/BHPR отмечали «возможную необходимость коррекции дозы ГК с учетом тяжести заболевания, коморбидных факторов, риска переломов, пожеланий пациента и ПЭ» и необходимость длительного приема низких доз ГК в отдельных случаях, а также рекомендовали обеспечить профилактику остеопороза и гастропротекцию (с помощью ингибиторов протонной помпы) [17].
В разработке французской группы по изучению системных васкулитов крупных сосудов (GEFA, 2015) лечения ГКА касались семь из 15 рекомендаций. Их основные положения представлены в табл. 8, по всем ним достигнут уровень согласия 80 % [28, 50, 51].
/26.jpg)
Накопление доказательств частого (до 83 % случаев) поражения аорты и ее основных ветвей, пересмотр классификации ГКА с выделением его крупнососудистого субтипа [12] сопровождались разработкой и изданием рекомендаций EULAR (2018) по использованию визуализирующих методов диагностики ГКА и артериита Такаясу в клинической практике [26]. В опубликованных недавно рекомендациях BSR (2020) по диагностике и лечению ГКА [2] пересмотрена разработка BSR/BHPR 2010 г. [17], в частности, «включена визуализирующая диагностика» васкулита. Документ содержит 8 принципов и 11 рекомендаций, по которым достигнут высокий уровень согласия: все принципы имеют консенсус-оценку > 7 (от 9,17 до 9,81), что отражает их «критическую важность для принятия решений». Рассмотрим эти принципы.
1. Как следует лечить пациента с предполагаемым ГКА? При сильном клиническом подозрении на ГКА показано неотложное лечение высокими дозами ГК. Уровень согласия 9,61.
Принцип подразумевает клиническое суждение о том, что ГКА наилучшим образом объясняет имеющиеся симптомы (лихорадку, похудение, острофазовую реакцию и пр.) по сравнению с другими диагнозами.
2. Как срочно пациент с предполагаемым ГКА должен быть направлен на экспертизу? ГКА — неотложное состояние. Каждое учреждение здравоохранения должно располагать информацией о клиницистах (специалистах общей практики и неотложной помощи), о том, как срочно направлять пациентов с предполагаемым диагнозом ГКА на специальное обследование и экспертизу. В идеале пациент должен быть осмотрен специалистом в тот же день (по возможности), и во всяком случае в течение трех рабочих дней. Уровень согласия 9,17.
Отмечается, что неотложная консультация специалиста — ключевой принцип ведения ГКА. В поддержку этого принципа приведены ссылки на описанные выше «ретроспективные сообщения» P. Patil и соавт. (2015) и A.P. Diamantopoulos и соавт. (2016) [14, 20], а также проспективное многоцентровое исследование TABUL эффектов клинического обследования, УЗИ сосудов и БВА на первой неделе высокодозовой ГК-терапии при предполагаемом ГКА (Luqmani R. и соавт., 2016) [52].
3. К кому следует направить пациента с подозрением на ГКА? Пациента с предполагаемым ГКА должен консультировать клиницист, имеющий соответствующий опыт, обычно ревматолог. В случае «новой» потери зрения в анамнезе (преходящей или стойкой) или диплопии необходима консультация офтальмолога — как можно более срочная, в тот же календарный день. Уровень согласия 9,61.
В комментариях отмечена опасность возникновения диагностических трудностей при «неразборчивом использовании» высоких доз ГК, а также «возможная значимость» привлечения врачей многих специальностей в случаях трудного диагноза.
4. Какие исследования нужно выполнить в начале ГК-терапии? В начале лечения ГК по поводу предполагаемого ГКА следует документировать наличие у пациента «диагностически релевантных признаков и симптомов»; до или сразу после начала высокодозовой ГК-терапии следует выполнить общеклинический анализ крови (подсчет форменных элементов, определение СОЭ) и оценить содержание СРБ в крови. При сильном подозрении на ГКА первую дозу ГК следует дать, не ожидая результатов лабораторных тестов. Уровень согласия 9,61.
Релевантными для диагноза ГКА признаками и симптомами названы следующие: головная боль; повышенная чувствительность кожи черепа; «жевательная хромота» (перемежающаяся боль в челюсти или языке); болезненность по ходу височной артерии, ее узловатость или снижение пульса на ней; зрительные расстройства, включая диплопию и нарушения цветового зрения; перемежающаяся хромота конечностей; РП (боль или скованность плечевого или тазового пояса); лихорадка, потливость или похудение. Реже бывают боль по ходу сонных артерий (каротидиния), аудиовестибулярные симптомы, сухой кашель или критические признаки ишемии (некрозы) языка или черепа. Ссылаясь на G. Smetana и соавт. (2002) [53], указывают, что «ни один симптом не является совершенно специфичным (патогномоничным) для ГКА, многие из них очень неспецифичны, и каждый имеет ограниченное применение, если рассматривается отдельно». Отмечено, что ГКА сопровождается тромбоцитозом, повышением уровня СОЭ и СРБ, и что оценку СОЭ может заменить оценка вязкости плазмы. С учетом снижения уровня этих маркеров под влиянием ГК, анализ крови должен быть выполнен до начала лечения «при условии отсутствия признаков критической ишемии, таких как потеря зрения или диплопия, а также непосредственного доступа к флеботомии» [2].
5. Какие исследования нужно выполнить сразу после начала ГК-терапии? У пациента, получающего лечение по поводу ГКА, следует оценить прогностически важные характеристики болезни (клинические и лабораторные признаки выраженного воспаления при установлении диагноза; ишемические проявления — такие как преходящая потеря зрения или «жевательная хромота»; признаки или симптомы, отражающие вовлечение аорты и ее проксимальных ветвей), а также сопутствующие болезни, связанные с лечением, а именно СД, АГ и переломы. Уровень согласия 9,53.
В табл. 9 приведен перечень клинических оценок, рекомендованных к выполнению при диагностике ГКА. Авторы отмечают «недостаточность доказательств для стратификации пациентов с подтвержденным диагнозом ГКА с целью обеспечения их дифференцированного ведения с учетом таких ФР, как пол, возраст, маркеры острой фазы, наличие РП, васкулита крупных сосудов и атеросклероза, чувствительности к ГК и гистологических характеристик… Тем не менее эти черты болезни сохраняют диагностическую значимость и/или
важны при оценке риска ПЭ ГК» [2].
В этой части рекомендаций рассмотрены ФР трех неблагоприятных исходов — потери зрения, развития аневризмы аорты и пролонгированного лечения ГКА.
С учетом данных, полученных в 1998–2017 гг., «независимыми предикторами» потери зрения определены старший возраст, преходящая потеря зрения в анамнезе и «жевательная хромота» [54], «потенциальными ФР» — преходящая диплопия [55], АГ и КБС [56, 57], а также заболевание периферических артерий [58], выявленные в дебюте [2]. Десятью годами ранее BSR/BHPR относили к таким ФР лишь «жевательную хромоту», диплопию и аномалии височной артерии [17].
Отметив, что ФР развития аневризмы аорты являются аортит [59] и дилатация подключичной артерии [60], и назвав «возможными ФР» этого осложнения курение, мужской пол, АГ, атеросклероз и воспаление проксимальных ветвей аорты [59, 61–64], авторы рекомендаций указали на недостаток доказательств «для определения подгрупп высокого риска и отбора пациентов для визуализирующих исследований аорты», «неопределенность» в отношении рутинных скринингов (первичных и повторных) и рекомендовали осуществлять отбор пациентов «на усмотрение клиницистов» [2].
Ранее были рассмотрены ФР рецидивов и неблагоприятного прогноза ГКА [12]. В 2020 г. BSR указывает на связь большей частоты рецидивов и длительности лечения с «сильным воспалением» (т.е. наличием трех из таких признаков, как лихорадка, похудение, уровень СОЭ ≥ 85 мм/ч и гемоглобина < 110 г/л) [65–67] и более продолжительное лечение крупнососудистого ГКА (доказанного визуализирующими методами) по сравнению с классическим краниальным [59, 68].
Эксперты BSR приводят «правило наилучшей практики», в соответствии с которым в течение первых двух недель высокодозовой ГК-терапии необходимо оценить артериальное давление и уровень гликемии (и/или гликозилировнного гемоглобина). Созвучно EULAR [69], именно СД и остеопороз и его осложнения (переломы костей) названы сопутствующими болезнями, связанными с токсичностью ГК, а доза и длительность приема ГК — ФР их токсичности. Указано, что «симптомы и/или воздействие серьезных инфекций должны быть оценены у всех пациентов, начинающих лечение ГК, с учетом локальной распространенности этих инфекций» и содержания национальных руководств [2]. BSR обращает внимание на возможность повышения внутриглазного давления при пероральном приеме ГК и ухудшения течения первичной открытоугольной глаукомы. Согласно рекомендациям EULAR [70], скрининг на это осложнение должен проводить «подготовленный специалист», и ему подлежат пациенты, имеющие «глаукому, внутриглазную гипертензию (в том числе в анамнезе) или такие ФР, как заболевание соединительной ткани, СД 1-го типа, первая степень родства с больным первичной открытоугольной глаукомой или миопией высокой степени» [2].
В течение первых 6 мес. заболевания «клиницист соответствующей квалификации» должен консультировать пациента с ГКА не реже одного раза в 2–8 нед., в течение второго полугодия — каждые 12 нед., на втором году болезни — каждые 12–24 нед., а также дополнительно — в случае рецидива или при снижении дозы/прекращении приема ГК. Такая частота визитов определяется риском развития ПЭ ГК и должна быть «адаптирована для конкретного пациента». На каждом визите необходим тщательный сбор анамнеза, физикальное обследование, оценка общеклинического анализа крови, уровня СОЭ и/или СРБ, а также «наблюдение любых индивидуальных отклонений и скрининг на специфическую токсичность лекарственных средств» [2].
Ранее BSR/BHPR рекомендовали определять на каждом визите содержание в крови глюкозы, мочевины и электролитов, каждые 2 года выполнять рентгенографию органов грудной клетки для мониторинга развития аневризмы аорты (допуская также проведение эхокардиографии, ПЭТ и МРТ), и отмечали «возможную необходимость измерения МПКТ» [17].
6. Как индивидуализировать ведение пациента с ГКА? Решение о снижении доз ГК и добавлении препаратов с ГК-сберегающим эффектом следует принимать с учетом полной оценки основного и сопутствующих заболеваний и личных предпочтений пациента. Уровень согласия 9,67.
Предложенный BSR (2020) режим снижения доз ГК при ГКА представлен в табл. 10. В его основу положена описанная выше разработка BSR/BHPR 2010 г. [17] и опубликованные в 2017 г. данные клинического испытания тоцилизумаба [71]. В табл. 11 отражено влияние новых симптомов, возникших у пациентов с ГКА «в отсутствие других ФР или значимых сопутствующих заболеваний», на клинические решения [2].
По вопросам профилактики остеопороза и вакцинации больных ГКА клиницистам рекомендовано обращаться к разработкам ACR (2010) [72] и EULAR (2011) [73]. Приведено напоминание о снижении эффективности вакцин у лиц, получающих ГК, и о том, что использование живых вакцин противопоказано при приеме ГК в дозе > 20 мг/сут в течение ≥ 2 нед. Указана необязательность применения ингибиторов протонной помпы «при лечении ГК в дозах меньших, чем высокие». Пациентам с ГКА, не перенесшим ранее ветряную оспу, рекомендовано избегать тесного контакта с больными этим заболеванием или опоясывающим лишаем [2].
7. В чем должно состоять обучение пациента? Каждому пациенту следует предоставить информацию о ГКА и его лечении и дать рекомендации в отношении диеты, физической активности и прекращения курения. Уровень согласия 9,47.
BSR отмечает, что это должно быть сделано неоднократно и в письменной форме и указывает на отсутствие клинических исследований специальных программ при ГКА [2]. Проведенный нами ранее информационный анализ показал отсутствие доказательных разработок по питанию для больных системными васкулитами [74]. В обсуждаемых рекомендациях сказано, что «питание должно смягчить ПЭ ГК в отношении прибавки веса, постпрандиальной гликемии и риска переломов», а физическая реабилитация важна с учетом стимулирующего влияния упражнений на развитие коллатералей, улучшение подвижности, равновесия и психоэмоционального статуса [2]. В отсутствие доказательной базы BSR допускает применение при ГКА разработки EULAR 2018 г. по физической активности при артритах [75] и обращает внимание на такие ПЭ ГК, как миопатия (развивающаяся спустя недели и месяцы после начала терапии, особенно высокодозовой), инсулинорезистентность, остеопороз и центральное ожирение. Клиницистам рекомендовано поощрять соответствующие сообщества пациентов, разъяснять необходимость коррекции доз и лекарственных форм ГК при развитии интеркуррентных заболеваний (в частности, сопровождающихся рвотой), описывать симптомы отмены ГК и т.п. [2].
8. Что можно планировать в свете будущих обострений ГКА? В ходе титрования доз и после отмены ГК пациентов следует информировать о симптомах, позволяющих заподозрить рецидив ГКА, и их действиях в таких случаях, включая указание «первой контактной точки» для получения медицинской консультации и способа контакта с командой специалистов. Уровень согласия 9,81.
Перейдем к рекомендациям по применению диагностических тестов при подозрении на ГКА. Десять лет назад в Великобритании считали БВА желательной в каждом таком случае [17]. Позднее в клинике Мейо был разработан алгоритм оценки пациентов с предполагаемым ГКА в зависимости от преобладания краниальных или экстракраниальных симптомов; им предусмотрено выполнение исходной КТ- или МРТ-ангиографии даже при подтвержденном ГКА [12, 27].
На рис. 2 представлен предложенный BSR подход к срочному УЗИ сосудов при подозрении на этот диагноз [2].
Оценка вероятности ГКА учитывает всю доступную информацию (признаки, симптомы, лабораторные тесты, альтернативные диагнозы, объясняющие клиническую картину) и может быть изменена при получении новых данных (клиническое течение, результаты УЗИ височной и подмышечной артерий и/или БВА). Основу оценки составляет клиническое суждение, в идеале — индивидуальная экспертиза, и «при средней вероятности ГКА… может быть полезно выполнение УЗИ сосудов до биопсии, если ее результат негативный». Если клиническая вероятность ГКА высока, для подтверждения диагноза может быть достаточно позитивного УЗИ-теста, но дополнительное проведение БВА «еще больше повышает диагностическую определенность». В отсутствие признаков краниального васкулита БВА-тест тоже может быть позитивным, но «вместо него или наряду с ним» следует рассмотреть визуализацию крупных экстракраниальных сосудов.
Отмечая большое количество локальных разработок для оценки вероятности ГКА в клинической практике, BSR указывает на необходимость проверки их валидности. Если описанное на рис. 2 срочное УЗИ сосудов недоступно, пациенты, получающие лечение по поводу предполагаемого ГКА, подлежат БВА. В унисон с экспертами EULAR [26] сделан акцент на том, что «ни один тест не должен отсрочить назначение высоких доз ГК при сильном клиническом подозрении на ГКА» [2].
Собственно диагностическим тестам посвящены две рекомендации BSR, и достигнутые при этом высокие уровни согласия отражают их критическую важность.
1. При подозрении на ГКА пациенту следует выполнить подтверждающий диагностический тест. Им может быть БВА участка длиной не менее 1 см, либо УЗИ височных и подмышечных артерий, либо сочетание этих методов. Сильная рекомендация. Качество доказательств среднее (В), уровень согласия 9,33.
2. 18F-ФДГ-ПЭТ, МРТ- или КТ-ангиография или УЗИ подмышечных артерий могут быть использованы для оценки вовлечения аорты и ее проксимальных ветвей. Условная рекомендация. Качество доказательств очень низкое (D), уровень согласия 9,36.
Обсуждая роль визуализирующих тестов в диагностике поражения аорты и ее проксимальных ветвей, эксперты BSR называют дополнительными преимуществами ФДГ-ПЭТ/КТ возможность исключения таких альтернативных диагнозов, как опухоль и инфекция. Применение УЗИ возможно для подтверждения вовлечения сонных, подключичных и позвоночных артерий. Отмечен непрямой характер доказательств точности визуализирующих тестов при ГКА и недостаток данных из проспективных исследований.
Остальные девять рекомендаций BSR 2020 г. касаются лечения больных ГКА.
3. Стандартная начальная доза ГК при ГКА — 40–60 мг/сут преднизолона внутрь. Условная рекомендация. Качество доказательств очень низкое (D), уровень согласия 9,44.
Обсуждая это положение, BSR отмечает и отсутствие сравнительных исследований разных стартовых доз преднизолона per os при ГКА, и накопленный опыт, подтверждающий симптоматический ответ большинства больных на прием препарата в дозе 40–60 мг/сут
в течение 1–7 дней (за исключением необратимых проявлений — потери зрения, инсульта, некроза тканей). Отсутствие такого ответа является поводом для срочного пересмотра диагноза. При определении стартовой дозы ГК принимают во внимание именно вес пациента, но следует учитывать и риск дозозависимых коморбидных состояний. BSR рекомендует клиницистам рассматривать более высокие дозы в пределах 40–60 мг/сут у пациентов с ишемическими нарушениями зрения, перемежающейся болью в челюсти или языке, «осознавая слабость доказательной базы». Говоря о внутривенной одно- или трехдневной пульс-терапии МП в сравнении с приемом высоких доз преднизолона внутрь, BSR приводит результаты 4 рандомизированных клинических исследований (РКИ) [76–79], не выявившие различий по таким ПЭ, как инфекции, кушингоид, психиатрические, сердечно-сосудистые и глазные осложнения, диабет, желудочно-кишечные кровотечения и расстройства, флебиты/тромбозы, миопатии, остеопороз, переломы и смертность. Качество большинства доказательств оценено BSR как низкое и очень низкое. «Небольшое возможное преимущество состоит в редукции кумулятивной дозы ГК у лиц, получающих пульс-терапию МП, но… ценность этого подхода у больных ГКА без острой или интермиттирующей потери зрения останется неопределенной» [2].
4. При ГКА с острой или интермиттирующей потерей зрения до начала приема ГК внутрь возможна стартовая внутривенная терапия метилпреднизолоном в дозе от 500 мг до 1 г в сутки до трех последовательных дней. Условная рекомендация. Качество доказательств очень низкое (D), уровень согласия 9,00.
Отмечено отсутствие клинических исследований у пациентов с острой зрительной ишемией и наличие опыта, подтверждающего развитие большинства случаев слепоты до начала ГК-терапии. В 2010 г. BSR рекомендовало трехдневную пульс-терапию МП при осложненном ГКА [17], в 2014 г. — при угрозе сохранности органов при других системных васкулитах [80]. В обсуждаемом руководстве указана альтернатива пульс-терапии МП (при невозможности ее проведения) — прием преднизолона внутрь в дозе 60–100 мг/сут до трех последовательных дней [2].
5. Дозу ГК следует титровать до отмены в течение 12–18 мес. при условии отсутствия рецидивов (симптомов, признаков ГКА или лабораторных маркеров воспаления). Более быстрое снижение дозы является адекватным у пациентов, имеющих высокий риск токсичности ГК и/или получающих ГК-сберегающие препараты. Условная рекомендация. Качество доказательств очень низкое (D), уровень согласия 8,81.
Доказательную базу положения составили результаты двух РКИ, проведенных у пациентов с дебютом ГКА; они не выявили различий в исходах при разных режимах титрования ГК. Одно, опубликованное в 1989 г., было открытым моноцентровым [81] и обеспечило доказательства низкого и очень низкого качества; второе современное исследование очень высокого качества [71] не планировалось для оценки ПЭ ГК.
6. Следует отдавать предпочтение однократному ежедневному приему ГК перед альтернирующим режимом или разделением суточной дозы на несколько приемов. Условная рекомендация. Качество доказательств очень низкое (D), уровень согласия 9,53. В основу этой рекомендации положены результаты открытого моноцентрового РКИ «с неопределенным периодом наблюдения», опубликованные G.G. Hunder и соавт. в 1975 г. [82].
7. Для лечения больных ГКА не может быть дано рекомендаций по использованию преднизолона с модифицированным высвобождением. Доказательств недостаточно, уровень согласия 9,72. По данному вопросу нет ни клинических испытаний, ни клинического опыта.
8. Применение МТ для лечения ГКА может быть рассмотрено в сочетании с титрованием доз ГК у пациентов с высоким риском токсичности ГК и при рецидивах. Недостаточно доказательств для рекомендации любых других пероральных иммуносупрессантов, включая азатиоприн, лефлуномид и мофетила микофенолат. Условная рекомендация. Качество доказательств низкое (С), уровень согласия 8,82. Характеристика доказательной базы С такова: «Весьма вероятно, что дальнейшие исследования существенно повлияют на нашу уверенность в оценке эффекта и изменят ее» [2].
Метотрексат при ГКА изучен в трех двойных слепых плацебо-контролируемых РКИ 2001–2002 гг. (Jover J.A. и соавт. [83], Spiera R.F. и соавт. [84]; Hoffman G.S. и соавт. [77]) и метаанализе Mahr A.D. и соавт. (2007) [85]. В моноцентровом 24-месячном исследовании J.A. Jover и соавт. (2001) участвовали 42 пациента с недавним дебютом ГКА и стартовой дозой преднизолона 60 мг/сут, участники основной группы дополнительно получали МТ в дозе 10 мг/нед [83]. В многоцентровое 12-месячное исследование G.S. Hoffman и соавт. (2002) вошли 98 пациентов с недавним дебютом ГКА и стартовой дозой преднизолона 1 мг/кг/сут, доза МТ в основной группе была 15 мг/нед [77]. В наименьшем (n = 21) моноцентровом исследовании R.F. Spiera и соавт. (2001) МТ в дозе 7,5 мг/нед добавляли к ГК после снижения их дозы до 30 мг/сут по преднизолону, причем больные с нарушениями зрения исходно получали пульс-терапию ГК внутривенно [84]. BSR отмечает, что объединение данных двух более крупных РКИ позволило получить доказательства среднего качества (В) того, что добавление МТ уменьшает часть пациентов с рецидивами ГКА в течение 12–24 мес. по сравнению с плацебо (ОР 3,2; 95% ДИ 1,49–6,87). В самом крупном из описанных РКИ [77] был оценен такой исход, как «неэффективное лечение» (≥ 2 рецидива или рецидив, не контролируемый увеличением дозы преднизолона), и по этой конечной точке различий между МТ и плацебо не выявили (доказательства низкого качества — С).
В рекомендациях BSR указано, что ни в одном РКИ не выявили влияния МТ на кумулятивную дозу ГК (доказательства низкого и очень низкого качества). По данным всех трех РКИ, эффект МТ не отличался от плацебо в отношении ПЭ ГК, смертности, потери зрения, опухолей, инфекций, психиатрических осложнений, переломов, катаракты, диабета, кушингоида, прибавления массы тела, атрофии кожи (доказательства низкого и очень низкого качества) и АГ (качество доказательств среднее). BSR отмечает отсутствие сильных доказательств связи приема МТ с развитием его серьезных ПЭ и повышением частот встречаемости тошноты, рвоты, гиперферментемии, тромбоцитопении, язв полости рта, диареи, эпигастральной боли (все доказательства низкого и очень низкого качества), указав, что выявление различий между МТ и плацебо по ПЭ не было задачей ни одного РКИ [2].
Как сказано выше, BSR ссылается на итоги метаанализа A.D. Mahr и соавт. (2007) индивидуальных данных участников всех трех РКИ (n = 161) [85], доказавшие такие эффекты добавления МТ к преднизолону: умеренное снижение риска развития первого и второго рецидива (ОР 0,65 и 0,49 соответственно), большая частота ремиссий без ГК длительностью ≥ 24 нед. (ОР 2,8) и меньшая кумулятивная доза ГК на 96-й неделе (в среднем на 1,1 г). В целом «три небольших РКИ показали вероятность получения небольшой пользы от применения МТ при ГКА, которая состоит в снижении частоты рецидивов и кумулятивной дозы ГК и, возможно, риска второго и первого рецидива… хотя доказательства сомнительны». Отсутствуют доказательства эффектов более высоких доз МТ (до 25 мг/нед), применяемых в клинической практике [2].
Отметим, что в разработку BSR не включен реже цитируемый [86] метаанализ M. Yates и соавт. (2014) [87], выявивший по данным тех же трех РКИ лишь тенденцию к снижению риска рецидивов ГКА при приеме МТ (ОР 0,85; 95% ДИ 0,66–1,11), а также тенденцию к повышению риска инфекций (ОР 1,58; 95% ДИ 0,90–2,78).
Характеризуя эффекты азатиоприна, BSR ссылается на M. da Silva и соавт. (1986) [88], представивших итоги моноцентрового 52-недельного двойного слепого плацебо-контролируемого РКИ у больных РП с ГКА или без него (n = 31), получавших преднизолон в дозе ≥ 5 мг/сут. Отмечая связь приема препарата с меньшей дозой ГК в конце периода наблюдения (в среднем на 3 мг) и одинаковую частоту ПЭ, BSR считает качество доказательств этих эффектов очень низким и указывает на невозможность сформулировать рекомендацию по применению азатиоприна при ГКА.
Эффекты дополнительного приема дапсона в дозе 50–100 мг/сут изучены F. Liozon и соавт. (1993) у 47 участников открытого многоцентрового плацебо-контролируемого РКИ [89]. Качество полученных при этом доказательств снижения риска рецидивов ГКА (ОР 0,37; 95% ДИ 0,16–0,84) оценено BSR как очень низкое; низким названо качество доказательств более частого развития анемии (ОР 8,89; 95% ДИ 1,27–61,99) при приеме дапсона. Очень низкое качество доказательств установлено для отсутствия отличия от плацебо по таким ПЭ, как кожная сыпь, диабет, костные и сердечно-сосудистые осложнения, инфекции и потеря зрения [2].
Говоря о циклоспорине, авторы рекомендаций BSR ссылаются на два открытых исследования, проведенных C. Schaufelberger и соавт. (1998, 2006) на 82 пациентах [2, 90]. Препарат применяли в дозе 2,0–3,5 мг/кг/сут
в течение 6 или 12 мес. и в итоге не выявили его влияния на кумулятивную дозу ГК, маркеры острой фазы и глобальные оценки болезни пациентом и врачом (качество доказательств очень низкое), однако отмечали повышенный риск прекращения лечения в связи с ПЭ циклоспорина (ОР 13,00; 95% ДИ 1,78–95,10; качество доказательств низкое). BSR сделан вывод о том, что при ГКА «потенциальная токсичность дапсона или циклоспорина может превысить любую потенциальную пользу, и их использование не рекомендовано» [2].
Особо отмечено отсутствие РКИ лефлуномида: доказательства его пользы при ГКА получены в 2012–2019 гг. в открытых нерандомизированных исследованиях и сериях случаев. Циклофосфамид и микофенолата мофетил «иногда используются в клинической практике… для лечения тяжелого ГКА по аналогии с их применением при других системных васкулитах, но формально при ГКА они не исследованы» [2].
9. При ГКА может быть рассмотрено применение тоцилизумаба в сочетании с титрованием доз ГК, особенно у пациентов, имеющих высокий риск токсичности ГК или рецидив заболевания. Сильная рекомендация. Качество доказательств среднее (В), уровень согласия 9,61.
Тоцилизумаб — рекомбинантное гуманизированное моноклональное антитело к рецептору ИЛ-6. Селективно связывась с растворимыми и мембранными рецепторами ИЛ-6, препарат подавляет его классический и транссигнальный рецепторные пути. В 2017 г. применение тоцилизумаба при ГКА одобрено в США и Европе на основании итогов двух плацебо-контролируемых РКИ [71, 79]. В большем из них, проведенном J.H. Stone и соавт. (2017) [71], участвовали пациенты и с дебютом, и с рецидивом васкулита; тоцилизумаб сочетали с преднизолоном, дозы которого титровали по стандартной схеме до полной отмены через 6 мес. В группе плацебо использовали два альтернативных режима снижения доз ГК, отменяя их через 6 или 12 мес. В результате через год часть пациентов, достигших стойкой ремиссии, была выше в основной группе (56 % среди получавших тоцилизумаб раз в неделю и 53 % среди получавших его раз в две недели), чем в контрольной (14 и 18 % при снижении ГК до отмены через 6 и 12 мес. соответственно). При еженедельном введении тоцилизумаба вероятность достижения стойкой ремиссии оказалась гораздо выше, чем при приеме плацебо на фоне 6-месячного титрования ГК: ОР 4,0 (95% ДИ 1,97–8,12), что расценено BSR как доказательство высокого качества (А). Доказательства среднего качества (В) подтвердили большую вероятность достижения «стойкой ремиссии без учета уровня СРБ». В этом РКИ и исследовании P.M. Villiger и соавт. (2016) [79] установили и такие эффекты тоцилизумаба, как повышение уровня безрецидивной выживаемости через год (ОР 3,57; 95% ДИ 2,29–5,55) и снижение кумулятивной дозы ГК; качество этих доказательств признано BSR высоким. Результаты объединения данных двух РКИ (доказательства среднего качества) показали меньший риск развития серьезных ПЭ у получавших тоцилизумаб по сравнению с плацебо: ОР 0,64 (95% ДИ 0,41–1,00). Обсуждая достижение стероидсберегающего эффекта с помощью тоцилизумаба, BSR указывает на ряд практических ограничений, в том числе экономического характера [2].
Говоря о применении тоцилизумаба при ГКА с тяжелой коморбидной патологией, приведем вывод Т.В. Бекетовой и соавт. (2018) о «потенциальной эффективности непродолжительных курсов и невысоких доз, с которых, видимо, предпочтительнее начинать лечение у пациентов пожилого возраста с факторами риска неблагоприятных реакций» [91]. Адъювантная терапия тоцилизумабом у пожилых больных ГКА может иметь и такое преимущество, как влияние на депрессивные расстройства [8]. Также представляется перспективным применение при ГКА абатацепта (рекомбинантного растворимого белка, состоящего из внеклеточного домена антигена 4 цитотоксических Т-лимфоцитов, связанного с модифицированным Fc-фрагментом иммуноглобулина GI человека) и устекинумаба (блокатора ИЛ-12 и ИЛ-23) [27, 92].
В рекомендациях BSR указано, что эффекты aбатацепта по сравнению с плацебо недавно изучены в небольшом РКИ у пациентов с ГКА, достигших ремиссии. Препарат «показал существенное преимущество» по такому исходу, как время до наступления рецидива, но на 12-м месяце наблюдения части пациентов, находящихся в ремиссии, оказались сопоставимы в группах [92]. BSR считает качество доказательств низким и отмечает, что абатацепт не одобрен для применения при ГКА в настоящее время. Указано, что при этом васкулите не могут быть рекомендованы и ингибиторы фактора некроза опухоли — с учетом итогов двух РКИ [93, 94], доказавших и неэффективность инфликсимаба и адалимумаба, и повышение частоты инфекционных осложнений при их применении. Небольшое РКИ этанерцепта [95] «не рассмотрено из-за его несоответствия критериям включения в литературный обзор и отсутствие значимого результата по первичной конечной точке» [2].
10. Рутинное применение антитромбоцитарных и антикоагулянтных средств при ГКА не рекомендовано. Доказательств недостаточно, уровень согласия 9,61. BSR отмечает, что кокрановский обзор S.P. Mollan и соавт. (2014) показал отсутствие доказательств из РКИ для определения эффективности и безопасности адъювантной низкодозовой терапии аспирином при ГКА, и рекомендует клиницистам следовать национальным руководствам [96] по вторичной профилактике атеросклероза.
11. Рутинное применение при ГКА гипохолестеринемических средств, таких как статины, не рекомендовано. Доказательств недостаточно, уровень согласия 9,53. BSR отмечает отсутствие соответствующих РКИ и рекомендует клиницистам следовать национальным руководствам по вторичной профилактике атеросклероза [2].
Итак, целью лечения больных ГКА является выздоровление или достижение стойкой ремиссии. С учетом рекомендаций GEFA (2015) и BSR (2020), его основой остается пероральный прием преднизолона, ключевую роль играет раннее применение высоких доз (при явлениях краниальной ишемии — сверхвысоких доз МП внутривенно, с аспирином или без него) и их постепенное снижение под контролем клинических симптомов в течение 12–24 мес. до отмены. Пациентам с ГКА присуща коморбидность, которая связана с повышенными рисками развития рецидивов (независимо от сроков установления диагноза) и нежелательных эффектов ГК-терапии, а также определяет целесообразность систематического назначения статинов, дезагрегантов и антикоагулянтов. Адъювантная терапия ГКА должна прежде всего обеспечить стероидсберегающий эффект (особенно учитывая повышенный риск развития побочных эффектов ГК у пожилых пациентов). Именно при высоком риске токсичности ГК и рецидивах ГКА следует рассматривать применение метотрексата, а согласно с британским руководством — и тоцилизумаба. Перспективы раннего использования при ГКА биологических болезнь-модифицирующих противоревматических средств важны в свете повышенного риска развития инфекционных осложнений в течение первых 6 мес. ГК-терапии, и среди них наилучшую доказательную базу имеет тоцилизумаб.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи. Авторы не получали от отдельных лиц и организаций финансовой поддержки исследования, гонораров и других форм вознаграждения.
Информация о вкладе каждого автора: Лызиков А.Н. — концепция и дизайн работы; Пузанова О.Г. — обзор литературы, написание текста и подготовка его к печати; Лызиков А.А. — коррекция текста с внесением ценного интеллектуального содержания.
Список литературы
1. De Smit E., Palmer A.J., Hewitt A.W., Projected worldwide disease burden from giant cell arteritis by 2050. J. Rheumatol. 2015. 42. 119-125. doi: 10.3899/jrheum.140318.
2. Mackie S.L., Dejaco C., Appenzeller S., Camellino D., Duftner C., Gonzalez-Chiappe S., Mahr A., Mukhtyar C., Reynolds G., de Souza A.W., Brouwer E., Bukhan M., Buttgereit F., Byrne D., Cid M.C., Cimmino M., Direskeneli H., Gilbert K., Kermani T.A., Khan A., Lanyon P., Luqmani R., Mallen C., Mason J.C., Matteson E.L., Merkel P.A., Mollan S., Neill L., O’Sullivan E., Sandovici M., Schmidt W.A., Watts R., Whitlock M., Yatsyshyn E., Ytterberg S., Dasgupta B. British Society for Rheumatology guidelines on diagnosis and treatment of giant cell arteritis. Rheumatology. 2020. 0. 1-23. doi: 10.1093/rheumatology/kez672.
3. Pfeil A., Oelzner P., Hellmann P. The Treatment of Giant Cell Arteritis in Different Clinical Settings. Front Immunol. 2019. 9. 3129. doi: 10.3389/fimmu.2018.03129.
4. Barraclough K., Mallen C.D., Helliwell T., Hider S.L., Dasgupta B. Diagnosis and management of giant cell arteritis. Br. J. Gen. Pract. 2012. 62(599). 329-330. doi: 10.3399/bjgp12X649313.
5. Weyand C.M., Goronzy J.J. Clinical practice. Giant-cell arteritis and polymyalgia rheumatica. N. Engl. J. Med. 2014. 371(1). 50-57. doi: 10.1056/NEJMcp1214825.
6. Ninan J., Lester S., Hill C. Giant cell arteritis. Best Pract. Res. Clin. Rheumatol. 2016. 30. 169-188. doi: 10.1016/berh.2016.05.001.
7. Watanabe R., Goronzy J.J., Berry G., Liao Y.J., Weyand C.M. Giant-cell arteritis: From pathogenesis to therapeutic management. Curr. Treatm. Opt. Rheumatol. 2016. 2. 126-137. doi: 10.1007/s40674-016-0043-x.
8. Лисицына Т.А., Вельтищев Д.Ю., Лила А.М., Насонов Е.Л. Интерлейкин 6 как патогенетический фактор, опосредующий формирование клинических проявлений, и мишень для терапии ревматических заболеваний и депрессивных расстройств. Научно-практическая ревматология. 2019. 57(3). 318-327. doi: 10.14412/1995-4484-2019-318-327.
9. Brennan D., Ungprasert P., Warrington K.J., Koster M.J. Smoking as a risk factor for giant cell arteritis: A systematic seview and meta-analysis. Semin. Arthritis Rheum. 2018. 48(3). 529-537. doi: 10.1016/semarthrit.2018.07.001.
10. Svensjö S., Björck M., Gurtelschmid M., Djavani Gidlung K., Hellberg A., Wanhainen A. Low prevalence of abdominal aortic aneurysm among 65-year-old Swedish men indicates a change in the epidemiology of the disease. Circulation. 2011. 124(10). 1118-1123. doi: 10.1161/CIRCULATIONAHA.111.030379.
11. Brekke L.K., Diamantopoulos A.P., Fevang B.-T., Aßmus J., Espero E., Giesdal G.C. Incidence of giant cell arteritis in Western Norway 1972–2012: a retrospective cohort study. Arthritis Res. Ther. 2017. 19. 278. doi: 10.1186/s13075-017-1479-6.
12. Нетяженко В.З., Пузанова О.Г. Гигантоклеточный артериит: эпидемиология, диагностика, прогноз. Біль. Суглоби. Хребет. 2019. 9(2). 90-107. doi: 10.22141/2224-1507.9.2.2019.172121.
13. Smith J.H., Swanson J.W. Giant cell arteritis. Headache. 2014. 54(8). 1273-1289. doi: https://doi.org/10.1111/head.12425.
14. Patil P., Williams M., Maw W.W., Achilleos K., Elsideed S., Dejaco C., Borg F., Gupta S., Dasgupta B. Fast track pathway reduces sight loss in giant cell arteritis: results of a longitudinal observational cohort study. Clin. Exp. Rheumatol. 2015. 33(2 Suppl. 89). 103-6. PMID: 26016758.
15. Hayreh S.S., Zimmerman B. Management of giant cell arteritis. Our 27-year clinical study: new light on old controversies. Ophthalmologica. 2003. 217(4). 239-259. PMID: 12792130.
16. Baig I.F., Pascae A.R., Kini A., Lee A.G. Giant cell arteritis: early diagnosis is key. Eye Brain. 2019. 11. 1-12. doi: 10.2147/EB.S170388.
17. Dasgupta B., Borg F.A., Hassan N., Alexander L., Barraclough K., Bourke B., Fulcher J., Hoolywood J., Hutchings A., James P., Kyle V., Nott J., Power M., Samanta A. BSR and BHPR guidelines for the management of giant cell arteritis. Rheumatology (Oxford). 2010. 49. 1594-1597. doi: 10.1093/rheumatology/keq039a.
18. Prior J.A., Ranjbar H., Belcher J., Mackie S.L., Helliwell T., Liddle J. Diagnostic delay for giant cell arteritis — a systematic review and meta-analysis. BMC Medicine. 2017. 15. 120. doi: 10.1186/s12916-017-0871-z.
19. Chen J.J., Leavitt J.A., Fang C., Crowson C.S., Matteson E.L., Warrington K.J. Evaluating the Incidence of Arteritic Ischemic Optic Neuropathy and Other Causes of Vision Loss from Giant Cell Arteritis. Ophthalmology. 2016. 123. 1999. doi: 10.1016/j.ophtha.2016.05.008.
20. Diamantopoulos A.P., Haugeberg G., Lindland A., Myklebust G. The fast-track clinic for early diagnosis of giant cell arteritis significantly reduces permanent visual impairment: towards a more effective strategy to improve clinical outcome in giant cell arteritis? Rheumatology. 2016. 55(1). 66-70. doi: 10.1093/rheumatology/kev289.
21. Hayreh S.S., Zimmerman B. Visual deterioration in giant cell arteritis patients while on high doses of corticosteroid therapy. Ophthalmologica. 2003. 110(6). 1204-1215. PMID: 12799248.
22. Salehi-Abari I. 2016 ACR Revised Criteria for Early Diagnosis of Giant Cell (Temporal) Arteritis. Autoimmune Dis. Ther. Approaches. 2016. 3. 1. doi: http://dx.doi.org/10.14437/2378-6337-3-119.
23. El-Dairi M.A., Chang L., Proia A.D., Cummings T.J., Stinnett S.S., Bhatti M.T. Retrospective review of 213 consecutive cases of TAB seen at a single academic center over a 10-year period (2000-2009). J. Neuroophthalmol. 2015. 35(3). 246-253. doi: 10.1097/WNO.0000000000000234.
24. Бунчук Н.В. Ревматические заболевания пожилых (Избранные). М.: МЕДпресс-информ, 2010. 272 с.
25. Kumar B., Toney D.E., Alikhan M., Lohr K.M. Giant cell arteritis presenting as depressed mood and headache in an elderly patient. J. Clin. Rheumatol. 2013. 19(7). 405-406. doi: 10.1097/RHU.0b013e3182a701e8.
26. Dejaco C., Ramiro S., Duftner C., Besson F.L., Bley T.A., Blockmans D., Brouwer E., Cimmino M.A., Clark E., Dasgupta B. EULAR recommendations for the use of imaging in large vessels vasculitis in clinical practice. Ann. Rheum. Dis. 2018. 77(5). 636-643. doi: 10.1136/annrheumdis-2017-212649.
27. Koster M.J., Matteson E.L., Warrington K.J. Large-vessel giant cell arteritis: diagnosis, monitoring and management. Rheumatology (Oxford). 2018. 57. 32-42. doi: 10.1093/rheumatology.kex424.
28. Bienvenu B., Ly K.H., Lambert M., Agard C., André M., Benhamou Y., Bonnotte B., de Boysson H., Espitia O., Fau G., Fauchais A.L., Galateau-Sallé F., Haroche J., Héron E., Lapébie F.X., Liozon E., Luong Nguyen L.B., Magnant J., Manrique A., Matt M., de Menthon M., Mouthon L., Puéchal X., Pugnet G., Quemeneur T., Régent A., Saadoun D., Samson M., Séne D., Smets P., Yelnik C., Sailler L., Mahr A. Management of giant cell arteritis: Recommendations of the French Study Group for Large Vessel Vasculitis (GEFA). Rev. Med. Intern. 2016. 37(3). 154-165. doi: 10.1016/j.revmed.2015.12.015.
29. Stone J.R., Bruneval P., Angelini A., Bartoloni G., Basso C., Batoroeva L., Buja L.M., Butany J., d’Amati G., Fallon J.T., Gittenberger-de Groot A.C., Gouveia R.H., Halushka M.K., Kelly K.L., Kholova I., Leone O., Litovsky S.H., Maleszewski J.J., Miller D.V., Mitchell R.N., Preston S.D., Pucci A., Radio S.J., Rodriquez E.R., Sheppard M.N., Suvarna S.K., Tan C.D., Thiene G., van der Wal A.C., Veinot J.P. Consensus statement on surgical pathology of the aorta from the Society for Cardiovascular Pathology and the Association for European Cardiovascular Pathology: I. Inflammatory diseases. Cardiovasc. Pathol. 2015. 24(5). 267-278. doi: 10.1016/jcarpath.2015.05.001.
30. Hocevar A., Rotar Z., Jese R., Semrl S.S., Pizem J., Hawlina M., Tomsic M. Do early diagnosis and glucocorticoid treatment decrease the risk of permanent visual loss and early relapses in giant cell arteritis: a prospective longitudinal study. Medicine (Baltimore). 2016. 95(14). e3210. doi: 10.1097/MD0000000000003210.
31. Liozon E., de Boysson H., Dalmay F., Gondran G., Bezanahary H., Fauchais A.-L., Ly K.-H. Development of Giant Cell Arteritis after Treating Polymyalgia or Peripheral Arthritis: a Retrospective Case-control study. J. Rheumatol. 2018 March. doi: https://doi.org/10.3899/j.rheum.170455.
32. Petri H., Nevitt A., Saesour K., Napalkov P., Collinson N. Incidence of giant cell arteritis and characteristics of patients: data-driven analysis of comorbidities. Arthritis Care Res (Hoboken). 2015. 67(3). 390-395. doi: 10.1002/acr.22429.
33. Mohammad A.J., Englud M., Turesson C., Tomasson G., Merkel P.A. Rate of Comorbidities in Giant Cell Arteritis: A Population-based Study. J. Rheumatol. 2017. 44(1). 84-90. doi: 10.3899/j.rheum.160249.
34. Pujades-Rodriguez M., Duyx B., Thomas S.L., Stogiannis D., Smeeth L., Hemingway H. Association between polymyalgia rheumatica and giant cell arteritis and 12 cardiovascular diseases. Heart. 2016. 102(5). 383-389. doi: 10.1136/heartjnl-2015-308514.
35. Chazal T., Lhote R., Rey G., Haroche J., Eb M., Amoura Z., Cohen Aubart F. Giant-cell arteritis-related mortality in France: A multiple-cause-of-death analysis. Autoimm. Rev. 2018. 17(12). 1219-1224. doi: 10.1016/j.autrev.2018.06.012.
36. Brekke L.K., Fevang B., Diamantopoulos A.P., Assmus J., Esperø E., Giesdal G.C. Survival and death causes of patients with giant cell arteritis in Western Norway 1972–2012: a retrospective cohort study. Arthritis Res. Ther. 2019. 21(1). 154. doi: 10.1186/s13075-019-1945-4.
37. Myklebust G., Wilsgaard T., Jacobsen B.K., Gran J.T. No increased frequency of malignant neoplasm in polymyalgia rheumatica and temporal arteritis. A prospective longitudinal study of 398 cases and matched population controls. J. Rheumatol. 2002. 29(10). 2143-2147. PMID: 12375324.
38. Ungprasert P., Sanguankeo A., Upala S., Knight E.L. Risk of malignancy in patients with giant cell arteritis and polymyalgia rheumatica: a systematic review and meta-analysis. Semin. Arthritis Rheum. 2014. 44(3). 366-370. doi: 10.1016/j.semarthrit.2014.06.004.
39. Bellan M., Boggio E., Sola D., Gibbin A., Gualerzi A., Favretto S., Guaschino G., Bonometti R., Pedrazzoli R., Pirisi M., Sainaghi P.P. Association between rheumatic diseases and cancer: results from a clinical practice cohort study. Intern. Emerg. Med. 2017. 12(5). 621-627. doi: 10.1007/s11739-017-1626-8.
40. Albrecht K., Huscher D., Buttgereit F., Aringer M., Hoese G., Ochs W., Thiele K., Zink A. Long-term glucocorticoid treatment in patients with polymyalgia rheumatica, giant cell arteritis, or both diseases: results from a national rheumatology database. Rheumatol. Int. 2018. 38(4). 569-577. doi: 10.1007/s00296-017-3874-3.
41. Wilson J.C., Sarsour K., Collinson N., Tuckwell K., Musselman D., Klearman M., Napalkov P., Jick S.S., Stone J.H., Meier C.R. Incidence of outcomes potentially associated with corticosteroid therapy in patients with giant cell arteritis. Semin. Arthritis Rheum. 2017. 46(5). 650-656. doi: 10.1016/j.semarthrit.2016.10.001.
42. Wilson J.C., Sarsour K., Collinson N., Tuckwell K., Musselman D., Klearman M., Napalkov P., Jick S.S., Stone J.H., Meier C.R. Serious adverse effects associated with glucocorticoid therapy in patients with giant cell arteritis (GCA): A nested case-control analysis. Semin. Arthritis Rheum. 2017. 46(6). 819-827. doi: 10.1016/j.semarthrit.2016.11.006.
43. Durand M., Thomas S.L. Incidence of infections in patients with giant cell arteritis: a cohort study. Arthritis Care Res. (Hoboken). 2012. 64(4). 581-588. doi: 10.1002/acr.21569.
44. Udayakumar P.D., Chandran A.K., Crowson C.S., Warrington K.J., Matteson E.L. Hospitalized infections in giant cell arteritis: a population-based retrospective cohort study. J. Rheumatol. 2014. 41(12). 2447-2451. doi: 10.3899/j.rheum.140124.
45. Schmidt J., Smail A., Roche B., Gay P., Salle V., Pellet H., Duhaut P. Incidence of Severe Infections and Infection-Related Mortality During the Course of Giant Cell Arteritis: A Multicenter, Perspective, Double-Cohort Study. Arthritis Rheum. 2016. 68(6). 1477-1482. doi: 10.1002/art.39596.
46. Настанова 00789. Скроневий (гігантоклітинний) артеріїт. Настанови на засадах доказової медицини, cтворені DUODECIM Medical Publications, Ltd. URL: https://guidelines.moz.gov.ua/documents/3570. Доступ: 14.02.2020.
47. Paskins Z., Whittle R., Sultan A.A., Muller S., Blagojevic-Bucknall M., Helliwell T., Hider S., Roddy E., Mallen C. Risk of fracture among patients with polymyalgia rheumatica and giant cell arteritis: a population-based study. BMC Medicine. 2018. 16(1). 4. doi: 10.1186/s12916-017-0987-1.
48. Reiter S., Winocur E., Goldsmith C., Emodi-Perlman A., Gorsky M. Giant cell arteritis misdiagnosed as temporomandibular disorder: a case report and review of the literature. J. Orofac. Pain. 2009. 23(4). 360-365. PMID: 19888487.
49. Макаренко Е.В. Гигантоклеточный артериит. Часть I. Вестник Витебского государственного медицинского университета. 2017. 16(5). 21-30. doi: https://doi.org/10.22263/2312-4156.2017.5.21.
50. Бекетова Т.В., Сатыбалдыев А.М., Денисов Л.Н. Международные рекомендации по ведению больных гигантоклеточным артериитом и ревматической полимиалгией: итоги 2015 года. Научно-практическая ревматология. 2016. 54(4). 390-394. doi: http://dx.doi.org/10.14412/1995-4484-2016-390-394.
51. Макаренко Е.В. Гигантоклеточный артериит. Часть II. Вестник Витебского государственного медицинского университета. 2017. 16(5). 31-39. doi: https://doi.org/10.22263/2312-4156.2017.5.31.
52. Luqmani R., Lee E., Singh S., Gillett M., Schmidt W.A., Bradbum M., Dasgupta B., Diamantopoulos A.P., Forrester-Barker W., Hamilton W., Masters S., McDonald B., McNally E., Pease C., Piper J., Salmon J., Wailoo A., Wolfe K., Hutchings A. The role of ultrasound compared to biopsy of Temporal Arteries in the Diagnosis and Treatment of Giant Cell Arteritis (TABUL): a diagnostic accuracy and cost-effectiveness study. Health Technol. Assess. 2016. 20. 1-238. PMID: 27925577.
53. Smetana G.W., Shmerling R.H. Does this patient have temporal arteritis? JAMA. 2002. 287(1). 92-101. doi: 10.1001/jama.287.1.92
54. Liozon E., Dalmay F., Lalloue F., Gondran G., Bezanahary H., Fauchais A.L., Ly K.H. Risk factors for permanent visual loss in biopsy-proven giant cell arteritis: a study of 339 patients. J. Rheumatol. 2016. 43(7). 1393-1399. doi: 10.3899/jrheum.151135.
55. Cid M.C., Font C., Oristrell J., de la Sierra A., Coll-Vinent B., Lopez-Soto A., Vilaseca J., Urbano-Marquez A., Grau J.M. Association between strong inflammatory response and low risk of developing visual loss and other cranial ischemic complications in giant cell arteritis. Arthritis Rheum. 1998. 41(1). 26-32. PMID: 9433866.
56. Salvarani C., Bella C.D., Cimino L., Macchioni P., Formisano D., Bajocchi G., Pipitone N., Catanoso M.G., Restuccia G., Ghinoi A., Boiardi L. Risk factors for severe cranial ischemic events in an Italian population-based cohort of patients with giant cell (temporal) arteritis. Rheumatology (Oxford). 2009. 48. 250-253. doi: 10.1093/rheumatology/ken465.
57. González-Gay M.A., Pineiro A., Gomez-Gigirey A., Garcia-Porrua C., Pego-Reigosa R., Dierssen-Sotos T., Llorca J. Influence of traditional risk factors of atherosclerosis in the development of severe ischemic complications in giant cell arteritis. Medicine (Baltimore). 2004. 83(6). 342-347. PMID: 15525846.
58. Yates M., MacGregor A.J., Robson J., Craven A., Merkel P.A., Luqmani R.A., Watts R.A. The association of vascular risk factors with visual loss in giant cell arteritis. Rheumatology (Oxford). 2017. 56(4). 524-528. doi: 10.1093/rheumatology/kew397.
59. De Boysson H., Daumas A., Vautier M., Parienti J.J., Liozon E., Lambert M., Samson M., Ebbo M., Dumont A., Sultan A., Bonnotte B., Manrique A., Bienvenu B., Saadoun D., Aouba A. Large-vessel involvement and aortic dilation in giant cell arteritis. A multicenter study of 549 patients. Autoimmun. Rev. 2018. 17. 391-398. doi: 10.1016/j.autrev.2017.11.029.
60. Muratore F., Kermani T.A., Crowson C.S., Koster M.J., Matteson E.L., Salvarani C., Warrington K.J. Large-vessel dilatation in giant cell arteritis: a different subset of disease? Arthritis Care Res. 2018. 70. 1406-1411. doi: https://doi.org/10.1002/acr.23498.
61. Nuenninghof D.M., Hunder G.G., Christianson T.J., McClelland R.L., Matteson E.L. Incidence and predictors of large-artery complication (aortic aneurysm, aortic dissection, and/or large-artery stenosis) in patients with giant cell arteritis: a population-based study over 50 years. Arthritis Rheum. 2003. 48. 3522-3531. doi: http://doi.org/10.1002/art.11353.
62. González-Gay M.A., Garcia-Porrua C., Pineiro A., Pego-Reigosa R., Llorca J., Hunder G.G. Aortic aneurysm and dissection in patients with biopsy-proven giant cell arteritis from northwestern Spain: a population-based study. Medicine (Baltimore). 2004. 83(6). 335-341. PMID: 15525845.
63. González-Gay M.A., Garcia-Porrua C., González-Juanatey C., Miranda-Filloy J.A., Blanco R., Llorca J. Biopsy-proven giant cell arteritis patients with coronary artery disease have increased risk of aortic aneurysmal disease and artherial thrombosis. Clin. Exp. Rheumatol. 2013. 31(1 Suppl. 75). S94. PMID: 23463922.
64. Robson J.C., Kiran A., Maskell J., Hutchings A., Arden N., Dasgupta B., Hamilton W., Emin A., Culliford D., Luqmani R.A. The relative risk of aortic aneurysm in patient with giant cell arteritis compared with the general population of the UK. Ann. Rheum. Dis. 2015. 74(1). 129-135. doi: 10.1136/annrheumdis-2013-204113.
65. Hachulla E., Boivin V., Pasturel-Michon U., Fauchais A.L., Bouroz-Joly J., Perez-Cousin M., Hatron P.Y., Devulder B. Prognostic factors and long-term evolution in a cohort of 133 patients with giant cell arteritis. Clin. Exp. Rheumatol. 2001. 19. 171-176. PMID: 11326479.
66. Nesher G., Nesher R., Mates M., Sonnenblick M., Breuer S.G. Giant cell arteritis: intensity of the initial systemic inflammatory response and the course of the disease. Clin. Exp. Rheumatol. 2008. 26(3 Suppl. 49). 30-34. PMID: 18799050.
67. Alba M.A., Garcia-Martinez A., Prieto-Gonzáles S., Tavera-Bahillo I., Corbera-Bellalta M., Planas-Rigol E., Espígol-Frigolé G., Butjosa M., Hernández-Rodríguez J., Cid M.C. Relapses in patients with giant cell arteritis: prevalence, characteristics, and associated clinical findings in a longitudinally followed cohort of 106 patients. Medicine (Baltimore). 2014. 93(5). 194-201. doi: 10.1097/MD.0000000000000033.
68. Muratore F., Kermani T.A., Crowson C.S., Green A.B., Salvarani C., Matteson E.L., Warrington K.J. Large-vessel giant cell arteritis: a cohort study. Rheumatology (Oxford). 2015. 54(3). 463-470. doi: 10/1093/rheumatology/keu329.
69. Strehl C., Bijlsma J.W., de Wit M., Boers M., Caeyers N., Cutolo M., Dasgupta B., Dixon W.G., Geenen R., Huizinga T.W., Kent A., de Thurah A.L., Listing J., Mariette X., Ray D.W., Scherer H.U., Seror R., Spies C.M., Tarp S., Wiek D., Winthrop K.L., Buttgereit F. Defining conditions where long-term glucocorticoid treatment has an acceptably low level of harm to facilitate implementation of existing recommendations: viewpoints from an EULAR task force. Ann. Rheum. Dis. 2016. 75. 952-957. doi: 10.1136/annrheumdis-2015-208916.
70. Duru N., van der Goes M.C., Jacobs J.W., Andrews T., Boers M., Buttgereit F., Caeyers N., Cutolo M., Halliday S., Da Silva J.A., Kirwan J.R., Ray D., Rovensky J., Severijns G., Westhovens R., Bijlsma J.W. EULAR evidence-based and consensus-based recommendations on the management of medium to high dose glucocorticoid therapy in rheumatic diseases. Ann. Rheum. Dis. 2013. 72. 1905-1913. doi: 10.1136/annrheumdis-2013-203249.
71. Stone J.H., Tuckwell K., Dimonaco S., Klearman M., Aringer M., Blockman D., Brouwer E., Cid M.C., Dasgupta B., Rech J., Salvarani C., Schett G., Schulze-Koops H., Spiera R., Unizony S.H., Collinson N. Trial of tocilizumab in giant-cell arteritis. N. Engl. J. Med. 2017. 377. 317-328. doi: 10.1056/NEJMoa1613849.
72. Grossman J.M., Gordon R., Ranganath V.K., Deal C., Caplan L., Chen W., Curtis J.R., Furst D.E., McMahon M., Patkar N.M., Volkmann E., Saag K.G. American College of Rheumatology 2010 recommendations for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Care Res. (Hoboken). 2010. 62(11). 151-1526. doi: 10.1002/acr.20295.
73. Van Assen S., Agmon-Levin N., Elkayam O., Cervera R., Doran M.F., Dougados M., Emery P., Geborek P., Ioannidis J.P., Jayne D.R., Kallenberg C.G., Müller-Ladner U., Shoenfeld Y., Stojanovich L., Valesini G., Wulffraat N.M., Bijl M. EULAR recommendations for vaccination in adult patients with autoimmune inflammatory rheumatic diseases. Ann. Rheum. Dis. 2011. 70. 414-422. doi: 10.1136/ard.2010.137216.
74. Пузанова О.Г. Питание как фактор риска и вмешательство при ревматических заболеваниях. Біль. Суглоби. Хребет. 2019. 9(3). 9-29. doi: 10.22141/2224-1507.9.3.2019.178640.
75. Rausch Osthoff A.K., Niedermann K., Braun J., Adams J., Brodin N., Dagfinrud H., Duruoz T., Esbensen B.A., Günther K.P., Hurkmans E., Juhl C.B., Kennedy N., Kiltz U., Knittle K., Nurmohamed M., Pais S., Sererijns G., Swinnen T.W., Pitsillidou I.A., Warburton L., Уankov Z., Vilet Vlietland T.P.M. 2018 EULAR recommendations for physical activity in people with inflammatory arthritis and osteoarthritis. Ann. Rheum. Dis. 2018. 77. 1251-1260. doi: 10.1136/annrheumdis-2018-213585.
76. Chevalet P., Barrier J.H., Pottier P., Magadur-Joly G., Pottier M.A., Hanmidou M., Planchon B., El Kouri D., Connan L., Dupond JL., De Wasieres B., Dien G., Duhamel E., Grosbois B., Jego P., Le Strat A., Capdeville J., Letellier P., Agron L. A randomized, multicenter, controlled trial using intravenous pulses of methylprednisolone in the initial treatment of simple forms of giant cell arteritis: a one-year followup study of 164 patients. J. Rheumatol. 2000. 27(6). 1484-1491. PMID: 10852275.
77. Hoffman G.S., Cid M.C., Hellmann D.B. et al. International Network for the study of Systemic Vasculitides. A multicenter, randomized, double-blind, placebo-controlled trial of adjuvant methotrexate treatment for giant cell arteritis. Arthritis Rheum. 2002. 46(5). 1309-1318. PMID: 12115238.
78. Mazlumzadeh M., Hunder G.G., Easley K.A. Calamia K.T., Matteson E.L., Griffing W.L., Younge B.R., Weyand C.M., Goronzy J.J. Treatment of giant cell arteritis using induction therapy with high-dose glucocorticoids: a double-blind, placebo-controlled, randomized prospective clinical trial. Arthritis Rheum. 2006. 54(10). 3310-3318. PMID: 17009270.
79. Villiger P.M., Adler S., Kuchen S., Wermelinger F., Dan D., Fiege V., Bütikofer L., Seitz M., Reichenbach S. Tocilizumab for induction and maintenance of remission in giant cell arteritis: a phase 2, randomized, double-blind, placebo-controlled trial. Lancet. 2016. 387(10031). 1921-1927. doi: 10.1016/S0140-6736(16)00560-2.
80. Ntatsaki E., Carruthers D., Chakravarty K., D’Cruz D., Harper L., jayne D., Luqmani R., Mills J., Mooney J., Venning M., Watts R.A.; BSR and BHPR Standards, Guidelines and Audit Working Group. BSR and BHPR guidelines for the management of adults with ANCA-associated vasculitis. Rheumatology (Oxford). 2014. 53. 2306-2309. doi: 10.1093/rheumatology/ket445.
81. Kyle V., Hazleman B.L. Treatment of polymyalgia rheumatica and giant cell arteritis. I. Steroid regimens in the first two months. Ann. Rheum. Dis. 1989. 48(8). 658-661. PMID: 2782975.
82. Hunder G.G., Sheps S.G., Allen G.L., Joice J.W. Daily and alternate-day corticosteroid regimens in treatment of giant cell arteritis: comparison in a prospective study. Ann. Intern. Med. 1975. 82(5). 613-618. PMID: 1137255.
83. Jover J.A., Hernández-Garcia C., Morado I.C., Vargas E., Baňares A., Fernández-Gutiérrez C. Combined treatment of giant-cell arteritis with methotrexate and prednisone: a randomized, double-blind, placebo-controlled trial. Ann. Intern. Med. 2001. 134(2). 106-114. PMID: 11177313.
84. Spiera R.F., Mitnick H.J., Kupersmith M., Richmond M., Spiera H., Peterson M.G., Paget S.A. A prospective, double-blind, randomized, placebo controlled trial of methotrexate in the treatment of giant cell arteritis (GCA). Clin. Exp. Rheumatol. 2001. 19(5). 495-501. PMID: 11579707.
85. Mahr A.D., Jover J.A., Spiera R.F., Hernández-Garcia C., Fernández-Gutiérrez C., Lavalley M.P., Merkel P.A. Adjunctive methotrexate for treatment of giant cell arteritis: an individual patient data meta-analysis. Arthritis Rheum. 2007. 56(8). 2789-2797. PMID: 17665429.
86. Müller-Ladner U., Rau R. Metotrexat bei Spondylarthritiden, Vaskulitiden und Kollagenosen. In: Metotrexat bei Autoimmunerkrankungen — Moderne Therapiekonzepte in der Rheumatologie, dermatologie und gastroenterologie. 2. Auflage. Bremen: UNI-MED, 2016. 118 p.
87. Yates M., Loke Y.K., Watts R.A., MacGregor A.J. Prednisolone combined with adjunctive immunosuppression is not superior to prednisolone alone in terms of efficacy and safety in giant cell arteritis: meta-analysis. Clin. Rheumatol. 2014. 33(2). 227-236. doi: 10.1007/s10067-013-2384-2.
88. Da Silva M., Hazleman B.L. Azathioprine in giant cell arteritis/polymyalgia rheumatica: a double-blind study. Ann. Rheum. Dis. 1986. 45. 136-138. PMID: 3511861.
89. Liozon F., Vidal E., Barrier J. Does dapsone have a role in the treatment of temporal arteritis with regard to efficacy and safety? Clin. Exp. Rheumatol. 1993. 11(6). 694-695. PMID: 8299268.
90. Schaufelberger C., Mollby H., Uddhamer A., Bratt J., Nordborg E. No additional steroid-sparing effect of cyclosporine A in giant cell arteritis. Scand. J. Rheumatol. 2006. 35. 327-329. doi: https://doi.org/10.1080/03009740500474537.
91. Бекетова Т.В., Ушакова М.А., Никишина Н.Ю., Хелковская-Сергеева А.Н., Николаева E.В., Сажина E.Г., Новоселова Т.М., Насонов E.Л. Опыт применения ингибитора интерлейкина 6 тоцилизумаба для лечения гигантоклеточного артериита с тяжелой коморбидной патологией. Научно-практическая ревматология. 2018. 56(2). 228-234. doi: 10.14412/1995-4484-2018-228-234.
92. Langford C.A., Cuthbertson D., Ytterberg S.R., Khalidi N., Monach P.A., Carette S., Seo P., Moreland L.W., Weisman M., Koening C.L., Sreih A.G., Spiera R., McAlear C.A., Warrington K.J., Pagnoux C., McKinnon K., Forbess L.J., Hoffman G.S., Borchin R., Krischer J.P., Merkel P.A.; Vasculitis Clinical Research Consortium. A randomized, double-blind trial of abatacept (CTLA-4Ig) for the treatment of giant cell arteritis. Arthritis Rheumatol. 2017. 69. 837-845. doi: 10.1002/art.40044.
93. Hoffman G.S., Cid M.C., Rendt-Zagar K.E., Merkel P.A., Weyand C.M., Stone J.H., Salvarani C., Xu W., Visvanathan S., Rahman M.U; Infliximab-GCA Study Group. Infliximab for maintenance of glucocorticosteroid-induced remission of giant cell arteritis: a randomized trial. Ann. Intern. Med. 2007. 146(9). 621-630. PMID: 17470830.
94. Seror R., Baron G., Hachulla E., Debandt M., Larroche C., Puechal X., Maurier F., de Wazieres B., Quemeneur T., Ravaud P., Mariette X. Adalimumab for steroid sparing in patients with giant cell arteritis: results of a multicentre randomized controlled trial. Ann. Rheum. Dis. 2014. 73(12). 2074-2081. doi: 10.1136/annrheumdis-2013-203586.
95. Martinez-Taboada V.M., Rodriguez-Valverde V., Carreňo L., López-Longo J., Figueroa M., Belzunegui J., Mola E.M., Bonilla G. A double-blind placebo controlled trial of etanercept in patients with giant cell arteritis and corticosteroid side effects. Ann. Rheum. Dis. 2007. 67(5). 625-630. PMID: 18086726.
96. Mollan S.P., Sharrack N., Burdon M.A., Denniston A.K. Aspirin as adjunctive treatment for giant cell arteritis. Cochrane Database Syst. Rev. 2014. 8. CD010453.

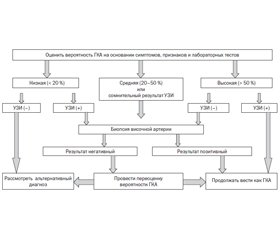
/19.jpg)
/21.jpg)
/22.jpg)
/23.jpg)
/26.jpg)
/28.jpg)
/29.jpg)
/30.jpg)