Лечение синдрома/болезни Бехчета (ББ) в настоящее время остается сложной и трудной задачей для врача-специалиста. В патологический процесс при болезни Бехчета вовлекается множество систем и органов, и в большинстве случаев необходимо назначение нескольких препаратов, имеющих различные цели. В дополнение к этому часто рецидивирующее течение болезни и уникальное естественное ее течение — с уменьшением степени тяжести со временем — значительно усложняют принятие решений о назначении или неназначении тех или иных терапевтических агентов. В этом обзоре представлены наиболее доказательные данные за последние 2 года о лечении ББ и рассмотрен современный ее менеджмент.
Рекомендации по лечению
В 2018 году Европейская противоревматическая лига (EULAR) обновила свои рекомендации по менеджменту пациентов с ББ [1]. К настоящему времени назрела необходимость в обновлении существующих рекомендаций EULAR 2008 года в связи с появлением новых публикаций о ведении пациентов с ББ и лекарственных препаратах, использующихся для их терапии. Особенно много работ в последние годы касается применения генно-инженерных биологических препаратов для лечения ББ.
На основе результатов новых систематических обзоров и мнений экспертов были сформированы пять всеобъемлющих принципов и 10 рекомендаций. В общих принципах подчеркивается важность междисциплинарного подхода, признание того, что ББ имеет рецидивирующе-ремиттирующее течение, а целями лечения ББ являются быстрое подавление воспаления в период обострения, уменьшение числа рецидивов и предотвращение необратимых повреждений органов [2]. Отмечается, что лечение должно быть подобрано индивидуально в зависимости от возраста, пола, типа и тяжести органных поражений, а также предпочтений пациента [3]. Более тяжелый прогноз ассоциирован с офтальмологическими, сосудистыми, неврологическими и желудочно-кишечными проявлениями ББ. Последний принцип рекомендаций по менеджменту пациентов с ББ акцентирует, что проявления болезни могут улучшаться со временем у многих пациентов [1].
Что касается конкретных рекомендаций, они были разделены в зависимости от вовлечения систем органов и типов поражений. Для кожно-слизистых проявлений предпочтительным является местное лечение, при неэффективности которого следует назначать колхицин. Кроме того, колхицин эффективен для профилактики рецидивов кожно-слизистых проявлений, в первую очередь узловатой эритемы и язв гениталий. Использование иммунодепрессантов, таких как азатиоприн (АЗА), интерферон α (ИФНα), циклоспорин А (ЦсА), ингибиторы фактора некроза опухоли (иФНО) и апремиласт, показано при тяжелых, долго не заживающих, рефрактерных, болезненных поражениях кожи и слизистых оболочек [2].
Пациентам с острым артритом при ББ показано в первую очередь лечение колхицином. Острый моноартрит может быть купирован внутрисуставным введением глюкокортикоидов (ГК). В случае рецидивирующего или хронического артрита должны назначаться АЗА, ИФНα или иФНО [1].
Лечение увеита у больных ББ требует тесного сотрудничества с офтальмологами. Пациентам с ББ и воспалительным поражением глаз с вовлечением заднего сегмента рекомендуется использовать АЗА, ЦсА, ИФНα или иФНО. ГК системно нужно назначать только в комбинации с АЗА или другим иммуносупрессантом. При первичных или повторных эпизодах острого увеита, угрожающего потерей зрения, показаны высокие дозы ГК, инфликсимаба или ИФНα. Дополнительно к системному лечению могут использоваться интравитреальные инъекции ГК у пациентов с односторонним обострением увеита [1]. Системное назначение иммуносупрессантов показано пациентам с изолированным передним увеитом и неблагоприятными прогностическими факторами — молодой возраст, мужской пол и ранний возраст начала ББ.
В случае острого тромбоза глубоких вен при ББ применяются ГК и иммуносупрессанты, такие как АЗА, ЦФ или ЦсА [1]. Пациентам с рефрактерным к терапии венозным тромбозом показано лечение иФНО. Антикоагулянты могут быть назначены, если риск кровотечения низкий, а аневризмы легочной артерии исключены.
Для лечения аневризм легочной артерии при ББ рекомендуются высокие дозы ГК и циклофосфамида (ЦФ), в рефрактерных случаях должны использоваться иФНО. У пациентов с легочным кровотечением или высоким риском кровотечения методом выбора является эмболизация артерий, а не открытая операция. У пациентов с аневризмами периферических артерий или аорты консервативное лечение ГК и ЦФ должно предшествовать хирургическому вмешательству [1]. В случае появления жизнеугрожающих симптомов показано оперативное лечение и стентирование артерий. Пульмональная лобэктомия в случаях гигантских легочных артериальных аневризм или хирургическая резекция периферических больших аневризм должны быть выполнены после иммуносупрессивного лечения и достижения ремиссии [4].
В период обострения поражений желудочно-кишечного тракта у больных ББ рекомендуется назначение ГК в сочетании с болезньмодифицирующими препаратами, такими как производные 5-аминосалициловой кислоты (сульфасалазин, месалазин) или АЗА [1]. В тяжелых и/или рефрактерных случаях должны назначаться иФНО и/или талидомид.
При остром паренхиматозном поражении центральной нервной системы (ЦНС) при ББ должны назначаться высокие дозы ГК с последующим медленным их снижением совместно с иммуносупрессантами, при этом препаратом выбора является АЗА [1]. Моноклональные антитела к ФНОα используются в качестве препаратов первой линии при тяжелом поражении ЦНС или у рефрактерных пациентов. Следует избегать назначения ЦсА у этих пациентов. Первый эпизод тромбоза венозных синусов головного мозга требует применения высоких доз ГК в виде пульс-терапии. Антикоагулянты следует назначать на короткий срок и с особой осторожностью, при этом должен проводиться скрининг на вовлечение экстракраниальных сосудов.
Ингибиторы фактора некроза опухоли
ИФНО в настоящее время используют у пациентов с ББ для лечения поражения глаз и других более тяжелых проявлений, таких как неврологические и сосудистые поражения, а иногда и для стойких слизисто-кожных проявлений. Такой подход обусловлен результатами многочисленных когортных исследований, открытых испытаний и одного контролируемого двойного слепого исследования [5]. Стойкость клинического ответа при применении иФНО позволяет предположить, что они могут быть основным видом лечения при различных проявлениях ББ. G. Emmi с соавт. (2018) [6] провели исследование для оценки клинической эффективности и глюкокортикоидсберегающего эффекта лечения адалимумабом (AДA) по сравнению с терапией болезньмодифицирующими антиревматическими лекарственными препаратами (БМАРП) в большой ретроспективной когорте пациентов с ББ, основным клиническим проявлением у которых были венозные тромбозы. Исследователями проведен ретроспективный анализ данных 70 пациентов с ББ и венозными осложнениями, получавших лечение БМАРП или АДА (с БМАРП или без них). После среднего периода наблюдения более 25 месяцев схемы лечения с АДА чаще и быстрее приводили к клиническому и инструментальному улучшению венозного тромбоза (p < 0,0001) по сравнению с лечением только БМАРП. Кроме того, лечение АДА сопровождалось применением более низких доз ГК (p < 0,0001). Таким образом, эти данные демонстрируют высокую эффективность АДА и иФНО в лечении венозных тромбозов и торпидного течения ББ. Не было обнаружено различий в эффективности и сроках лечения между изолированным применением БМАРП или схемами на основе АДА среди пациентов в зависимости от приема антикоагулянтов. В отношении использования последних не было выявлено никаких различий в эффективности, что согласуется с предыдущими исследованиями, в которых иммуносупрессия являлась краеугольным камнем лечения, а изолированная антикоагулянтная терапия не имела такого эффекта [7].
Сообщалось, что инфликсимаб обладал превосходной эффективностью при рефрактерном увеоретините при ББ и был одобрен для лечения этого проявления в Японии. В исследовании BRIGHT — перспективном, масштабном, долгосрочном постмаркетинговом исследовании инфликсимаба (ИНФ) у японских пациентов — рассмотрен долгосрочный профиль безопасности и эффективность ИНФ в реальных клинических условиях у пациентов с увеоретинитом при ББ [8]. В исследование были включены 650 пациентов с увеоретинитом, начавшие лечение ИНФ в период с января 2007 года по январь 2010 года. Каждые 6 месяцев проводилась оценка лечения на предмет безопасности и эффективности. По данным шкалы общей оценки врача, через 24 месяца частота ответа составила 80,7 %, при этом средняя частота обострений поражений глаз в течение 6 месяцев значительно снизилась на фоне применения ИНФ. Инфузионные реакции наблюдались у 11 % пациентов, большинство из которых были курабельными. Авторы пришли к выводу, что эти результаты свидетельствуют о том, что лечение инфликсимабом в течение 2 лет для рефрактерного увеоретинита при ББ было эффективным и хорошо переносимым, что пополняет доказательную базу ИНФ в лечении ББ.
В другом открытом исследовании проведено сравнение ИНФ и AДA в качестве первого биологического агента у большой серии пациентов с рефрактерным увеитом, вызванным ББ [9]. Пациенты были рефрактерны к обычной терапии небиологическими агентами. Проанализированы данные 177 пациентов (лечение ИНФ — 103, АДА — 74). После 1 года терапии улучшение всех офтальмологических проявлений было отмечено в обеих группах. AДA продемонстрировал лучший результат по некоторым параметрам, таким как витрит (78,95 против 93,33 %; p = 0,04), лучшая коррекция остроты зрения (0,67 ± 0,34 против 0,81 ± 0,26; p = 0,001) и переносимость препарата (84,95 против 95,24 %; p = 0,042). Однако это исследование не было плацебо-контролируемым, что затрудняет возможность сделать однозначные выводы.
С. Fabiani с соавт. (2019) [10] также сравнивали эффективность AДA и ИНФ в лечении неинфекционного среднего увеита, заднего увеита и панувеита, ретроспективно анализируя данные 107 пациентов. Из них 66 (61,7 %) получали АДА и 41 (38,3 %) — ИНФ. Несмотря на то, что уменьшение числа обострений увеита в течение первых 12 месяцев лечения было более значимым у пациентов, получавших АДА, эти различия были статистически незначимыми. Возможно, это обусловлено большими дозами ГК, разнообразием проявлений поражений глаз у пациентов, получавших AДA.
В другом исследовании сравнивали ИНФ с ИФНα у пациентов с рефрактерным увеитом на фоне ББ [11]. Ученые провели ретроспективный анализ 20 пациентов, получавших ИНФ, и 33 пациентов, получавших ИФНα. В результате примерно одинаковое количество пациентов достигли ремиссии в обеих группах (16 в группе ИНФ (80 %) и 28 — в группе ИФНα (85 %)). В обеих группах одинаково улучшились и средняя острота зрения, и все параметры воспаления; профили безопасности также были схожими. На основании этого исследования не было отмечено существенных различий между ИНФ и ИФНα в контроле внутриглазного воспаления, что может иметь значение в клинической практике, поскольку стоимость этих двух вариантов лечения различна.
Одно из последних значимых исследований A. Katsuyama с соавт. (2019) [12] было направлено на оценку долгосрочной эффективности и безопасности комбинированной терапии ИНФ и ЦсА для лечения рефрактерного увеоретинита при ББ. Исследование включало ретроспективный анализ медицинских карт 11 пациентов с ББ и увеоретинитом, невосприимчивым к традиционному лечению, которые получали комбинированную терапию ИНФ + ЦсА в течение 5,6 ± 2,3 года. Частота обострений офтальмологических проявлений за 6-месячный период достоверно снизилась с 2,9 ± 1,6 до 0,6 ± 0,9 и до 0,0 ± 0,0 по окончании наблюдения (p = 0,003). Серьезных побочных эффектов не наблюдалось, за исключением инфекции мочевыводящих путей и прогрессирования катаракты. Таким образом, был сделан вывод, что в случае рефрактерного увеоретинита на фоне ББ комбинированная терапия ИНФ + ЦсА представляет собой многообещающий вариант лечения.
В настоящее время отсутствует информация, когда следует прекратить лечение у пациентов, которые хорошо отвечают на терапию иФНО или какую-либо другую иммуносупрессивную терапию. В ряде исследований ученые стремились приостановить лечение у пациентов с поражением глаз после 2–5 лет эффективного медикаментозного лечения [13, 14]. Были сделаны предварительные выводы о возможности прекращения лечения иФНО, однако существует необходимость в подтверждении этого утверждения в соответствующих высокодоказательных клинических исследованиях.
Другие виды лечения
Устекинумаб
Устекинумаб является гуманизированным моноклональным антителом против интерлейкина (ИЛ) -12 и ИЛ-23, одобренным для применения при псориазе, псориатическом артрите и болезни Крона в США. А. Mirouse с соавт. (2018) сообщили о своих результатах использования устекинумаба в лечении ББ в двух разных исследованиях: они начали с небольшого исследования и увеличили количество пациентов во втором. В первом сообщении [15] исследователи оценили эффективность и безопасность применения устекинумаба при лечении язв полости рта у пациентов с ББ в открытом клиническом исследовании. Они включили 14 пациентов, из них три четверти составляли мужчины с активными язвами в полости рта, которые были устойчивы к лечению колхицином. Пациенты получали подкожно устекинумаб 90 мг (11) или 45 мг (3) в начале исследования, через 4 недели и затем каждые 12 недель.
Первичной конечной точкой (КТ) эффективности была доля пациентов с полным клиническим ответом, определяемым как отсутствие язвы в полости рта через 12 недель. На 12-й неделе КТ достигли девять (69 %) пациентов, три пациента (21 %) имели частичный ответ, двое (14 %) не ответили на проводимую терапию. Среднее количество язв в полости рта уменьшилось с 2 до 1 (p < 0,0005) вместе с уменьшением показателя активности ББ (BSAS — опросник активности пациента с оценкой в диапазоне от 0 до 100) до 22,8 ± 0,3 (p < 0,01) от исходного уровня к 12-й неделе. Эти улучшения в активности болезни также обусловили возможность меньшего использования преднизолона. После медианного наблюдения через 7 месяцев 10 пациентов все еще получали устекинумаб, а у четырех был рецидив.
Во второе исследование [16] авторы включили 30 пациентов и наблюдали за ними не менее 24 недель. Были получены аналогичные предыдущему исследованию результаты: среднее число язв полости рта достоверно уменьшалось на 12-й неделе терапии устекинумабом по сравнению с исходным уровнем (0 против 2, р < 0,0001). КТ были достигнуты у 60 и 89 % пациентов на 12-й и 24-й неделе соответственно. Оценка по шкале BSAS была значительно ниже в эти временные интервалы по сравнению с исходным уровнем. После медианного наблюдения в течение 12 месяцев 26 (86,6 %) пациентов все еще получали лечение устекинумабом. В течение этого периода лечения и наблюдения не зафиксировано серьезных побочных эффектов.
На основании этих результатов исследователи пришли к выводу, что устекинумаб эффективен для лечения язв в полости рта, обусловленных ББ и устойчивых к колхицину [15, 16]. Конечно, прежде чем делать четкие выводы, необходимо продемонстрировать эти преимущества с помощью плацебо-контролируемых исследований, однако эти ранние данные являются многообещающими. Кроме того, необходимо больше данных о влиянии устекинумаба на неоральные язвенные проявления ББ, прежде чем будет установлено истинное место устекинумаба в лечении ББ.
Секукинумаб
Секукинумаб — ингибитор ИЛ-17, одобренный для лечения псориаза, псориатического артрита и анкилозирующего спондилита (АС) в США, изучался у пациентов с ББ. Учитывая некоторые данные, указывающие на потенциально перекрывающиеся патогенетические особенности между серонегативными спондилоартритами и ББ, этот терапевтический агент может оказаться полезным в лечении ББ. В небольшом исследовании [17] авторы лечили и ретроспективно оценивали исходы пяти пациентов с преимущественно слизисто-кожными и суставными проявлениями ББ, невосприимчивыми к колхицину, БМАРП и по меньшей мере одному иФНО-агенту. Четверо из пациентов с ББ (они также имели классификационные критерии АС) получали 150 мг секукинумаба в месяц; один пациент (он также имел классификационные критерии псориатического артрита) получал 300 мг в месяц. Авторы определили КТ как уменьшение количества язв в полости рта более чем на 50 %; показатели индекса активности АС BASDAI менее 4, a ASDAS менее 1,4 и снижение на 50 % или более индекса активности ББ (BDCAF). Пациент, начавший прием секукинумаба в дозе 300 мг в месяц, достиг КТ в течение 3 месяцев с сохранением результата в течение 9 месяцев наблюдения. Из четырех пациентов, начавших принимать секукинумаб в дозе 150 мг в месяц, двое достигли КТ к 6-му месяцу, но у одного пациента произошел рецидив. Эти пациенты были переведены на секукинумаб 300 мг ежемесячно и успешно достигли КТ после увеличения дозы.
Это интересное исследование, в котором, несмотря на то, что результаты кажутся многообещающими, отсутствие группы контроля и небольшое количество пациентов подразумевают необходимость дальнейших, более доказательных исследований. Кроме того, эти данные напоминают нам о трудности диагностики ББ, поскольку все эти пять пациентов соответствовали диагностическим классификационным критериям других состояний с потенциально перекрывающимися патогенетическими механизмами. Согласно диагностическим критериям ББ, для постановки диагноза необходимо исключить все другие потенциальные заболевания, поэтому точное применение этой рекомендации дало бы возможность предположить, что у этих пациентов не было ББ. Перекрывающиеся патогенетические механизмы могут также потенциально вызывать неожиданные состояния: как сообщалось, ББ развивается у пациентов, которые получали секукинумаб для лечения АС [18].
Тоцилизумаб
В небольшом исследовании Y. Ding с соавт. (2018) [19] ретроспективно проанализировали клинические данные для пациентов с тяжелым и/или рефрактерным синдромом васкуло-Бехчета, которых лечили тоцилизумабом в период 2014–2018 годов. Исследователи определили семь пациентов (шесть мужчин и одна женщина), средний возраст которых составил около 33 лет. Множественные артериальные поражения были зарегистрированы у всех пациентов, включая артериальные аневризмы (у 5 пациентов), стенозы (у 4) и окклюзии (у 3). У двух пациентов также был задокументирован множественный венозный тромбоз. Основные локализации поражения артерий включали подключичную (5/7), сонную артерии (4/7), брюшную аорту (4/7), дугу аорты (3/7), бедренную (2/7) и коронарную артерии (2/7). До начала применения тоцилизумаба все пациенты принимали комбинацию ГК и иммуносупрессивного агента. У всех пациентов отмечена неудовлетворительная клиническая реакция с прогрессированием заболевания, им дополнительно был назначен тоцилизумаб 8 мг/кг каждые 4 недели с сохранением прежней терапии. После 19 месяцев наблюдения все пациенты достигли улучшения клинических симптомов и маркеров воспаления в крови, никаких новых проявлений поражения артерий или вен не наблюдалось. Некоторые из пациентов уменьшили дозы других лекарственных препаратов, включая ГК.
Это небольшое и не плацебо-контролируемое исследование позволяет предположить, что тоцилизумаб в комбинации с иммунодепрессантами и ГК может играть важную роль в лечении активной рефрактерной формы синдрома васкуло-Бехчета. Однако, как и для других новых агентов, для лучшего определения эффективности и профиля безопасности тоцилизумаба требуются более длительные и масштабные исследования.
Ингибиторы интерлейкина-1
Ингибиторы интерлейкина-1 (ИЛ-1) — анакинра, канакинумаб и гевокизумаб представляют собой многообещающую терапевтическую альтернативу при ББ. На сегодняшний день доказательства использования этих препаратов в основном базируются на небольших изолированных исследованиях или сериях случаев, и реальное место анти-ИЛ-1-агентов в лечении ББ до сих пор неясно. А. Bettiol с соавт. (2019) [20] был проведен систематический обзор современных данных об эффективности и безопасности анти-ИЛ-1-агентов при ББ. Применение анакинры и канакинумаба ассоциировалось с хорошим контролем поражения слизистых оболочек и глаз. Анакинра также оказался эффективным терапевтическим агентом при костно-суставных проявлениях. Гевокизумаб был апробирован только для глазных проявлений ББ, но продемонстрировал противоречивые результаты.
Также было проведено рандомизированное двойное плацебо-контролируемое исследование эффективности гевокизумаба у 83 пациентов с ББ и недавним обострением увеита; 40 пациентов получали гевокизумаб и 43 — плацебо [21]. При снижении высоких доз ГК пациентам назначили 60 мг гевокизумаба или плацебо каждые 4 недели подкожно. В результате установлено, что гевокизумаб существенно не влиял на риск возникновения обострений поражения оболочек глаз. Тем не менее данные свидетельствуют о том, что на фоне лечения гевокизумабом сохранялась острота зрения, уменьшалась тяжесть увеита, выраженность макулярного отека, и это моноклональное антитело сыграло роль стероидсберегающего агента. Гевокизумаб хорошо переносился. Хотя первичная КТ эффективности не была достигнута с помощью гевокизумаба, контроль пути ИЛ-1 у пациентов с ББ и увеитом все еще остается актуальной целью.
Данные подтверждают возможность использования анакинры и канакинумаба в педиатрической практике в качестве первой линии лечения ББ. Наиболее частыми побочными эффектами были местные или диффузные кожные реакции и реакции в месте инъекции, особенно при лечении анакинрой. Таким образом, блокирование пути ИЛ-1 может быть эффективной терапевтической стратегией при ББ.
Интерферон
Тромбоз глубоких вен нижних конечностей (ТГВНК) является серьезным осложнением ББ. Лечебная стратегия предполагает иммуносупрессанты, однако предикторы рецидива и оптимальный выбор препаратов остаются неясными. В проспективном исследовании [22] стратегия лечения первой линии состояла из АЗА и ГЛ. ИФНα использовался у пациентов, у которых АЗА был неэффективен или имело место тяжелое поражение глаз, требующее дополнительного лечения. 33 пациента с ТГВНК проспективно наблюдались в течение 40,7 ± 13,4 месяца. В целом 29 пациентов получали АЗА, а 17 — ИФНα. Частота рецидивов была ниже, а частота реканализации была выше при применении ИФНα по сравнению с АЗА (12 против 45 и 86 против 45 %). Были сделаны выводы, что ИФНα, по-видимому, является многообещающим средством для предотвращения рецидивов ТГВНК и достижения хорошей реканализации.
Апремиласт
Одной из наиболее значимых новостей в менеджменте пациентов с ББ за последний год стало одобрение Управлением по надзору за качеством пищевых продуктов и медикаментов (FDA) США апремиласта — перорального ингибитора фосфодиэстеразы-4, модулирующего несколько воспалительных путей, для лечения язв в полости рта при ББ. Это решение было основано на данных об эффективности и безопасности апремиласта в 3-й фазе рандомизированного плацебо-контролируемого двойного слепого исследования RELIEF [23]. У всех участников этого исследования диагностирована ББ с активными язвами в полости рта, и они ранее получали хотя бы один небиологический препарат. Первичной КТ было уменьшение общего количества язв полости рта в течение 12 недель. Другими важными исходами были уменьшение боли в полости рта, обусловленной язвенным поражением, и полное разрешение язв; также были оценены комплексные показатели активности болезни BDCAF и BSAS. Исследование контролировалось плацебо в течение 12 недель, но пациенты получали препарат до 64-й недели. Зарегистрировано 207 пациентов, достигших первичной КТ: эти результаты были статистически значимыми для язв полости рта при лечении апремиластом по сравнению с плацебо. Эффективность, наблюдаемая на 12-й неделе, удерживалась до 28-й недели. На 28-й неделе 62 % пациентов достигли КТ, касающейся разрешения язв в полости рта. Пациенты, которые были рандомизированы как получающие плацебо, стали получать апремиласт на 12-й неделе и продемонстрировали сходные преимущества с пациентами, рандомизированными в группу апремиласта исходно. Профиль побочных эффектов был одинаковым у апремиласта и плацебо во время двойной слепой фазы. Наиболее распространенными побочными эффектами были диарея, тошнота, головная боль и инфекции верхних дыхательных путей, большинство неблагоприятных событий были легкой или средней степени тяжести.
Данное испытание было продолжением предыдущего исследования 2-й фазы применения апремиласта для лечения ББ при оральных язвах, в котором были получены аналогичные результаты [24]. В этом исследовании 111 пациентов с ББ и язвенными поражениями полости рта получали апремиласт или плацебо в течение 12 недель, после чего пациенты с плацебо были переведены на апремиласт. Первичной КТ было уменьшение количества язв полости рта на 12-й неделе. Вторичные КТ включали степень болезненности язв полости рта, количество генитальных язв, общую активность заболевания и качество жизни. В результате установлено, что апремиласт был значительно эффективнее, чем плацебо, и в группе, получавшей апремиласт, серьезных побочных эффектов не было отмечено.
Эти исследования показывают, что апремиласт является эффективным вариантом лечения язв в полости рта при ББ и может быть так же эффективен при лечении других слизисто-кожных проявлений, таких как язвы половых органов. Однако исследования, специфичные для этих признаков ББ, не проводились. Еще одним направлением для будущих исследований станет изучение эффективности и безопасности апремиласта в комбинации с другими иммунодепрессантами для лечения ББ, так как многие пациенты нуждаются в продолжительном лечении, в комбинированной терапии для лучшего контроля активности болезни, а также для достижения ремиссии.
Другие препараты для лечения ББ
Эффективность пероральной формы 5-аминосалициловой кислоты (5-AСК) была изучена Н. Kinoshita с соавт. (2019) [25] при интестинальных проявлениях ББ. Авторы изучили индукцию ремиссии через 8 недель, эндоскопические результаты и безрецидивную выживаемость через 52 недели у 41 пациента, получавшего пероральную терапию 5-АСК. На 8-й неделе клиническая эффективность была зарегистрирована у 28 пациентов, а показатели ответа на лечение и ремиссии составили 61 и 57 % соответственно. Большинство пациентов также имели эндоскопическое подтверждение ответа через 52 недели, что свидетельствует о значительной роли пероральной 5-АСК у пациентов с ББ и поражением кишечника.
Еще в одном исследовании оценивали эффективность метотрексата (МТХ) для лечения пациентов с ББ и рефрактерными гастроинтестинальными проявлениями, несмотря на лечение 5-AСК, ГК, АЗА или иФНО [26]. 10 пациентов получали MTX для лечения активного рефрактерного поражения кишечника на фоне ББ. Четыре пациента получали MTX в качестве монотерапии, а 6 пациентов — комбинацию MTX с АДА. Показаниями к терапии МТХ были: непереносимость тиопурина — 10 %; недостаточная эффективность иФНО — 60 %; ГК-зависимость. Способ введения был пероральный у 8 пациентов, подкожный или внутримышечный — у 2 пациентов. Средняя доза MTX для рефрактерной интестинальной ББ составила 13,0 мг (7,5–20,0 мг); средняя продолжительность поддерживающей терапии составила 7,9 ± 5,0 месяца. Это исследование первым продемонстрировало эффективность и переносимость монотерапии MTX и комбинированной терапии MTX и адалимумабом у пациентов с ББ. Три пациента (30 %) через 3 месяца и 4 пациента (50 %) через 6 месяцев ответили на MTX, достигнув ремиссии без применения ГК. Кроме того, уровень СРБ в сыворотке был значительно снижен через 6 месяцев по сравнению с исходным уровнем. На основании этого исследования можно сделать выводы, что MTX может быть эффективным терапевтическим агентом для лечения рефрактерных интестинальных проявлений при ББ. Но для подтверждения этих предположений необходимы дальнейшие более масштабные исследования.
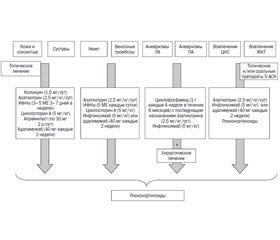
На рис. 1 обобщены данные относительно менеджмента пациента с ББ в зависимости от поражения органов-мишеней, касающиеся только одобренных к лечению препаратов на сегодняшний день.
Выводы
За последние 2 года в лечении ББ достигнуты значительные успехи: обновлены рекомендации EULAR, получено одобрение первого препарата, специально маркированного для лечения ББ, — апремиласта, представлены данные о перспективных новых терапевтических агентах, которые могут быть вскоре добавлены в лечение этого состояния. Мы также узнали больше о других лекарственных средствах, таких как иФНО: многие пациенты принимали их в течение длительного периода времени, и данные долгосрочного наблюдения подтверждают их весомую роль в лечении ББ. Отсутствие по большей части плацебо-контролируемых и рандомизированных исследований все еще остается проблемой. Кроме того, необходимы исследование эффективности препаратов в условиях реальной клинической практики и исследования с отменой терапевтического агента — для ответа на многие вопросы менеджмента в области редких проявлений ББ, таких как неврологические и сосудистые осложнения.
Лечение индивидуально для каждого пациента и зависит от типа и степени поражения органов, возраста и пола пациента и продолжительности заболевания. Пациентов с поражением только слизистой оболочки, кожи и суставов можно лечить местными препаратами и колхицином. При неэффективности последних к лечению следует добавить иммуносупрессивные или иммуномодулирующие агенты, такие как азатиоприн, ИФНα, апремиласт или иФНО. У пациентов с поражением глаз, сосудов, центральной нервной системы или желудочно-кишечного тракта иммунодепрессанты, такие как азатиоприн, используются в качестве лечения первой линии. Биологические агенты, такие как ИФНα или иФНО, используются у пациентов, устойчивых к иммуносупрессивной терапии. Циклофосфамид обычно является средством первого выбора для начального лечения жизнеугрожающих аневризм артериальных сосудов. Глюкокортикоиды могут быть использованы для быстрого подавления обострений, для предотвращения повреждения при всех видах поражения.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
Список литературы
1. Hatemi G., Christensen R., Bang D., et al. 2018 Update of the EULAR recommendations for the management of Behcet’s syndrome. Ann. Rheum. Dis. 2018. 77(6). 808-818. doi: 10.1136/annrheumdis-2018-213225.
2. Leccese P., Ozguler Y., Christensen R., et al. Management of skin, mucosa and joint involvement of Behçet’s syndrome: A systematic review for update of the EULAR recommendations for the management of Behçet’s syndrome. Seminars in Arthritis and Rheumatism. 2019. 48(4). 752-762. doi: 10.1016/j.semarthrit.2018.05.008.
3. Emmi G., Prisco D. Behçet’s syndrome: focus on pathogenetic background, clinical phenotypes and specific treatments. Intern. Emerg. Med. 2019. 14. 639. doi: 10.1007/s11739-019-02154-9.
4. Tuzun H., Seyahi E., Guzelant G., et al. Surgical Treatment of Pulmonary Complications in Behçet’s Syndrome. Semin. Thorac. Cardiovasc. Surg. 2018. 30(3). 379-380. doi: 10.1053/j.semtcvs.2018.07.008.
5. Melikoglu M., Fresko I., Mat C., et al. Short-term trial of etanercept in Behcet’s disease: a double blind, placebo controlled study. J. Rheumatol. 2005. 32. 98-105.
6. Emmi G., Vitale A., Silvestri E., et al. Adalimumab-based treatment versus disease-modifying antirheumatic drugs for venous thrombosis in Behcet’s syndrome. Arthritis Rheumatol. 2018. 70(9). 1500-1507. doi: 10.1002/art.40531.
7. Ozguler Y., Leccese P., Christensen R., et al. Management of major organ involvement of Behcet’s syndrome: a systematic review for update of the EULAR recommendations. Rheumatology (Oxford). 2018. 57(12). 2200-2212. doi: 10.1093/rheumatology/key242.
8. Ohno S., Umebayashi I., Matsukawa M., et al. Safety and efficacy of infliximab in the treatment of refractory uveoretinitis in Behcet’s disease: a large-scale, long-term postmarketing surveillance in Japan. Arthritis Res. Ther. 2019. 21. 2. doi: 10.1186/s13075-018-1793-7.
9. Atienza-Mateo B., Martın-Varillas J.L., Calvo-Rıo V., et al. Comparative study of infliximab versus adalimumab in refractory uveitis due to Behcet’s disease, national multicenter study of 177 cases. Arthritis Rheumatol. 2019. 71(12). 2081-2089. doi: 10.1002/art.4102.
10. Fabiani C., Vitale A., Rigante D., et al. Comparative efficacy between adalimumab and infliximab in the treatment of noninfectious intermediate uveitis, posterior uveitis, and panuveitis: a retrospective observational study of 107 patients. Clin. Rheumatol. 2019. 38(2). 407-415. doi: 10.1007/s10067-018-4228-6.
11. Yalçindag N., Köse H.C. Comparison of the treatment results for Behçet uveitis in patients treated with infliximab and interferon. Ocul. Immunol. Inflamm. 2019. 3. 1-10. doi: 10.1080/09273948.2019.1606256.
12. Katsuyama A., Kusuhara S., Nishisho R., Matsumiya W., Azumi A., Nakamura M. Long-term efficacy and safety of infliximab and cyclosporine combination therapy for refractory uveoretinitis in Behçet’s disease. Clin. Ophthalmol. 2019. 13. 521-527. doi: 10.2147/OPTH.S198648.
13. Martıin-Varillas J.L., Calvo-Rio V., Beltran E., et al. Successful optimization of adalimumab therapy in refractory uveitis due to Behçet’s Disease. Ophthalmology. 2018. 125(9). 1444-1451. doi: 10.1016/j.ophtha.2018.02.020.
14. Sfikakis P.P., Arida A., Panopoulos S., et al. Brief report: drug-free long-term remission in severe Behçet’s Disease following withdrawal of successful antitumor necrosis factor treatment. Arthritis Rheumatol. 2017. 69(12). 2380-2385. doi: 10.1002/art.40235.
15. Mirouse A., Barete S., Monfort J.B., et al. Ustekinumab for Behcet’s disease. J. Autoimmun. 2017. 82. 41-46. doi: 10.1016/j.jaut.2017.05.002.
16. Mirouse A., Barete S., Desbois A.C., et al. Long-term outcome of ustekinumab therapy for Behçet’s disease. Arthritis Rheumatol. 2019. 71(10). 1727-1732. doi: 10.1002/art.40912.
17. Di Scala G., Bettiol A., Cojan R.D., et al. Efficacy of the anti-IL 17 secukinumab in refractory Behcet’s syndrome: a preliminary study. J. Autoimmun. 2019. 97. 108-113. doi: 10.1016/j.jaut.2018.09.002.
18. Dincses E., Yurttas B., Estaoglu S.N., et al. Secukinumab induced Behcet’s syndrome: a report of two cases. Oxf. Med. Case Reports. 2019. 5. 239-241. doi: 10.1093/omcr/omz041.
19. Ding Y., Li C., Liu J., et al. Tocilizumab in the treatment of severe and/or refractory vasculo-Behcet’s disease: a single-centre experience in China. Rheumatology (Oxford). 2018. 57(11). 2057-2059. doi: 10.1093/rheumatology/key230.
20. Bettiol А., Silvestri E., Di Scala G. The right place of interleukin-1 inhibitors in the treatment of Behçet’s syndrome: a systematic review. Rheumatol. Int. 2019. 39(6). 971-990. doi: 10.1007/s00296-019-04259-y.
21. Tugal-Tutkun I., Pavesio C., De Cordoue A., Bernard-Poenaru O., Gül A. Use of Gevokizumab in Patients with Behçet’s Disease Uveitis: An International, Randomized, Double-Masked, Placebo-Controlled Study and Open-Label Extension Study. Ocul. Immunol. Inflamm. 2018. 26(7). 1023-1033. doi: 10.1080/09273948.2017.1421233.
22. Ozguler Y., Hatemi G., Cetinkaya F., et al. Clinical course of acute deep vein thrombosis of the legs in Behçet’s syndrome. Rheumatology (Oxford). 2019. pii: kez352. doi: 10.1093/rheumatology/kez352.
23. Hatemi G., Mahr A., Ishigatsubo Y., et al. Efficacy of apremilast for oral ulcers associated with active Behcet’s syndrome over 28 weeks: results from a phase 3 study. Arthritis Rheumatol. 2018. Supplement, abstract number 2789.
24. Hatemi G., Melikoglu M., Tunc R., et al. Apremilast for Behcet’s syndrome ― a phase 2, placebo-controlled study. N. Engl. J. Med. 2015. 372. 1510-1518. doi: 10.1056/NEJMoa1408684.
25. Kinoshita H., Nishioka H., Ikeda A., et al. Remission induction, maintenance, and endoscopic outcome with oral 5-aminosalicylic acid in intestinal Behсet’s disease. J. Gastroenterol. Hepatol. 2019. 34(11). 1929-1939. doi: 10.1111/jgh.14690.
26. Jihye P., Hee C.J., Yehyun P., Park S.J., Kim N.I., Kim W.H. Efficacy and tolerability of methotrexate therapy for refractory intestinal Behçet’s disease: a single center experience. Intest. Res. 2018. 16(2). 315-318. doi: 10.5217/ir.2018.16.2.315.

/53.jpg)