Вступ
Згідно з рекомендаціями Європейської антиревматичної ліги (EULAR), гіперурикемією вважають підвищення рівня сечової кислоти понад 360 мкмоль/л у жінок та 420 мкмоль/л у чоловіків [1]. Поширеність даної патології у світовій популяції становить 5–12 % [2, 3]. Враховуючи велику кількість літературних даних, які свідчать про урикозуричні властивості естрогенів, що виступають фактором захисту від появи гіперурикемії в жінок, дослідження рівня сечової кислоти в осіб у постменопаузальному періоді набуває з кожним роком все більшої актуальності [2, 4]. Як відомо, подагра в жінок розвивається зазвичай в період менопаузи на тлі прийому діуретиків (для лікування артеріальної гіпертензії або для зниження маси тіла). Поширеність порушень обміну сечової кислоти в жінок віком понад 50 років досягає 35 % [5]. Відомо, що існує взаємозв’язок гіперурикемії з ендотеліальною дисфункцією (яка сприяє прогресуванню атеросклерозу) та оксидативним стресом (сприяє формуванню атеросклеротичних бляшок) [6–9]. Згідно з результатами досліджень National Collaborating Center for Primary Care (2006), ожиріння в дорослих з індексом маси тіла (ІМТ) ≥ 30 ум.од. підвищує ризик розвитку гіперурикемії у 2–3 рази [1, 10]. Незважаючи на те, що сечова кислота розглядається як фактор ризику різних захворювань, зокрема метаболічного синдрому, результати наукових досліджень вказують на позитивний вплив гіперурикемії на метаболічні процеси в кістці [11, 12]. Зокрема, встановлено, що сечова кислота має антиоксидантні властивості, а оксидативний стрес, як відомо, негативно впливає на кісткову тканину.
На сьогодні в Україні існують поодинокі наукові дослідження щодо вивчення показників мінеральної щільності кісткової тканини (МЩКТ) у пацієнтів із різним рівнем сечової кислоти. Американські та австралійські вчені довели, що пацієнти з високим рівнем сечової кислоти мають меншу частоту переломів кісток та вищі показники МЩКТ, вони відводять першочергову роль оксидативному стресу як основному патогенетичному чиннику й поясненню даного факту. Знаючи рівень сечової кислоти в пацієнта, можна спрогнозувати можливість розвитку в нього остеопенії, остеопорозу та переломів кісток, що можна застосовувати як початковий метод діагностики цих патологій у тих місцевостях, де немає доступних інструментальних методик для діагностики остеопорозу.
Мета дослідження — вивчити структурно-функціональний стан кісткової тканини (показники мінеральної щільності, якості кісткової тканини) та компоненти метаболічного синдрому в жінок у постменопаузальному періоді з різним рівнем сечової кислоти.
Матеріали та методи
Дослідження здійснювали на базі відділення клінічної фізіології і патології опорно-рухового апарату ДУ «Інститут геронтології імені Д.Ф. Чеботарьова» НАМН України та Українського науково-медичного центру проблем остеопорозу. Були обстежені 412 жінок у постменопаузальному періоді. Виділені 4 групи залежно від ІМТ: I група (ІМТ = 18,5–24,9 ум.од.) — норма, II група (ІМТ = 25,0–29,9 ум.од.) — передожиріння, III група (ІМТ = 30,0–34,9 ум.од.) — ожиріння І ступеня, IV група (ІМТ > 35 ум.од.) — ожиріння ІІ ступеня. Залежно від рівня сечової кислоти у сироватці крові за квартильним розподілом були виділені 4 групи пацієнтів: Q1 < 235 мкмоль/л, Q2 = 235–281 мкмоль/л, Q3 = 282–329 мкмоль/л, Q4 > 329 мкмоль/л.
Визначення рівня сечової кислоти в сироватці крові здійснювали за допомогою ферментативного методу (уриказно-пероксидазного), проводячи спектрофотометричний аналіз.
Визначення показників МЩКТ всього скелета, поперекового відділу хребта, шийки стегнової кістки, трикутника Варда, стегнової та променевої кісток проводили на приладі Prodigy (CE Medical systems, model 8743, 2005).
Оцінка показника якості трабекулярної кісткової тканини (TBS (L1–L4)) проводилась за допомогою інстальованої програми TBS iNsight® software на рентгенівському денситометрі (Med-Imaps, Pessac, Франція).
Статистичний аналіз проводили з використанням параметричних та непараметричних критеріїв, для проведення аналізу використовували програми Statistica 6.0 та Microsoft Office Excel.
Результати та обговорення
Результати досліджень показали, що найвищий рівень сечової кислоти в сироватці крові був у жінок у постменопаузальному періоді із найвищим індексом маси тіла (ІМТ > 35 ум.од.), тобто з найбільшим ступенем ожиріння. Так, у І групі даний показник становив 277,52 ± 8,40 мкмоль/л; у II групі — 286,81 ± 7,79 мкмоль/л; у III — 291,81 ± 7,56 мкмоль/л; у IV — 327,17 ± 12,17 мкмоль/л. Частка пацієнтів із гіперурикемією серед жінок у постменопаузальному періоді становила у I групі 10,2 %; у II групі — 15,9 %; у III — 21,2 %; у IV — 34,2 %.
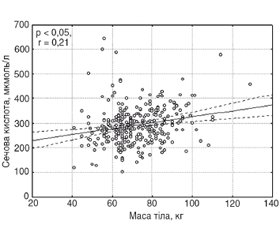
Установлена вірогідна залежність між рівнем сечової кислоти та масою тіла в жінок в постменопаузальному періоді (r = 0,21, p < 0,05) (рис. 1).
Було встановлено, що в жінок у постменопаузальному періоді існує вірогідна залежність між деякими показниками ліпідного обміну, зокрема ліпопротеїдами дуже низької щільності (ЛПДНЩ) (r = 0,40, p < 0,05), тригліцеридами (r = 0,26, p < 0,05) та коефіцієнтом атерогенності (r = 0,24, p < 0,05) (рис. 2–4).
Установлено, що частота остеопорозу була нижчою в групі пацієнток із гіперурикемією порівняно з особами з нормоурикемією. Так, у групі пацієнтів із гіперурикемією вона становила 19 %, а в пацієнтів із нормоурикемією — 34 % на рівні поперекового відділу хребта, 17 і 21 % — на рівні шийки стегнової кістки відповідно. Частота остеопенії в групі пацієнтів із гіперурикемією була 37 % на рівні поперекового відділу хребта та 49 % — на рівні шийки стегнової кістки, у пацієнтів з нормоурикемією — 30 та 53 % відповідно.
При розподілі рівня сечової кислоти в сироватці крові з використанням квартильного аналізу були виділені 4 групи пацієнтів (Q1 < 235 мкмоль/л; Q2 = 235–281 мкмоль/л; Q3 = 282–329 мкмоль/л; Q4 > 329 мкмоль/л). Установлено вірогідні відмінності показників МЩКТ шийки стегнової кістки та ультрадистального відділу кісток передпліччя між Q1 та Q4 групами (МЩКТ Q1 = 0,789 г/см2 й МЩКТ Q4 = 0,842 г/см2; МЩКТ Q1 = 0,711 г/см2 й МЩКТ Q4 = 0,773 г/см2, р < 0,05 відповідно) (рис. 5).
Результати квартильного аналізу також не виявили вірогідних відмінностей рівня сечової кислоти залежно від показника якості кісткової тканини між Q1 та Q4 групами (р > 0,05).
Таким чином, отримані результати вказують на те, що в пацієнтів із високим рівнем сечової кислоти частота остеопорозу нижча, а показники МЩКТ, зокрема на рівні шийки стегнової кістки та ультрадистального відділу кісток передпліччя, є вірогідно вищими в тих, хто має високі показники рівня сечової кислоти в сироватці крові.
Постменопаузальний вік у жінок можна віднести до одного з факторів ризику розвитку гіперурикемії. Установлено, що в жінок у постменопаузальному періоді існує вірогідна залежність між віком, масою тіла та деякими показниками ліпідного обміну. Тому можна рекомендувати визначення рівня сечової кислоти як обов’язковий метод обстеження для жінок віком понад 50 років із метою запобігання розвитку серцево-судинної патології, метаболічного синдрому та інших соматичних захворювань, до яких призводить тривала гіперурикемія. Установлений вірогідний зв’язок між рівнем сечової кислоти, індексом маси тіла, тригліцеридами, ЛПДНЩ, коефіцієнтом атерогенності.
На сьогодні вчені ведуть дискусії щодо ролі сечової кислоти в організмі людини. Високі її рівні — це ризик летальності від захворювань серцево-судинної системи. Проте зниження показників при застосуванні урикодепресивної терапії призведе до пригнічення її антиоксидантних властивостей, що може спровокувати не лише збільшення частки остеопорозу та остеопенії у світовій популяції, а й негативно впливати на діяльність центральної нервової системи і знижувати захисні властивості організму. Враховуючи те, що жінки з ожирінням мають високий рівень сечової кислоти в плазмі крові, необхідно рекомендувати знижувати масу тіла для профілактики розвитку гіперурикемії.
На сьогодні вивчення маркерів кісткового метаболізму та показників якості кісткової тканини в пацієнтів із гіперурикемією та подагрою є новим напрямком наукових досліджень, про що свідчать зарубіжні публікації, що повинно стимулювати українських науковців активно вивчати дану проблему в нашій країні для подальшої розробки тактики ведення таких пацієнтів з метою покращення якості життя української популяції. Так, в одному з досліджень, проведеному в Кореї з 2008 по 2010 рік, де були обстежені 7502 жінки у постменопаузальному періоді, досліджували стан мінеральної щільності кісткової тканини у здорових жінок з урахуванням показників сечової кислоти в сироватці крові. Середній вік обстежених становив 57,4 ± 6,8 року, а середній рівень сечової кислоти в сироватці крові — 4,5 мг/дл. Було встановлено, що існує позитивний кореляційний зв’язок між рівнем сечової кислоти та показниками МЩКТ поперекового відділу хребта, шийки стегнової кістки та вертлюга стегнової кістки (r = 0,11, p < 0,001; r = 0,10, p < 0,001; r = 0,12, p < 0,001; r = 0,13, p < 0,001 відповідно). Крім цього, у жінок із гіперурикемією було виявлено низькі показники маркерів резорбції кісткової тканини, що ще раз підтверджувало позитивний вплив сечової кислоти на метаболічні процеси в кістці.
Висновки
Найвищий рівень сечової кислоти в сироватці крові був у жінок у постменопаузальному періоді з найвищим індексом маси тіла (ІМТ > 35 ум.од.). У І групі даний показник становив 277,52 ± 8,40 мкмоль/л; у II групі — 286,81 ± 7,79 мкмоль/л; у III — 291,81 ± 7,56 мкмоль/л; у IV — 327,17 ± 12,17 мкмоль/л. Виявлено вірогідну залежність між рівнем сечової кислоти та масою тіла в жінок у постменопаузальному періоді (r = 0,21, p < 0,05).
У жінок у постменопаузальному періоді існує вірогідна залежність між деякими показниками ліпідного обміну, зокрема ліпопротеїдами дуже низької щільності (r = 0,40, p < 0,05), тригліцеридами (r = 0,26, p < 0,05) та коефіцієнтом атерогенності (r = 0,24, p < 0,05).
Частота остеопорозу в жінок із гіперурикемією нижча порівняно із жінками з нормоурикемією. У групі пацієнтів з гіперурикемією вона становила 19 %, а в пацієнтів із нормоурикемією — 34 % на рівні поперекового відділу хребта, 17 і 21 % — на рівні шийки стегнової кістки відповідно.
Мінеральна щільність кісткової тканини була вірогідно вищою в жінок із найвищими показниками рівня сечової кислоти: шийки стегнової кістки та ультрадистального відділу кісток передпліччя (p < 0,05). Результати квартильного аналізу не виявили вірогідних відмінностей рівня сечової кислоти залежно від показника якості кісткової тканини між Q1 та Q4 групами (р > 0,05).
Конфлікт інтересів та фінансова підтримка. Автори заявляють про відсутність конфлікту інтересів та фінансової підтримки при отриманні результатів та написанні даної статті.
Список литературы
1. Zhang W., Doherty M., Pascual E. et al. EULAR evidence based recommendation for gout. Ann. Rheum. Dis. 2006. 10. 1301-1311. DOI: 10.1136/ard.2006.05525.
2. Максудова А.Н., Саліхов І.Г., Хабіров Р.А. Подагра. 2008. 96.
3. Lai S.W., Tan C.K., Ng К.С. Epidemiology of hyperuricemia in the elderly. Yale J Biol. Med. 2001. 74(3). 151-157. PMID: 11501710.
4. Koga M., Saito H., Mukai M., Kasayama S.Y. Factors contributing to increased serum urate in postmenopausal Japanese females. Climacteric. 2009. 12(2). 146-152. DOI: 10.1080/13697130802607719.
5. Дзяк Г.В., Хомазюк Т.А. Подагра: «Капкан» метаболічних проблем: Наукове видання. 2010. 112. https://www.twirpx.com/file/907381.
6. Zhang M., Chang H., Gao Y. et al. Major dietary patterns and risk of asymptomatic hyperuricemia in Chinese adults. J. Nutr. Sci. Vitaminol. (Tokyo). 2012. 58(5). 339-345. DOI: 10.3177/jnsv.58.339.
7. Zoccali C., Mallamaci F. Uric acid, hypertension, and cardiovascular and renal complications. Curr. Hypertens. Rep. 2013. 15(6). 531-537. DOI: 10.1007/s11906-013-0391-y.
8. Ziaee A. Association between Uric Acid and Metabolic Syndrome in Qazvin Metabolic Diseases Study (QMDS), Iran Glob. J. Health Sci. 2012. 5(1). 155-165. DOI: 10.5539/gjhs.v5n1p155.
9. Zhang X. Value of three-dimensional speckle tracking echocardiography to assess left ventricular function in hyperuricemia patients. Clin. Rheumatol. 2018. 412-417. DOI: 10.1007/s10067-018-4132-0.
10. Yue J.R., Huang C.Q., Dong B.R. Association of serum uric acid with body mass index among long-lived Chinese. Exp. Gerontol. 2012. 47(8). 595-600. DOI: 10.1016/j.exger.2012.05.008.
11. Ahn S.H., Lee S.H., Kim B.J. et al. Higher serum uric acid is associated with higher bone mass, lower bone turnover, and lower prevalence of vertebral fracture in healthy postmenopausal women. Osteoporos. Int. 2013. 24(12). 2961-2970. DOI: 10.1007/s00198-013-2377-7.
12. Makovey J., Macara M., Chen J.S. et al. Serum uric acid plays a protective role for bone loss in peri- and postmenopausal women: a longitudinal study. Bone. 2013. 52(1). 400-406. DOI: 10.1016/j.bone.2012.10.025.

/69.jpg)
/70.jpg)