Журнал «Боль. Суставы. Позвоночник» Том 10, №2, 2020
Вернуться к номеру
Trabecular bone score and vertebral fracture assessment in portuguese premenopausal women with hyperthyroidism
Авторы: Ana Paula Gouveia dos Santos Barbosa(1), Mário Rui Guerreiro Mascarenhas(1), Manuel Diamantino Pires Bicho(2), António Manuel Gouveia de Oliveira(3)
(1) — University Clinic of Endocrinology, Environmental Health Institute, Lisbon University Medical School, Endocrinology, Diabetes and Metabolism Department, Santa Maria University Hospital, Lisbon, Portugal
(2) — Genetics Laboratory, Environmental Health Institute, Lisbon University Medical School, Lisbon, Portugal
(3) — Pharmacy Department, Health Sciencies Center, Federal University Rio Grande do Norte, Natal, Brazil
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
Гіпертиреоз є фактором ризику зниження мінеральної щільності кісткової тканини (МЩКТ) та виникнення остеопоротичних переломів. Оцінка вертебральних переломів (ОВП) допомагає діагностувати вертебральний перелом, а показник якості трабекулярної кісткової тканини (ТКТ) — оцінити кісткову мікроархітектуру. Ми поставили собі за мету оцінити вплив гіпертиреозу на МЩКТ, склад м’яких тканин тіла, частоту «мовчазних» (невиявлених) вертебральних переломів і ТКТ. 80 пременопаузальних португальських жінок були розподілені в групи пацієнтів з підтвердженим гіпертиреозом (n = 40) і контрольну групу (n = 40). МЩКТ (г/см2) поперекового відділу хребта, стегнової кістки, 33 % променевої кістки, усього скелета досліджували за допомогою двохенергетичної рентгенівської абсорбціометрії (ДРА) з урахуванням маси тіла (кг) пацієнтів. ОВП застосовувалась для діагностики переломів, що згодом класифікували за напівкількісним методом Женанта та підтверджували за допомогою рентгенографії. Показник ТКТ отримували за допомогою ДРА поперекового відділу хребта. Жоден пацієнт раніше не отримував лікування щодо гіпертиреозу, остеопорозу або зниженої кісткової маси (остеопенії). Отримані результати підтверджувалися статистичними підрахунками. У групі пацієнтів з гіпертиреозом середня МЩКТ (МЩКТ стегнової кістки, шийки стегнової кістки, усього скелета), загальна знежирена маса та ТКТ були вірогідно нижчими, ніж у контрольній групі; згідно з класифікацією Міжнародної асоціації клінічної денситометрії (ISCD), відзначалася тенденція до більшої частоти зниження МЩКТ; кількість вертебральних переломів також вірогідно зростала. Ці результати свідчать про те, що в групі пременопаузальних жінок з гіпертиреозом показники МЩКТ, знежиреної маси та ТКТ є вірогідно нижчими. Частота «мовчазних» вертебральних переломів є також вірогідно вищою.
Гипертиреоз является фактором риска снижения минеральной плотности костной ткани (МПКТ) и возникновения остеопоротических переломов. Оценка вертебральных переломов (ОВП) помогает диагностировать вертебральный перелом, а показатель качества трабекулярной костной ткани (ТКТ) — оценить костную микроархитектуру. Мы поставили себе цель оценить влияние гипертиреоза на МПКТ, состав мягких тканей тела, частоту «немых» (невыявленных) вертебральных переломов и ТКТ. 80 пременопаузальных португальских женщин были распределены в группу пациентов с подтвержденным гипертиреозом (n = 40) и контрольную группу (n = 40). МПКТ (г/см2) поясничного отдела позвоночника, бедренной кости, 33 % лучевой кости, всего скелета исследовали с помощью двухэнергетической рентгеновской абсорбциометрии (ДРА) с учетом массы тела (кг) пациентов. ОВП применялась для диагностики переломов, которые впоследствии классифицировали с применением полуколичественного метода Женанта и подтверждали с помощью рентгенографии. Показатель ТКТ получали с помощью ДРА поясничного отдела позвоночника. Ни один пациент ранее не получал лечения по поводу гипертиреоза, остеопороза или пониженной костной массы (остеопении). Полученные результаты подтверждались статистическими подсчетами. В группе пациентов с гипертиреозом средняя МПКТ (МПКТ бедренной кости, шейки бедренной кости, всего скелета), общая обезжиренная масса и ТКТ были достоверно ниже, чем в контрольной группе; согласно классификации Международной ассоциации клинической денситометрии (ISCD), отмечалась тенденция к большей частоте снижения МПКТ; количество вертебральных переломов также достоверно возрастало. Эти результаты свидетельствуют о том, что в группе пременопаузальных женщин с гипертиреозом показатели МПКТ, обезжиренной массы и ТКТ являются достоверно более низкими. Частота «немых» вертебральных переломов также достоверно выше.
Hyperthyroidism is a risk factor for reduced bone mineral density (BMD) and osteoporotic fractures. Vertebral fracture assessment (VFA) detects vertebral fractures and trabecular bone score (TBS) is an index of bone microarchitecture. We aimed to evaluate the effects of hyperthyroidism on BMD, soft body tissue composition, prevalence of silent vertebral fractures and TBS. Eighty Portuguese premenopausal women were divided and matched in overt hyperthyroidism (n = 40) and control (n = 40) groups. BMD (g/cm2) at lumbar spine, hip, radius 33 % and whole body and the total body masses (kg) were studied by DXA. VFA was used to detect fractures and those were classified by Genant’s semiquantitative method and confirmed by X-ray. TBS was obtained from lumbar spine DXA images. No patient had previously been treated for hyperthyroidism, osteoporosis or low bone mass. Adequate statistical tests were used. In the hyperthyroidism group, the mean BMD (total hip, femoral neck and whole body), the total lean mass and TBS were significantly lower; according to ISCD classification, there was a trend for a higher prevalence of low BMD; vertebral fractures were significantly higher. These results suggest that in a group of hyperthyroid premenopausal women there are significantly lower BMD, lean mass and TBS. The prevalence of silent vertebral fractures is also significantly higher.
показник якості трабекулярної кісткової тканини; остеопороз; гіпертиреоз; переломи; пременопаузальні жінки
показатель качества трабекулярной костной ткани; остеопороз; гипертиреоз; переломы; пременопаузальные женщины
TBS; osteoporosis; hyperthyroidism; vertebral fractures; premenopausal women
Introduction
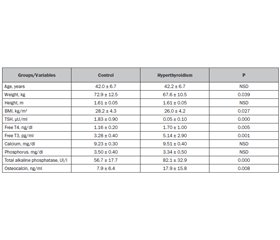
Materials and methods
Results
Discussion
Conclusions
1. Britto J.M., Fenton A.J., Holloway W.R., Nicholson G.C. Osteoblasts mediate thyroid hormone stimulation of osteoclastic bone resorption. Endocrinology. 1994. 134. 169-176.
2. Abe E., Marians R.C., Yu W. TSH is a negative regulator of skeletal remodeling. Cell. 2003. 115(2). 151-162.
3. Sun L., Zhu L.L., Lu P. Genetic confirmation for a central role for TNFα in the direct action of thyroid stimulating hormone on the skeleton. Proc. Natl. Acad. Sci USA. 2013. 110. 9891-9896.
4. Bassett J.H., O’Shea P.J., Sriskantharajah S. Thyroid hormone excess rather than thyrotropin deficiency induces osteoporosis in hyperthyroidism. Mol. Endocrinol. 2007. 21. 1095-1107.
5. Cummings S.R., Nevitt M.C., Browner W.S. Risk factors for hip fracture in white women. Study of Osteoporotic Fractures Research Group. N. Engl. J. Med. 1995. 332. 767-773.
6. Mudde A.H., Reijnders F.J.L., Nieuwenhuijzen A.C. Peripheral bone density in women with untreated multinodular goitre. Clin. Endocrinol. 1992. 37. 35-39.
7. Földes J., Tarján G., Szathmari M. Bone mineral density in patients with endogenous subclinical hyperthyroidism: Is this thyroid status a risk factor for osteoporosis? Clin. Endocrinol. 1993. 39. 521-527.
8. Mazziotti G., Porcelli T., Patelli I. Serum TSH values and risk of vertebral fractures in euthyroid post-menopausal women with low bone mineral density. Bone. 2010. 46(3). 747-751.
9. Baran D. Thyroid Hormone and the Skeleton. In: Marcus R., Feldman D. (eds.). Osteoporosis. 4th ed. Elsevier, Oxford. 2013. 1239-1247.
10. Barbosa A.P., Mascarenhas M.R., Silva C.F. Prevalence of silent vertebral fractures detected by vertebral fracture assessment in young Portuguese men with hyperthyroidism. Eur. J. Endocrinol. 2015. 172. 189-194.
11. Black D.M., Arden N.K., Palermo L. Prevalent Vertebral deformities predict hip fractures and new vertebral deformities but not wrist fractures. J. Bone Miner. Res. 1999. 14(5). 821-828.
12. Jager P., Jonkman S., Koolhaas W. Combined vertebral fracture assessment and bone mineral density measurement: a new standard in the diagnosis of osteoporosis in academic populations. Osteoporos Int. 2011. 22(4). 1059-1068.
13. Rea J.A., Chen M.B., Li J. Morphometric X-ray absorptiometry and morphometric radiography of the spine: a comparison of prevalent vertebral deformity identification. J. Bone Miner. Res. 2000. 15. 564-574.
14. Bousson V., Bergot C., Sutter B. Trabecular bone score (TBS): available knowledge, clinical relevance, and future prospects. Osteoporos Int. 2012. 23(5). 1489-1501.
15. Silva B.C., Leslie W.D., Resch H. Trabecular Bone Score: A Noninvasive Analytical Method Based Upon the DXA Image. J. Bone Miner. Res. 2014. 29(3). 518-530.
16. Schousboe J.T., Shepherd J.A., Bilezikian J.P. Executive Summary of the 2013 ISCD Position Development Conference on Bone Densitometry. J. Clin. Densitom. 2013. 16(4). 455-467.
17. McClosky E.V., Odén A., Harvey N.C. A Meta-Analysis of Trabecular Bone Score in Fracture Risk Prediction and its Relationship to FRAX. J. Bone Min. Res. 2016. 31(5). 940-948.
18. Medimaps Group. 2016 TBS Reference Curves.
19. Genant H.K., Wu C.Y., van Kuijk C. Vertebral fracture assessment using a semiquantitative technique. J. Bone Miner. Res. 1993. 8. 1137-1148.
20. Van den ven A.C., Erdtsieck R.J. Changes of bone mineral density, quantitative ultrasound parameters and markers of bone turnover during treatment of hyperthyroidism. The Netherlands J. Medicine. 2008. 66(10). 428-432.
21. Greenspan S.L., Greenspan F.S. The effect of thyroid hormone on skeletal integrity. Annals of Internal Medicine. 1999. 130(9). 750-758.
22. Langdahl B.L., Loft A.G., Eriksen E.F. Bone mass, bone turnover, calcium homeostasis, and body composition in surgically and radioiodine-treated former hyperthyroid patients. Thyroid. 1996. 6. 169-175.
23. Boonya-Ussadorn T., Punkaew B., Sriassawaamorn N. A comparative study of bone mineral density between premenopausal women with hyperthyroidism and healthy premenopausal women. J. Med. Associat. Thailand. 2010. 93(suppl. 6). S1-S5.
24. Svare A., Nilsen T.I., Bjøro T. Hyperthyroid levels of TSH correlate with low bone mineral density: the HUNT 2 study. Eur. J. Endocrinol. 2009. 161. 779-786.
25. Van der Deure W.M., Uitterlinden A.G., Hofman A. Effects of serum TSH and FT4 levels and the TSHR-Asp727Glu polymorphism on bone: the Rotterdam Study. Clin. Endocrinol. (Oxf.). 2008. 68. 175-181.
26. Vestergaard P., Mosekilde L. Hyperthyroidism, bone mineral and fracture risk — a meta-analysis. Thyroid. 2003. 13(6). 585-93.
27. Blum M., Bauer D., Collet T. Subclinical thyroid dysfunction and fracture risk a meta-analysis. JAMA. 2015. 313(20). 2055-65.
28. Lee J.S., Buzková P., Fink H.A. Subclinical thyroid dysfunction and incident hip fracture in older adults. Arch. Intern. Med. 2010. 170. 1876-1883.
29. Heijckmann A.C., Huijberts M.S.P., Geusens P. Hip bone mineral density, bone turnover and risk of fracture in patients on long-term suppressive L-thyroxine therapy for differentiated thyroid carcinoma. Eur. J. Endocrinol. 2005. 153. 23-29.
30. Turner M.R., Camacho X., Fischer H.D. Levothyroxine dose and risk of fractures in older adults: nested case-control study. British. Med. J. 2011. 342. 1-9.
31. Ock S.Y., Chung Y., Choi Y.J. Changes in bone mineral density and trabecular bone score in Graves’ disease patients after anti-thyroid therapy. Osteoporosis and Sarcopenia. 2016. 2. 175-179.
32. Kuzma M., Vanuga P., Binkley N. High serum fractalkine is associated with lower trabecular bone score in premenopausal women with Graves’s disease. Horm. Metab. Res. 2018. 50(8). 609-614.

/10.jpg)
/11.jpg)