Международный эндокринологический журнал Том 16, №6, 2020
Вернуться к номеру
Гормональні маркери раку передміхурової залози й лікування хворих
Авторы: Синяченко О.В.(1), Палій М.І.(2), Думанський Ю.В.(3), Єрмолаєва М.В.(1), Столярова О.Ю.(2)
(1) — Донецький національний медичний університет МОЗ України, м. Лиман, Україна
(2) — Національний інститут раку МОЗ України, м. Київ, Україна
(3) — Інститут експериментальної патології, онкології та радіобіології ім. Р.Є. Кавецького НАН України,
м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
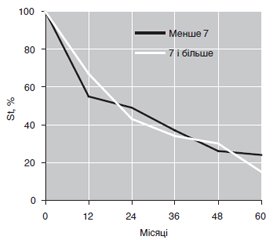
Актуальність. У структурі онкологічної патології у чоловіків рак передміхурової залози (РПЗ) посідає лідируючі позиції, при цьому є другою за частотою причиною смерті у випадках злоякісних новоутворень. Захворюваність і смертність від РПЗ, який належить до гормонозалежних пухлин, у всьому світі щорічно збільшуються. Серед біомаркерів пухлинного процесу при РПЗ обговорюються такі статеві й гонадотропні гормони, як тестостерон (TS) і лютеїнізуючий гормон (лютропін, LТ). Частково сказане стосується функціонального аналогу інсуліну — білкового інсуліноподібного фактора росту 1 (ISF). Мета дослідження: оцінити клініко-прогностичну значущість гормональних пухлинних маркерів (TS, LT, ISF) у крові хворих на РПЗ. Матеріали та методи. Під спостереженням перебували 195 чоловіків з РПЗ віком від 52 до 82 років. Критеріями виключення були хворі з патологічним процесом менше за другу стадію. Тривалість з моменту діагностики захворювання становила від 5 місяців до 17 років. Аденокарциному діагностовано у 94 % від числа обстежених хворих, метастази в лімфатичних вузлах виявлено в 39 % випадків, у віддалених органах — у 19 %, у скелеті — у 28 %. Рівні в сироватці крові TS і LT вивчали методом імунохімічного аналізу, а вміст ISF — імуноферментного аналізу. Результати. Збільшення рівня таких гормональних маркерів РПЗ, як TS і ISF, спостерігається в крові відповідно в 46 і 100 % від числа хворих, залежить від характеру перебігу пухлинного процесу і його метастазування. П’ятирічна виживаність хворих на РПЗ залежить від вихідного рівня критерію Глісона, методики проведеної променевої терапії та паралельного призначення антиандрогенної гормональної терапії. У процесі проведених лікувальних заходів вірогідно зменшується вміст у крові гормональних маркерів пухлинного процесу (TS, LT, ISF), що визначається початковим характером перебігу захворювання. Висновки. Вивчені гормональні біомаркери РПЗ беруть участь в патогенетичних побудовах захворювання і мають діагностичну та прогностичну значущість в процесі проведення лікувальних заходів.
Актуальность. В структуре онкологической патологии у мужчин рак предстательной железы (РПЖ) занимает лидирующие позиции, при этом является второй по частоте причиной смерти в случаях злокачественных новообразований. Заболеваемость и смертность от РПЖ, который относится к гормонозависимым опухолям, во всем мире ежегодно увеличиваются. Среди биомаркеров опухолевого процесса при РПЖ обсуждаются такие половые и гонадотропные гормоны, как тестостерон (TS) и лютеинизирующий гормон (лютропин, LТ). Отчасти сказанное касается функционального аналога инсулина — белкового инсулиноподобного фактора роста 1 (ISF). Цель исследования: оценить клинико-прогностическую значимость гормональных опухолевых маркеров (TS, LT, ISF) в крови больных РПЖ. Материалы и методы. Под наблюдением находились 195 мужчин с РПЖ в возрасте от 52 до 82 лет. Критериями исключения были больные с патологическим процессом менее второй стадии. Продолжительность с момента диагностики заболевания составила от 5 месяцев до 17 лет. Аденокарцинома диагностирована у 94 % от числа обследованных больных, метастазы в лимфатических узлах выявлены в 39 % случаев, в отдаленных органах — в 19 %, в скелете — в 28 %. Уровни в сыворотке крови TS и LT изучали методом иммунохимического анализа, а содержание ISF — иммуноферментного анализа. Результаты. Повышение уровня таких гормональных маркеров РПЖ, как TS и ISF, наблюдается в крови соответственно у 46 и 100 % от числа больных, зависит от характера течения опухолевого процесса и его метастазирования. Пятилетняя выживаемость больных РПЖ зависит от исходного уровня критерия Глисона, методики проводимой лучевой терапии и параллельного назначения антиандрогенной гормональной терапии. В процессе проведенных лечебных мероприятий достоверно уменьшается содержание в крови гормональных маркеров опухолевого процесса (TS, LT, ISF), что определяется исходным характером течения заболевания. Выводы. Изученные гормональные биомаркеры РПЖ участвуют в патогенетических построениях заболевания и обладают диагностической и прогностической значимостью в процессе проведения лечебных мероприятий.
Background. In the structure of oncological pathology in men, prostate cancer occupies a leading position, while being the second most frequent cause of death in cases of malignant neoplasms. The incidence and mortality of prostate cancer, which is a hormone-dependent tumor, increase every year around the world. Among the biomarkers of the tumor process in prostate cancer, such sex and gonadotropic hormones as testosterone (TS) and luteinizing hormone (lutropin, LT) are discussed. Partially, this concerns a functional analogue of insulin — insulin-like growth factor 1 (IGF). The purpose of the study was to assess the clinical and prognostic significance of hormonal tumor markers (TS, LT, IGF) in the blood of patients with prostate cancer. Materials and methods. The study included 195 men with prostate cancer aged 52 to 82 years. The exclusion criteria were patients with less than stage II of the pathological process. The duration since the diagnosis of the disease ranged from 5 months to 17 years. Adenocarcinoma was diagnosed in 94 % of the examined patients, metastases in the lymph nodes were found in 39 %, in distant organs — in 19 %, in the skeleton — in 28 % of cases. Serum levels of TS and LT were studied by immunochemical analysis, and the content of IGF — by enzyme immunoassay. Results. An increase in the level of hormonal markers of prostate cancer, such as TS and IGF, is observed in the blood of 46 and 100 % of individuals, respectively, depending on the nature of the tumor process and its metastasis. The five-year survival rate of patients with prostate cancer depends on the initial Gleason criterion, the method of radiation therapy and the concurrent administration of anti-androgen hormone therapy. In the course of the treatment measures, the content of hormonal markers of the tumor process (TS, LT, IGF) in the blood significantly decreases, which is determined by the initial nature of the course of the disease. Conclusions. Studied hormonal biomarkers of prostate cancer are involved in the pathogenetic constructions of the disease and have diagnostic and prognostic significance in the course of treatment.
рак; передміхурова залоза; біомаркери; гормони
рак; предстательная железа; биомаркеры; гормоны
cancer; prostate; biomarkers; hormones
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Gesmundo I., Di Blasio L., Banfi D., Villanova T., Fanciulli A., Favaro E. et al. Proton pump inhibitors promote the growth of androgen-sensitive prostate cancer cells through ErbB2, ERK1/2, PI3K/Akt, GSK-3β signaling and inhibition of cellular prostatic acid phosphatase. Cancer Lett. 2019. 449(1). 252-62. doi: 10.1016/j.canlet.2019.02.028.
- Ouellette V., Côté M.F., Gaudreault R.C., Tajmir-Riahi H.A., Bérubé G. Second-generation testosterone-platinum(II) hybrids for site-specific treatment of androgen receptor positive prostate cancer: Design, synthesis and antiproliferative activity. Eur. J. Med. Chem. 2019. 29(179). 660-6. doi: 10.1016/j.ejmech.2019.06.090.
- Cheaito K.A., Bahmad H.F., Hadadeh O., Saleh E., Dagher C., Hammoud M.S. et al. emt markers in locally-advanced prostate cancer: predicting recurrence? Front. Oncol. 2019. 11(9). 131. doi: 10.3389/fonc.2019.00131.
- Lang R., Rolny V., Leinenbach A., Karl J., Swiatek-de Lange M., Kobold U. et al. Investigation on core-fucosylated prostate-specific antigen as a refined biomarker for differentiation of benign prostate hyperplasia and prostate cancer of different aggressiveness. Tumour Biol. 2020. 41(3). 27223. doi: 10.1177/ 1010428319827223.
- Xu W., Qian J., Zeng F., Li S., Guo W., Chen L. et al. Protein kinase Ds promote tumor angiogenesis through mast cell recruitment and expression of angiogenic factors in prostate cancer microenvironment. J. Exp. Clin. Cancer Res. 2019. 38(1). 114-9. doi: 10.1186/s13046-019-1118-y.
- Zhao J.G., Nie L., Chen X.Q., Chen N., Zeng H. The subgroup analysis of the prognostic value of the intraductal carcinoma of the prostate in patients with metastatic prostate cancer. Zhonghua Wai Ke Za Zhi. 2019. 57(6). 422-7. doi: 10.3760/cma.j.issn.0529-5815.2019.06.006.
- Cheung A.S., Gray H.A., Schache A.G., Hoermann R., Bicknell J., Joon D.L. et al. Biomechanical leg muscle function during stair ambulation in men receiving androgen deprivation therapy. J. Gerontol. A Biol. Sci. Med. Sci. 2019. 16(7). 169. doi: 10.1093/gerona/glz169.
- Morote J., Comas I. Serum testosterone level is a useful biomarker for determining the optimal treatment for castration-resistant prostate cancer. Urol. Oncol. 2019. 22(6). 30202-9. doi: 10.1016/j.urolonc.2019.05.016.
- Wang W., Chen Z.X., Guo D.Y., Tao Y.X. Regulation of prostate cancer by hormone-responsive G protein-coupled receptors. Pharmacol. Ther. 2018. 191(11). 135-47. doi: 10.1016/j.pharmthera.2018.06.005.
- Pak S., Park S.Y., Shin T.J., You D., Jeong I.G., Hong J.H. et al. Association of muscle mass with survival after radical prostatectomy in patients with prostate cancer. J. Urol. 2019. 27(3). 00249. doi: 10.1097/JU.0000000000000249.
- Bedolla R.G., Shah D.P., Huang S.B., Reddick R.L., Ghosh R., Kumar A.P. Receptor tyrosine kinase recepteur d’origine nantais as predictive marker for aggressive prostate cancer in African Americans. Mol. Carcinog. 2019. 11(3). 23002. doi: 10.1002/mc.23002.
- Morote J., Comas I., Planas J., Maldonado X., Celma A., Placer J. et al. Serum testosterone levels in prostate cancer patients undergoing luteinizing hormone-releasing hormone agonist therapy. Clin. Genitourin. Cancer. 2018. 16(2). 491-6. doi: 10.1016/j.clgc.2017.10.025.
- Shim M., Bang W.J., Oh C.Y., Lee Y.S., Cho J.S. Effectiveness of three different luteinizing hormone-releasing hormone agonists in the chemical castration of patients with prostate cancer: Goserelin versus triptorelin versus leuprolide. Investig. Clin. Urol. 2019. 60(4). 244-50. doi: 10.4111/icu.2019.60.4.244.
- Cordero J.A., Sancho G., Bonfill X. Population-based estimate of the use of intermittent androgen deprivation therapy in prostate cancer patients in Catalonia, Spain. Pharmacoepidemiol. Drug Saf. 2019. 6(3). 4744. doi: 10.1002/pds.4744.
- Shevach J., Chaudhuri P., Morgans A.K. Adjuvant therapy in high-risk prostate cancer. Clin. Adv. Hematol. Oncol. 2019. 17(1). 45-53. PMID: 30843898.
- Shimodaira K., Shimodaira K., Nakashima J., Nakagami Y., Hirasawa Y., Hashimoto T. et al. Prognostic value of platelet counts in patients with metastatic prostate cancer treated with endocrine therapy. Urol. J. 2019. 18(3). 4735. doi: 10.22037/uj.v0i0.4735.
- Farhood B., Mortezaee K., Haghi-Aminjan H., Khanlarkhani N., Salehi E., Nashtaei M.S. et al. A systematic review of radiation-induced testicular toxicities following radiotherapy for prostate cancer. J. Cell. Physiol. 2019. 10(2). 28283. doi: 10.1002/jcp.28283.
- Porcaro A.B., Tafuri A., Sebben M., Pirozzi M., Processali T., Rizzetto R. et al. Positive association between basal total testosterone circulating levels and tumor grade groups at the time of diagnosis of prostate cancer. Urol. Int. 2019. 4(6). 1-8. doi: 10.1159/000500960.
- Kardoust Parizi M., Abufaraj M., Fajkovic H., Kimura S., Iwata T., D’Andrea D. et al. Oncological safety of testosterone replacement therapy in prostate cancer survivors after definitive local therapy: A systematic literature review and meta-analysis. Urol. Oncol. 2019. 8(7). 30236. doi: 10.1016/j.urolonc.2019.06.007.
- Vallat A., Pillot P., Lebâcle C., Irani J. Prognostic value of testosterone during androgene deprivation therapy. Prog. Urol. 2019. 13(7). 30153-8. doi: 10.1016/j.purol.2019.06.002.
- Yan Y., Chen Z., Xiao Y., Wang X., Qian K. Long non-coding RNA SNHG6 is upregulated in prostate cancer and predicts poor prognosis. Mol. Biol. Rep. 2019. 25(3). 04723-9. doi: 10.1007/s11033-019-04723-9.

/63.jpg)
/64.jpg)