Международный эндокринологический журнал Том 16, №6, 2020
Вернуться к номеру
Порушення вуглеводного обміну у хворих на неалкогольний стеатогепатит, ожиріння та хронічне обструктивне захворювання легень
Авторы: Хухліна О.С., Гринюк О.Є., Антонів А.А., Каушанська О.В.
Вищий державний навчальний заклад України «Буковинський державний медичний університет»,
м. Чернівці, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
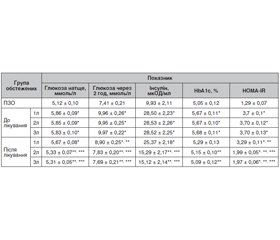
Актуальність. Істотне зростання захворюваності на неалкогольний стеатогепатит (НАСГ) у хворих на ожиріння та хронічне обструктивне захворювання легень (ХОЗЛ) у світі зумовлює потребу в проведенні досліджень механізмів їх взаємообтяження та корекції метаболічних складових патогенезу й наслідків коморбідності. Мета дослідження: визначення стану показників глікемії, регуляції вуглеводного обміну й встановлення ефективності застосування антралю та комбінації антралю із поліконазолом щодо впливу на стан глікемії, ступінь інсулінорезистентності у хворих на неалкогольний стеатогепатит на тлі ожиріння за коморбідності з хронічним обструктивним захворюванням легень. Матеріали та методи. 160 хворих розподілені на 3 групи. Перша група — 35 хворих на НАСГ із ожирінням І ст., 90 хворих на НАСГ із ожирінням І ст. та ХОЗЛ 2–3 D — друга група та 35 хворих на ХОЗЛ 2–3 D — третя група. Залежно від проведеного лікування друга група хворих була розподілена на 3 підгрупи, з яких 25 хворих (1л підгрупа — контрольна) отримували терапію НАСГ (eсенціальні фосфоліпіди 300 мг по 2 капсули тричі на день 60 днів) та базисну терапію ХОЗЛ. Друга підгрупа (основна, 2л) — 35 хворих, крім аналогічної базисної терапії ХОЗЛ для лікування НАСГ як гепатопротектор отримували антраль 200 мг тричі на день 60 днів. Третя підгрупа (основна, 3л) — 30 хворих, крім аналогічної базисної терапії ХОЗЛ для лікування НАСГ отримували антраль 200 мг тричі на день та, додатково, поліконазол 20 мг після вечері упродовж 60 днів. Групу порівняння становили 30 практично здорових осіб. Результати. У хворих першої та другої груп до лікування встановлено незначне вірогідне підвищення рівня глікемії натще відповідно на 10,9 та 14,3 % (р < 0,05), вмісту в крові постпрандіальної глюкози — на 18,6 та 34,4 % (р < 0,05), у той час як у хворих третьої групи зміни показників були невірогідні. Після лікування у хворих 2л та 3л підгруп зниження глікемії натще становило 8,9 % (р < 0,05), у той час у 1л підгрупі виявлено незначне її зниження — 3,4 % (р > 0,05). Вміст постпрандіальної глюкози в крові у хворих усіх груп знизився, відповідно у 1л, 2л та 3л підгрупах на 10,6, 21,3 та 21,9 %, порівняно з даними до лікування (р < 0,05). Максимальне зниження вмісту в крові інсуліну (у 1,9 раза) та ступеня інсулінорезистентності (на 46,8 %) також спостерігалось у 3л підгрупі (р < 0,05). Висновки. Призначення антралю впродовж 60 днів призвело до вірогідної корекції глікемії у хворих на НАСГ із ожирінням та ХОЗЛ, що супроводжувалось вірогідним зниженням рівня інсуліну (р < 0,05), вмісту постпрандіальної глюкози та ступеня інсулінорезистентності (р < 0,05).
Актуальность. Существенный рост заболеваемости неалкогольным стеатогепатитом (НАСГ) у больных с ожирением и хронической обструктивной болезнью легких (ХОБЛ) в мире обусловливает потребность в проведении исследований механизмов их взаимного утяжеления и коррекции метаболических составляющих патогенеза и последствий коморбидности. Цель исследования: определение состояния показателей гликемии, регуляции углеводного обмена и установление эффективности применения антраля и комбинации антраля с поликоназолом относительно влияния на состояние гликемии, степень инсулинорезистентности у больных с неалкогольным стеатогепатитом на фоне ожирения при коморбидности с хроническим обструктивным заболеванием легких. Материалы и методы. 160 больных разделены на 3 группы. Первая группа — 35 больных НАСГ с ожирением I ст., 90 больных НАСГ с ожирением I ст. и ХОБЛ 2–3 D — вторая группа и 35 больных ХОБЛ 2–3 D — третья группа. В зависимости от проводимого лечения вторую группу больных разделили на 3 подгруппы, из которых 25 больных (1л подгруппа — контрольная) получали терапию НАСГ (эссенциальные фосфолипиды 300 мг по 2 капсулы 3 раза в день 60 дней) и базисную терапию ХОБЛ. Вторая подгруппа (основная, 2л) — 35 больных, кроме аналогичной базисной терапии ХОБЛ для лечения НАСГ в качестве гепатопротектора получали антраль 200 мг 3 раза в день 60 дней. Третья подгруппа (основная, 3л) — 30 больных, кроме аналогичной базисной терапии ХОБЛ для лечения НАСГ получали антраль 200 мг 3 раза в день и, дополнительно, поликоназол 20 мг после ужина в течение 60 дней. Группу сравнения составили 30 практически здоровых людей. Результаты. У больных первой и второй групп до лечения установлено незначительное достоверное повышение уровня гликемии натощак соответственно на 10,9 и 14,3 % (р < 0,05), содержание в крови постпрандиальной глюкозы — на 18,6 и 34,4 % (р < 0,05), в то время как у больных третьей группы изменения показателей были недостоверные. После лечения у больных 2л и 3л подгрупп снижение гликемии натощак составило 8,9 % (р < 0,05), в то время в 1л подгруппе выявлено незначительное ее снижение — 3,4 % (р > 0,05). Содержание постпрандиальной глюкозы в крови у больных всех групп снизилось, соответственно в 1л, 2л и 3л подгруппах на 10,6, 21,3 и 21,9 %, по сравнению с данными до лечения (р < 0,05). Максимальное снижение содержания в крови инсулина (в 1,9 раза) и степени инсулинорезистентности (на 46,8 %) также наблюдалось в 3л подгруппе (р < 0,05). Выводы. Назначение антраля в течение 60 дней привело к достоверной коррекции гликемии у больных НАСГ с ожирением и ХОБЛ, сопровождалось достоверным снижением уровня инсулина (р < 0,05), содержания постпрандиальной глюкозы и степени инсулинорезистентности (р < 0,05).
Background. A significant increase in the incidence of non-alcoholic steatohepatitis (NASH) in obese patients with chronic obstructive pulmonary disease (COPD) in the world requires the study of the mechanisms of their mutual aggravation, and correction of the metabolic components of pathogenesis and the consequences of concomitant pathology. The purpose was determination of the state of glycemic parameters, regulation of carbohydrate metabolism and evaluation of the effectiveness of antral and the combination of antral with policosanol use in terms of the effect on the state of glycemia, the degree of insulin resistance in patients with non-alcoholic steatohepatitis against the background of obesity combined with chronic obstructive pulmonary disease. Materials and methods. One hundred and sixty patients were screened and divided into 3 groups. Group I consisted of 35 people with NASH against the background of degree I obesity. Group II includes 90 patients with NASH, degree I obesity and COPD 2–3 D, group III — 35 individuals with COPD 2–3 D. According to the treatment received, group II of patients was divided into 3 subgroups, of which 25 people (subgroup 1t — control one) received NASH therapy (essential phospholipids 300 mg 2 capsules 3 times daily for 60 days) and baseline COPD therapy. Subgroup II (primary, 2t) — 35 patients, in addition to similar COPD therapy, for the treatment of NASH, instead of essential phospholipids, they received antral 200 mg 3 times a day for 60 days. Subgroup III (primary, 3t) — 30 patients, in addition to similar COPD therapy, for the treatment of NASH they received antral 200 mg 3 times daily and, additionally, policosanol 20 mg after the dinner for 60 days. Comparison group consisted of 30 apparently healthy individuals. Results. Before treatment, a slight insignificant increase in the level of fasting glycemia by 10.9 and 14.3 %, respectively (p < 0.05), was established in patients of groups I and II, in the content of postprandial glucose in the blood — by 18.6 and 34.4 % (p < 0.05), while in the patients of group 3, the changes in indicators were insignificant. After treatment, in patients from the subgroups 2t and 3t, a decrease in fasting glucose was 8.9 % (p < 0.05), while in the subgroup 1t, its slight decrease was revealed — 3.4 % (p > 0.05). The content of postprandial blood glucose in patients of all groups decreased, respectively, in the subgroups 1t, 2t and 3t — by 10.6, 21.3 and 21.9 % compared to the data before treatment (p < 0.05). The maximum decrease in the blood insulin content (by 1.9 times) and the degree of insulin resistance (by 46.8 %) was also observed in the subgroup 3t (p < 0.05). Conclusions. The administration of antral for 60 days led to a significant correction of glycemia in NASH patients with obesity and COPD that was accompanied by a significant decrease in insulin levels (p < 0.05), postprandial glucose content and the insulin resistance degree (p < 0.05).
неалкогольний стеатогепатит; хронічне обструктивне захворювання легень; ожиріння; антраль; поліконазол
неалкогольный стеатогепатит; хроническое обструктивное заболевание легких, ожирение; антраль; поликоназол
non-alcoholic steatohepatitis; chronic obstructive pulmonary disease; obesity; antral; policosanol
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Anokhina A.A. Non-alcoholic fatty liver disease as a multisystem metabolic disease: features of prevention and treatment. Hepatology. 2018. 7(3). 35-40 (in Ukrainian).
- Bril F., Bril К. Cusi Management of Nonalcoholic Fatty Liver Disease in Patients With Type 2 Diabetes: A Call to Action. Diabetes Care. 2017. 40(3). 419-430. Doi: 10.2337/dc16-1787.
- Stepanov Yu.M., Nedzvetska N.V., Yahmur V.B. Noninvasive diagnosis of liver fibrosis in patients with nonalcoholic fatty liver disease. Hastroenterolohiia. 2017. 51(3). 188-95. DOI: 10.22141/2308-2097.51.3.2017.112635.
- Khukhlina O.S., Antoniv A.A., Mandryk O.Y., Smandych V.S., Matushchak M.R. The role of endothelial dysfunction in the progression mechanisms of non-alcoholic steatohepatitis in patients with obesity and chronic kidney disease. Wiad. Lek. 2019. 72(4). 523-526. PMID: 31055525.
- European Association for the Study of the Liver et al. EASL-EASD-EASO Clinical Practice Guidelines for the Management of Non-Alcoholic Fatty Liver Disease. Obes. Facts. 2016. 9. 65-90. DOI: 10.1159/000443344.
- Lonardo A., Mantovani A., Lugari S., Targher G. Epidemiology and pathophysiology of the association between NAFLD and metabolically healthy or metabolically unhealthy obesity. Annals of Hepatology. 2020. 19(4). 359-366. Doi: 10.1016/j.aohep.2020.03.001.
- Angulo P., Kleiner D.E., Dam-Larsen S. et al. Liver Fibrosis, but No Other Histologic Features, Is Associated With Long-term Outcomes of Patients With Nonalcoholic Fatty Liver Disease. Gastroenterology. 2015. 149(2). 389-97. Е10. doi: 10.1053/j.gastro.2015.04.043.
- Lonardo A., Sookoian S., Pirola C.J., Targher G. Non-alcoholic fatty liver disease and risk of cardiovascular disease. Metabolism. 2016. 65. 1136-1150. Doi: 10.1016/j.metabol.2015.09.017.
- Targher G., Byrne C.D., Lonardo A., Zoppini G., Barbui C. Non-alcoholic fatty liver disease and risk of incident cardiovascular disease: A meta-analysis. J. Hepatol. 2016. 65. 589-600. Doi: 10.1016/j.jhep.2016.05.013.
- Lonardo A., Nascimbeni F., de Leon M.P. Nonalcoholic fatty liver disease and COPD: is it time to cross the diaphragm? European Respiratory Journal. 2017. 49. 1700546. doi: 10.1183/13993003.00546-2017.
- Italian Association for the Study of the Liver. AISF position paper on nonalcoholic fatty liver disease (NAFLD): updates and future directions. Dig. Liver Dis. 2017. 49. 471-483. Doi: 10.1016/j.dld.2017.01.147.
- Friedman S.L., Neuschwander-Tetri B.A., Rinella M., Sanya A.J. Mechanisms of NAFLD development and therapeutic strategie. Nature Medicine. 2018. 24. 908-922. Doi: 10.1038/s41591-018-0104-9.
- Viglino D., Jullian-Desayes I., Minoves M. et al. Nonalcoholic fatty liver disease in chronic obstructive pulmonary disease. Eur. Respir. J. 2017. 49. 1601923. Doi: 10.1183/13993003.01923-2016.
- Sadikova S.I., Tagaeva M.H., Dzhalilova S.H., Rustamova M.T. Chronic liver disease of viral etiology — therapy with modern principles Antral. Ilmij-Amalij Tibbijot Zhurnali. 2015. 2. 85-88.
- Kuzminov B.P., Matysik S.I., Zazuliak T.S., Mykytchak T.I. Assessment of acute toxicity of hepatoprotector antral on alternative test systems. Environment and health. 2016. 2. 43-46.
- Younossi Z.M. The economic and clinical burden of nonalcoholic fatty liver disease in the United States and Europe. Hepatology. 2016. 64. 1577-1586. Doi: 10.1002/hep.28785.
- Fadieienko H.D., Kushnir I.E., Chernova V.M., Solomentseva T.A., Nikiforova Ya.V., Kurinna O.H., Pietienova L.L. Nutrigenetic characteristics of patients with non-alcoholic fatty disease liver against the background of metabolic syndrome. Modern Gastroenterology. 2018. 6(104). 7-13. DOI: http://doi.org/10.3978/MG-2018-6-7.
- Younossi Z.M., Koenig A.B., Abdelatif D., Fazel Y., Henry L., Wymer M. Global epidemiology of nonalcoholic fatty liver disease. Meta-analytic assessment of prevalence, incidence, and outcomes. Hepatology. 2016. 64(1). 73-84. DOI: 10.1002/hep.28431.
- Singh S., Khera R., Allen A.M., Murad M.H., Loomba R. Comparative effectiveness of pharmacological interventions for nonalcoholic steatohepatitis: A systematic review and network meta-analysis. Hepatology. 2015. 62. 1417-1432. doi: 10.1002/hep.27999.

/69.jpg)
/70.jpg)