Вступ
Останніми десятиліттями активно вивчають особливості якості життя хворих при багатьох захворюваннях. Особливе значення має оцінка якості життя при хронічних захворюваннях, які невпинно прогресують і призводять до обмеження усіх складових нормальної життєдіяльності особистості. Не виняток анкілозивний спондиліт (АС), що є другим за поширеністю запальним ревматичним захворюванням, яке характеризується переважним ураженням хребта та крижово-клубових суглобів. Біль, загальна скутість, втома є основними симптомами у хворих на АС, які разом із притаманним для цього захворювання запальним компонентом ведуть до значних функціональних обмежень, поступової втрати рухливості хребта та погіршення якості життя. Відомо, що вже в перші 5 років захворювання значне обмеження рухливості мають приблизно 20 % хворих на АС, при тривалості захворювання понад 10 років — 40 % хворих, а при ураженні периферичних суглобів — 55 % пацієнтів [1]. За даними літератури, у хворих на АС порівняно із загальною популяцією спостерігається значно нижчий загальний показник якості життя, і ще нижчим він є в осіб із супутньою коморбідною патологією [2, 3]. Зокрема, за даними С. Шевчук та співавт. (2020), якість життя, оцінена за опитувальниками SF-36 та HAQ, була вірогідно нижчою у хворих на АС з анемічним синдромом, ніж в осіб без анемії [4]. За даними N. Rencber та співавт. (2019), якість життя, оцінена за шкалою ASQoL, була статистично гіршою у хворих на АС із супутньою фіброміалгією [5]. Цікавими та актуальними є дані, які вказують на те, що прогностичними факторами низької якості життя (оціненими за опитувальником ASQoL) у хворих на АС є постійний прийом нестероїдних протизапальних засобів [6]. Тобто, з одного боку, основне захворювання призводить до порушень якості життя пацієнтів, а з іншого — супутня медикаментозна терапія також негативно позначається на якості життя пацієнта. Хворим на АС притаманні системна втрата кісткової тканини, що проявляється розвитком остеопорозу та його ускладнень, деформацій тіл хребців, які теж ведуть до погіршення всіх складових якості життя [7, 8]. У багатьох дослідженнях доведено, що вертебральні та невертебральні переломи значно погіршують якість життя, обмежують фізичну та соціальну активність пацієнтів з остеопорозом [9]. Однак літературних відомостей щодо впливу супутнього остеопорозу на якість життя хворих на АС нами не виявлено. Також нами не знайдено відомостей про те, як впливають інші фактори ризику виникнення остеопорозу (вік, тривалість захворювання, дефіцит вітаміну D, прийом глюкокортикоїдів (ГК)) на фізичний і психічний компоненти здоров’я хворих. Тому метою дослідження було вивчити показники якості життя за допомогою опитувальників SF-36 та HAQ у хворих на АС чоловіків та оцінити їх зв’язок із перебігом захворювання та структурно-функціональним станом кісткової тканини.
Матеріали та методи
До клінічного дослідження були включені 105 чоловіків, хворих на АС, які перебували на стаціонарному лікуванні в ревматологічному відділенні Науково-дослідного інституту реабілітації осіб з інвалідністю Вінницького національного медичного університету ім. М.І. Пирогова. Дослідження було затверджене Комітетом біоетики університету. Діагноз АС встановлювали на основі критеріїв ASAS [10]. В основну групу були включені чоловіки, хворі на АС, середній вік яких становив 40,7 ± 0,8 року, при цьому 85,7 % хворих були віком до 50 років. Структурно-функціональний стан кісткової тканини визначали в пацієнтів вікової категорії молодше 50 років. Середня тривалість захворювання дорівнювала 8,7 ± 0,5 року. У переважної більшості пацієнтів (81 %) діагностували хронічний та повільнопрогресуючий перебіг АС, у 19 % — швидкопрогресуючий перебіг. До контрольної групи включені 25 практично здорові особи, репрезентативні за віком та статтю.
У всіх хворих оцінювали прийом глюкокортикоїдів, препаратів кальцію та вітаміну D. Для кожного хворого визначалася сумарна доза ГК, а також тривалість лікування даними препаратами. Усім пацієнтам проведене комплексне клініко-лабораторне обстеження. Клінічна активність АС визначалася відповідно до індексу BASDAI та індексу ASDAS-CРБ [11, 12].
Оцінку якості життя проводили за опитувальником Medical Outcomes Study Short Form (SF-36), який включає 36 питань, що складаються з 8 шкал: фізична працездатність (Physical Functioning — PF), вплив фізичного стану на повсякденну діяльність (Role-Physical Functioning — RP), інтенсивність болю (Bodily pain — BP), загальний стан здоров’я (General Health — GH), життєва активність (Vitality — VT), соціальне функціонування (Social Functioning — SF), рольове функціонування, зумовлене емоційним станом (Role-Emotional — RE), психічне здоров’я (Mental Health — MH). Загалом питання опитувальника формують два компоненти здоров’я: фізичний (Physical Health — PH) і психологічний (Mental Health — MH). Показники кожної шкали варіюють у межах 0–100, де 100 — повне здоров’я [13].
Для оцінки функціонального статусу та якості життя хворих на АС використаний опитувальник HAQ (The Health Assessment Questionnaire), який включає 20 питань, згрупованих у 8 субшкал, із 2–3 питаннями в кожній. На кожне питання про те, чи може пацієнт виконувати певні дії в повсякденному житті, відповіді кодуються від 0 до 3: 0 — без труднощів, 1 — із невеликими труднощами, 2 — із великими труднощами, 3 — не може виконати зовсім [14].
Біохімічні маркери синтезу кісткової тканини (остеокальцин та N-термінальний пропептид колагену I типу (PINP)) оцінювали імуноферментним методом із використанням наборів «N-MID Osteocalcin ELISA Kit» (Immunodiagnostic Systems, Великобританія) та «Human PINP (Procollagen I N-Terminal Propeptide) ELISA Kit» (Elabscience, США). Маркер резорбції кісткової тканини (N-кінцевий телопептид колагену І типу — NTx) визначали імуноферментним методом за набором «Human NTXI» (Elabscience, США, catalog №: E-EL-H0836, Lot: 31DCADXW39) відповідно до інструкції фірми-виробника. Рівень вітаміну D визначали за допомогою набору «25-ОН Vitamin D Total (Vit-D direct) Test System» (Monoblind Inc., США). Статус вітаміну D в організмі оцінювали як оптимальний (30–50 нг/мл), недостатній (20–30 нг/мл) та дефіцитний (вітамін D < 20 нг/мл).
Мінеральну щільність кісткової тканини (МЩКТ) поперекового відділу хребта та шийки стегна визначали методом двохенергетичної рентгенівської абсорбціоетрії приладом «Hologic Discovery Wi» (S/N 87227). Для чоловіків віком молодших за 50 років застосовувався Z-критерій, зниження якого ≤ –2,0 SD і більше вказувало на втрату кісткової маси.
Статистичний аналіз отриманих результатів проводили за загальноприйнятими методами варіаційної статистики з використанням пакета статистичної програми Microsoft Office Excel 2007, Statistica 6.1 та застосуванням параметричних і непараметричних методів. Визначали кількість спостережень (n), відносні величини (абс., %), середню арифметичну (М) та середню помилку середньої арифметичної (m). За умов правильного розподілу даних оцінку відмінностей показників між вибірками проводили за допомогою t-критерію Стьюдента, неправильного розподілу — за допомогою U-критерію Манна — Уїтні. Для визначення зв’язків між показниками проводили кореляційний аналіз Пірсона (r). Вірогідним вважався рівень статистичної значущості р < 0,05. Для порівняння вірогідності відмінностей між відносними величинами використовували точний метод Фішера.
Результати
Дане дослідження встановило, що у хворих на АС чоловіків показники якості життя вірогідно нижчі за всіма субшкалами опитувальника SF-36, ніж у групі контролю (табл. 1). Зокрема, за шкалами, що оцінюють фізичне здоров’я, найбільші відмінності між хворими на АС та групою контролю виявлені для показників рольового фізичного функціонування (RP: 14,0 ± 3,1 бала проти 99,0 ± 0,6 бала) та показників болю (Р: 37,2 ± 1,6 бала проти 100,0 ± 0,0 бала). Дещо менші відмінності були виявлені для показників загального здоров’я (GH: 40,5 ± 1,6 бала проти 97,5 ± 0,9 бала) та фізичного функціонування (PF: 57,4 ± 1,9 бала проти 100,0 ± 0,0 бала). За шкалами, що оцінюють психічне здоров’я, також отримані статистично значущі відмінності між групами, при цьому найбільші з них виявлені для показника рольового емоційного функціонування (RE: 22,2 ± 3,9 бала проти 98,2 ± 0,7 бала), а найменша різниця між групами виявлена для шкал соціального функціонування (SF: 54,3 ± 1,9 бала проти 95,8 ± 1,6 бала) та психічного здоров’я (МН: 56,0 ± 1,6 бала проти 96,6 ± 1,0 бала). У загальній когорті хворих з АС зниження фізичної складової здоров’я переважало над зниженням психічної складової здоров’я: сумарні показники РSH та MSH становили 37,3 ± 1,5 бала та 44,2 ± 1,7 бала відповідно.
/28.jpg)
Загальний показник індексу HAQ у хворих на АС дорівнював 0,9 ± 0,1 бала. За шкалами опитувальника HAQ у пацієнтів з АС помірний ступінь відхилення відзначався в категоріях «одягання», «вставання», «досягання» та «мобільність, активність», інші види діяльності («прийом їжі», «прогулянка», «гігієна», «стискання») меншою мірою відрізнялися від показників осіб контрольної групи.
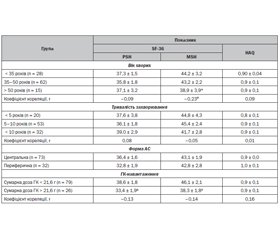
У дослідженні не виявлений асоціативний зв’язок між віком та фізичною складовою якості життя за –SF-36 (PSH) (табл. 2). Зокрема, найнижчий показник PSH (35,8 ± 1,8 бала) був виявлений у віковій групі 35–50 років, у групах пацієнтів віком до 35 та понад 50 років показник PSH практично не відрізнявся. Натомість психічна складова здоров’я (MSH) вірогідно знижувалась зі збільшенням віку хворих і була найнижчою у віковій групі понад 50 років (38,9 ± 3,9 бала). Не виявлений зв’язок між показниками якості життя та тривалістю захворювання. Водночас відмічена тенденція до зниження сумарного фізичного та психічного компонентів здоров’я при периферичній формі захворювання. Збільшення сумарної дози ГК негативно впливало на фізичну та психічну складову якості життя. Так, у групі хворих із високою сумарною дозою ГК показники PSH та MSH (33,4 ± 1,9 бала та 38,3 ± 1,8 бала) були в 1,2 раза нижчими, ніж в осіб із низькою сумарною дозою ГК (38,6 ± 1,8 бала та 46,1 ± 2,1 бала).
/29.jpg)
Проведений аналіз якості життя (SF-36) та HAQ з Z-показником МЩКТ також не виявив вірогідних відмінностей між групами. Відмічена лише тенденція до порушень фізичного компонента здоров’я в осіб з остеопорозом (табл. 3). Лише в групі хворих з остеопорозом показник загального здоров’я (GH) був в 1,2 раза нижчим (35,8 ± 2,1 бала), ніж у хворих із нормальними показниками МЩКТ (43,4 ± 2,7 бала). Сумарний фізичний та психічний компоненти теж мали тенденцію до зниження за умов низької МЩКТ. Водночас показники опитувальника HAQ вірогідно не відрізнялися між досліджуваними групами.
Водночас якість життя, оцінена за SF-36, асоціювалася з дефіцитом вітаміну D (табл. 4). Зокрема, середні значення сумарного фізичного (PSH) та психічного (МSH) компонентів у групі хворих із дефіцитом вітаміну D були на 9,7–17,3 % нижчими, ніж у групі хворих з оптимальним рівнем вітаміну D. Крім того, показник психічного здоров’я (МН) був вірогідно нижчим саме у хворих із дефіцитом вітаміну D. За опитувальником HAQ хворі з оптимальним рівнем вітаміну мали дещо кращі показники (0,8 ± 0,1 бала) функціонального статусу, ніж при недостатньому рівні вітаміну D (0,9 ± 0,1 бала).
/30.jpg)
У наступній частині дослідження ми оцінили зв’язок між маркерами метаболізму кісткової тканини та показниками якості життя хворих на АС (табл. 5). Виявлено, що при низькому рівні остеокальцину сумарний фізичний компонент здоров’я (PSH) та показник загального здоров’я (GH) були дещо нижчими, ніж при оптимальному рівні, а компоненти психічної складової мали тенденцію до зниження при низькому рівні даного маркера. Не виявлений також зв’язок показників якості життя з концентрацією маркера резорбції кісткової тканини (NTx). Зокрема, при оптимальному рівні NTx сумарний фізичний та психічний компоненти дорівнювали 35,2 ± 1,8 бала та 41,6 ± 2,4 бала, а при високому рівні — 39,5 ± 4,0 бала і 47,4 ± 4,5 бала відповідно. Функціональний статус за індексом HAQ також не мав зв’язку з біохімічними маркерами ремоделювання кісткової тканини.
Водночас показники якості життя тісно асоціювалися з високою активністю запального процесу (табл. 6). Зокрема, у групі хворих із високим ступенем активності захворювання (BASDAI > 4) середній показник –SF-36 (PSH) становив 34,3 ± 1,3 бала порівняно з 44,7 ± 3,6 бала у підгрупі хворих із низькою активністю (BASDAI < 4 балів), тобто сумарний фізичний компонент був нижчим на 23,2 %. Сумарний психічний компонент здоров’я (MSH) також вірогідно знижувався в групі з високим ступенем активності (BASDAI > 4 бали). Подібні закономірності спостерігалися і за індексом ASDAS, де показники якості життя (SF-36 — PSH та MSH) мали тенденцію до зниження в осіб із дуже високою активністю захворювання (ASDAS-СРБ > 3,5 бала). Низька функціональна спроможність, визначена за індексом BASFI, також асоціювалась із низькою якістю життя хворих. Так, у групі з низьким функціональним статусом (BASFI > 4 бали) середні значення PSH і MSH були на 10,7 та 14,3 % гіршими, ніж у групі зі збереженою функціональною здатністю (BASFI < 4 бали). За даними опитувальника HAQ, у групах із високою активністю захворювання та низькою функціональною спроможністю відзначали найвищі середні показники індексу.
Додатковим підтвердженням негативного впливу високої активності захворювання та низької функціональної здатності на якість життя хворих з АС був виявлений нами вірогідний кореляційний зв’язок між показниками PSH, MSH та HAQ з індексами BASDAI (r = –0,38; –0,30; 0,29), ASDAS (r = –0,20; –0,16; 0,27) та BASFI (r = –0,23; –0,27; 0,37 відповідно).
Обговорення
Результати нашого дослідження продемонстрували, що хворі на АС чоловіки мають гірший стан здоров’я порівняно з контрольною групою у всіх сферах життя, але особливо щодо шкал, що вимірюють фізичний компонент здоров’я. Так, сумарний фізичний компонент (37,3 ± 1,5 бала) був на 16 % гіршим, ніж сумарний психічний компонент (44,2 ± 1,7 бала). За шкалами, що оцінюють фізичне здоров’я, найгірші значення виявлені для показника інтенсивності болю (37,2 ± 1,6 бала) та рольового функціонування (14,0 ± 3,1 бала), зумовленого фізичним станом. За шкалами, що оцінюють психічне здоров’я, також отримані статистично значущі відмінності показників хворих з АС та контрольної групи, при цьому найгірші значення були виявлені для показника рольового функціонування, зумовленого емоційним станом (22,2 ± 3,9 бала). Наші висновки узгоджуються з результатами інших дослідників, які вказують на суттєве зниження якості життя хворих на АС, більшою мірою за рахунок фізичного компонента здоров’я, ніж психічного, хоча обидва вірогідно зменшуються порівняно із контрольною групою [15, 16]. У дослідженні J. Huang та співавт. (2017) сумарний фізичний компонент SF-36 був на 22,7 % нижчим, ніж сумарний психічний компонент (44,21 ± 20,79 проти 54,19 ± 20,47; р < 0,001) [17].
Наше дослідження не виявило впливу тривалості захворювання на якість життя хворих з АС. Усі субшкали опитувальника SF-36 не мали асоціативного зв’язку з тривалістю захворювання і за даними W. Hamdi та спів–авт. (2012) [18]. Однак, за даними H. Bodur та співавт. (2011), виявляли вірогідні кореляційні зв’язки між якістю життя (дані опитувальника ASQoL) та тривалістю AС [19].
Подібні закономірності встановлені і щодо ролі віку. Так, медіанний показник сумарного фізичного компонента (PSH) індексу SF-36 не відрізнявся в різних вікових групах і не корелював із віком. Натомість медіана показника сумарного психічного компонента (MSH) була вірогідно гіршою у віковій групі > 50 років. Що стосується літературних даних, то в дослідженні F. Salaffi та співавт. (2009) показники фізичного та психічного компонентів здоров’я були практично порівнянними в усіх вікових групах [20].
Ми показали, що в групі хворих із периферичною формою захворювання спостерігалась тенденція до зниження показників якості життя за даними SF-36 (PSH; MSH) та HAQ порівняно з показниками хворих з центральною формою АС. Подібні результати констатували G. Elolemy та співавт. (2020), які зазначили, що в пацієнтів із периферичною формою захворювання якість життя була гіршою, ніж в осіб із центральною формою АС, за рахунок фізичного компонента здоров’я [3]. Однак, згідно з даними W. Hamdi та спів–авт. (2012), таких закономірностей із формою захворювання знайдено не було [18].
Як відомо, тривале використання ГК веде до зниження показників МЩКТ та розвитку остеопорозу, що, у свою чергу, призводить до збільшення ризику переломів та погіршення якості життя. Згідно з результатами нашого дослідження, у хворих із високою сумарною дозою ГК (> 21,6 г) відмічалися вірогідно нижчі показники фізичного та психічного компонентів здоров’я, ніж у хворих із низькою сумарною дозою ГК (< 21,6 г). Нами не знайдені відомості щодо змін показників якості життя залежно від сумарної дози ГК у хворих на АC.
Зниження МЩКТ практично не позначалося на якості життя хворих з АС. Так, при остеопорозі вірогідно гірші показники якості життя були саме за рахунок фізичної складової здоров’я. Однак при порівнянні показників фізичної та психічної складової залежно від рівнів маркерів синтезу (остеокальцину) та резорбції кісткової тканини (NTx) істотних вірогідних відмінностей не виявлено. Нами не знайдені наукові публікації щодо оцінки якості життя залежно від змін МЩКТ у хворих на АС. Проте в одному з досліджень у китайській популяції хворих на АС особи з вираженим кіфозом мали значно гірший показник фізичного здоров’я порівняно з пацієнтами з кіфозом меншого ступеня [17]. Не виявлено суттєвого зв’язку між рентгенологічними змінами чи наявністю синдесмофітів у хребті з показниками якості життя за SF-36 у дослідженні L. Law та співавт. [16].
Як відомо, вітамін D відіграє важливу роль у патофізіології психологічних порушень, оскільки бере участь у численних нейрофізіологічних процесах, які відбуваються в головному мозку, зокрема нейромодуляції та нейропротекції. Крім того, рецептори вітаміну D присутні на нейронах різних ділянок головного мозку, включаючи цингулярну кору та гіпокамп, які, у свою чергу, залучені до патофізіології психічних розладів [21]. Низький уміст вітаміну D в сироватці крові також пов’язаний зі зниженням фізичного функціонування за рахунок м’язової слабкості, оскільки вітамін D стимулює всмоктування кальцію з кишечника та підтримує рівень кальцію в сироватці крові, який необхідний для мінералізації кісткової тканини та для підтримки функціонування м’язів [22]. Нами встановлено, що в умовах дефіциту вітаміну D показники психічного компонента здоров’я були значно нижчими, ніж при оптимальних рівнях вітаміну саме за рахунок субшкали психічного здоров’я (МН). За шкалами, що оцінюють фізичне здоров’я, також отримані вірогідні відмінності між групою хворих із дефіцитом вітаміну D та оптимальним його рівнем, при цьому найгірші значення були виявлені для показника «рольове фізичне функціонування» (RP). Літературні дані щодо даного питання у хворих на АС є відсутніми, однак у хворих на ревматоїдний артрит та остеоартрит зниження показників психічного й фізичного компонентів здоров’я асоціювались із дефіцитом вітаміну D в сироватці крові [23, 24].
Дане дослідження продемонструвало, що висока активність захворювання (оцінена за рівнем BASDAI та ASDAS) та низька функціональна спроможність є факторами, що призводять до погіршення якості життя у хворих на АС. У всіх випадках середні значення показників SF-36 (PSH, MSH) та HAQ були гіршими в пацієнтів із високою активністю запального процесу та вираженими функціональними обмеженнями. Подібні закономірності раніше були встановлені і в дослідженнях O. Ozdemir та співавт. (2011) і J. Huang та співавт. (2017), де індекси BASDAI та BASFI мали суттєві негативні кореляційні зв’язки з усіма субшкалами опитувальника SF-36 [2, 17]. За даними Q. Wen та співавт. (2016), індекси BASDAI та BASFI мали тісний зв’язок із показниками фізичного та психічного здоров’я –SF-36 (р < 0,01) [25]. Однак літературних даних щодо зв’язків між активністю захворювання та психічним компонентом здоров’я знайдено не було. Зокрема, за даними D. Revicki та співавт. (2011), фізичний компонент здоров’я PSH мав високий асоціативний зв’язок з індексами BASDAI та BASFI (r = –0,47; r = –0,65), тоді як психічний компонент MSН його не мав (r = –0,22; r = –0,15) [15]. А в дослідженні Y. Turan та співавт. (2007) жодна підгрупа психічного здоров’я не мала вірогідного зв’язку з показниками активності запального процесу [26].
Таким чином, аналізуючи власні дані та результати літературних джерел, варто відмітити, що у хворих на АС чоловіків виявляється суттєве зниження показників якості життя за SF-36 (PSH та MSH) та HAQ, які не мають зв’язку з віком хворих (окрім MSH), формою та тривалістю захворювання, структурно-функціональним станом кісткової тканини, є гіршими в осіб із дефіцитом вітаміну D, високою дозою ГК та високою активністю захворювання.
Висновки
У хворих на АС чоловіків відмічається вірогідне зниження якості життя за даними опитувальника SF-36 та HAQ порівняно з показниками осіб контрольної групи. Щодо фізичного компонента здоров’я, найбільші відмінності виявлені для показника інтенсивності болю (37,2 ± 1,6 бала) та рольового фізичного функціонування (14,0 ± 3,1 бала); щодо шкал, що оцінюють психічне здоров’я, найгірші значення були виявлені для показника рольового емоційного функціонування (22,2 ± 3,9 бала).
Показники якості життя не мають зв’язку з віком хворих, тривалістю захворювання та формою АС, а також зі структурно-функціональним станом кісткової тканини та біохімічними маркерами її ремоделювання (Z-показник, остеокальцин, NTx).
У групі з дефіцитом вітаміну D порівняно з оптимальним його значенням відмічається зниження показників психічного компонента здоров’я саме за рахунок субшкали «психічне здоров’я». Установлено чіткий зворотний зв’язок між якістю життя та ступенем активності запального процесу за ASDAS, BASDAI та ГК-навантаженням.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та будь-яку фінансову підтримку при написанні статті.
Внесок кожного автора: Шевчук С.В. — аналіз та обробка отриманих даних, написання тексту, концепція і дизайн дослідження; Павлюк О.М. — збір та обробка матеріалів, аналіз отриманих даних, написання тексту.
Отримано/Received 20.04.2021
Рецензовано/Revised 14.05.2021
Прийнято до друку/Accepted 01.06.2021

/28.jpg)
/29.jpg)
/30.jpg)
/31.jpg)