Международный эндокринологический журнал Том 17, №5, 2021
Вернуться к номеру
Діагностика та лікування первинного гіперпаратиреозу (власний 20-річний досвід та огляд літератури)
Авторы: Караченцев Ю.І.(1, 2), Сазонов М.Є.(1), Хазієв В.В.(1), Дубовик В.М.(1), Гончарова О.А.(1, 2), Гопкалова І.В.(1)
(1) — ДУ «Інститут проблем ендокринної патології ім. В.Я. Данилевського Національної академії медичних наук України», м. Харків, Україна
(2) — Харківська медична академія післядипломної освіти, м. Харків, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
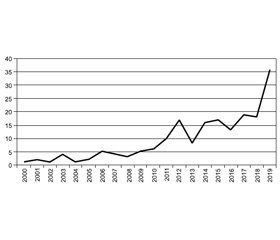
Актуальність. На сьогодні первинний гіперпаратиреоз (пГПТ) є третьою за поширеністю серед ендокринних патологій після захворювань щитоподібної залози й цукрового діабету. Несвоєчасна діагностика призводить до тяжкого перебігу хвороби з розвитком інвалідизуючих ускладнень — остеопоротичних переломів, рецидивуючого каменеутворення в сечовивідних шляхах, шлунково-кишкових кровотеч та ін., а також підвищеного ризику передчасної смерті. Мета дослідження: оцінити динаміку виявлення захворювань прищитоподібної залози за період 2000–2019 рр. Матеріали та методи. Із 2000 року на базі хірургічного відділення клініки «Інститут проблем ендокринної патології ім. В.Я. Данилевського Національної академії медичних наук України» з приводу пГПТ було проведено 205 операцій (у 188 жінок й 17 чоловіків: 91,7 і 8,3 %). Результати. Із 2008 р. фіксується впевнене зростання кількості випадків. Частота виникнення пГПТ у жінок зростає з віком і стає вірогідно вищою у віці 50–69 років. При цьому з віком посилюється розрив між жінками й чоловіками, причина якого потребує дослідження. Кількість пацієнтів із малосимптомною й вираженою клінічною картиною є пропорційною впродовж 20 років і становить приблизно 2 : 1. У країнах, де впроваджений скринінг кальцію крові, питома вага асимптомних форм досягає 80 %. Отримані нами дані підтверджують факт несвоєчасної діагностики пГПТ у сучасній Україні, що потребує впровадження широкомасштабного популяційного скринінгу у вигляді як анкетування, так і дослідження кальцію сироватки крові. Висновки. Позитивний внесок у своєчасне виявлення пГПТ може зробити активація в даному напрямку роботи закладів післядипломної (безперервної) освіти, насамперед кафедр ендокринології, розташованих на базі ендокринологічних клінік із хірургічними відділеннями.
Background. Currently, primary hyperparathyroidism (pHPT) is the third most common endocrine disease after thyroid gland pathology and diabetes mellitus. Untimely diagnosis leads to a severe course of the disease with the development of disabling deformations — osteoporotic fractures, recurrent stone formation in the urinary tract, gastrointestinal bleeding, etc., as well as to an increased risk of premature death. The purpose of the study is to assess the dynamics of detection of thyroid disease (thyroid) for the period 2000–2019. Materials and methods. Since 2000, based on the surgical department of the clinic of the State Institution “V. Danilevsky Institute for Endocrine Pathology Problems of the National Academy of Medical Sciences of Ukraine”, 205 surgeries have been carried out for pHPT (in 188 women and 17 men: 91.7 and 8.3 %). Results. Since 2008, there has been a steady increase in the number of cases. The incidence of pHPT in women increases with age and becomes significantly higher at the age of 50–69 years. At the same time, the gap between women and men is widening, the reason for which needs to be studied. The proportional ratio of the number of patients with asymptomatic and clinically pronounced course persists for 20 years and is approximately 2 : 1. In countries where blood calcium screening has been introduced, the proportion of asymptomatic forms reaches 80 %. The obtained data confirm the fact of untimely diagnosis of pHPT in Ukraine, which requires the introduction of large-scale population screening in the form of a questionnaire survey and study of serum calcium. Conclusions. A positive contribution to the timely detection of pHPT can be made by activating the work of postgraduate (continuous) education institutions in this direction, primarily the departments of endocrinology based on endocrinological clinics with surgical departments.
первинний гіперпаратиреоз; скринінг; анкетування
primary hyperparathyroidism; screening; questionnaires
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Dedov I.I., Melnichenko G.A., Mokrysheva N.G., Rozhinskaya L.Ya., Kusnezov N.S., Pigarova E.A., Eremkina A.K. et al. Primary hyperparathyroidism: the clinical picture, diagnostics, differential diagnostics, and methods of treatment. Problems of Endocrinology. 2016. 62(6). 40-77. (In Russian) https://doi.org/10.14341/probl201662640-77.
- Mokrysheva N.G., Eremkina A.K., Mirnaya S.S., Kovaleva E.V. Challenges in differential diagnosis between primary and secondary forms of hyperparathyroidism. Obesity and metabolism. 2017. 14(3). 48-53. (In Russian) https://doi.org/10.14341/omet2017348-53.
- Khan A.A., Hanley D.A., Rizzoli R., Bollerslev J., Young J.E., Rejnmark L., Thakker R. et al. Primary hyperparathyroidism: review and recommendations on evaluation, diagnosis, and management. A Canadian and international consensus. Osteoporos Int. 2017. 28(1). 1-19. doi: 10.1007/s00198-016-3716-2.
- Primary hyperparathyroidism. Nat. Rev. Dis. Primers. 2016. 2. 16034. https://doi.org/10.1038/nrdp.2016.34.
- Zhu C.Y., Sturgeon C., Yeh M.W. Diagnosis and Management of Primary Hyperparathyroidism. JAMA. 2020. 323(12). 1186-1187. doi: 10.1001/jama.2020.0538.
- Walker M.D., Silverberg S.J. Primary hyperparathyroidism. Nat. Rev. Endocrinol. 2018. 14(2). 115-125. doi: 10.1038/nrendo.2017.104.
- Kaminsky O.V. Parathyroid ultrasonography: methodology, clinical evaluation. International Journal of Endocrinology (Ukraine). 2020. 16(5). doi: 10.22141/2224-0721.16.5.2020.212743 (in Ukrainian).
- Madkhali T., Alhefdhi A., Chen H., Elfenbein D. Primary hyperparathyroidism. Ulus. Cerrahi Derg. 2016. 32(1). 58-66. doi: 10.5152/UCD.2015.3032.
- Bouziane T., Belmahi N., El Ouahabi H. Primary hyperparathyroidism and Gougerot disease. Eur. J. Rheumatol. 2018. 5(1). 72-74. doi: 10.5152/eurjrheum.2017.16127.
- Farkhutdinova L.M. Primary Hyperparathyroidism: Modern Conception and Clinical Observation. The Russian Archives of Internal Medicine. 2020. 10(2). 94-101. https://doi.org/10.20514/2226-6704-2020-10-2-94-101 (in Russian).
- Tee M.C., Holmes D.T., Wiseman S.M. Ionized vs serum calcium in the diagnosis and management of primary hyperparathyroidism: which is superior? Am. J. Surg. 2013. 205(5). 591-596; doi: 10.1016/j.amjsurg.2013.01.017.
- Norman J., Goodman A., Politz D. Calcium, parathyroid hormone, and vitamin D in patients with primary hyperparathyroidism: normograms developed from 10,000 cases. Endocr. Pract. 2011. 17(3). 384-394. doi: 10.4158/EP09346.OR.
- Tay Y.D., Liu M., Bandeira L., Bucovsky M., Lee J.A., Silverberg S.J., Walker M.D. Occult urolithiasis in asymptomatic primary hyperparathyroidism. Endocr. Res. 2018. 43(2). 106-115. doi: 10.1080/07435800.2018.1431275.
- Black C.E., Berg R.L., Urquhart A.C. 24-hour urinary calcium in primary hyperparathyroidism. Clin. Med. Res. 2013 Dec. 11(4). 219-225. doi: 10.3121/cmr.2013.1164. PMID: 24510320; PMCID: PMC3917997.
- Walker M., Silverberg S. Primary hyperparathyroidism. Nat. Rev. Endocrinol. 2018. 14. 115-125. doi: 10.1038/nrendo.2017.104.
- Walker M.D., Cong E., Lee J.A., Kepley A., Zhang C., McMahon D.J., Silverberg S.J. Vitamin D in Primary Hyperparathyroidism: Effects on Clinical, Biochemical, and Densitometric Presentation. J. Clin. Endocrinol. Metab. 2015. 100(9). 3443-3451. doi: 10.1210/jc.2015-2022.
- Simonds W.F. Genetics of Hyperparathyroidism, Including Parathyroid Cancer. Endocrinol. Metab. Clin. North. Am. 2017. 46(2). 405-418. doi: 10.1016/j.ecl.2017.01.006.
- Bilezikian J.P., Potts J.T. Jr, Fuleihan Gel-H., Kleerekoper M., Neer R., Peacock M., Rastad J. et al. Summary statement from a workshop on asymptomatic primary hyperparathyroidism: a perspective for the 21st century. J. Clin. Endocrinol. Metab. 2002. 87(12). 5353-5361. doi: 10.1210/jc.2002-021370.
- Wermers R.A., Khosla S., Atkinson E.J., Hodgson S.F., O’Fallon W.M., Melton L.J. 3rd. The rise and fall of primary hyperparathyroidism: a population-based study in Rochester, Minnesota, 1965–1992. Ann. Intern. Med. 1997. 126(6). 433-440. doi: 10.7326/0003-4819-126-6-199703150-00003.
- Christensson T., Hellström K., Wengle B., Alveryd A., Wikland B. Prevalence of hypercalcaemia in a health screening in Stockholm. Acta Medica Scandinavica. 1976. 200(16). 131-137. https://doi.org/10.1111/j.0954-6820.1976.tb08208.x.
- Baranova I.A., Klemushina T.V., Zykova T.A. Epidemiology of primary hyperparathyroidism – invisible part of the iceberg (literature rewiew). Medical Herald of the South of Russia. 2016. 2. 4-8. (In Russian) https://doi.org/10.21886/2219-8075-2016-2-4-8.
- Bilezikian J.P. Primary Hyperparathyroidism. The Journal of Clinical Endocrinology & Metabolism. 2018. 103(11). 3993-4004. doi: 10.1210/jc.2018-01225.
- Cherenko S.M. Primary hyperparathyroidism: modern laboratory diagnostics and differential diagnostics. International Journal of Endocrinology (Ukraine). 2014. 6(62). 174-181. (in Russian)
- Weber T., Dotzenrath C., Dralle H., Niederle B., Riss P., Holzer K., Kußmann J. et al. Management of primary and renal hyperparathyroidism: guidelines from the German Association of Endocrine Surgeons (CAEK). Langenbecks Arch. Surg. 2021. 406(3). 571-585. doi: 10.1007/s00423-021-02173-1.
- National Guideline Centre (UK). Hyperparathyroidism (primary): diagnosis, assessment and initial management. London: National Institute for Health and Care Excellence (UK), 2019 May. PMID: 31194309.
- Palermo A., Naciu A.M., Tabacco G., Falcone S., Santonati A., Maggi D., D’Onofrio L. et al. Clinical, Biochemical, and Radiological Profile of Normocalcemic Primary Hyperparathyroidism. J. Clin. Endocrinol. Metab. 2020. 105(7). dgaa174. doi: 10.1210/clinem/dgaa174.
- Reid L., Muthukrishnan B., Patel D., Crane M., Akyol M., Thomson A., Seckl J.R., Gibb F.W. Presentation, diagnostic assessment and surgical outcomes in primary hyperparathyroidism: a single centre’s experience. Endocr. Connect. 2018. 7(10). 1105–1115. doi: 10.1530/EC-18-0195.
- Yadav S.K., Johri G., Bichoo R.A., Jha C.K., Kintu-Luwaga R., Mishra S.K. Primary hyperparathyroidism in developing world: a systematic review on the changing clinical profile of the disease. Arch. Endocrinol. Metab. 2020. 64(2). 105-110. doi: 10.20945/2359-3997000000211.
- Wu J.X., Yeh M.W. Asymptomatic Primary Hyperparathyroidism: Diagnostic Pitfalls and Surgical Intervention. Surg. Oncol. Clin. N. Am. 2016. 25(1). 77-90. doi: 10.1016/j.soc.2015.08.004.
- Cusano N.E., Maalouf N.M., Wang P.Y., Zhang C., Cre–mers S.C., Haney E.M., Bauer D.C. et al. Normocalcemic hyperparathyroidism and hypoparathyroidism in two community-based nonreferral populations. J. Clin. Endocrinol. Metab. 2013. 98(7). 2734-2741. doi: 10.1210/jc.2013-1300.
- Vignali E., Cetani F., Chiavistelli S., Meola A., Sapo-naro F., Centoni R., Cianferotti L., Marcocci C. Normocalcemic primary hyperparathyroidism: a survey in a small village of Sout-hern Italy. Endocr. Connect. 2015. 4(3). 172-178. doi: 10.1530/EC-15-0030.
- Soon P.S., Delbridge L.W., Sywak M.S., Barraclough B.M., Edhouse P., Sidhu S.B. Surgeon performed ultrasound facilitates minimally invasive parathyroidectomy by the focused lateral mini-incision approach. World J. Surg. 2008. 32(5). 766-771. doi: 10.1007/s00268-007-9436-1.
- Nilsson I.-L. Primary hyperparathyroidism: should surgery be performed on all patients? Current evidence and residual uncertainties. Journal of Internal Medicine. 2018. 285(2). 149-164. doi: 10.1111/joim.12840.
- Cheung K., Wang T.S., Farrokhyar F., Roman S.A., Sosa J.A. A meta-analysis of preoperative localization techniques for patients with primary hyperparathyroidism. Ann. Surg. Oncol. 2012. 19(2). 577-583. doi: 10.1245/s10434-011-1870-5.
- Nafisi Moghadam R., Amlelshahbaz A.P., Namiranian N., Sobhan-Ardekani M., Emami-Meybodi M., Dehghan A., Rahmanian M., Razavi-Ratki S.K. Comparative Diagnostic Performance of Ultrasonography and 99mTc-Sestamibi Scintigraphy for Parathyroid Adenoma in Primary Hyperparathyroidism; Systematic Review and Meta- Analysis. Asian Pac. J. Cancer Prev. 2017. 18(12). 3195-3200. doi: 10.22034/APJCP.2017.18.12.3195.
- Giusti M., Dolcino M., Vera L., Ghiara C., Massaro F., Fazzuoli L., Ferone D. et al. Institutional experience of PTH evaluation on fine-needle washing after aspiration biopsy to locate hyperfunctioning parathyroid tissue. J. Zhejiang Univ. Sci. B. 2009. 10(5). 323-330. doi: 10.1631/jzus.B0820372.
- Vestergaard P., Mosekilde L. Cohort study on effects of parathyroid surgery on multiple outcomes in primary hyperparathyroidism. BMJ. 2003. 327(7414). 530-534.
- Kouvaraki M.A., Greer M., Sharma S., Beery D., Armand R., Lee J.E., Evans D.B., Perrier N.D. Indications for operative intervention in patients with asymptomatic primary hyperparathyroidism: practice patterns of endocrine surgery. Surgery. 2006. 139(4). 527-534. doi: 10.1016/j.surg.2005.09.006.
- Khosla S., Melton L.J. 3rd, Wermers R.A., Crowson C.S., O’Fallon W.M., Riggs B.L. Primary hyperparathyroidism and the risk of fracture: a population-based study. J. Bone Miner. Res. 1999. 14(10). 1700-1707. doi: 10.1359/jbmr.1999.14.10.1700.
- Šiprová H., Fryšák Z., Souček M. Primary hyperparathyroidism, with a focus on management of the normocalcemic form: to treat or not to treat? Endocr. Pract. 2016. 22(3). 294-301. doi: 10.4158/EP15704.OR.
- Irvin G.L. 3rd, Dembrow V.D., Prudhomme D.L. Operative monitoring of parathyroid gland hyperfunction. Am. J. Surg. 1991. 162(4). 299-302. doi: 10.1016/0002-9610(91)90135-z.
- Irvin G.L. 3rd, Carneiro D.M., Solorzano C.C. Progress in the operative management of sporadic primary hyperparathyroidism over 34 years. Ann. Surg. 2004. 239(5). 704-708; discussion 708-711. doi: 10.1097/01.sla.0000124448.49794.74.

/15_2.jpg)
/15.jpg)
/16.jpg)