Журнал «Боль. Суставы. Позвоночник» Том 11, №3, 2021
Вернуться к номеру
Нейропатичний біль як можливий предиктор регресу неврологічних розладів у пацієнтів із хребетно-спинномозковою травмою
Авторы: Нехлопочин О.С. (1), Вербов В.В. (1), Цимбалюк Я.В. (1), Вороді М.В. (1), Чешук Є.В. (1, 2)
(1) — ДУ «Інститут нейрохірургії ім. акад. А.П. Ромоданова НАМН України», м. Київ, Україна
(2) — Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
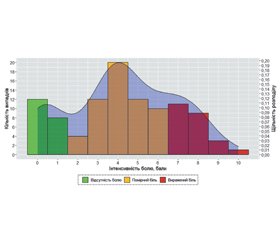
Актуальність. Нейропатичний біль є одним з основних вторинних ускладнень хребетно-спинномозкової травми. Біологічна роль нейропатичного болю не встановлена. Даний тип болю формується безпосередньо в зоні ураження спинного мозку, тому можна припустити, що його інтенсивність може характеризувати як дегенеративні, так і репаративні процеси. Мета дослідження: оцінити можливий взаємозв’язок між інтенсивністю нейропатичних больових відчуттів у пацієнтів, які перенесли хребетно-спинномозкову травму на субаксіальному рівні шийного відділу хребта, та динамікою регресу неврологічних розладів. Матеріали та методи. Проведений ретроспективний аналіз бази даних пацієнтів, які звернулися по консультативну допомогу в поліклінічне відділення Інституту нейрохірургії імені акад. А.П. Ромоданова НАМН України в період із 2010 по 2020 р. після хірургічного лікування травматичного пошкодження шийного відділу хребта на субаксіальному рівні. Оцінювали рівень неврологічних розладів та інтенсивність нейропатичного болю через 5–7 і 11–13 міс. після хірургічного втручання. Результати. Залежно від інтенсивності зареєстрованих больових відчуттів 102 пацієнти, які відібрані для аналізу, були розподілені на три групи: 1) із відсутністю постійних больових відчуттів — 19,6 % постраждалих, 2) помірним болем — 56,9 %, 3) вираженим нейропатичним болем — 23,5 %. У 1-й групі регрес неврологічних розладів становив 3,5 бала (95% довірчий інтервал (ДІ) 2,15–6,15), у 2-й — 25,0 (95% ДІ 24,14–29,58), у 3-й — 13,0 (95% ДІ 10,87–16,55). Відмінності статистично значущі (χ2 = 60,4, p < 0,0001). У пацієнтів із грубими неврологічними порушеннями динаміка відновлення не корелювала з інтенсивністю больових відчуттів. При ASIA B у 1-й групі динаміка становила 8,5 бала (95% ДІ 10,56–27,56), у 2-й групі — 15,0 (95% ДІ 13,41–18,41), у 3-й — 10,5 (95% ДІ 7,45–14,89). У пацієнтів із функціональним класом ASIA С різниця була ще вираженішою: у 1-й групі медіана становила 8,0 бала (95% ДІ 0,83–20,83), у 2-й — 32,0 (95% ДІ 25,41–36,86), у 3-й — 15,5 (95% ДІ 10,27–27,4). При ASIA D спостерігали схожу динаміку. Висновки. Найгірший регрес неврологічних порушень спостерігається в пацієнтів без клінічно значимих больових відчуттів, найкращі показники відновлення неврологічної дисфункції — у пацієнтів із помірними нейропатичними болями.
Background. Neuropathic pain is one of the principal secondary complications of spinal cord injury. The biological role of neuropathic pain has not been established yet. This type of pain is formed directly in the area of the spinal cord injury; therefore, it can be assumed that its intensity may characterize both degenerative and reparative processes. The aim of this work is to assess the possible relationship between the intensity of neuropathic pain in patients with spinal cord injury at cervical subaxial spine and the dynamics of neurological disorder regression. Materials and methods. We have performed a retrospective analysis of patients referred to outpatient department of the Romodanov Neurosurgery Institute of National Academy of Medical Sciences of Ukraine in the period from 2010 to 2020 after a surgical treatment of subaxial cervical spine traumatic injury. The extent of neurological disorders and the intensity of neuropathic pain were assessed within 5–7 and 11–13 months after surgery. Results. All 102 patients selected for analysis were divided into three groups depending on the intensity of the registered pain sensations: 1) absence of constant pain sensations — 19.6 % of subjects, 2) moderate pain — 56.9 %, 3) severe neuropathic pain — 23.5 %. In the first group, the regression of neurological disorders was 3.5 (95% confidence interval (CI) 2.15–6.15), in the second — 25.0 (95% CI 24.14–29.58), in the third — 13.0 (95% CI 10.87–16.55). The differences are statistically significant (χ2 = 60.4, df = 2, p < 0.0001). In patients with severe neurological disorders, the dynamics of recovery did not correlate with the pain intensity. With ASIA B, the dynamics of group 1 was 8.5 (95% CI 10.56–27.56), of group 2 — 15.0 (95% CI 13.41–18.41), of group 3 — 10.5 (95% CI 7.45–14.89). With ASIA C functional class, the difference is even more pronounced: in group 1, the median was 8.0 (95% CI 0.83–20.83), in group 2 — 32.0 (95% CI 25.41–36.86), in group 3 — 15.5 (95% CI 10.27–27.4). With ASIA D, a similar trend was observed. Conclusions. The worst regression of neurological disorders is observed in patients without clinically significant pain, the best results of neurological dysfunction recovery are found in patients with mode rate neuropathic pain.
хребетно-спинномозкова травма; субаксіальний рівень; неврологічні розлади; нейропатичний біль; динаміка відновлення
spinal cord injury; subaxial level; neurological disorders; neuropathic pain; dynamics of recovery
Вступ
Матеріали та методи
Результати
/27.jpg)
Обговорення
Висновки
- Franz S., Schulz B., Wang H., Gottschalk S. et al. Management of pain in individuals with spinal cord injury: Guideline of the German-Speaking Medical Society for Spinal Cord Injury. German medical science: GMS e-journal. 2019. 17. Doc 05. doi: 10.3205/000271. PMID: 31354397.
- Siddall P.J., Middleton J.W. Spinal cord injury-induced pain: mechanisms and treatments. Pain management. 2015. 5(6). 493-507. doi: 10.2217/pmt.15.47. PMID: 26402151.
- Siddall P.J., McClelland J.M., Rutkowski S.B., Cousins M.J. A longitudinal study of the prevalence and characteristics of pain in the first 5 years following spinal cord injury. Pain. 2003. 103(3). 249-257. doi: 10.1016/S0304-3959(02)00452-9. PMID: 12791431.
- van Gorp S., Kessels A.G., Joosten E.A., van Kleef M., Patijn J. Pain prevalence and its determinants after spinal cord injury: a systematic review. European journal of pain (London, England). 2015. 19(1). 5-14. doi: 10.1002/ejp.522. PMID: 24824334.
- Dijkers M., Bryce T., Zanca J. Prevalence of chronic pain after traumatic spinal cord injury: a systematic review. Journal of rehabilitation research and development. 2009. 46(1). 13-29. PMID: 19533517.
- Bryce T.N., Biering-Sorensen F., Finnerup N.B. et al. International spinal cord injury pain classification: part I. Background and description. March 6–7, 2009. Spinal Cord. 2012. 50(6). 413-417. doi: 10.1038/sc.2011.156. PMID: 22182852.
- Loeser J.D., Treede R.D. The Kyoto protocol of IASP Basic Pain Terminology. Pain. 2008. 137(3). 473-477. doi: 10.1016/j.pain.2008.04.025. PMID: 18583048.
- Jensen T.S., Baron R., Haanpaa M. et al. A new definition of neuropathic pain. Pain. 2011. 152(10). 2204-2205. doi: 10.1016/j.pain.2011.06.017. PMID: 21764514.
- Finnerup N.B. Neuropathic pain and spasticity: intricate consequences of spinal cord injury. Spinal Cord. 2017. 55(12). 1046-1050. doi: 10.1038/sc.2017.70. PMID: 28695904.
- Vaccaro A.R., Koerner J.D., Radcliff K.E. et al. AOSpine subaxial cervical spine injury classification system. Eur. Spine J. 2016. 25(7). 2173-2184. doi: 10.1007/s00586-015-3831-3. PMID: 25716661.
- Fehlings M.G., Tetreault L.A., Wilson J.R. et al. A Clinical Practice Guideline for the Management of Acute Spinal Cord Injury: Introduction, Rationale, and Scope. Global Spine J. 2017. 7(3 Suppl). 84-94. doi: 10.1177/2192568217703387. PMID: 29164036.
- Maynard F.M., Bracken M.B., Creasey G. et al. International Standards for Neurological and Functional Classification of Spinal Cord Injury. American Spinal Injury Association. Spinal Cord. 1997. 35(5). 266-274. doi: 10.1038/sj.sc.3100432. PMID: 9160449.
- Ferreira-Valente M.A., Pais-Ribeiro J.L., Jensen M.P. Validity of four pain intensity rating scales. Pain. 2011. 152(10). 2399-2404. doi: 10.1016/j.pain.2011.07.005. PMID: 21856077.
- Moucha R., Kilgard M.P. Cortical plasticity and rehabilitation. Progress in brain research. 2006. 157. 111-122. doi: 10.1016/s0079-6123(06)57007-4. PMID: 17167905.
- Brown A.R., Martinez M. From cortex to cord: motor circuit plasticity after spinal cord injury. Neural. Regen. Res. 2019. 14(12). 2054-2062. doi: 10.4103/1673-5374.262572. PMID: 31397332.
- Button D.C., Kalmar J.M. Understanding exercise-dependent plasticity of motoneurons using intracellular and intramuscular approaches. Applied physiology, nutrition, and metabolism = Physiologie appliquee, nutrition et metabolisme. 2019. 44(11). 1125-1133. doi: 10.1139/apnm-2018-0862. PMID: 31075205.
- Maegele M., Muller S., Wernig A. et al. Recruitment of spinal motor pools during voluntary movements versus stepping after human spinal cord injury. J. Neurotrauma. 2002. 19(10). 1217-1229. doi: 10.1089/08977150260338010. PMID: 12427330.
- Brown A., Weaver L.C. The dark side of neuroplasticity. Experimental neurology. 2012. 235(1). 133-141. doi: 10.1016/j.expneurol.2011.11.004, PMID: 22116043.
- Devor M., Wall P.D. Reorganisation of spinal cord sensory map after peripheral nerve injury. Nature. 1978. 276(5683). 75-76. doi: 10.1038/276075a0. PMID: 570248.
- Devor M., Wall P.D., Catalan N. Systemic lidocaine silences ectopic neuroma and DRG discharge without blocking nerve conduction. Pain. 1992. 48(2). 261-268. doi: 10.1016/0304-3959(92)90067-L. PMID: 1589245.
- Woolf C.J. Evidence for a central component of post-injury pain hypersensitivity. Nature. 1983. 306(5944). 686-688. doi: 10.1038/306686a0. PMID: 6656869.
- Woolf C.J., Thompson S.W.N. The induction and maintenance of central sensitization is dependent on N-methyl-D-aspartic acid receptor activation; implications for the treatment of post-injury pain hypersensitivity states. Pain. 1991. 44(3). 293-299. doi: 10.1016/0304-3959(91)90100-C. PMID: 1828878.
- Woolf C.J., Mannion RJ. Neuropathic pain: aetiology, symptoms, mechanisms, and management. Lancet (London, England). 1999. 353(9168). 1959-1964. doi: 10.1016/S0140-6736(99)01307-0. PMID: 10371588.
- Wong S.T., Atkinson B.A., Weaver L.C. Confocal microscopic analysis reveals sprouting of primary afferent fibres in rat dorsal horn after spinal cord injury. Neuroscience letters. 2000. 296(2–3). 65-68. doi: 10.1016/s0304-3940(00)01601-3. PMID: 11108982.
- Lombard M.C., Nashold B.S. Jr., Albe-Fessard D., Nada S., Cesar S. Deafferentation hypersensitivity in the rat after dorsal rhizotomy: a possible animal model of chronic pain. Pain. 1979. 6(2). 163-174. doi: 10.1016/0304-3959(79)90123-4. PMID: 460928.
- Hatch M.N., Cushing T.R., Carlson G.D., Chang E.Y. Neuropathic pain and SCI: Identification and treatment strategies in the 21st century. J. Neurol. Sci. 2018. 384. 75-83. doi: 10.1016/j.jns.2017.11.018. PMID: 29249383.
- Finnerup N.B., Baastrup C. Spinal cord injury pain: mechanisms and management. Curr. Pain Headache Rep. 2012. 16(3). 207-216. doi: 10.1007/s11916-012-0259-x. PMID: 22392531.
- Felix E.R. Chronic neuropathic pain in SCI: evaluation and treatment. Physical medicine and rehabilitation clinics of North America. 2014. 25(3). 545-571, viii. doi: 10.1016/j.pmr.2014.04.007. PMID: 25064788.
- Kale A., Borcek A.O., Emmez H. et al. Neuroprotective effects of gabapentin on spinal cord ischemia-reperfusion injury in rabbits. J. Neurosurg. Spine. 2011. 15(3). 228-237. doi: 10.3171/2011.4.SPINE10583. PMID: 21599445.
- Hao H.H., Wang L., Guo Z.J. et al. Valproic acid reduces autophagy and promotes functional recovery after spinal cord injury in rats. Neuroscience bulletin. 2013. 29(4). 484-492. doi: 10.1007/s12264-013-1355-6. PMID: 23852559.
- Hook M.A., Moreno G., Woller S. et al. Intrathecal morphine attenuates recovery of function after a spinal cord injury. J. Neurotrauma. 2009. 26(5). 741-752. doi: 10.1089/neu.2008.0710. PMID: 19388818.
- Cragg J.J., Haefeli J., Jutzeler C.R. et al. Effects of Pain and Pain Management on Motor Recovery of Spinal Cord-Injured Patients: A Longitudinal Study. Neurorehabilitation and neural repair. 2016. 30(8). 753-761. doi: 10.1177/1545968315624777. PMID: 26747127.
- Putzke J.D., Richards S.J., Hicken B.L., DeVivo M.J. Interference due to pain following spinal cord injury: important predictors and impact on quality of life. Pain. 2002. 100(3). 231-242. doi: 10.1016/S0304-3959(02)00069-6. PMID: 12467994.

/29.jpg)
/30.jpg)
/30_2.jpg)