Журнал «Боль. Суставы. Позвоночник» Том 11, №3, 2021
Вернуться к номеру
Ефективність, переносимість та вплив на метаболізм хрящової тканини неденатурованого колагену ІІ типу UC-II™ (Меркана) у хворих на остеоартрит колінних суглобів
Авторы: Яременко О.Б. (1), Федьков Д.Л. (1), Яременко К.М. (2), Комкіна М.О. (1), Мазанко К.В. (1)
(1) — Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
(2) — КНП «Олександрівська клінічна лікарня м. Києва», м. Київ, Україна
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
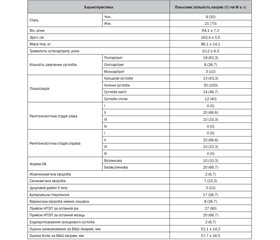
Актуальність. Остеоартрит (ОА) є найпоширенішим хронічним захворюванням суглобів, для якого характерні значні структурні пошкодження суглобів, функціональні розлади й біль. Щодо лікування цієї патології, то останніми роками з’являється все більше публікацій про клінічну ефективність патентованого неденатурованого колагену 2-го типу (undenatured collagen type 2, UC-II™), який представлений в Україні брендом Меркана. Метою цього дослідження було повторно оцінити ефективність і переносимість неденатурованого колагену ІІ типу UC-II™ (Меркана), а також визначити його вплив на метаболізм хрящової тканини при монотерапії у хворих з ОА колінних суглобів. Матеріали та методи. У дослідження були включені 30 хворих на ОА з залученням колінних суглобів, які мали на момент початку дослідження ІІ чи ІІІ рентгенологічну стадію за Kellgren-Lawrence. Усі включені хворі приймали неденатурований колаген ІІ типу UC-II™ (Меркана) по 1 капсулі (40 мг) 1 раз на добу протягом 6 місяців. Продовження прийому нестероїдних протизапальних препаратів (НПЗП) у звичних для пацієнта дозах дозволялося протягом усього дослідження. Оцінювалися відповідь на лікування за WOMAC та шкалою Лекена, зміна частоти застосування НПЗП, динаміка C-телопептиду колагену ІІ типу, що визначається в сечі (uCTX-ІІ), динаміка показників товщини хряща колінного суглоба (см) та синовіту (за його наявності) за даними УЗД і переносимість препарату. Результати. Установлене вірогідне поліпшення всіх клінічних показників уже на 4-му тижні лікування — індекси Лекена і WOMAC знизились на 5,3 та 9,1 % відповідно. На момент завершення дослідження поліпшення за індексом Лекена становило 25 %, а за індексом WOMAC — 33,1 % від вихідного значення. За даними УЗД, за 6 місяців потовщення хряща становило 5,6 % для правого та 17,6 % — для лівого колінного суглобів. Також на 12-му тижні лікування спостерігалось вірогідне зниження концентрації uCTX-II (продукту руйнації колагену II типу) на 5,6 %. Шість хворих із 20, які приймали НПЗП на початку лікування, припинили їх прийом. За весь період дослідження в жодного хворого не були відзначені несприятливі ефекти, які, на думку лікаря, були б пов’язані з прийомом досліджуваного препарату. Висновки. Неденатурований колаген ІІ типу UC-II™ (Меркана) ефективний щодо поліпшення клінічних проявів і метаболічних розладів хряща, має хороший профіль безпеки й може застосовуватись у лікуванні хворих на ОА з ураженням колінних суглобів.
Background. Osteoarthritis (OA) is the most common joint disease characterized by significant structural joints damage, functional disorders, and pain. In recent years, there have been a lot of publications regarding the clinical efficacy of patented undenatured collagen type II (UC-II™) presented in Ukraine as the Mercana brand. This study aimed to re-estimate the effectiveness and tolerability of undenatured collagen type II UC-II (Mercana) monotherapy and evaluate its impact on cartilage metabolism in patients with knee OA. Materials and methods. Thirty patients with knee OA (II to III X-ray stage by Kellgren-Lawrence) were enrolled. All participants received undenatured collagen type II UC-II™ (Mercana), one capsule (40 mg) once a day within 6 months. The patients were allowed to continue nonsteroidal anti-inflammatory drugs (NSAIDs) in habitual dosage within the whole period of the study. The treatment response assessed by WOMAC and Leken’s index, NSAIDs discontinuation, dynamics of collagen type IIC-telopeptide determined in urine (uCTX-ІІ), dynamics of knee cartilage thickness (cm) and synovitis (if present) measured with ultrasound, and the drug tolerability were assessed. Results. The significant improvement of all clinical parameters was determined already on the fourth week of the treatment — Leken’s index and WOMAC decreased by 5.3 and 9.1 %, respectively. At the end of the study, the improvement of the Leken’s parameters was 25 %, and WOMAC — 33.1 % compared with baseline. The ultrasound data demonstrated a 5.6% increase in cartilage thickness within 6 months for the right knee and a 17.6% increase for the left knee. The concentration of uCTX-II (product of collagen type II degradation) significantly decreased (by 5.6 %) by week 12. Six patients out of 20 who took NSAIDs at the beginning of the study discontinued their administration. Within the period of the study, no patient noted the adverse events associated with UC-II™. Conclusions. Undenatured collagen type II UC-II™ (Mercana) is clinically effective, has a positive metabolic effect on cartilage, a good safety profile, and can be used to treat patients with knee OA.
остеоартрит; SYSADOA; неденатурований колаген 2-го типу; undenatured collagen type 2; UC-II; Меркана; WOMAC; індекс Лекена; УЗД суглобів; uCTX-II
osteoarthritis; SYSADOA; undenatures collagen type II, UC-II; Mercana; WOMAC; Leken’s index; ultrasound of cartilage; uCTX-II
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Vos T., Abajobir A.A., Abbafati C. et al. Global, regional, and national incidence, prevalence, and years lived with disability for 328 diseases and injuries for 195 countries, 1990–2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet. 2017. № 390. Р. 1211-1159.
- Salmon J.H., Rat A.C., Sellam J. et al. Economic impact of lower-limb osteoarthritis worldwide: a systematic review of cost-of-illness studies. Osteoarthr. Cartil. 2016. № 24. Р. 1500-1508.
- Bannuru R.R., Osani M.C., Vaysbrot E.E. et al. OARSI guidelines for the non-surgical management of knee, hip, and polyarticular osteoarthritis. Osteoarthr. Cartil. 2019. № 27. Р. 1578-1589.
- Bruyère O., Honvo G., Veronese N. et al. An updated algorithm recommendation for the management of knee osteoarthritis from the European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases (ESCEO). Semin. Arthritis. Rheum. 2019. № 49. Р. 337-350.
- Yusuf E. Pharmacologic and non-pharmacologic treatment of osteoarthritis. Curr. Treat. Options Rheumatol. 2016. № 2. Р. 111-125.
- Olsen A.M.S., Fosbøl E.L., Lindhardsen J. et al. Long-term cardiovascular risk of nonsteroidal anti-inflammatory drug use according to time passed after first-time myocardial infarction: a nationwide cohort study. Circulation. 2012. № 126. Р. 1955-1963.
- Kwoh C.K., Roemer F.W., Hannon M.J. et al. Effect of oral glucosamine on joint structure in individuals with chronic knee pain: a randomized, placebo-controlled clinical trial. Arthritis Rheumatol. 2014. № 66. Р. 930-939.
- Zegels B., Crozes P., Uebelhart D. et al. Equivalence of a single dose (1200 mg) compared to a three-time a day dose (400 mg) of chondroitin 4&6 sulfate in patients with knee osteoarthritis. Results of a randomized double blind placebo controlled study. Osteoarthr. Cartil. 2013. № 21. Р. 22-27.
- Tashiro T., Seino S., Sato T. et al. Oral Administration of Polymer Hyaluronic Acid Alleviates Symptoms of knee osteoarthritis: a double-blind, placebo-controlled study over a 12-month period. Sci. World J. 2012. № 2012. Р. 1-8.
- Hussain S., Singh A., Akhtar M., Najmi A.K. Vitamin D supplementation for the management of knee osteoarthritis: a systematic review of randomized controlled trials. Rheumatol. Int. 2017. № 37. Р. 1489-1498.
- Benito-Ruiz P., Camacho-Zambrano M.M., Carrillo-Arcentales J.N. et al. A randomized controlled trial on the efficacy and safety of a food ingredient, collagen hydrolysate, for improving joint comfort. Int. J. Food Sci. Nutr. 2009. № 60. Р. 99-113.
- Lugo J.P., Saiyed Z.M., Lane N.E. Efficacy and tolerability of an undenatured type II collagen supplement in modulating knee osteoarthritis symptoms: a multicenter randomized, double-blind, placebo-controlled study. Nutrition Journal. 2016. № 15. Р. 14.
- Roman-Blas J.A. et al. Combined Treatment With Chondroitin Sulfate and Glucosamine Sulfate Shows No Superiority Over Placebo for Reduction of Joint Pain and Functional Impairment in Patients With Knee Osteoarthritis. Arthritis & Rheumatology. 2017. № 69(1). Р. 77-85.
- Sibilla S., Godfrey M., Brewer S. et al. An overview of the beneficial effects of hydrolysed collagen as a nutraceutical on skin properties: scientific background and clinical studies. Open Nutraceuticals J. 2015. № 8. Р. 29-42.
- Broere F., Wieten L., Klein Koerkamp E.I. et al. Oral or nasal antigen induces regulatory T cells that suppress arthritis and proliferation of arthritogenic T cells in joint draining lymph nodes. J. Immunol. 2008. № 181. Р. 899-906.
- Castrogiovanni P., Trovato F.M., Loreto C. et al. Nutraceutical supplements in the management and prevention of osteoarthritis. Int. J. Mol. Sci. 2016. № 17. Р. 2042.
- Müller R.D., John T., Kohl B. et al. IL-10 overexpression differentially affects cartilage matrix gene expression in response to TNF-α in human articular chondrocytes in vitro. Cytokine. 2008. № 44. Р. 377-385.
- Van Meegeren M.E.R., Roosendaal G., Jansen N.W.D. et al. IL-4 alone and in combination with IL-10 protects against blood-induced cartilage damage. Osteoarthr. Cartil. 2012. № 20. Р. 764-772.
- Li T.F., O’Keefe R.J., Chen D. TGF-beta signaling in chondrocytes. Front. Biosci. 2005. № 10. Р. 681-8.
- Lugo J.P., Saiyed Z.M., Lau F.C. et al. Undenatured type II collagen (UC-II®) for joint support: a randomized, double-blind, placebo-controlled study in healthy volunteers. J. Int. Soc. Sports Nutr. 2013. № 10(1). Р. 48.
- García-Coronado J.M., Martínez-Olvera L., Elizondo-Omaña R.E. et al. Effect of collagen supplementation on osteoarthritis symptoms: a meta-analysis of randomized placebo-controlled trials. Int. Orthop. 2019. № 43. Р. 531-538.
- Liu X., Machado G.C., Eyles J.P., Ravi V., Hunter D.J. Dietary supplements for treating osteoarthritis: a systematic review and meta-analysis. Br. J. Sports Med. 2018. № 52. Р. 167-175.
- Van Vijven J.P.J., Luijsterburg P.A.J., Verhagen A.P. et al. Symptomatic and chondroprotective treatment with collagen derivatives in osteoarthritis: a systematic review. Osteoarthr. Cartil. 2012. № 20. Р. 809-821.
- David C., Crowley et al. Safety and efficacy of undenatured type II collagen in the treatment of osteoarthritis of the knee: a clinical trial, International Journal of Medical Sciences. 2009. № 6(6). Р. 312-321.
- Bagi C.M. et al. Oral administration of undenatured native chicken type II collagen (UC-II) diminished deterioration of articular cartilage in a rat model of osteoarthritis (OA). Osteoarthritis and Cartilage. 2017. № 25(12). Р. 2080-2090.
- Peat G., Thomas E., Duncan R. et al. Clinical classification criteria for knee osteoarthritis: performance in the general population and primary care. Ann. Rheum. Dis. 2006. № 65(10). Р. 1363-1367. doi: 10.1136/ard.2006.051482.
- Bellamy N., Buchanan W.W., Goldsmith C.H., Campbell J., Stitt L.W. Validation study of WOMAC: a health status instrument for measuring clinically important patient relevant outcomes to antirheumatic drug therapy in patients with osteoarthritis of the hip or knee. J. Rheumatol. 1988. № 15. Р. 1833-1840.
- Lequesne M., Mery C., Samson M., Gerard P. Indices of severity for osteoarthristis of the hip and knee. Validation. Value in comparison with other assessment tests. Scand. J. Rheumatol. 1987. № 65. Р. 85-89.
- Arunrukthavon P., Heebthamai D. et al. Can urinary CTX-II be a biomarker for knee osteoarthritis? Arthroplasty. 2020. Vol. 2. № 6.
- Pelletier J.-P. et al. Strontium ranelate reduces the progression of experimental dog osteoarthritis by inhibiting the expression of key proteases in cartilage and of IL-1β in the synovium. Ann. Rheum. Dis. 2013. № 72(2). Р. 250-257.
- Railhac J.-J., Zaim M., Saurel A.-S. et al. Effect of 12 months treatment with chondroitin sulfate on cartilage volume in knee osteoarthritis patients: a randomized, double-blind, placebo-controlled pilot study using MRI. Clin. Rheumatol. 2012 Sep. № 31(9). Р. 1347-57. doi: 10.1007/s10067-012-2022-4.
- Martel-Pelletier J., Roubille C., Abram F., Hochberg M.C. et al. First-line analysis of the effects of treatment on progression of structural changes in knee osteoarthritis over 24 months: data from the osteoarthritis initiative progression cohort. Ann. Rheum. Dis. 2015. № 74(3). Р. 547-556.

/36.jpg)
/37.jpg)
/38.jpg)