Вступ
Біль є частою причиною звернення за медичною допомогою в усьому світі. Згідно із даними Global Pain Index Report (Дослідження глобального індексу болю), у 2020 році 34 % населення світу щодня відчували хронічний біль різної локалізації, серед яких кожна п’ята особа була віком молодше 30 років [1]. В осіб молодого віку (18–34 років) найпоширенішим типом болю є м’язовий, тоді як серед осіб середнього та літнього віку (старше 55 років) найчастіше виникає біль у суглобах [2].
Найбільш поширеною причиною болю в суглобах є остеоартрит (ОА). У результаті його прогресування в процес залучаються всі структурні елементи суглоба (хрящ, синовіальна оболонка, капсула, субхондральна кістка та ін.) [3]. Захворюваність на ОА зростає з віком, а його поширеність серед жіночого населення вища, ніж у чоловіків. У структурі захворювань опорно-рухового апарату частота ОА колінного суглоба (КС) є вдвічі вищою, ніж ОА кистей та кульшового суглоба. Тенденція до збільшення кількості випадків ОА зберігається до 80 років, а серед осіб старечого віку та довгожителів спостерігається деяке зниження частоти ураження всіх груп суглобів [4]. Протягом останніх 20 років поширеність ОА в світі зросла майже на 65 %, а кількість звернень до лікарів первинної ланки медичної допомоги досягає 4 мільйонів на рік [5].
Крім основної скарги пацієнтів на біль, симптоми ОА КС варіюють від незначної скутості до вираженої зміни ходи та обмеження рухів. Лікування ОА є тривалим процесом, який повинен базуватися на засадах доказової медицини [3]. Проте на сьогодні не існує ефективних методів лікування, які могли б забезпечити пацієнтам повне одужання. Терапія ОА повинна бути комплексною та включати немедикаментозні підходи, фармакологічні методи лікування та, за потреби, хірургічні процедури [6].
Для лікування даної патології найбільш часто призначають нестероїдні протизапальні препарати (НПЗП). Їх застосування рекомендовано в усіх актуальних іноземних і вітчизняних настановах щодо лікування пацієнтів ОА різної локалізації. Важливо пам’ятати, що застосовувати НПЗП рекомендовано в найнижчих ефективних дозах протягом максимально короткого проміжку часу, а у пацієнтів із підвищеним ризиком шлунково-кишкових ускладнень слід застосовувати гастропротективні заходи [6]. НПЗП вважають наріжним каменем медикаментозної терапії ОА, оскільки основною їх функцією є забезпечення полегшення проявів болю та зменшення запалення [7].
Метою дослідження було порівняння ефективності лікування пацієнтів із симптоматичним ОА КС препаратами диклофенаку натрію та мелоксикаму.
Матеріали та методи
На базі відділу клінічної фізіології та патології опорно-рухового апарату Державної установи «Інститут геронтології імені Д.Ф. Чеботарьова НАМН України» проведено проспективне рандомізоване відкрите активно-контрольоване в двох паралельних групах дослідження, яке було схвалене комісією з питань етики зазначеної установи (протокол № 36/20 від 17 грудня 2020 року).
Випробовування було проведено відповідно до умов Гельсінської декларації. Перед початком скринінгових процедур дослідники отримали підписану пацієнтом власноруч інформовану згоду на участь у ньому. Ідентифікаційна інформація пацієнта оброблялася лише уповноваженим персоналом і зберігалася в замкнених шафах, доступних лише для дослідницького персоналу.
У дослідження включено 40 осіб жіночої статі з симптоматичним ОА КС II–III ступеня за Келгреном — Лоуренсом. Критерії включення: жінки у постменопаузальному періоді віком 50–75 років; тривалість клініко-рентгенологічно підтвердженого ОА не менше 3 місяців; вираженість больового синдрому > 40 мм за візуально-аналоговою шкалою (ВАШ) на момент включення в дослідження; індекс маси тіла (ІМТ) ≤ 35 кг/м2. Критеріями виключення з дослідження були: гіперчутливість до диклофенаку натрію чи мелоксикаму або до інших складових лікарських засобів чи до активних речовин з подібною дією; наявність симптомів астми, ангіоневротичного набряку або кропив’янки після прийому НПЗП; кровотеча із шлунково-кишкового тракту чи перфорація в анамнезі; активна пептична виразка, гостра чи тяжка серцево-судинна недостатність, порушення функції печінки та нирок. Крім того, до критеріїв виключення відносили прийом інших НПЗП протягом 2 тижнів або глюкокортикостероїдів протягом 4 тижнів до моменту включення в дослідження та прийом симптом-модифікуючих засобів сповільненої дії для лікування ОА (SYSADOA) протягом 2 тижнів до початку участі в дослідженні.
Пацієнти, які відповідали критеріям включення і не мали критеріїв виключення, були зареєстровані та випадковим чином розподілені до групи І або ІІ. Пацієнти обох груп отримували стандартну немедикаментозну терапію ОА (фізична терапія, застосування наколінників у разі потреби).
До групи I увійшли 20 осіб, які отримували внутрішньом’язові ін’єкції диклофенаку натрію (диклоберл) 75 мг (3 мл) 1 раз на добу протягом 5 діб, з подальшим пероральним прийомом диклофенаку натрію (диклоберл ретард) 100 мг на добу в капсульній формі впродовж 15 діб. До групи II увійшли 20 осіб, які 1 раз на добу протягом 5 діб отримували внутрішньом’язові ін’єкції мелоксикаму 15 мг (1,5 мл) з подальшим прийомом препарату в таблетованій формі 7,5 мг двічі на добу впродовж 15 діб.
На етапі скринінгу всім пацієнтам проводили загальноклінічне обстеження, антропометричні виміри (зріст, маса тіла та розрахунок ІМТ), оцінку больового синдрому, функціонального стану колінних суглобів та загального самопочуття.
Вираженість больового синдрому оцінювали за допомогою чотирьохскладової ВАШ та субшкали болю індексу Western Ontario and McMaster Universities Osteoarthritis Index (WOMAC), скутість — за відповідною субшкалою індексу WOMAC, функціональний стан КС — за субшкалою повсякденної активності WOMAC, індексом Лекена та шляхом проведення функціональних тестів: 3-метрового (с), 4-метрового (с), 15-метрового (с), 6-хвилинного (м) та тесту «сісти — встати» перед початком терапії, на 5-ту та 20-ту добу лікування. Динаміку зниження больового синдрому оцінювали за ВАШ щоденно протягом 1–5 діб лікування. Оцінку переносимості та безпечності вивчали методом контролю небажаних явищ та побічних реакцій на підставі суб’єктивних симптомів і відчуттів пацієнта й об’єктивних даних, отриманих дослідником при обстеженні.
Статистичний аналіз проводили з використанням програми Statistica 10.0. Нормальність розподілу отриманих результатів визначали за критерієм Шапіро — Вілка. Результати статистичного аналізу наведені у вигляді M ± SD, де M — середнє значення, SD — стандартне відхилення. Відмінності показників вважали вірогідними за умови р < 0,05. Для проведення статистичного аналізу використовували t-критерій Стьюдента для споріднених і незалежних вибірок та критерій Крускала — Волліса у разі непараметричного розподілу даних.
Результати
Пацієнти обох груп не відрізнялися між собою за віком, антропометричними даними та початковим рівнем болю у КС (табл. 1).
На тлі проведеного лікування пацієнти обох груп продемонстрували значне зниження інтенсивності болю за ВАШ порівняно з вихідними даними на 5-ту та 20-ту добу лікування (р < 0,01). Однак вірогідних відмінностей у зменшенні інтенсивності болю за ВАШ між групами не було (р = 0,36 та р = 0,67 на 5-ту та 20-ту добу лікування). Кількість пацієнтів, у яких показник ВАШ покращився > 50 % на 20-ту добу лікування, становив 17 у групі І та 13 у групі ІІ. Ці відмінності не були статистично значущими (р = 0,23), що свідчить про високу ефективність обох препаратів у хворих з ОА КС.
/36.jpg)
У пацієнтів обох груп також виявлено вірогідне зменшення показників болю, скутості та обмеження повсякденної активності за субшкалами WOMAC порівняно з початковим рівнем на 5-ту та 20-ту добу лікування. Так, після 5 діб лікування у групі І інтенсивність болю зменшилась з 46,8 ± 8,9 мм до 26,4 ± 14,1 мм (t = 6,1, p < 0,00001) та з 49,9 ± 14,4 мм до 35,7 ± 13,6 мм (t = 7,8, p < 0,00001) у групі II. У хворих, які отримували диклофенак натрію, інтенсивність больового синдрому через 5 діб лікування була вірогідно меншою (t = 2,8, p < 0,004), ніж у групі ІІ. Після завершення повного курсу лікування біль зменшився з 46,8 ± 8,9 мм до 19,2 ± 14,3 мм (t = 7,1, p < 0,00001) у пацієнтів групи І та з 49,9 ± 14,4 мм до 21,5 ± 14,1 мм (t = 6,9, p < 0,00001) у пацієнтів групи ІІ (рис. 1).
/37.jpg)
Результати дослідження також продемонстрували вірогідне зменшення проявів скутості за даними WOMAC після 5 діб лікування у групі І з 53,1 ± 23,7 мм до 34,6 ± 22,6 мм (t = 3,8, p < 0,001) та з 57,8 ± 20,1 мм до 36,7 ± 21,8 мм (t = 6,4, p < 0,0001) у групі ІІ. Після завершення повного курсу лікування прояви скутості за шкалою WOMAC зменшились з 53,1 ± 23,7 мм до 25,7 ± 21,4 мм (t = 5,6, p < 0,0001) у пацієнтів групи І та з 57,8 ± 20,1 мм до 25,5 ± 19,0 мм (t = 7,8, p < 0,0001) у пацієнтів групи ІІ.
Обмеження повсякденної активності, пов’язане з ОА КС, на 5-ту добу лікування ін’єкціями диклофенаку натрію зменшилося з 45,7 ± 15,6 мм до 33,1 ± 17,7 мм (t = 4,2, p < 0,001), а в групі хворих, які отримували мелоксикам, — з 50,1 ± 19,1 мм до 35,0 ± 20,7 мм (t = 4,8, p < 0,0001). Після завершення курсу лікування обмеження повсякденної активності за шкалою WOMAC у пацієнтів групи І зменшилося з 45,7 ± 15,6 мм до 26,2 ± 19,1 мм (t = 5,8, p < 0,0001) та з 50,1 ± 19,1 мм до 23,3 ± 17,7 мм у пацієнтів групи ІІ (t = 6,9, p < 0,0001).
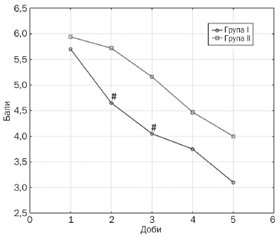
Разом з цим у пацієнтів, які отримували ін’єкції препаратом диклофенаку, було зареєстровано більш швидке зменшення інтенсивності больового синдрому в КС. Так, рівень болю за ВАШ на 2-гу та 3-тю добу лікування був вірогідно нижчим у групі І порівняно з показниками групи ІІ (p = 0,003 та p = 0,03 відповідно) (рис. 2).
За результатами оцінки альгофункціонального індексу Лекена виявлено вірогідне його покращення серед пацієнтів обох груп на тлі проведеного лікування. Так, у групі І виявлено вірогідне покращення на 22,5 % на 5-ту добу лікування (p < 0,01) та на 31,4 % (p < 0,01) на 20-ту добу. У групі ІІ відповідні показники на 5-ту та 20-ту добу зменшились на 16,2 % (p < 0,01) і на 24,2 % (p < 0,01) відповідно. Вірогідних відмінностей показників у групах І та ІІ через 5 і 20 діб лікування виявлено не було.
Під час вивчення функціональних можливостей з використанням 3-метрового, 4-метрового, 15-метрового, 6-хвилинного тесту та тесту «сісти — встати» в обох групах виявлено вірогідне покращення у виконанні функціональних тестів на 5-ту та 20-ту доби лікування. Так, у групі І тривалість виконання 3-метрового тесту на 5-ту добу лікування вірогідно покращилась на 9,7 % (p < 0,01) та на 12,0 % — на 20-ту добу (p < 0,01). У групі ІІ покращення його виконання становило 5,2 % (p < 0,01) та 11,3 % (p < 0,01) на 5-ту та 20-ту добу лікування відповідно.
Покращення показників 6-хвилинного тесту у групі І становило 2,9 % (p < 0,01) після курсу ін’єкцій і 3,4 % — після завершення повного курсу лікування (p < 0,01), на 0,9 % (p < 0,01) та 1,4 % (p < 0,01) у групі ІІ.
За результатами тесту «сісти — встати» виявлено, що у групі І тривалість його виконання на 5-ту добу лікування вірогідно зменшилась на 11,5 % (p < 0,01) та на 10,8 % (p < 0,01) на 20-ту добу. У групі ІІ показники виконання тесту покращились на 8,6 % (p < 0,01) і 13,7 % (p < 0,01) на 5-ту та 20-ту добу лікування відповідно.
Небажаних явищ або побічних ефектів, які вимагали б відміни чи зміни дози досліджуваних препаратів чи застосування додаткових лікарських засобів, в обох групах протягом усього дослідження не зареєстровано.
Обговорення
У всьому світі диклофенак натрію залишається препаратом вибору за наявності переважної більшості больових синдромів, разом з цим маючи також жарознижуючі та протизапальні властивості. Як і більшість НПЗП, диклофенак знижує концентрацію прозапальних і ноцицептивних простагландинів у синовіальній рідині та крові шляхом пригнічення їхнього синтезу. Диклофенак часто використовують як порівняльний засіб у рандомізованих контрольованих дослідженнях щодо оцінки ефективності НПЗП за наявності ОА. Результати клінічних випробувань вказують на його високу ефективність, яка не поступається більш новим молекулам НПЗП [6].
Найчастіше диклофенак призначають у пероральній формі, але також часто використовують і місцеві, внутрішньовенні, внутрішньом’язові, підшкірні та ректальні форми введення. Парентеральні форми є пріоритетними за необхідності швидкого початку знеболювання пацієнта [9]. Внутрішньом’язове введення забезпечує вищу біодоступність та швидкість розвитку терапевтичної дії препарату порівняно з місцевою ректальною чи пероральною формою [10].
За даними літератури, препарати диклофенаку та мелоксикаму показали найбільш виражений ефект щодо зменшення інтенсивності болю за ВАШ [11]. У дослідженні, проведеному J. Hosie та співавт., в якому обстежено 336 пацієнтів, які отримували пероральний препарат мелоксикам 7,5 мг 1 раз на добу або диклофенак 100 мг 1 раз на добу протягом 6 місяців, обидва препарати продемонстрували високий рівень ефективності. Однак авторами не отримано вірогідних відмінностей між групами лікування щодо зменшення болю в КС під час руху та в спокої, загальної оцінки ефективності лікування або оцінки якості життя наприкінці лікування [12]. За результатами нашого дослідження також виявлено зниження інтенсивності болю за ВАШ на 5-ту добу лікування в групі І на 33,3 % та у групі ІІ на 30,1 % (p < 0,01 для обох груп), на 20-ту добу на 57,9 та 56,6 % у групах І та ІІ відповідно (p < 0,01 для обох груп), однак вірогідних відмінностей показників між групами не отримано (р = 0,36 і р = 0,67 на 5-ту та 20-ту добу лікування).
За результатами метааналізу, який включав 192 дослідження за участю 102 829 осіб, де порівнювали ефективність та безпечність 90 активних схем лікування НПЗП, опіоїдів та парацетамолу з пероральним плацебо, найбільш ефективними препаратами для зменшення болю у пацієнтів з ОА колінного та кульшового суглобів виявили диклофенак у дозі 150 мг/д та еторикоксиб 60 мг/д [13].
За даними ще одного метааналізу, в якому порівнювали ефективність різних схем лікування НПЗП за результатами 8973 друкованих праць, з яких 76 рандомізованих досліджень із загальною кількістю 58 451 пацієнт, диклофенак у дозі 150 мг/д виявився найбільш ефективним з точки зору зменшення інтенсивності болю та відновлення фізичної функції. Ефективність лікування варіювала залежно від діючої речовини НПЗП та її дози. Тоді як парацетамол показав мінімальний вплив на вираженість больового синдрому за умов використання різних доз, що відповідав різниці 4,5 мм на 100 мм за ВАШ, диклофенак натрію у дозі 150 мг/д продемонстрував ефект, що відповідав різниці 14 мм за ВАШ. Цей показник в 1,5 раза перевищував мінімальну клінічно важливу різницю для лікування хронічного болю. Результати даного метааналізу також свідчать про те, що типовий пацієнт з ОА має 100% вірогідність мінімального клінічно важливого поліпшення під час прийому диклофенаку натрію в дозі 150 мг/д, еторикоксибу 60 мг/д або рофекоксибу 25 мг/д [14]. За результатами нашого дослідження зменшення болю на 20-ту добу лікування становило 33 мм у групах І та ІІ (p < 0,01 для обох груп).
За даними різних авторів, інтенсивність больового синдрому за показниками субшкали болю WOMAC серед пацієнтів, які застосовують диклофенак натрію, зменшується до 88,9 % через 4 тижні лікування. Після 4 тижнів лікування показник болю за ВАШ зменшується з вихідного рівня до 79,3 %, показник скутості — до 78,1 %, а показник якості життя — до 76,5 % [15]. За результатами нашого дослідження, на 20-ту добу лікування диклофенаком натрію показник болю за WOMAC зменшився на 55,5 % (p < 0,01), скутості — на 51,5 % (p < 0,01) та якості життя — на 42,6 %.
Висновки
Застосування диклофенаку натрію та мелоксикаму на тлі комплексного немедикаментозного лікування ОА КС є ефективним та безпечним, проте у разі застосування диклофенаку натрію знеболювання настає швидше, що проявляється вірогідно більш вираженим зниженням інтенсивності больового синдрому вже на 2-гу та 3-тю добу лікування.
Обмеження даного дослідження: дизайн дослідження (проведення його в одному центрі), включення лише жінок віком 50–75 років та нетривалий період спостереження (20 діб).
Конфлікт інтересів. Препарат для дослідження надано компанією Berlin-Chemie Ag (Menarini Group). Автори заявляють про відсутність фінансової підтримки у написанні статті та аналізі результатів дослідження.
Інформація про внесок кожного автора: Поворознюк В.В. — концепція і дизайн дослідження; Бистрицька М.А. — статистична обробка, написання тексту; Мусієнко А.С. — збирання й обробка матеріалів, написання тексту; Заверуха Н.В. — аналіз літератури, збирання й обробка матеріалів, написання тексту; Григор’єва Н.В. — аналіз отриманих даних, корекція тексту; Ткачук А.А. — обробка первинного матеріалу; Солоненко Т.Ю. — обробка первинного матеріалу.
Отримано/Received 23.11.2021
Рецензовано/Revised 08.12.2021
Прийнято до друку/Accepted 13.12.2021
/38.jpg)

/36.jpg)
/37.jpg)