Резюме
Актуальність. Жодна відома схема лікування Н.pylori-асоційованої пептичної виразки дванадцятипалої кишки (ПВДПК) не має 100% ефективності. Мета: оцінити ефективність модифікованої комплексної терапії Н.pylori-асоційованої пептичної виразки дванадцятипалої кишки в дітей. Матеріали та методи. У дослідження включені 66 дітей віком від 7 до 18 років, хворих на Н.pylori-асоційовану ПВДПК у стадії загострення. Рівні вітаміну D в сироватці крові вимірювали за допомогою електрохемілюмінесцентного методу (Roche Diagnostics GmBH, Мангейм, Німеччина). Використовувався класичний метод посіву фекалій. Дітей розподілено на три групи: I — 20 дітей, які отримували протокольну ерадикаційну терапію, II — 23 дитини, які отримували модифіковану комплексну терапію із включенням препарату вітаміну D3, III — 23 дитини, які отримували модифіковану комплексну терапію із включенням препарату вітаміну D3 та синбіотик. Результати. Середня тривалість перебування у стаціонарі хворих, які отримували модифіковану терапію із додаванням препарату вітаміну D3, скоротилась на 18,8 %, а у хворих, які отримували додатково ще і синбіотик, — на 23,8% порівняно з особами І групи. При ендоскопічному дослідженні, проведеному через 1 місяць, вірогідно частіше в дітей I групи спостерігали наявність на місці виразкового дефекту витягнутого рубця червоного кольору (65,5 %), ніж у дітей II (47,8 %) та III групи (39,1 %), χ2 = 3,87, р < 0,05; через 1 рік у 33,3 % осіб I групи, у 17,3 % осіб II групи та у 8,7 % осіб III групи (р < 0,01) встановлено рецидив захворювання. Визначення основних показників оцінки ефективності лікування ПВДПК із застосуванням модифікованої схеми показало, що відносний ризик розвитку рецидивів захворювання знизиться в 0,42 раза (χ2 = 3,96, р < 0,05) при включенні препарату вітаміну D3 в схему лікування та в 0,52 раза (χ2 = 4,06, р < 0,01) при застосуванні препарату D3 та синбіотика. Висновки. 1. У дітей із Н.pylori-асоційованою пептичною виразкою дванадцятипалої кишки визначається недостатність вітаміну D3 та реєструються різноманітні порушення кишкової мікрофлори, що може ускладнювати перебіг, посилювати хронізацію процесу, знижувати ефективність антигелікобактерної терапії. 2. У результаті використання модифікованого комплексного лікування виразки дванадцятипалої кишки, асоційованої з мікроорганізмом H.pylori, спостерігалось скорочення термінів купірування основних клінічних проявів захворювання, тривалості стаціонарного лікування хворих дітей та зменшення частоти рецидивування захворювання.
Background. None of the known regimens for the treatment of H.pylori-associated peptic ulcer of the duodenum (PUD) is 100 % effective. The purpose was to evaluate the effectiveness of the modified comprehensive therapy for Н.pylori-associated peptic ulcer of the duodenum in children. Materials and methods. The study included 66 patients aged 7 to 18 years with Н.pylori-associated PUD in the acute stage. Serum vitamin D levels were measured using the electrochemiluminescence method (Roche Diagnostics GmbH, Mannheim, Germany). The classical method of stool culture was used. The children were divided into three groups: the first — 20 patients who received protocol eradication therapy, the second — 23 children who received modified comprehensive therapy with the inclusion of vitamin D3, the third — 23 patients who received modified comprehensive therapy with the inclusion of vitamin D3 and a synbiotic. Results. The average length of stay in the hospital for patients who received modified therapy with the inclusion of vitamin D3 was reduced by 18.8 %, and in those who received synbiotic additionally — by 23.8 % compared to the first group. During the endoscopic examination conducted after 1 month, the presence of an elongated red scar at the site of the ulcer defect was observed significantly more often in group I (65.5 %) than in groups II (47.8 %) and III (39.1 %), χ2 = 3.87, p < 0.05; after 1 year, 33.3 % of children in group I, 17.3 % in group II, and 8.7 % in group III (p < 0.01) had a recurrence of the disease. The determination of the main indicators for the effectiveness of PUD treatment using a modified scheme showed that the relative risk of disease recurrence will decrease by 0.42 times (χ2 = 3.96, p < 0.05) when vitamin D3 preparation is included in the treatment scheme and by 0.52 times (χ2 = 4.06, p < 0.01) when using vitamin D3 and a synbiotic. Conclusions. 1. Children with Н.pylori-associated peptic ulcer of the duodenum have vitamin D3 deficiency and various disturbances of the intestinal microbiota, which can complicate the course, increase the chronicity of the process, and reduce the effectiveness of anti-Helicobacter therapy. 2. The use of a modified comprehensive treatment for duodenal ulcer associated with H.pylori leads to a reduction in the duration of the main clinical manifestations of the disease, the duration of inpatient treatment of sick children and a decrease in the frequency of recurrence of the disease.
Вступ
У даний час доведено етіологічну роль інфекції Helicobacter pylori (Н.pylori) у розвитку хронічних запальних та деструктивних захворювань верхніх відділів шлунково-кишкового тракту [1]. Повсюдним та високим поширенням хелікобактерної інфекції зумовлений великий інтерес до Н.pylori-асоційованих захворювань [2]. Серед цих захворювань у дітей чільне місце посідає виразкова хвороба, зокрема виразка дванадцятипалої кишки. Проблема лікування даного захворювання набуває не тільки наукової, а й соціальної значущості і є актуальною для дільничних лікарів, фахівців-гастроентерологів та дитячих хірургів. Багатофакторність виникнення, рецидивуючий перебіг та неухильне прогресування патологічних змін у слизовій оболонці дванадцятипалої кишки роблять актуальною розробку та впровадження заходів, спрямованих на підвищення ефективності терапевтичних підходів у таких хворих [3].
Вивчення особливостей інфекційного процесу, зумовленого присутністю в слизовій оболонці шлунка і дванадцятипалої кишки мікроорганізму H.pylori [4], дозволило по-новому подивитися на патогенез виразкової хвороби шлунка і дванадцятипалої кишки, а також призвело до успішної ерадикаційної терапії інфекції [5]. Останні десятиліття суттєво трансформували уявлення про співвідношення причинних факторів виразкової хвороби, що призвело до значних змін у лікувальних підходах щодо таких хворих. Провідне місце в лікуванні виразкової хвороби відводиться антибактеріальному впливу на мікроорганізм H.pylori. Антибактеріальна терапія — найбільш жорстко регламентований у всьому світі розділ фармакотерапії [6]. Це продиктовано міркуваннями ефективності та безпеки використання медичної технології. Тому в багатьох державах Європи та Америки розроблено стандарти лікування інфекції H.pylori у хворих на виразкову хворобу [7, 8]. Елімінація мікроорганізмів із шлункової слизової оболонки значно знижує частоту виникнення ускладнень виразкової хвороби [9]. Однак практичний досвід показує, що антихелікобактерна терапія супроводжується у частини хворих виникненням несприятливих побічних реакцій. Крім того, у низці випадків при виразковій хворобі, асоційованій з інфекцією H.pylori, після курсу ерадикаційної терапії можуть виникати рецидиви інфекції та клініко-ендоскопічні ознаки загострення захворювання [10]. Відповідно до результатів досліджень, виконаних із позицій науково обґрунтованої медичної практики, найкращі результати в етіотропній терапії хворих із шлунковим хелікобактеріозом сьогодні досягаються шляхом застосування комбінацій одного препарату, що блокує шлункову секрецію, та двох або трьох препаратів, що безпосередньо впливають на бактерію. Жодна відома схема лікування Н.pylori-асоційованої пептичної виразки дванадцятипалої кишки (ПВДПК) не має 100% ефективності. Дискутабельними залишаються питання, пов’язані з використанням конкретних фармакотерапевтичних режимів лікування ПВДПК. Все більше обґрунтованою є думка про необхідність індивідуалізації лікування захворювання.
Матеріали та методи
У дослідження включені 66 дітей віком від 12 до 18 років, хворих на Н.pylori-асоційовану ПВДПК у стадії загострення. Усім дітям проведене комплексне клінічно-параклінічне дослідження за загальноприйнятими методиками. Діагноз ПВДПК верифікувався за допомогою клінічного, ендоскопічного та морфологічного дослідження (наказ МОЗ України № 59, 2013 р.). Критерії включення в дослідження: місце проживання (м. Чернівці та Чернівецька область); вік (7–18 років); стать (кількість хлопчиків та дівчаток); однотипність клінічного діагнозу, однотипний характер порушень функції шлунка, єдина діагностична програма, позитивний тест на H.pylori. Критерії виключення з дослідження: наявність декомпенсованої супутньої патології; вік до 7 років, обстеження в інших лікувально-профілактичних закладах, проживання за межами Чернівецької області; вживання антибактеріальної терапії, біопрепаратів, пробіотиків упродовж одного місяця та антисекреторних препаратів за 4 доби до дослідження. Дослідження проведене з урахуванням основних положень GCР ІCH та Гельсінської декларації з біомедичних досліджень. Дизайн дослідження передбачав дотримання принципів конфіденційності та поваги до особистості дитини й інших етичних принципів стосовно людей, які виступають суб’єктами дослідження.
Верифікація H.pylori проводилася безпосередньо під час ендоскопічного дослідження (забір біоптатів із тіла, антрального відділу шлунка та цибулини ДПК). У сироватці крові дітей, хворих на виразкову хворобу ДПК, методом імуноферментного аналізу виявляли сумарні антитіла до антигену CagA H.pylori.
Рівні вітаміну D в сироватці крові вимірювали за допомогою електрохемілюмінесцентного методу (Roche Diagnostics GmBH, Мангейм, Німеччина). Сироватки, отримані центрифугуванням, зберігали при –20 °C і аналізували одночасно. Оцінка результатів проводилася відповідно до рекомендацій Міжнародного товариства ендокринологів (Holick M.F., 2011): дефіцит вітаміну D — рівень менше 20 нг/мл (менше 50 нмоль/л); недостатність вітаміну D — 21–29 нг/мл (51–75 нмоль/л); нормальний уміст вітаміну D — 30–100 нг/мл (76–250 нмоль/л).
Дослідження мікрофлори товстої кишки проводилося відповідно до рекомендацій Р.В. Епштейн-Литвак і Ф.Л. Вільшанської (1977). Використовувався класичний метод посіву фекалій [22], розведених в ізотонічному розчині натрію хлориду (102–109) на диференційно-діагностичні середовища (референтні штами Escherichia coli АТСС25922; Pseudomonas aerugіnosa АТСС27853-(F51); Bacillus subtilis АТСС6633; Staphylococcus aureus АТСС25923-(F-49); Klebsiella pneumoniaе № 43; Proteus mirabilis № 50; Proteus vulgaris № 52; Citrobacter сoseri ATCC 27156). Для оцінки ступеня тяжкості дисбактеріозу використовували класифікацію І.В. Куваєвої і К.С. Ладодо (1991).
Дітей розподілено на три групи: I — 20 дітей, які отримували протокольну ерадикаційну терапію (інгібітор протонної помпи (езомепразол по 40 мг/добу), флемоксин солютаб (по 20 мг/кг 2 рази/добу), фуразолідон (по 10 мг/кг 2 рази/добу), колоїдний субцитрат вісмуту (де-нол по 0,12 г 3 рази/добу) впродовж 7 діб), II — 23 дитини, які отримували модифіковану комплексну терапію (протокольна ерадикаційна терапія із включенням препарату вітаміну D3 у дозі 2000 МО щодня впродовж 1 місяця), III — 23 дитини, які отримували модифіковану комплексну терапію (протокольна ерадикаційна терапія з включенням препарату вітаміну D3 у дозі 2000 МО щодня впродовж 1 місяця та синбіотик, що містить Bifidobacterium animalis ssp. (BB-12), Lactobacillus acidophilus (LA-5) у співвідношенні 1 : 1 у кількості 4 × 109 КУО та фруктоолігосахарид 1400 мг (рафтилоза) по 1 саше 2 рази на день 1 місяць). Групи спостереження репрезентативні за віком, статтю та місцем проживання (р > 0,05).
Оцінку ефективності комплексного модифікованого лікування проводили через 3 міс., 6 міс. та 1 рік. Як критерії ефективності лікування використовували строки зникнення основних синдромів захворювання, характер ендоскопічної картини, стійкість ерадикації H.pylori, частоту рецидивування та ускладнень.
Нормальність розподілу ознаки у варіаційному ряду оцінювали за допомогою критерію Колмогорова — Смирнова. Дані, що підкоряються закону нормального розподілу, подані у вигляді середнього значення і стандартного відхилення. При порівнянні кількісних ознак двох сукупностей, що підкоряються закону нормального розподілу, використовували критерій Стьюдента. Критерій Манна — Уїтні застосовували, якщо порівнювані сукупності не відповідали закону нормального розподілу. Визначали відносний ризик розвитку рецидиву та число хворих, яких необхідно пролікувати для одного позитивного результату.
Результати та обговорення
Діти обох груп до проведення лікування не відрізнялися за клінічними проявами захворювання (больовий синдром спостерігався у 98,4 % дітей, диспептичний — у 87,8 %, інтоксикаційний — у 81,8 %) та ендоскопічною картиною (у 89,3 % дітей діагностований один виразковий дефект малого або середнього розмірів частіше по передній стінці цибулини ДПК, у 10,6 % хворих — по два і більше виразкових дефекти слизової оболонки цибулини ДПК; у всіх пацієнтів спостерігали ознаки дуоденіту або гастродуоденіту).
При оцінюванні тривалості больового синдрому встановлено вірогідне переважання випадків із збереженням болю впродовж 1 тижня (86,4 %) порівняно з особами, у яких біль не зникав впродовж 2 (10,2 %) та 3 тижнів (3,4 %), р < 0,001. Прояви диспептичного синдрому нівелювались впродовж 6,7 ± 0,8 дня в дітей І групи, 5,4 ± 0,4 дня в дітей II групи та 4,3 ± 0,2 дня в дітей IІІ групи, p < 0,01.
Застосування модифікованого комплексного лікування у хворих на ПВДПК дітей III групи дозволило скоротити на 27,8 % термін купірування больового, на 14,0 % — диспептичного та на 25,0 % — астеновегетативного синдромів щодо таких показників у дітей I групи, тоді як у дітей II групи ці показники становили відповідно 22,4; 11,7 та 19,4 %.
Середня тривалість перебування у стаціонарі хворих, які отримували модифіковану терапію із додаванням препарату вітаміну D3, скоротилась на 18,8 %, а у хворих, які отримували додатково ще і синбіотик, — на 23,8 % порівняно з особами І групи.
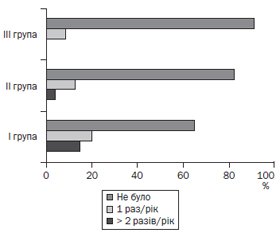
При ендоскопічному дослідженні, проведеному через 1 місяць, вірогідно частіше в дітей I групи спостерігали наявність на місці виразкового дефекту витягнутого рубця червоного кольору (65,5 %), ніж у дітей II (47,8 %) та III групи (39,1 %), χ2 = 3,87, р < 0,05. Через 3 місяці та через півроку загострення ПВДПК із наявністю виразок або ерозій виявлене лише в дітей I групи. За даними ендоскопічного обстеження через 1 рік у 33,3 % осіб I групи, у 17,3 % осіб II групи та у 8,7 % осіб III групи (р < 0,01) встановлено рецидив захворювання (рис. 1).
Середній рівень вітаміну D3 в крові дітей із ПВДПК становив 27,78 ± 4,49 нг/мл, що свідчить про його недостатність та обґрунтовує додаткове призначення в комплексній терапії. Динаміка показників вітаміну D3 в крові дітей, які знаходилися під спостереженням, подана в табл. 1.
Установлено, що у дітей із ПВДПК, асоційованою із Н.pylori, суттєво знижується виявлення біфідобактерій та виділення із порожнини товстої кишки пептострептококів, ентерококів, підвищується рівень умовно-патогенних анаеробних бактерій, факультативних анаеробних та аеробних ентеротоксигенних та ентеропатогенних ешерихій. Найбільш часто виявляються відхилення в бік зростання дріжджоподібних грибів роду Candida. Динаміка біотопу дітей із ПВДПК залежно від схеми лікування подана в табл. 2.
Визначення основних показників оцінки ефективності лікування ПВДПК із застосуванням модифікованої схеми показало, що відносний ризик розвитку рецидивів захворювання знизиться в 0,42 раза (χ2 = 3,96, р < 0,05) при включенні препарату вітаміну D3 в схему лікування та в 0,52 раза (χ2 = 4,06, р < 0,01) при застосуванні препарату D3 та синбіотика (табл. 3).
Як відомо, імунна система реагує на циркулюючі рівні вітаміну D (25(OH)D) і забезпечує стійке і потенційно вигідне утворення 1,25(OH)2D під час імунної відповіді [11]. Метаболізм вітаміну D в макрофагах пов’язаний із розпізнаванням патогенів, що робить його невід’ємною частиною вродженої імунної відповіді. Раніше повідомлялося, що вітамін D3 демонструє анти-H.рylori-активність [12]. У дослідженні [13] створили моделі інфекції H.pylori у мишей для демонстрації того, що вітамін D3 пригнічує інфекцію H.pylori шляхом посилення експресії рецептора вітаміну D3 і антимікробного пептиду кателіцидину [14–16].
В метааналізі 13 досліджень виявлено взаємозв’язок між запальними захворюваннями кишечника й низьким рівнем 25(OH)D, причому на тлі загострення хвороби Крона реєструвалися більш низькі концентрації вітаміну D в крові [17]. Додавання вітаміну D дітям із запальними захворюваннями кишечника супроводжувалося підвищенням рівня 25(OH)D в крові (р < 0,05) і зниженням активності захворювання [18]. Проведені нами дослідження виявили недостатність вітаміну D3 в крові дітей із H.pylori-асоційованою виразкою дванадцятипалої кишки, що й було передумовою застосування препарату вітаміну D3 в комплексному лікуванні. Відомо, що ерадикаційна терапія, яка проводиться комбінацією 2–3 антибіотиків спільно з інгібіторами протонної помпи, часто супроводжується розвитком широкого спектра побічних ефектів і небажаних явищ (діарея, нудота, блювання, біль у животі), пов’язаних у тому числі із впливом на мікрофлору шлунково-кишкового тракту. Як показали дані рандомізованих клінічних досліджень [19], S.boulardii I-745, L. rhamnosus GG, а також комбінація 2 штамів лактобактерій L.helveticus R52 + L. rhamnosus R11, що застосовуються під час ерадикації, можуть покращувати переносимість терапії, знижуючи вираженість побічних ефектів. В метааналізі зі включенням 19 рандомізованих досліджень виявлено, що пробіотики, що містять комбінацію штамів L.acidophilus La5 + B.animalis lactis Bb12; L.helveticus R52 + L.rhamnosus R11; L.acidophilus nr + B.longum nr + E.faecalis nr, також підвищують частоту успішної ерадикації [20]. LA-5 (Lactobacillus acidophilus) і ВВ-12® (Bifidobacterium) є одними з найбільш вивчених штамів лакто- та біфідобактерій у світі, використовуються в харчовій та медичній промисловості з 1979 та 1985 р. відповідно, що дозволяє не сумніватися в їх безпеці, підтвердженій статусами GRAS (FDA, США) та QPS (Європейське агентство з безпеки продуктів харчування). Наше дослідження із застосуванням синбіотика, який містить Bifidobacterium animalis ssp. (BB-12), Lactobacillus acidophilus (LA-5) та фруктоолігосахарид, у складі модифікованої терапії H.pylori-асоційованої виразки дванадцятипалої кишки довело високу ефективність. Отже, з позицій доказової медицини призначення пробіотиків на період ерадикаційної терапії є доцільним як з точки зору досягнення успішної ерадикації, так і для запобігання побічним ефектам та кращої переносимості терапії. Оцінка віддалених результатів запропонованої модифікованої терапії показала, що при включенні до лікування препарату вітаміну D3 та синбіотика спостерігається тривала стійка клінічно-ендоскопічна ремісія захворювання з відновленням мікробіоценозу кишечника.
Висновки
1. У дітей із Н.pylori-асоційованою пептичною виразкою дванадцятипалої кишки визначається недостатність вітаміну D3 та реєструються різноманітні порушення кишкової мікрофлори, що може ускладнювати перебіг, посилювати хронізацію процесу, знижувати ефективність антигелікобактерної терапії.
2. У результаті використання модифікованого комплексного лікування виразки дванадцятипалої кишки, асоційованої з мікроорганізмом H.pylori, спостерігалось скорочення термінів купірування основних клінічних проявів захворювання, тривалості стаціонарного лікування хворих дітей та зменшення частоти рецидивування захворювання.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та дотримання принципів конфіденційності, концепції інформованої згоди та урахування основних положень GCР ІCH та Гельсінської декларації з біомедичних досліджень.
Отримано/Received 06.08.2022
Рецензовано/Revised 25.08.2022
Прийнято до друку/Accepted 06.09.2022
Список литературы
1. Saif N., Jensen N., Farrar E., Blackstone S., Hauck F.R. Prevalence of Helicobacter pylori infection among resettled refugees presenting to a family medicine clinic in the United States. Helicobacter. 2022. 27(3). e12894. doi: 10.1111/hel.12894.
2. Аguilera Matos I., Diaz Oliva S.Е., Escobedo A.A. Helicobacter pylori infection in children. BMJ Paediatr. Open. 2020. 4. e000679. doi: 10.1136/bmjpo-2020-000679.
3. White B., Winte M., DeSipio J., Phadtare S. Clinical Factors Implicated in Antibiotic Resistance in Helicobacter pylori Patients. Microorganisms. 2022. 10(2). 322. doi: 10.3390/microorganisms10020322.
4. Sharndama H.С., Mba I.E. Helicobacter pylori: an up-to-date overview on the virulence and pathogenesis mechanisms. Braz. J. Microbiol. 2022. 53(1). 33-50. doi: 10.1007/s42770-021-00675-0.
5. Cardos A.І., Maghiar A., Zaha D.С. et al. Evolution of Diagnostic Methods for Helicobacter pylori Infections: From Traditional Tests to High Technology, Advanced Sensitivity and Discrimination Tools. Diagnostics (Basel). 2022. 12(2). 508. doi: 10.3390/diagnostics12020508.
6. Karbalaei M., Talebi Bezmin Abadi A., Keikha M. Clinical relevance of the cagA and vacA s1m1 status and antibiotic resistance in Helicobacter pylori: a systematic review and meta-analysis. BMC Infec. Dis. 2022. 22(1). 573. doi: 10.1186/s12879-022-07546-5.
7. Saif N., Jensen N., Farrar E., Blackstone S., Hauck F.R. Prevalence of Helicobacter pylori infection among resettled refugees presenting to a family medicine clinic in the United States. Helicobacter. 2022. 27(3). e12894. doi: 10.1111/hel.12894.
8. Jones N.L., Koletzko S., Goodman K. et al. On behalf of ESPGHAN, NASPGHAN. Joint ESPGHAN/NASPGHAN Guidelines for the Management of Helicobacter pylori in Children and Adolescents (Update 2016). Journal of Pediatric Gastroenterology and Nutrition. 2017. 64(6). 991-1003. doi: 10.1097/MPG.0000000000001594.
9. Vital J.S., Tanoeiro L., Lopes-Oliveira R., Vale F.F. Biomarker Characterization and Prediction of Virulence and Antibiotic Resistance from Helicobacter pylori Next Generation Sequencing Data. Biomolecules. 2022. 12(5). 691. Published 2022 May 11. doi: 10.3390/biom12050691.
10. Park J.S., Jun J.S., Seo J.H., Youn H.S., Rhee K.H. Changing prevalence of Helicobacter pylori infection in children and adolescents. Clin. Expl. Pediatr. 2021. 64. 1. 21-25. https://doi.org/10.3345/cep.2019.01543.
11. Charoenngam N., Holick M.F. Immunologic Effects of Vitamin D on Human Health and Disease. Nutrients. 2020. 12(7). 2097. https://doi.org/10.3390/nu12072097.
12. El Shahawy M.S., Hemida M.Н., El Metwaly I., Shady Z.M. The effect of vitamin D deficiency on eradication rates of Helicobacter pylori infection. JGH Open. 2018. 2. 6. 270-275. doi: 10.1002/jgh3.12081.
13. Zhou A., Li L., Zhao G. et al. Vitamin D3 Inhibits Helicobacter pylori Infection by Activating the VitD3/VDR-CAMP Pathway in Mice. Front. Cell. Infect. Microbiol. 2020. 10. 566730. doi: 10.3389/fcimb.2020.566730.
14. Golpour A., Bereswill S., Heimesaat M.M. Antimicrobial and Immune-Modulatory Effects of Vitamin D Provide Promising Antibiotics-Independent Approaches to Tackle Bacterial Infections — Lessons Learnt from a Literature Survey. Eur. J. Microbiol. Immunol. 2019. 3. 80-87. doi: 10.1556/1886.2019.00014.
15. Hu W., Zhang L., Li M.Х. et al. Vitamin D3 activates the autolysosomal degradation function against Helicobacter pylori through the PDIA3 receptor in gastric epithelial cells. Autophagy. 2019. 5 (4). 707-725. doi: 10.1080/15548627.2018.1557835.
16. Senait A., Jolanta M., Anders R. et al. Vitamin D(3) Status and the Association with Human Cathelicidin Expression in Patients with Different Clinical Forms of Active Tuberculosis. Nutrients. 2018. 6. 721. doi: 10.3390/nu10060721.
17. Lu C., Yang J., Yu W. et al. Association between 25(OH)D Level, Ultraviolet Exposure, Geographical Location, and Inflammatory Bowel Disease Activity: A Systematic Review and Meta-Analysis. PLoS One. 2015. 10(7). e0132036. doi: 10.1371/journal.pone.0132036.
18. Martin N., Rigterink T., Adamji M., Wall C., Day A.S. Single high-dose oral vitamin D3 treatment in New Zealand children with inflammatory bowel disease. Transl. Pediatr. 2019. 8(1). 35-41. doi: 10.21037/tp.2018.11.01.
19. McFarland L.V., Malfertheiner P., Huang Y., Wang L. Meta-analysis of single strain probiotics for the eradication of Helicobacter pylori and prevention of adverse events. World Journal of Metaanalysis. 2015. 3(2). 97-117. https://doi.org/10.13105/wjma.v3.i2.97.
20. McFarland L.V., Huang Y., Wang L., Malfertheiner P. Systematic review and meta-analysis: Multi-strain probiotics as adjunct therapy for Helicobacter pylori eradication and prevention of adverse events. United European Journal of Gastroenterology. 2016. 4(4). 546-561. https://doi.org/10.1177/2050640615617358.
/20.jpg)

/21.jpg)