Журнал «Боль. Суставы. Позвоночник» Том 12, №2, 2022
Вернуться к номеру
Якість життя у хворих на анкілозивний спондиліт з анемічним синдромом за даними опитувальника ASQoL, зв’язок з перебігом захворювання
Авторы: Шевчук С.В. (1, 2), Звягіна О.В. (1), Звягін О.С. (3), Безсмертний Ю.О. (1, 2), Сегеда Ю.С. (1, 2)
(1) — Вінницький національний медичний університет імені М.І. Пирогова, м. Вінниця, Україна
(2) — Науково-дослідний інститут реабілітації осіб з інвалідністю Вінницького національного медичного університету імені М.І. Пирогова, м. Вінниця, Україна
(3) — Вінницький національний технічний університет, м. Вінниця, Україна
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
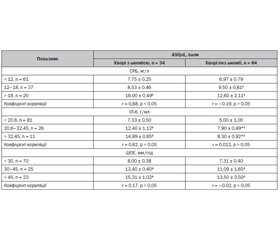
Актуальність. Анемія, як часта коморбідна патологія, посилює тяжкість перебігу, знижує якість життя (ЯЖ) та погіршує прогноз у хворих на анкілозивний спондиліт (АС). Проте досліджень, які вивчали б вплив анемії на перебіг захворювання та ЯЖ, оцінену за допомогою опитувальника ASQoL, на сьогодні недостатньо. Мета: проаналізувати ЯЖ з використанням опитувальника ASQoL у хворих на АС з анемією та оцінити її залежність від статевих чинників, а також форми та перебігу захворювання. Матеріали та методи. Обстежено 118 пацієнтів із АС та 26 практично здорових осіб групи контролю, репрезентативних за віком та статтю. ЯЖ оцінено за допомогою опитувальника ASQoL. Результати. ЯЖ у хворих на АС за даними опитувальника ASQoL становила 8,96 ± 0,41 бала. У хворих на АС з анемічним синдромом показники ЯЖ становили 11,85 ± 0,74 бала, у хворих на АС без анемії — 7,88 ± 0,44 бала. Пацієнти з периферичною формою АС та анемією мали гірші показники ASQoL (12,13 ± 0,94 бала) порівняно з особами з центральною формою АС та анемією (10,42 ± 1,21 бала). Також найгірші показники ЯЖ відмічені у хворих з анемією хронічного захворювання (АХЗ) (16,27 ± 0,44 бала) та АХЗ з дефіцитом заліза (11,50 ± 0,92 бала). У хворих із залізодефіцитною анемією показники ЯЖ вірогідно не відрізнялись від показників хворих без анемії (7,16 ± 0,52 бала). Активність захворювання та наявність анемічного синдрому мали вірогідний (р < 0,05) прямий кореляційний зв’язок (ІЛ-6: r = 0,62; СРБ: r = 0,68; BASDAI: r = 0,5; ASDAS: r = 0,25) з погіршенням ЯЖ за даними ASQoL. Висновки. Анемія є частою коморбідною патологією у хворих на АС та погіршує ЯЖ пацієнтів. Ступінь та патогенетичний тип анемії (зокрема, АХЗ) тісно корелюють з нижчою ЯЖ хворих на АС.
Introduction. Anemia, as a frequent comorbid pathology, increases the severity of the course, reduces the quality of life (QoL), and worsens the prognosis in patients with ankylosing spondylitis (AS). However, studies examining the impact of anemia on the course of the disease and QoL assessed using the ASQoL questionnaire are currently insufficient. The purpose was to analyze the QoL indices according to the ASQoL questionnaire in AS patients with anemia and to evaluate its dependence on gender, as well as the form and course of the disease. Materials and methods. 118 patients with AS and 26 practically healthy subjects, representative of age and gender, had been examined. QoL index was assessed using the ASQoL questionnaire. Results. QoL index in AS patients according to the ASQoL questionnaire was 8.96 ± 0.41 points. In AS patients with anemic syndrome, the QoL parameter was 11.85 ± 0.74 points, QoL index in AS patients without anemia was 7.88 ± 0.44 points. Patients with a peripheral form of AS and anemia have worse QoL index according to ASQoL scores (12.13 ± 0.94), compared to the subjects with a central form of AS and anemia (10.42 ± 1.21). Also, the worst indices of QoL were established in patients with anemia of chronic disease (ACD) (16.27 ± 0,44) and ACD with iron deficiency (11.50 ± 0.92). In the subjects with iron deficiency anemia (IDA), the indices of QoL did not significantly differ from parameters of the patients without anemia (7.16 ± 0.52). Disease activity and the presence of anemic syndrome have a reliable (p < 0.05) direct correlation (IL-6: r = 0.62; CRP: r = 0.68; BASDAI: r = 0.5; ASDAS: r = 0.25) with deterioration of QoL index according to ASQoL. Conclusions. Аnemia is a frequent comorbid pathology in patients with AS and worsens the QoL indices of the patients. The degree and pathogenetic type of anemia (in particular, ACD) is closely correlated with the lower QoL index of patients with AS.
якість життя; анкілозивний спондиліт; анемічний синдром; ASQoL
quality of life; ankylosing spondylitis; anemic syndrome; ASQoL
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Barnett R., Ingram T., Sengupta R. Axial spondyloarthritis 10 years on: still looking for the lost tribe. Rheumatology. 2020. 59(4). iv25-iv37. doi: 10.1093/rheumatology/keaa472.
- Macfarlane G.J., Rotariu O., Jones G.T., Pathan E., Dean L.E. Determining factors related to poor quality of life in patients with axial spondyloarthritis: results from the British Society for Rheumatology Biologics Register (BSRBR-AS). Annals of the Rheumatic Diseases. 2020. 79(2). 202-208. doi: 10.1136/annrheumdis-2019-216143.
- Nikiphorou E., Ramiro S., van der Heijde D. et al. Association of comorbidities in spondyloarthritis with poor function, work disability, and quality of life: results from the Assessment of SpondyloArthritis International Society Comorbidities in Spondyloarthritis Study. Arthritis Care & Research. 2018. 70(8). 1257-1262. doi: 10.1002/акр.2346.
- Braun J., Van Der Heijde D., Doyle M.K. et al. Improvement in hemoglobin levels in patients with ankylosing spondylitis treated with infliximab. Arthritis Care & Research. 2009. 61(8). 1032-1036. doi: 10.1002/art.24865.
- Bulut Y., Tas D.A., Ozturk O.G., Karaogullarindan U. SAT0396 Investigation of iron deficiency anemia in ankylosing spondylitis patients. BMJ. 2017. 921-922. doi: 10.1136/annrheumdis-2017-eular.5913.
- Ki-Jo K.I.M., Chul-Soo C.H.O. Anemia of chronic disease in ankylosing spondylitis: improvement following anti-TNF therapy. Archives of Rheumatology. 2012. 27(2). 090-097. doi: 10.5606/tjr.2012.014.
- Niccoli L., Nannini C., Cassara E., Kaloudi O., Cantini F. Frequency of anemia of inflammation in patients with ankylosing spondylitis requiring anti-TNFα drugs and therapy-induced changes. International Journal оf Rheumatic Diseases. 2012. 15(1). 56-61. doi: 10.1111/j.1756-185X.2011.01662.x
- Ertenli I., Ozer S., Kiraz S. et al. Infliximab, a TNF-alpha antagonist treatment in patients with ankylosing spondylitis: the impact on depression, anxiety and quality of life level. Rheumatology Іnternational. 2012. 32(2). 323-330. doi: 10.1007/s00296-010-1616-x. Epub 2010 Nov 16. PMID: 21079965.
- Шевчук С.В., Звягіна О.В. Якість життя у пацієнтів з анкілозивним спондилітом, зв’язок з перебігом захворювання та наявністю анемічного синдрому. Український ревматологічний журнал. 2020. 79(1). 76-82. doi: 10.32471/rheumatology.2707-6970.79.14825.
- Doward L., Spoorenberg A., Cook S.A. et al. Development of the ASQoL: a quality of life instrument specific to ankylosing spondylitis. Annals of the Rheumatic Diseases. 2003. 62(1). 20-26. doi: 10.1136/ard.62.1.20.
- Kiltz U., Feldtkeller E., Braun J. 2010 update of the ASAS/EULAR recommendations for the management of ankylosing spondylitis. Annals of the Rheumatic Diseases. 2011. 70(6). 896-904. doi: 10.1136/ard.2011.151027.
- Наказ МОЗ України від 02.11.2015 року № 709 «Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги при залізодефіцитній анемії». Електронний документ. Режим доступу: http://search.ligazakon.ua/l_doc2.nsf/link1/MOZ25195.html.
- Weiss G., Goodnough L.T. Anemia of chronic disease. New England Journal of Medicine. 2005. 352(10). 1011-1023. DOI: 10.1056/NEJMra041809.
- Lukas C., Landewé R., Sieper J., Dougados M., Davis J., Braun J. Assessment of SpondyloArthritis international Society. Development of an ASAS-endorsed disease activity score (ASDAS) in patients with ankylosing spondylitis. Annals of the Rheumatic Diseases. 2009. 68(1). 18-24. doi: 10.1136/ard.2008.094870.
- Олексів Н.М., Масик О.М., Надашкевич О.Н. Валідизація україномовної версії шкал BASDAI та BASFI. Український ревматологічний журнал. 2010. 2(40). 51-56.
- Ali A.Y., El-Tanawy R.M., Fawzy R.M., Abdel Bary E.M. Correlation between Different Parameters of Disease Status and Quality of Life in Patients with Ankylosing Spondyolitis. Benha Journal of Applied Sciences. 2021. 6(1). 67-70. doi: 10.21608/БЯС.2021.168488.
- Sallam R.A., Elbahnasawy A.S. Health related quality of life (HRQoL) in ankylosing spondylitis patients: Relation to clinical features, disease activity and radiographic damage. The Egyptian Rheumatologist. 2020. 42(4). 287-290. doi: 10.1016/j.ejr.2020.02.006.
- Yılmaz O., Tutoğlu A., Garip Y., Ozcan E., Bodur H. Health-related quality of life in Turkish patients with ankylosing spondylitis: impact of peripheral involvement on quality of life in terms of disease activity, functional status, severity of pain, and social and emotional functioning. Rheumatol. Int. 2013 May. 33(5). 1159-63. doi: 10.1007/s00296-012-2510-5. Epub 2012 Sep 6. PMID: 22955799. doi: 10.1007/s00296-012-2510-5.
- Huang J.C., Qian B.P., Qiu Y. et al. Quality of life and correlation with clinical and radiographic variables in patients with ankylosing spondylitis: a retrospective case series study. BMC Musculoskelet. Disord. 2017. 18(1). 352. doi: 10.1186/s12891-017-1711-1.
- Salaffi F., Carotti M., Gasparini S., Intorcia M., Grassi W. The health-related quality of life in rheumatoid arthritis, ankylosing spondylitis, and psoriatic arthritis: a comparison with a selected sample of healthy people. Health and Quality оf Life Outcomes. 2009. 7(1). 1-12. doi: 10.1186/1477-7525-7-25.

/18.jpg)
/19.jpg)
/20.jpg)