Журнал «Боль. Суставы. Позвоночник» Том 12, №2, 2022
Вернуться к номеру
Особливості структурно-функціонального стану кісткової тканини в дітей у період другого ростового стрибка
Авторы: Фролова Т.В., Осман Н.С., Стенкова Н.Ф., Терещенкова І.І., Сіняєва І.Р., Сенаторова А.В., Амаш А.Г.
Харківський національний медичний університет, м. Харків, Україна
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
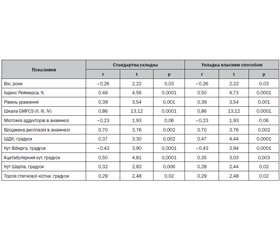
Актуальність. Здоров’я кісткової тканини є актуальним для пацієнтів усіх вікових груп. Особлива увага дослідників приділяється дитячому й підлітковому віку, оскільки саме у цей період активно накопичується кісткова маса. Метою дослідження було визначення особливостей структурно-функціонального стану кісткової тканини в дітей у період другого ростового спурту на підставі аналізу маркерів кісткового моделювання, рівня гідроксивітаміну D (25(OH)D) і показників ультразвукової і рентгенівської денситометрії. Матеріали та методи. Обстежено 205 дітей віком 9–17 років, розподілених на три групи залежно від наявності й інтенсивності ростового спурту. Проведені загальноклінічне обстеження з оцінкою рівнів фізичного й статевого розвитку, ультразвукова і рентгенівська денситометрія, визначені рівні в сироватці крові 25(OH)D, глікозаміногліканів, хондроїтинсульфатів і лужної фосфатази. Результати. Дефіцит вітаміну D мали 83,9 %, недостатність — 16,1 % осіб. Зниження мінеральної щільності кісткової тканини (МЩКТ) за даними ультразвукової денситометрії діагностовано в 48,0 % дітей з ростовим спуртом, у 60,9 % осіб з інтенсивним ростовим спуртом і 39,5 % дітей без ростового спурту. За даними рентгенівської денситометрії зниження МЩКТ підтвердилось у 56,3 % із 32 обстежених: особи з ростовим спуртом — 38,9 %, діти з інтенсивним ростовим спуртом — 50,0 %, особи без ростового спурту — 11,1 %. Рівень хондроїтинсульфатів у дітей з ростовим спуртом та інтенсивним ростовим спуртом був вірогідно вищим, ніж в осіб без ростового спурту. Проте рівень загальних глікозаміногліканів був вірогідно нижчим у групі дітей з ростовим спуртом та інтенсивним ростовим спуртом, ніж у групі осіб без ростового спурту, що свідчить про напруженість обмінних процесів у дітей цих груп. Висновки. Дефіцит і недостатність вітаміну D спостерігалися в 100 % дітей. Зниження МЩКТ частіше діагностувалось в осіб у період інтенсивного ростового спурту і не мало вірогідного зв’язку з рівнем вітаміну D на відміну від дітей без ростового спурту. У дітей з ростовим спуртом та інтенсивним ростовим спуртом виявлено дисбаланс вмісту хондроїтинсульфатів і глікозаміногліканів.
Background. Bone health is relevant for patients of all age groups. Special attention is paid to childhood and adolescence, since it is during this period that bone mass is actively accumulated, which depends on the structural and functional state of the bone tissue of an adult. The purpose of this study was to determine the features of the structural and functional state of bone tissue in children during the second growth spurt based on the analysis of markers of bone modeling, the level of 25(OH)D and the indicators of ultrasound densitometry and DXA. Materials and methods. 205 children aged 9–17 years were examined. They divided into three groups depending on the presence and intensity of growth spurts. Examination included: general clinical examination with an assessment of the levels of physical and sexual development, determine of the levels of 25(OH)D, glycosaminoglycans, chondroitin sulfates and alkaline phosphatase, ultrasound densitometry and DXA. Results. 83.9 % of children had vitamin D deficiency, 16.1 % of children had insufficiency. A decrease in BMD according to UD data was diagnosed in 48.0 % (n = 24) of children with growth spurt, in 60.87 % (n = 28) of children with intense growth spurt, and in 39.45 % (n = 43) of children without growth spurt. According to DXA data, BMD reduction was confirmed in 56.25 % (n = 18) of 32 examined children: children with growth spurt — 38.9 % (n = 7), children with intense growth spurt — 50.0 % (n = 9), children without growth spurt — 11.1 % (n = 2). The level of chondroitin sulfates in children with growth spurt and intense growth spurt is significantly higher than in children without growth spurt, which indicates the instability of metabolic processes. At the same time, the level of total glycosaminoglycans is significantly lower in the group of children with growth spurt and intense growth spurt than in the group of children without growth spurt, which indicates the intensity of metabolic processes in children of these groups. Conclusions. 100 % of children had insufficiency and deficiency of vitamin D. A decrease in BMD is more often diagnosed in children during an intense growth spurt and does not have a reliable relationship with the level of vitamin D, in contrast to children without a growth spurt. Children with growth spurts and intense growth spurts had an imbalance in the level of chondroitin sulfates and glycosaminoglycans, which indicates the instability and activity of bone tissue growth processes.
діти; фізичний розвиток; кісткова тканина; вітамін D; денситометрія; глікозаміноглікани; хондроїтинсульфати
children; physical development; bone tissue; vitamin D; densitometry; glycosaminoglycans; chondroitin sulfates
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Moreira C.A., Dempster D.W., Baron R. Anatomy and Ultrastructure of Bone — Histogenesis, Growth and Remodeling. 2019 Jun 5. In: Feingold K.R., Anawalt B., Boyce A. et al., editors. Endotext. South Dartmouth (MA): MDText.com, Inc, 2000. PMID: 25905372.
- Радутна О.А. Остеопенічний синдром у дітей. Вітчизняна наука на зламі епох: проблеми та перспективи розвитку: матеріали Всеукр. наук.-практ. інтернет-конф.: зб. наук. праць. Переяслав-Хмельницький, 2019. 54. 276-279. http://dspace.zsmu.edu.ua/handle/123456789/10355.
- Hensley A.P., McAlinden A. The role of microRNAs in bone development. Bone. 2021. 143. 115760. doi: 10.1016/j.bone.2020.115760. PMID: 33220505; PMCID: PMC8019264.
- Горобец А.А. Витамины и микроэлементы как специфические регуляторы физиологических и метаболических процессов в организме детей и подростков. Перинатология и педиатрия. 2019. 4(80). 75-92. doi: 10.15574/PP.2019.80.75.
- Cranney A., Horsley T., O’Donnell S. et al. Effectiveness and safety of vitamin D in relation to bone health. Evid. Rep. Technol. Assess (Full Rep). 2007. (158). 1-235. PMID: 18088161. PMCID: PMC4781354.
- Courbebaisse M., Cavalier E. Vitamin D in 2020: An Old Pro-Hormone with Potential Effects beyond Mineral Metabolism. Nutrients. 2020. 12(11). 3378. doi: 10.3390/nu12113378. PMID: 33153017; PMCID: PMC7692961.
- Bouillon R., Marcocci C., Carmeliet G. et al. Skeletal and Extraskeletal Actions of Vitamin D: Current Evidence and Outstanding Questions. Endocr. Rev. 2019. 40(4). 1109-1151. doi: 10.1210/er.2018-00126. PMID: 30321335; PMCID: PMC6626501.
- Павлишин Г.А., Шульгай А.М. Вітамін D-статус у патогенезі розвитку захворювань дітей. Актуальні питання педіатрії, акушерства та гінекології. 2018. 1. 25-31. doi: 10.11603/24116-4944.2018.1.8800.
- Тяжка О.В., Сельська З.В. Проведення скринінгу серед здорових дітей та дітей з алергічними захворюваннями на виявлення вітамін-Д дефіциту. Перинатология и педиатрия. 2014. 2. 34-36. http://nbuv.gov.ua/UJRN/perynatology_2014_2_10.
- Salerno G., Ceccarelli M., de Waure C et al. Epidemiology and risk factors of hypovitaminosis D in a cohort of internationally adopted children: a retrospective study. Ital. J. Pediatr. 2018. 44(1). 86. doi: 10.1186/s13052-018-0527-4. PMID: 30053889; PMCID: PMC6062984.
- Brito A., Cori H., Olivares M. et al. Less than adequate vitamin D status and intake in Latin America and the Caribbean: a problem of unknown magnitude. Food Nutr. Bull. 2013. 34(1). 52-64. doi: 10.1177/156482651303400107. PMID: 23767281.
- Holten-Andersen M.N., Haugen J., Oma I., Strand T.A. Vitamin D status and its determinants in a paediatric population in Norway. Nutrients. 2020. 12(5). 1385. doi: 10.3390/nu12051385. PMID: 32408637; PMCID: PMC7285155.
- Martínez R.I., García R.R., Calmarza P. et al. Vitamin D insufficiency in a healthy pediatric population. The importance of early prophylaxis. Nutr. Hosp. 2021. 38(6). 1155-1161. doi: 10.20960/nh.03606. PMID: 34431303.
- Ohta H. Growth spurts of the bone from infancy to puberty. Clinical Calcium. 2019. 29(1). 9-17. PMID: 30590354.
- Бекетова Г.В., Поворознюк В.В., Сиваченко Ю.В. Фактори, що впливають на досягнення піку кісткової маси у дітей та підлітків, як основи профілактики остеопорозу. Збірник наукових праць співробітників НМАПО ім. П.Л. Шупика. 2018. 30. 480-491.
- Протокол надання медичної допомоги дітям за спеціальністю «Дитяча ендокринологія», наказ МОЗ України від 27.04.2016. https://zakononline.com.ua/documents/show/89079__682282.
- Di Iorgi N., Maruca K., Patti G., Mora S. Update on bone density measurements and their interpretation in children and adolescents. Best Pract. Res. Clin. Endocrinol. Metab. 2018. 32(4). 477-498. doi: 10.1016/j.beem.2018.06.002. PMID: 30086870.
- Skeletal Health Assessment In Children from Infancy to Adolescence. Official Pediatric Positions of the ISCD as updated in 2019. https://www.iscd.org.
- Płudowski P., Karczmarewicz E., Bayer M. et al. Practical guidelines for the supplementation of vitamin D and the treatment of deficits in Central Europe — recommended vitamin D intakes in the general population and groups at risk of vitamin D deficiency. Endokrynol. Pol. 2013. 64(4). 319-327. doi: 10.5603/ep.2013.0012. PMID: 24002961.
- Sherief L.M., Ali A., Gaballa A. et al. Vitamin D status and healthy Egyptian adolescents: Where do we stand? Medicine (Baltimore). 2021. 100(29). e26661. doi: 10.1097/MD.0000000000026661. PMID: 34398026; PMCID: PMC8294863.
- Поворознюк В.В., Паньків І.В. Статус вітаміну D у населення Буковини і Прикарпаття залежно від місця проживання над рівнем моря. Біль. Суглоби. Хребет. 2016. 2(22). 7-10. doi: 10.22141/2224-1507.2.22.2016.75755
- Антипкін Ю.Г., Волосовець О.П., Майданник В.Г. та ін. Стан здоров’я дитячого населення — майбутнє країн (частина 1). Здоров’я дитини. 2018. 13(1). 1-11. http://nbuv.gov.ua/UJRN/Zd_2018_13_1_3.

/32.jpg)
/33.jpg)