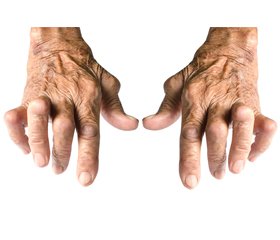
Остеоартрит (ОА) периферичних суглобів та ревматоїдний артрит (РА) становлять серйозну медико-соціальну проблему. Це обумовлено значною поширеністю даної патології серед населення, істотними матеріальними збитками унаслідок зниження і втрати працездатності хворих, значними витратами на лікування і реабілітацію [1].
Тенденція до старіння населення в усьому світі призводить до того, що кількість хворих на ОА неухильно зростає. За даними епідеміологічних досліджень встановлено, що ОА має місце у 10–12 % дорослого населення, у половини осіб старше 50 років наявні його клінічні та/або рентгенологічні симптоми. У віці старше 70 років рентгенологічні ознаки ОА знаходять у 90 % жінок і 80 % чоловіків [2, 3]. В Україні поширеність ОА становить 2515,7 на 100 000, захворюваність — 423,1 у чоловіків і 558,8 у жінок на 100 000 населення. Поширеність РА становить 0,6–1,3 %, а щорічна захворюваність за останні роки зберігається на високому рівні — 0,02 % [4].
ОА та РА характеризуються високою частотою зниження працездатності, інвалідизацією в 8–21 % випадків [5, 6] і значним зниженням якості життя, що обумовлено больовим синдромом, обмеженням свободи пересування і втратою функціональної активності, а іноді і здатності до самообслуговування [7–9]. Щодо зниження якості життя хворих ці захворювання випереджають шлунково-кишкові, респіраторні та серцево-судинні хвороби. Разом з ішемічною хворобою серця, алкоголізмом, депресією і діабетом вони входять в число факторів, які найбільш часто обумовлюють тривале порушення здоров’я [10]. Фармакоекономічні дослідження останніх років свідчать про високі витрати на лікування та реабілітацію таких пацієнтів. Тільки в США щорічно вони становлять 12,1 млрд доларів, у Великобританії — 733 млн фунтів стерлінгів [11]. Усе це обумовлює необхідність здійснення профілактики та надання своєчасної, ефективної та безпечної медичної допомоги пацієнтам з цими захворюваннями. Фармакотерапія ОА та РА до недавнього часу була спрямована більшою мірою на зменшення симптомів хвороби, ніж на її причини, основу лікування становили анальгетики, нестероїдні протизапальні препарати (НПЗП) і стероїди. Однак побічні ефекти більшості цих лікарських препаратів змусили переглянути показання до їх широкого призначення хворим на остеоартрит і ревматоїдний артрит і сприяли розробці засобів, здатних контролювати перебіг хвороби [12, 13]. До таких засобів відноситься Меркана® Актив, яка має у своєму складі рідкий екстракт кореневища куркуми та смоли босвелії (NovaSOL® Curcumin Boswellia), запатентований колаген неденатурований ІІ типу (UC-II®), вітамін D3 (холекальциферол). Компоненти Меркана® Актив мають виражені протизапальні властивості, взаємно доповнюють і підсилюють дію один одного, тим самим сприяють зменшенню болю, гальмуванню руйнації суглобового хряща та відновленню уражених структур, що входять до складу суглобів [14].
ОА та РА: дефініція, етіологія і патогенез
Остеоартрит, або остеоартроз, — гетерогенна група захворювань різної етіології з подібними біологічними, морфологічними, клінічними проявами, в основі яких лежить ураження всіх компонентів суглоба, у першу чергу хряща, а також субхондральної кістки, синовіальної оболонки, зв’язок, капсули, навколосуглобових м’язів [15]. У зарубіжній літературі замість терміна «остеоартроз» використовують більш адекватний термін «остеоартрит», що підкреслює важливу роль запального компонента в розвитку і прогресуванні захворювання [16, 17].
Ревматоїдний артрит — хронічне системне імуноопосередковане запальне захворювання з переважним ураженням периферичних (синовіальних) суглобів за типом симетричного ерозивно-деструктивного поліартриту, що супроводжується проліферацією синовіоцитів і ангіогенезом [4].
До основних причин, що сприяють розвитку ОА, належать генетичні (немодифіковані) фактори: жіноча стать, дефекти і мутації (COL2A1) гена колагену ІІ типу (синдром Стиклера), етнічна приналежність, вроджені захворювання кісток і суглобів; потенційно модифіковані (придбані) фактори: літній вік, надлишкова маса тіла, зниження рівня естрогенів, особливо у жінок у постменопаузі, порушення розвитку або придбані захворювання кісток і суглобів, операції на суглобах, травми суглобів; фактори зовнішнього середовища: професійні особливості, навантаження на суглоби і заняття спортом [18, 19].
Унаслідок впливу одного або декількох етіологічних факторів на суглобовий хрящ виникають порушення обміну і синтетичної активності хондроцитів, а також фізико-хімічні пошкодження його матриксу, який складається з колагену (70 %) і протеогліканів (30 %) [20]. Протеоглікани мають гідрофільні глікозаміногліканові ланцюги, які утворюють зв’язки з молекулами води і забезпечують компресійну стійкість хряща. Колагенові волокна представлені переважно волокнами II типу (90 %), які за рахунок утворення міцних ковалентних міжмолекулярних зв’язків формують у матриксі полімерні мережі, забезпечуючи міцність і розтягнення хряща.
В основі порушення метаболізму хряща при остеоартриті лежить зменшення кількості і зміна якості протеогліканів основної речовини хряща, що забезпечують стабільність структури колагенової мережі [21]. Крім того, спостерігається недостатнє утворення або посилений катаболізм компонентів хрящової тканини, у результаті чого розвивається деструкція хряща з втратою матриксом глікозаміногліканів, хондроїтинсульфату, кератансульфату і гіалуронової кислоти. Відзначається зменшення розміру молекул протеогліканів, у результаті чого вони стають здатними виходити з матриксу хряща [22]. Змінені і дрібні протеоглікани поглинають воду, але не можуть міцно її утримувати. Надлишкова вода поглинається колагеном, який набухає і розволокнюється, що веде до зниження резистентності хряща [23].
При пошкодженні хондроцитів спостерігається вироблення ними непритаманного для нормальної хрящової тканини колагену — короткого колагену, що не утворює фібрил [24, 25]. Крім того, вивільняються продукти розпаду колагену, які індукують утворення антитіл з формуванням локального запального процесу [26, 27]. У свою чергу, комплекс антиген — антитіло діє на макрофаги в синовіальній мембрані. Це сприяє виділенню великої кількості медіаторів запалення: кисневих радикалів, простагландинів, лейкотрієнів і інтерлейкінів, які активують матриксні металопротеїнази, що також мають пошкоджуючу дію та руйнують хондроцити та хрящовий матрикс. Унаслідок цього виникає реактивний синовіт. Запалена синовіальна оболонка також виділяє біологічні медіатори запалення, що підтримують синовіт і сприяють деструкції хряща. Так утворюється замкнуте коло запальної реакції [13, 23, 28]. Прозапальні цитокіни підвищують функціональну активність клітин субхондральної кістки і остеокластичну резорбцію. Це призводить до ущільнення суглобової поверхні кісток з утворенням ділянок ішемії, склерозу, кіст і компенсаторним розростанням кісткової тканини. При цьому прогресування ОА набуває необоротного характеру [29].
При РА невідомий етіологічний фактор викликає первинну імунну реакцію у вигляді утворення антитіл (IgG). З невідомих причин вони трансформуються і перетворюються на автоантигени, які в умовах імунодефіциту Т-супресорів ініціюють вироблення В-лімфоцитами антитіл груп IgM, IgA, IgG (ревматоїдні фактори). Ці ревматоїдні фактори з автоантигеном утворюють циркулюючі імунні комплекси, що осідають у синовіальній оболонці суглобів і викликають підвищення активності медіаторів запалення, порушення мікроциркуляції, активацію хемотаксису лейкоцитів [4].
Нестероїдні протизапальні препарати найбільш часто застосовуються для полегшення симптомів при лікуванні ОА та РА, але вони не впливають на імунний механізм руйнування хряща. Тому для лікування цих захворювань доцільно призначати комплексні засоби, які не тільки зменшують запальне пошкодження хряща, але й мають механізми специфічної імуномодуляції [28].
Нові можливості впливу на ланки патогенезу ОА та РА
Меркана® Актив — новий натуральний препарат, добова доза якого містить такі активні інгредієнти, як рідкий екстракт кореневища куркуми та смоли босвелії (NovaSOL® Curcumin Boswellia) — близько 1660 мг, неденатурований колаген ІІ типу (UC-II®) — 40,0 мг та вітамін D3 (холекальциферол) — 15 мкг (що відповідає 600 МО). Завдяки багатокомпонентному складу Меркана® Актив справляє мультимодальну дію.
Неденатурований колаген II типу позитивно впливає на функціональний стан суглобів за допомогою імунного механізму дії — доведено знижує запалення та біль у суглобах, покращує гнучкість та рухливість, гальмує руйнацію суглобового хряща, стимулює синтез колагену та інших структурних компонентів хрящового матриксу, що сприяє оновленню суглобового хряща [30].
Рідкий екстракт кореневища куркуми та смоли босвелії, створений за патентованою технологією NovaSOL®, має швидку та виражену протизапальну дію. Компоненти натуральних екстрактів куркуми та босвелії через низьку водорозчинність погано всмоктуються в шлунково-кишковому тракті та мають низьку біодоступність. Особливістю технології NovaSOL® є міцелювання компонентів екстракту, що надає їм виражених амфіфільних (водо- та жиророзчинних) властивостей та в десятки — сотні разів збільшує їх біодоступність. Завдяки цьому у 185 разів збільшується біодоступність куркуміну [31] та у 56 разів збільшується біодоступність найбільш активного компонента екстракту босвелії — ацетил-11-кето-β-босвелієвої кислоти (AKBA) [32].
Вітамін D3 регулює обмін фосфору і кальцію в організмі, покращує засвоєння необхідного для структури кісток кальцію, покращує тонус скелетних м’язів, який зазвичай знижений при остеоартриті та у людей старшого віку, бере участь у метаболізмі кісткової і хрящової тканини, що важливо для процесів їх відновлення. Було показано здатність вітаміну D зменшувати ерозію суглобового хряща, знижувати рівень матриксних металопротеїназ 9 та 13 з одночасним збільшенням рівня TGF-β1. Деякі клінічні дослідження продемонстрували зниження дискомфорту та покращення функції колінних суглобів при застосуванні вітаміну D [33]. Усі компоненти Меркана® Актив доповнюють і підсилюють дію один одного.
Роль неденатурованого колагену II типу (UC-II®) в лікуванні ОА та РА
Колаген II типу — це основний білок суглобового хряща, який утворює його структуру і служить опорою для інших колагенів і неколагенових білків. Молекула колагену являє собою лівозакручену спіраль з трьох α-ланцюгів, кожна з яких містить тріаду амінокислот, у якій третя амінокислота — гліцин, друга — пролін або лізин, перша — будь-яка інша амінокислота, крім трьох наведених [34]. З молекул колагену формуються колагенові волокна, що утворюють мережу, де більш товсті філаменти знаходяться в глибоких шарах, а більш тонкі — горизонтально в поверхневому шарі. Це забезпечує підтримку форми і обсягу суглобового хряща, а також чинить опір деформуючим силам, які впливають на нього. Тому руйнування колагену може відігравати провідну роль у прогресуванні хвороби [35]. Неденатурованим (нативним) колагеном II типу вважають колаген зі збереженою структурою у вигляді потрійної спіралі. Ця складна, жорстка структура не руйнується під впливом травних ферментів і має особливі біологічно активні властивості, які принципово відрізняються від властивостей гідролізованого (частково зруйнованого або денатурованого) колагену [36].
Механізм дії неденатурованого колагену II типу (UC-II®) пов’язаний з феноменом оральної толерантності [37], перший опис якої був наданий H.G. Wells і Т.В. Osborne в 1911 році. Оральна толерантність — одна з форм периферичної толерантності, яка являє собою стан специфічного пригнічення клітинної і гуморальної імунної відповіді на антигени, що надійшли, як правило, пероральним шляхом. Вважається, що даний феномен є захисним механізмом, який запобігає розвитку реакцій гіперчутливості на «безпечні» антигени їжі і бактерії мікробіоти кишечника [38]. Головна роль у формуванні оральної толерантності належить інтестинальній імунній системі, яка поділяється на індуктивну і ефекторну. Індуктивна включає пеєрові бляшки та ізольовані лімфоїдні фолікули (GALT — лімфоїдна тканина, асоційована з кишечником), власну пластинку слизової оболонки (lamina propria) та мезентеріальні лімфатичні вузли; ефекторна — епітелій кишечника, а також lamina propria, де розташовані активовані Т-клітини і плазматичні клітини, що секретують антитіла. В індуктивну зону антигени надходять з просвіту кишечника через спеціалізовані М-клітини GALT-системи або за допомогою дифузії і трансцитозу. Надалі антигени поглинаються дендритними клітинами. Ключову роль у розвитку оральної толерантності відіграють CD103+-дендритні клітини власної пластинки слизової оболонки, які фагоцитують антигени, а потім мігрують у мезентеріальні лімфатичні вузли. У мезентеріальних лімфатичних вузлах CD103+-дендритні клітини продукують ретиноєву кислоту, яка індукує експресію кишкових хомінгових рецепторів α4β7-інтегринів і C-C хемокінового рецептора 9 на антигенспецифічних Т-клітинах, а також сприяє TGF-β-залежному диференціюванню наївних СD4+ Т-клітин в Foxp3+-індукованих регуляторних Т-клітинах. Т-регуляторні клітини мігрують у власну пластинку слизової оболонки, де пригнічують розвиток імунної відповіді шляхом інгібування проліферації Т-клітин [39].
Крім того, регуляторні Т-лімфоцити (Т-регулятори) продукують протизапальні цитокіни, такі як інтерлейкін-10 (IL-10), інтерлейкін-4 (IL-4) та TGF-β [44]. Ці цитокіни здатні проникати у синовіальну рідину суглоба через кровоносну систему синовіальної оболонки та субхондральної кістки, пригнічувати запалення та покращувати метаболізм хрящової тканини. IL-10 чинить вплив на рецептори макрофагів і синовіоцитів, інгібуючи вивільнення інтерлейкіну-1 (IL-1). TGF-β стимулює синтез матриксу хряща шляхом пригнічення катаболічної активності хондроцитів і активації анаболічної функції та проліферації хондроцитів. IL-10 і TGF-β сприяють збільшенню продукції IL-4. Це сприяє перемиканню метаболізму хондроцитів у бік синтезу компонентів міжклітинного матриксу.
Повторне та низькодозоване введення неденатурованого колагену ІІ типу змушує Т-хелперні клітини розпізнавати епітопи антигена, викликаючи початкову м’яку імунну відповідь, а потім поступово розвиваючи оральну толерантність. Тим самим досягається послаблена імунна відповідь проти колагену ІІ типу [28].
Доцільність використання неденатурованого колагену II типу для комплексного впливу на проблеми із суглобами показана в доклінічних і подвійних сліпих рандомізованих клінічних дослідженнях не тільки порівняно з плацебо, але й порівняно з глюкозаміном і хондроїтином.
На тваринних моделях остеоартриту продемонстровано, що після впливу пошкоджуючого фактора застосування неденатурованого колагену призводить до збереження цілісності губчастої речовини кістки, підвищення здатності витримувати навантаження вагою, зменшення формування остеофітів та гальмування руйнації хряща [39]. В іншій роботі, також проведеній на щурах, було показано, що прийом неденатурованого колагену II типу протягом 13 днів сприяє вірогідно значимому зниженню рівня CTX-II (маркера деструкції хряща) в плазмі і сечі, а також підвищенню порогу больової чутливості [40]. В іншому дослідженні було продемонстровано, що прийом щурами Sprague-Dawley неденатурованого колагену ІІ типу у дозі 10, 20 або 40 мкг/кг призводить до пригнічення вторинних запальних реакцій, зниження рівнів IL-2, IL-17 і Т-хелперів, які продукують IL-17, підвищення IL-4, TGF-β і Т-регуляторів [41, 42]. У дослідженні С. Orhan et al. доведено, що призначення UC-II® призводить до інгібування простагландину PGE2 на 19,6 % та зниження експресії IL-1β, IL-6, TNF-α, ЦОГ-2, MCP-1, NF-κB, MMP-3, що корисне для полегшення запалення і зменшення болю в суглобах при ОА та РА [41]. У дослідженні D. Bagchi et al. [43] продемонстровано, що невеликі дози перорального неденатурованого колагену II типу, на відміну від денатурованого колагену, ефективно дезактивують атаку Т-кілерів, зменшують біль та запалення.
У 2017 році Bagi et al. [39], вивчаючи здатність UC-II® запобігати руйнуванню суглобового хряща на мишачих моделях посттравматичного ОА, отримали результати, які довели, що застосування неденатурованого колагену ІІ типу одразу після травми поліпшує механічну функцію колінного суглоба й уповільнює дегенерацію суглобового хряща. Це свідчить про можливий структурно-модифікуючий ефект UC-IІ®. У групі UC-IІ® на гістологічних зрізах хряща великогомілкової кістки із забарвленням сафраніном було відмічене зменшення втрати хряща та утворення детриту порівняно з групою без лікування. Крім того, на 3D-зображенні епіфіза великогомілкової кістки в групі без лікування було чітко видно сформований остеофіт досить великих розмірів, тоді як у групі UC-II® розміри остеофіту були значно меншими.
Ефективність і безпека неденатурованого колагену II типу (UC-II®) доведені в подвійному сліпому рандомізованому плацебо-контрольованому дослідженні, у яке було включено 55 добровольців (Lugo J.P. et al., 2013). Учасники дослідження не страждали на остеоартрит, проте відчували дискомфорт у колінних суглобах при значному фізичному навантаженні. Випадковим чином їх розділили на дві групи: перша (n = 27) протягом чотирьох місяців отримувала неденатурований колаген II типу (UC-II®) в дозі 40 мг, друга (n = 28) — плацебо. Ефективність терапії оцінювали за ступенем згинання та розгинання колінних суглобів, а також часу виникнення дискомфорту в колінних суглобах при навантаженні (степміл-тест). У групі UC-II® відзначено статистично значуще поліпшення розгинання в колінних суглобах порівняно з групою плацебо (р = 0,011). Крім того, зафіксовано значуще поліпшення розгинання в колінних суглобах щодо вихідних даних (р = 0,002). Час між початком фізичного навантаження і виникненням дискомфорту в колінних суглобах також збільшився (р = 0,019). У групі плацебо статистично вірогідної різниці не виявлено. За час прийому препарату побічні ефекти терапії не зареєстровані [44].
У дослідженні, проведеному М.А. Azeem et al. [45], оцінювалася ефективність та безпека використання неденатурованого колагену ІІ типу у 100 пацієнтів з остеоартритом колінного суглоба. Протягом 120 днів усі пацієнти отримували 40 мг UC-II®. Результати дослідження підтверджувалися за допомогою функціонального індексу Лекена (LFI), візуальної аналогової шкали болю (ВАШ) та індексу WOMAC. При призначенні неденатурованого колагену ІІ типу (UC-II®) було продемонстровано значне поліпшення функції колінного суглоба та зменшення болю і скутості, що супроводжувалося зниженням загального бала за шкалою WOMAC, LFI та ВАШ.
У неінтервенційному дослідженні А. Mehra et al. [46] вивчався вплив неденатурованого колагену ІІ типу на перебіг остеоартриту. У дослідженні взяв участь 291 пацієнт з ОА колінного суглоба. Зареєстрованих пацієнтів спостерігали на 30-й день (відвідування 2), на 60-й день (відвідування 3) і на 90-й день (відвідування 4). Ефективність оцінювалася за індексом WOMAC і за ВАШ при кожному відвідуванні. Безпеку оцінювали за частотою передбачуваних небажаних явищ (НЯ) та аномальними лабораторними параметрами. Лікування неденатурованим колагеном II типу було пов’язане зі значним зниженням показників WOMAC (p < 0,0001) і ВАШ (p < 0,0001) порівняно з вихідним рівнем до 90-го дня. Спостерігалося зниження показників за шкалою WOMAC-біль з 9,6 ± 3,9 на 30-й день до 7,8 ± 4,1 і 6,7 ± 4,9 на 60-й і 90-й день відповідно. Показник WOMAC-скутість становив 4,2 ± 2,2 на 30-й день, 3,2 ± 1,9 на 60-й день і 2,5 ± 2,1 на 90-й день. Показник фізичної функції покращився з 39,2 ± 15,4 на 30-й день до 36,6 ± 16,4 на 60-й день і 33,8 ± 17,9 на 90-й день. НЯ під час лікування спостерігалися у 4,47 % пацієнтів. Жодне з НЯ не було серйозним і не призвело до виключення пацієнтів з дослідження. Таким чином, дані цього дослідження свідчать про те, що UC-II® є безпечним і ефективним при лікуванні ОА в звичайній клінічній практиці. Його споживання пов’язане зі зменшенням болю, скутості і поліпшенням функціональної рухливості пацієнтів, що може значно поліпшити їх якість життя. З огляду на недоліки при тривалому застосуванні НПЗП, UC-II® може потенційно заповнити терапевтичну прогалину в лікуванні ОА, будучи більш безпечним терапевтичним варіантом, який потенційно зупиняє патогенез захворювання за допомогою унікального механізму.
D.C. Crowley і співавт. порівнювали ефективність комбінації хондроїтин/глюкозамін і неденатурованого колагену II типу у 52 хворих на остеоартрит. Їх рандомізували на дві групи. Протягом трьох місяців перша група отримувала 40 мг/добу неденатурованого колагену II типу (UC-II®), друга — 1200 мг/добу хондроїтину сульфату з 1500 мг/добу глюкозаміну гідрохлориду. У групі UC-II® зареєстровано більше зниження індексу вираженості ОА за шкалою WOMAC, ніж у групі пацієнтів, які отримували комбінацію глюкозаміна з хондроїтином (33 vs 14 %). У групі лікування комбінацією глюкозаміну з хондроїтином додаткового знеболювання потребували 23 із 26 пацієнтів після першого місяця лікування (11,5 %), у той час як у групі UC-II® необхідність у додатковому знеболюванні була відсутня у 69,2 % пацієнтів вже після першого місяця прийому. Крім цього, у хворих, які отримували неденатурований колаген II типу, значно підвищилася толерантність до фізичного навантаження порівняно з тими, які приймали хондроїтин і глюкозамін. Між групами не було вірогідної різниці щодо несприятливих реакцій [47].
У мультицентровому подвійному сліпому рандомізованому дослідженні, проведеному J.P. Lugo і співавт. (2016), порівнювалася ефективність неденатурованого колагену II типу (UC-II®) в дозі 40 мг/добу, плацебо і комбінації глюкозаміну гідрохлориду в дозі 1500 мг/добу з хондроїтину сульфатом у дозі 1200 мг/добу (ГГ + ХС) у 191 пацієнта з гонартрозом. Тривалість лікування становила 6 місяців. Як первинну кінцеву точку вибрано зміну загального індексу WOMAC, вторинну кінцеву точку — зміну функціонального індексу Лекена, ступеня болю за візуальною аналоговою шкалою, балів за підшкалами WOMAC. Через 6 місяців у групі хворих, які приймали UC-II®, спостерігали більш значне зниження загального бала за індексом WOMAC порівняно з хворими, які отримували плацебо (на 33 %) та комбінацію ГГ + ХС (на 21,4 %). Також в осіб, які приймали UC-II®, відзначалось вірогідне поліпшення за всіма підшкалами WOMAC: за підшкалою болю — на 41,2 % порівняно з групою плацебо та на 25 % — порівняно з групою ГГ + ХС; за підшкалою скутості — на 33,7 % краще за результати в групі плацебо та на 22,7 % — за результати в групі ГГ + ХС; за підшкалою фізичної функції — на 30,1 % краще за результати в групі плацебо та на 19,7 % — за результати в групі ГГ + ХС. Крім того, UC-II® значно зменшував потребу в знеболювальних засобах: 17,5 % хворих у групі UC-II® потребували додаткового знеболювання за весь період спостереження, тоді як у групі плацебо — 48,3 %, а в групі ГГ + ХС — 32,3 %. У групі UC-II® було досягнуто зниження потреби в знеболюючих препаратах на 61 % порівняно з початковим рівнем. Протягом усього періоду спостереження вірогідної різниці в ефективності між плацебо і ГГ + ХС не спостерігалось. Таким чином, було доведено вірогідно вищу ефективність UC-IІ® порівняно з комбінацією ГГ та ХС [48].
У систематичному огляді G. Honvo et al., що включав 16 доклінічних і 25 клінічних досліджень, вивчався вплив гідролізованого і неденатурованого колагену II типу на перебіг ОА. У більшості з них тривалість лікування варіювала від 3 до 6 місяців (найкоротша становила 1,4 місяця, а найдовша — 11 місяців). У доклінічних та клінічних дослідженнях in vivo були отримані висновки про сприятливий вплив похідних колагену (неденатурований колаген II типу та гідролізат) на ОА та відновлення хряща як при пероральному прийомі у вигляді дієтичних добавок, так і введених внутрішньосуглобово. Однак три з чотирьох доступних досліджень in vitro, усі з гідролізатом колагену, дійшли висновку, що гідролізати колагену, отримані з різних джерел і різної молекулярної маси, були або неефективними, або навіть шкідливими для хряща з ОА [43].
На підставі результатів проведених досліджень, що підтвердили безпеку неденатурованого колагену II типу (UC-II®), Управління з санітарного нагляду за якістю харчових продуктів і медикаментів США зареєструвало неденатурований колаген II типу як харчову добавку для профілактики і комплексної терапії остеоартриту [49].
У дослідженні M. Barnett et al. [50] була продемонстрована ефективність та безпечність неденатурованого колагену ІІ типу при ревматоїдному артриті (РА). У ньому взяли участь 2274 пацієнти з активним РА, які були рандомізовані для отримання плацебо або 1 з 4 дозувань (20, 100, 500 або 2500 мкг/день) перорального неденатурованого курячого колагену II типу протягом 24 тижнів. Результати дослідження показали, що найбільш позитивні ефекти спостерігалися при дозі 20 мкг/день порівняно з плацебо (кумулятивний критерій Паулюса — 39 проти 19 %), а наявність сироваткових антитіл до колагену II типу на вихідному рівні передбачала кращу відповідь на терапію. Жодних побічних ефектів не спостерігалося.
У 24-тижневому сліпому подвійному рандомізованому дослідженні W. Wei et al. [51] проводилася оцінка ефективності та переносимості неденатурованого колагену II типу порівняно з метотрексатом при лікуванні ревматоїдного артриту. У дослідженні взяли участь 503 хворі на РА, які були поділені на дві групи: перша група (n = 326) отримувала неденатурований колаген ІІ типу у дозі 100 мкг/день, друга (n = 177) — 10 мг метотрексату 1 раз/тиждень. У кожного пацієнта оцінювали клінічні симптоми: біль, ранкову скутість, кількість болючих і набряклих суглобів. Використовувалася анкета оцінки стану здоров’я (HAQ), досліджувалися такі лабораторні показники, як швидкість осідання еритроцитів (ШОЕ) і С-реактивний білок (СРБ), з використанням стандартного тесту на вихідному рівні (0-й тиждень) і на 12-й і 24-й тижні. Крім того, на 0-й і 24-й тиждень визначали ревматоїдний фактор (РФ). Дослідження завершили 454 пацієнти (94,43 %). В обох групах спостерігалося статистично значуще зменшення болю, ранкової скутості, кількості болючих і набряклих суглобів, покращення стану здоров’я за HAQ. У групі метотрексату відзначалося зниження ШОЕ і СРБ. РФ не змінився в жодній із груп. Через 24 тижні 41,55 % пацієнтів у групі, яка отримувала неденатурований колаген ІІ типу, і 57,86 % у групі метотрексату відповідали критеріям поліпшення Американської колегії ревматологів на 20 % (ACR-20), а 16,89 і 30,82 % пацієнтів відповідно — критеріям поліпшення на 50 % (ACR-50). Однак обидві частоти відповіді ACR-20 і ACR-50 в групі неденатурованого колагену ІІ типу були нижчими, ніж у групі метотрексату, і ця різниця була статистично значущою (p < 0,05).
Скарги з боку шлунково-кишкового тракту були поширені в обох групах, але в групі неденатурованого колагену ІІ типу побічних ефектів було менше і вони були більш слабкими, ніж у групі метотрексату. Різниця частоти небажаних явищ між двома групами була статистично вірогідною (P < 0,05).
Автори дослідження дійшли висновку, що неденатурований колаген ІІ типу ефективний та безпечний при лікуванні РА. Він чинить сприятливий вплив, контролюючи запальні реакції та індукуючи оральну толерантність у пацієнтів з РА.
Екстракт босвелії — важливий компонент Меркана® Актив з вираженою протизапальною активністю
Екстракт босвелії, що входить до складу Меркана® Актив, отриманий зі смоли рослини босвелія зубчаста (Boswellia serrata). Компоненти смоли босвелії зубчастої відомі як потужні протизапальні та знеболюючі протиартритні засоби. Основними активними інгредієнтами Boswellia serrata є босвелієві кислоти, головними з яких є ацетил-11-кето-β-босвелієва кислота (AKBA), 11-кето-β-босвелієва кислота, α-босвелієва кислота, β-босвелієва кислота, ацетил-α-босвелієва кислота та ацетил-β-босвелієва кислота.
У численних дослідженнях було доведено, що ці кислоти здатні інгібувати низку основних ферментів запалення — 5-ліпоксигеназу, катепсин G та мікросомальну простагландин-Е-синтазу-1, а також транскрипційний ядерний фактор kB (NF-kB) та кілька прозапальних цитокінів — фактор некрозу пухлини α (TNF-α), інтерлейкін-1β, інтерлейкін-2 та інтерлейкін-6. Крім того, босвелієві кислоти пригнічують активність нейтрофільної еластази — основної протеази, що забезпечує деградацію матриксу і підвищує проникність ендотелію для клітин — учасників запалення [52, 53].
AKBA є найактивнішою сполукою екстракту босвелії і являє собою потужний інгібітор 5-ліпоксигенази— ключового ферменту в біосинтезі лейкотрієнів з арахідонової кислоти в клітинному запальному каскаді. Вона викликає інгібування матриксної металопротеїнази-3, індукованої прозапальними цитокінами у первинних хондроцитах людини. При порівняльному аналізі різних досліджень in vitro та in vivo встановлено, що порівняно з іншими кислотами AKBA має більш сильну протизапальну дію і демонструє краще відновлення глікозаміногліканів у хондроцитах хряща [54].
Ця протизапальна дія опосередкована модуляцією імунної системи, що доведено в роботі S. Umar et al. [55] на моделі артриту у самців щурів Wistar, які протягом 21 дня отримували екстракт Boswellia serrata в дозах 100 і 200 мг/кг 1 раз на день.
Результати дослідження показали, що застосування екстракту босвелії призводить до значного зниження рівня таких біохімічних параметрів, як суглобова еластаза, перекисне окиснення ліпідів, глутатіон, каталаза, супероксиддисмутаза та оксид азоту. Крім того, відзначалося зниження рівня медіаторів запалення — IL-1β, IL-6, TNF-α, IFN-γ і PGE2 і підвищення рівня IL-10. Протективні ефекти екстракту босвелії на хрящ підтверджувалися клінічним і гістологічним поліпшенням стану суглобового хряща. Автори дослідження дійшли висновку, що протизапальні ефекти екстракту босвелії обумовлені її здатністю інгібувати прозапальні цитокіни і модулювати антиоксидантний статус, що опосередковано модуляцією імунної системи [55].
У дослідженні A.G. Karra et al. [56] встановлено, що босвелієві кислоти є потужними селективними регуляторами глюкокортикоїдних рецепторів (GR). Вони активують мономерний GR шляхом транспресії, внаслідок чого він зв’язується з факторами транскрипції NF-kB і AP-1, тим самим запобігаючи посиленню регуляції експресії цільових генів, що кодують циклооксигеназу, NO-синтазу, фосфоліпазу А2, фактор некрозу пухлини, ICAM-1 і низку інших прозапальних білків. Така селективна регуляція глюкокортикоїдних рецепторів босвелієвими кислотами забезпечує їх виражену протизапальну дію і відсутність побічних ефектів, що може мати великий терапевтичний потенціал для використання екстракту босвелії при ОА і РА.
Усі ці ефекти екстракту босвелії мають велике значення для лікування дегенеративно-дистрофічних та запальних захворювань суглобів.
У дослідженні А.А. Vishal [57] оцінювалася ефективність та безпека екстракту босвелії у 60 пацієнтів з ОА колінних суглобів, які були розподілені на дві групи: І (n = 30) — прийому екстракту босвелії у дозі 50 мг 2 р/день і ІІ (n = 30) — плацебо у тій же дозі. У кожного суб’єкта оцінювали біль і фізичну функцію з використанням стандартних інструментів (візуальна аналогова шкала болю, функціональний індекс Лекена й індекс WOMAC) на початку дослідження (0-й день), а також на 5, 15 і 30-й дні. Результати дослідження показали, що екстракт босвелії призвів до клінічно і статистично значущого поліпшення показників болю та фізичної функції у пацієнтів з ОА, що підтверджувалося зниженням болю за ВАШ на 49,1 %, індексу Лекена — на 34,4 %, болю за WOMAC — на 49,5 %, скутості за WOMAC — на 48,4 % та показників фізичної функції за WOMAC — на 45,2 %.
У метааналізі, проведеному G. Yu et al. [58], що включав 7 клінічних досліджень і 545 пацієнтів з ОА, була підтверджена ефективність екстракту босвелії. Порівняно з контрольною групою, яка отримувала плацебо, екстракт босвелії забезпечував зменшення болю за ВАШ на 8,33 мм, за шкалою WOMAC-біль на 14,22 бала. Також відзначалося зниження скутості в суглобах за WOMAC на 10,04 бала і поліпшення функції суглоба за WOMAC на 10,75 бала. На підставі отриманих даних автори дійшли висновку, що екстракт босвелії є ефективним і безпечним варіантом лікування пацієнтів з ОА. При цьому рекомендована тривалість лікування повинна становити не менше ніж 4 тижні.
У рандомізованому подвійному сліпому плацебо-контрольованому перехресному дослідженні оцінювалася ефективність, безпека і переносимість екстракту Boswellia serrata у 30 пацієнтів з остеоартритом колінних суглобів протягом восьми тижнів. Встановлено вірогідне зниження болю в колінних суглобах, збільшення обсягу згинання/розгинання, тривалості ходіння, зниження частоти виявлення рідини в колінному суглобі [59].
Ефективність Boswellia serrata в лікуванні ревматоїдного артриту [60] доведена у двох плацебо-контрольованих дослідженнях за участю 81 пацієнта з РА. Було встановлено значне зменшення набряку та болю протягом 3 місяців.
Екстракт куркуми — протизапальна, антиоксидантна та імуномодулююча дія для лікування ОА та РА
Екстракт куркуми, що входить до складу Меркана® Актив, отриманий з кореневища рослини куркума довга (Curcuma longa). Він містить різні складові, серед яких більш відомі куркумін, ефірні масла, δ-елландрен, цингіберен та сабінен. Однак найбільш вивченим, з точки зору використання у медицині, є куркумін, який має антиоксидантну, протизапальну, протидіабетичну та кардіопротекторну властивості.
Куркумін є найбільш активним інгредієнтом екстракту куркуми, що використовується як протизапальний та антиоксидантний засіб. У численних дослідженнях була продемонстрована його протизапальна властивість. Дослідження клітинної культури показали, що куркумін запобігає продукції IL-1 і IL-6, індукованій TNF-α, шляхом втручання в транскрипційний фактор NF-kB та сигнальні шляхи мітогенактивованих кіназ. Він чинить інгібуючу дію на експресію циклооксигенази-2, 5-ліпоксигенази та індуцибельної синтази оксиду азоту, що призводить до зниження рівня простагландину Е2 та оксиду азоту [61].
Антиоксидантна дія заснована на здатності куркуміну брати участь у механізмі пригнічення запальної відповіді, зв’язувати активні кисневі радикали та запобігати оксидативному пошкодженню клітин [62, 63]. У роботі S.J. Hewlings et al. [64] повідомляється, що куркумін підвищує активність антиоксидантів у сироватці крові — супероксиддисмутази, каталази і глутатіонпероксидази та інгібує перекисне окиснення ліпідів.
Імуномодулюючий ефект куркуміну обумовлений здатністю впливати на імунокомпетентні (Т- і В-лімфоцити) і допоміжні клітини організму — клітини моноцитарно-макрофагального ряду, нейтрофіли та дендритні клітини [63]. У дослідженні L. Jiping et al. [67] було показано, що куркумін нормалізує апоптотичну активність лімфоцитів, індуковану кінцевими продуктами глікування, та зменшує утворення активних форм кисню в мезангіальних клітинах.
Усі ці ефекти екстракту куркуми можуть відіграти важливу роль у профілактиці та лікуванні запальних і дегенеративно-дистрофічних захворювань суглобів, що підтверджується численними клінічними дослідженнями.
У пілотному клінічному дослідженні B. Chandran et al. [66] оцінювалася безпека і ефективність куркуміну як монотерапії і в поєднанні з диклофенаком натрію у пацієнтів з активним ревматоїдним артритом. У ньому взяли участь 45 пацієнтів з діагнозом РА, які були рандомізовані на три групи: 1-ша група (n = 15) отримувала 500 мг куркуміну, 2-га (n = 15) — 500 мг куркуміну + 50 мг диклофенаку натрію і 3-тя (n = 15) — 50 мг диклофенаку натрію. Первинною кінцевою точкою було зниження показника активності захворювання DAS-28. Вторинні кінцеві точки включали критерії Американської колегії ревматологів (ACR) щодо зниження болючості та набряклості суглобів. Результати дослідження виявили найвищий відсоток поліпшення загальних показників DAS-28 і ACR (ACR-20, -50 і -70) у групі пацієнтів, які отримували куркумін. Причому ці показники були значно вищими, ніж у пацієнтів групи диклофенаку натрію. При цьому лікування куркуміном було безпечним і не супроводжувалося жодними побічними ефектами.
У плацебо-контрольованому дослідженні K. Perkins et al. 739 пацієнтів з активним ОА щодня приймали від 200 до 400 мг екстракту куркуми протягом 6 місяців. До його застосування більшість пацієнтів отримували знеболюючі (65 %) та протизапальні препарати (54 %). Пацієнти повідомили про значне зниження вираженості болю протягом 6 місяців порівняно з вихідним рівнем — з 6,9 до 3,2 за 11-бальною шкалою Лайкерта. Під час дослідження екстракт куркуми продемонстрував сприятливий профіль безпеки [67].
У рандомізованому сліпому плацебо-контрольованому дослідженні К. Madhu [62] взяли участь 120 пацієнтів (37 чоловіків і 83 жінки) з первинним ОА колінного суглоба, які отримували плацебо (400 мг 2 р/день), або екстракт куркуми (500 мг 2 р/день), або глюкозаміну сульфат (750 мг 2 р/день) окремо або в комбінації з екстрактом куркуми протягом 42 днів. Ефективність терапії оцінювалася на 21-й і 42-й день лікування. Зменшення вираженості болю і зміна функції ураженого коліна розглядалися як основні показники ефективності і оцінювалися за допомогою ВАШ і індексу WOMAС. Середні вихідні бали болю за ВАШ становили від 60 до 67 для кожної групи. Середні оцінки за WOMAC на початковому рівні — від 54 до 61 для кожної групи. Через 6 тижнів лікування оцінка болю за ВАШ становила 46,03 ± 20,84 для плацебо, 19,48 ± 17,84 — для екстракту куркуми, 29,29 ± 20,58 — для глюкозаміну сульфату і 36,33 ± 28,99 — для комбінованої групи — глюкозаміну сульфату + екстракт куркуми. Як екстракт куркуми, так і глюкозаміну сульфат окремо значно знижували біль порівняно з плацебо і комбінованою терапією (P < 0,05). Наприкінці дослідження бали за WOMAC становили 47,90 ± 12,59 для плацебо, 27,14 ± 16,13 — для групи екстракту куркуми, 34,92 ± 19,48 — для глюкозаміну сульфату і 36,21 ± 24,74 — для комбінованої групи. У групі екстракту куркуми спостерігалося більш виражене зниження показників за WOMAC порівняно з плацебо та комбінованою терапією (р < 0,05). Було 2 повідомлення (6,6 %) про диспепсію в групі екстракту куркуми, у комбінованій групі — 4 повідомлення про небажані явища, включно з кашлем, диспепсією, лихоманкою та набряком стоп.
У дослідженні R. Kizhakkedath [68] порівнювали ефективність та безпеку лікування екстрактами Curcuma longa і Boswellia serrata з селективним інгібітором ЦОГ-2 целекоксибом у пацієнтів з ОА. У дослідження були включені 30 хворих, які були розподілені на дві рівні групи: прийому 500 мг 2 р/день екстрактів Curcuma longa і Boswellia serrata або 100 мг 2 р/день целекоксибу протягом 12 тижнів. На початковому рівні у 86 % пацієнтів групи комбінованої терапії та у 79 % хворих у групі целекоксибу відзначався помірний або сильний біль. На 12-му тижні ці показники знизились до 21 і 50 % відповідно. На початку дослідження тільки 21 % пацієнтів, які отримували комбіновану терапію, і 29 % пацієнтів, які приймали целекоксиб, могли пройти більше ніж 1000 метрів. Через 12 тижнів подолати цю дистанцію змогли 93 і 86 % пацієнтів відповідно. Автори дійшли висновку, що комбінований препарат більш ефективний у лікуванні остеоартриту порівняно з целекоксибом.
У рандомізованому відкритому паралельному контрольованому клінічному дослідженні D. Shep et al. [69] порівнювали ефективність і безпеку екстракту куркуми і диклофенаку у 139 пацієнтів з ОА колінного суглоба. Усі пацієнти випадковим чином були розподілені на дві групи лікування: 1-ша група — прийому 500 мг екстракту куркуми 3 р/день, 2-га група — диклофенаку 50 мг 2 р/день протягом 28 днів. Первинною кінцевою точкою була тяжкість болю за ВАШ на 14-й і 28-й дні лікування; вторинними кінцевими точками — оцінка ефективності лікування лікарем і пацієнтом. Безпеку препаратів оцінювали шляхом реєстрації небажаних явищ і лабораторними дослідженнями.
Результати дослідження показали, що на 14-й і 28-й день терапії у пацієнтів, які отримували екстракт куркуми, спостерігалося зменшення болю в суглобах, порівнянне з прийомом диклофенаку. У той же час лікування екстрактом куркуми добре переносилося і не вимагало додаткового призначення Н2-блокаторів, тоді як у групі диклофенаку така потреба виникла у 28 % хворих. Глобальна оцінка терапії пацієнтом і лікарем була однаковою у двох групах лікування. Побічні ефекти були значно меншими у групі екстракту куркуми — 13 проти 38 % у групі диклофенаку.
Таким чином, у дослідженні екстракт куркуми продемонстрував ефективність, подібну такій диклофенаку, але переносимість екстракту куркуми у пацієнтів, які страждали на ОА колінних суглобів, була значно кращою. Це доводить, що екстракт куркуми може бути використаний як альтернативний варіант лікування у хворих, які мають непереносимість побічних ефектів НПЗП.
Ці результати узгоджуються з раніше опублікованим звітом Kuptniratsaikul et al. [70], у якому повідомлялося про порівнянну ефективність екстракту куркуми й ібупрофену для полегшення клінічних симптомів у пацієнтів, які страждали на ОА колінного суглоба. Також у звіті відзначалася нижча частота побічних ефектів у групі куркуми — 33,3 % порівняно з 44,2 % при використанні ібупрофену.
Крім того, використання екстракту куркуми може бути корисним людям з високими фізичними навантаженнями та спортсменам. У дослідженні B.K. McFarlin [71] визначалася ефективність застосування екстракту куркуми у пацієнтів, які відчували виражені м’язові болі в чотириголовому м’язі стегна, що виникли внаслідок фізичних вправ. Усі суб’єкти дослідження (n = 28) випадковим чином розподілялися на групу прийому куркуміну 400 мг/день або плацебо. Їх застосування здійснювалося за 2 дні до фізичного навантаження і до 4 днів після. Результати дослідження показали вірогідну перевагу куркуміну порівняно з плацебо, що проявлялося в зниженні креатинкінази на 48 %, TNF-α — на 25 % і IL-8 — на 21 % порівняно з плацебо. У свою чергу, зниження біологічного запалення призводило до більш швидкого відновлення і поліпшення функціональних можливостей суглобів під час наступних тренувань.
Технологія NovaSOL® Curcumin Boswellia — підвищення біодоступності екстрактів куркуми і босвелії
У Меркана® Актив використовується запатентований комплекс екстракту кореневища куркуми та смоли босвелії NovaSOL® Curcumin Boswellia. NovaSOL® — це запатентована німецька технологія розміщення слаборозчинних речовин у 30-нанометрові міцели, які таким чином набувають ліпо- та гідрофільних (водночас жиро- та водорозчинних, або амфіфільних) властивостей. Технологія NovaSOL® Curcumin Boswellia збільшує швидкість всмоктування та біодоступність розміщених у міцелах інгредієнтів. Була доведена до 185 разів більша біодоступність куркуміну при його пероральному застосуванні в міцелярному вигляді порівняно з нативним куркуміном. Також була продемонстрована у 56 разів більша біодоступність найбільш активного компонента екстракту босвелії — ацетил-11-кето-β-босвелієвої кислоти при пероральному застосуванні розчиненого екстракту босвелії у міцелах порівняно зі звичайним (нативним) екстрактом босвелії [31, 32, 72].
Доведено, що міцелярна солюбілізація посилює протизапальну активність куркуміну та босвелієвих кислот. Це було показано в дослідженні у щурів з ад’ювантно-індукованим артритом M.T. Khayyal et al. [31]. Ад’ювантний артрит був викликаний ін’єкцією ад’юванта Фройнда в праву задню лапу щурів, з подальшим моніторингом об’єму лап протягом 3 тижнів. Препарати давали щодня протягом 3 тижнів, починаючи з дня ад’ювантного щеплення. Сироватку збирали в кінці експерименту для аналізу параметрів запального і окисного стресу. Солюбілізований куркумін показав кращу протизапальну активність, ніж його нативна форма. Зменшення об’єму лапи корелювало зі зниженням медіаторів запалення, таких як TNF-α, IL-6, С-реактивний білок, мієлопероксидаза і маркери перекисного окиснення ліпідів. Поєднання солюбілізатів куркуміну та босвелії призводило до синергізму ефектів, що виявляло більш потужну терапевтичну дію.
Таким чином, отримані дані підтверджують, що міцелярна солюбілізація куркуміну і босвелії не тільки підвищує біодоступність, але й підсилює їх біологічну активність. Міцелярний куркумін у поєднанні з міцелярною босвелією являє собою більш перспективний засіб для протизапального лікування і потенційну альтернативу синтетичним препаратам.
Вітамін D3 (холекальциферол) при остеоартриті
Активні форми вітаміну D беруть участь у регуляції фосфорно-кальцієвого обміну. Вітамін D стимулює всмоктування іонів кальцію і фосфору стінкою кишечника, стимулює реабсорбцію кальцію і фосфору в ниркових канальцях. Він необхідний для функціонування паращитоподібних залоз, кишечника, нирок та для забезпечення мінералізації кісткової тканини.
Концентрація іонів кальцію впливає на низку важливих біохімічних процесів, що зумовлюють підтримку тонусу скелетної мускулатури, беруть участь у проведенні нервового збудження та впливають на згортання крові.
У дослідженнях показана здатність вітаміну D зменшувати ерозію суглобового хряща, знижувати рівень ферментів, що руйнують хрящовий та кістковий колаген (матриксні металопротеїнази 9 та 13) з одночасним збільшенням рівня TGF-β1.
У дослідженнях in vitro показано, що додавання до культури синовіоцитів активного метаболіту вітаміну D призводить до істотного зниження експресії IL-6, INF-γ, фактора росту фібробластів і ендотелію судин, порівнянного з впливом дексаметазону. При цьому відзначено відстрочене збереження протизапального ефекту активного метаболіту вітаміну D [73]. Активний метаболіт холекальциферолу — альфакальцидол у дозі 0,5 мкг протягом 3 місяців збільшував співвідношення CD4+/CD8+-лімфоцитів і зменшував співвідношення ІL-6/ІL-10, що свідчить про системний вплив даного препарату на клітинний і гуморальний імунітет [74]. Вітамін D впливає на метаболізм хряща [75], що обумовлено його здатністю модулювати синтез позаклітинного матриксу суглобового хряща, активувати синтез колагену і мембранної АТФази хондроцитів [82]. Вітамін D інгібує активність матриксних металопротеїназ і апоптоз шляхом перенесення іонів кальцію, активує фосфоліпазу D, збільшує продукцію лізофосфатидинової кислоти [84]. Високі дози вітаміну D активують остеоцитарне диференціювання та функціональну активність остеобластів субхондральної кістки, що веде до підвищення експресії остеокальцину та перешкоджає резорбції кістки [76]. Про ефективність та безпеку застосування вітаміну D свідчать численні клінічні дослідження, які демонструють зниження дискомфорту та покращення функції колінних суглобів при його застосуванні [77]. У рандомізованому контрольованому пілотному дослідженні D. Sanghi et al. [78] взяли участь 107 пацієнтів з ОА колінного суглоба і недостатністю вітаміну D (25(OH)D ≤ 50 нмоль/л). Усі вони були розподілені на дві групи: перорального прийому вітаміну D або плацебо. Первинними показниками результату були біль і функція суглоба, оцінювані за ВАШ і індексом WOMAC, вторинними — біохімічні маркери (загальний кальцій сироватки крові, лужна фосфатаза). Спостереження за пацієнтами проводилося протягом року. Через 12 місяців біль у коліні в групі вітаміну D зменшився в середньому на –0,26 (95% ДІ від –2,82 до –1,43) за ВАШ і на –0,55 (95% ДІ від –0,07 до 1,02) за індексом WOMAC, тоді як у групі плацебо він збільшився в середньому на 0,13 (95% ДІ від –0,03 до 0,29) за ВАШ і на 1,16 (95% ДI від 0,82 до 1,49) за WOMAС (величина ефекту = 0,37 і 0,78). Аналогічним чином функція колінного суглоба покращилася в групі вітаміну D у середньому на –1,36 (95% ДІ від –1,87 до –0,85) порівняно з групою плацебо, яка мала середнє значення 0,69 (95% ДІ від –0,03 до 1,41; величина ефекту = 0,06). Спостерігалися біохімічні зміни загального кальцію в сироватці крові і лужної фосфатази. Ці результати свідчать про статистично значущу клінічну перевагу лікування вітаміном D у пацієнтів з ОА колінного суглоба.
У великому метааналізі Z. Wu et al. [79], що включав 19 рандомізованих контрольованих досліджень з 3436 пацієнтами, які мали хронічний больовий синдром, була показана аналгетична дія тривалого прийому вітаміну D (≥ 4 тижнів). Повідомлялося про значно більше зниження середнього показника болю для групи вітаміну D порівняно з плацебо (середня різниця –0,57). За даними метааналізу 4 РКД, проведеного Gao et al. [80] за участю 1136 пацієнтів з гонартрозом, застосування вітаміну D у добовій дозі понад 2000 MО призводило до істотного зменшення болю і дисфункції колінних суглобів [80]. В обох дослідженнях підкреслювалася добра переносимість і низька кількість небажаних реакцій, порівнянна з плацебо.
У дослідженні J. Javadian et al. [81] оцінювався вплив дефіциту вітаміну D на біль і м’язову силу квадрицепса при ОА колінного суглоба. У ньому взяли участь 67 пацієнтів віком 50,0 ± 6,6 року, які мали біль у коліні протягом не менше ніж 1 місяць і дефіцит вітаміну D (25(OH)D). Усі учасники отримували 50 000 МО холекальциферолу щотижня протягом щонайменше двох місяців. Вплив підвищення сироваткового 25(OH)D на силу чотириголового м’яза та біль оцінювали шляхом розрахунку середніх змін від вихідного рівня в кінці періоду лікування з використанням парного Т-тесту. Наприкінці дослідження 25(OH)D у сироватці крові досяг достатнього рівня у 66 пацієнтів. Також збільшилася м’язова сила квадрицепса порівняно з вихідним рівнем і зменшилися вираженість болю за ВАШ та індекс Лайкерта. Ці результати показали, що корекція дефіциту вітаміну D у пацієнтів з ОА колінного суглоба сприятливо впливає на м’язову силу квадрицепса і біль у коліні.
Капсули Меркана® Актив зроблені за технологію Licaps®
Капсули Меркана® Актив виробляються за спеціальною технологією рідиновмісних твердих капсул Licaps®, що забезпечує стабільність, захист вмісту капсули від протікання, зовнішнього впливу та окиснення. Крім того, оболонка капсули Licaps® забезпечує більш швидке її розчинення для прискорення всмоктування активних речовин вмісту капсули.
Висновки
Остеоартрит периферичних суглобів і суглобів хребта, ревматоїдний артрит становлять серйозну медико-соціальну проблему. Нестероїдні протизапальні препарати є найбільш визнаними препаратами для полегшення симптомів при лікуванні ОА та РА, але вони не впливають на імунний механізм руйнування хряща [28] та здатні посилювати його деградацію. Тому для лікування цих захворювань доцільно призначати комплексні засоби, які не тільки зменшують запальне пошкодження хряща, а й впливають на імуномодуляцію.
Меркана® Актив — це новий натуральний препарат, який поєднав 4 високоактивні натуральні ходропротекторні компоненти з клінічно доведеною вираженою протизапальною та протибольовою ефективністю, порівнянною з дією НПЗП, але зі значно кращою переносимістю та структурно-модифікуючим впливом на суглобовий хрящ.
Добова доза Меркана® Актив містить такі активні інгредієнти, як рідкий екстракт кореневища куркуми та смоли босвелії (NovaSOL® Curcumin Boswellia) — близько 1660 мг, колаген неденатурований ІІ типу –(UC-II®) — 40,0 мг та вітамін D3 (холекальциферол) — 15 мкг (що відповідає 600 МО), завдяки чому чинить мультимодальну дію. Зручна схема прийому — лише 2 капсули на добу, які можна прийняти за 1 прийом, дозволяє значно покращити комплаєнс пацієнтів.
Ефективність і безпека усіх компонентів Меркана® Актив доведена численними дослідженнями. З огляду на дані клінічних та лабораторних досліджень неденатурованого колагену II типу (UC-II®), екстракту босвелії, екстракту куркуми та вітаміну D Меркана® Актив доцільно застосовувати для зменшення болю, запалення та покращення стану суглобового хряща при остеоартриті та ревматоїдному артриті.
Список литературы
1. Медицинские диссертации. http://medical-diss.com/medicina/faktory-rika-osteoartroza-i-osteohondroza-u-rabochih-shinnogo-proizvodstva#ixzz5DzCGTMUk
2. Современные возможности оценки болезнь-модифицирующего потенциала препаратов для лечения остеоартрита. Новости медицины и фармации. 2016. № 7.
3. Bozic K.J., Cramer B., Albert T.J. Medicare and the Orthopaedic Surgeon: Challenges in Providing, Financing, and Accessing Muscoskeletal Care for the Elderly. J. Bone Joint Surg. [Am]. 2010. № 92. Р. 1568-1574.
4. Балабанова Р.М. Ревматоидный артрит: новые подходы к старой проблеме. https://medi.ru/info/1912/
5. Имаметдинова Г.Р. Хондроитина сульфат при заболеваниях опорно-двигательного аппарата: эффективность и безопасность с позиций доказательной медицины. РМЖ. 2016. № 22. С. 1481-1488.
6. Ратбиль О.Е. Остеохондроз: современное состояние вопроса. РМЖ. 2010. № 26. С. 1615.
7. Conaghan P.G., Dickson J., Grant R.L. Care and management of osteoarthritis in adults: summary of NICE guidance. British Medical Journal. 2008. Vol. 336. P. 502-3.
8. Берглезов М.А., Андреева Т.М. Остеоартрит (этиология, патогенез). Вестник травматологии и ортопедии им. Н.Н. Приорова. 2006. № 4. С. 79-86.
9. Андреева Т.М., Троценко В.В. Ортопедическая заболеваемость и организация специализированной помощи при патологии костно-мышечной системы. Вестник травматологии и ортопедии им. Н.Н. Приорова. 2006. № 1. С. 3-6.
10. Мазуров В.И., Онущенко И.А. Остеоартрит. Санкт-Петербург: СПбМАПО, 1999. 116 с.
11. Выбор лекарства для лечения остеоартрита. https://ilive.com.ua/health/vybor-lekarstva-dlya-leche–niya-osteoartroza_70221i16101.html.
12. Алексеева Л.И. Хондроитин сульфат в лечении остеоартрита. Новости медицины и фармации. 2008. № 15(252).
13. Orhan C., Juturu V., Sahin E., Tuzcu M., Ozercan I.H., Durmus A.S., Sahin N., Sahin K. Undenatured Type II Collagen Ameliorates Inflammatory Responses and Articular Cartilage Damage in the Rat Model of Osteoarthritis. Front. Vet. Sci. 2021 March. https://doi.org/10.3389/fvets.2021.617789.
14. Текст етикетування дієтичної добавки Меркана® Актив.
15. Наумов А.В., Шамуилова М.М. Остеоартрит в современной клинической практике: анализ факторов и рекомендации. Терапевт. 2009. № 10. С. 5-33.
16. Кraus V.B., Blanco F.J., Englund M. et al. Call for Standardized Definitions of Osteoarthritis and Risk Stratification for Clinical Trials and Clinical Use. Osteoarthritis Cartilage. 2015. Vol. 23 (8). P. 1233-1241. doi: 10.1016/joca.2015.03.036.
17. Петров К.Б. Остеохондроз позвоночника: в защиту нозологической, терминологической и классификационной индивидуальности. http://www.eurolab.ua/encyclopedia/565/46687/.
18. Балла Е. Остеоартрит: схема лечения шаг за шагом. http://www.medvestnik.by/ru/sovremennii_podxod/view/osteoartroz-sxema-lechenija-shag-za-shagom-17029-2017/.
19. Беленький А.Г. Препараты гиалуроновой кислоты в лечении остеоартрита: Учебное пособие. Москва: РМАПО, 2004. 25 с.
20. Насонов Е.Л. Современные направления терапии остеоартрита. Consilium medicum. 2001. № 9. С. 408-415.
21. Насонова В.А. Остеоартрит коленного сустава: причины развития, диагностика и профилактика. Consilium medicum. 2003. № 5 (2). С. 87-92.
22. Боровков Н.Н. Современные подходы к комплексной терапии остеоартрита с использованием мази «Хондроксид». Н.-Новгород: Нижфарм, 2002. 25 с.
23. Клиническая ревматология: Руководство для практикующих врачей. Под ред. чл.-кор. РАМН В.И. Мазурова. Санкт-Петербург: Фолиант, 2001. 416 с.
24. Цветкова Е.С. Нестероидные противовоспалительные препараты в терапии остеоартрита (гонартроза). Consilium medicum. 2003. № 5 (2). С. 100-103.
25. Цветкова Е.С. Остеоартрит. Ревматические болезни: Руководство по внутренним болезням. Москва: Медицина, 1997. С. 385-396.
26. Ребров А.П. Новые возможности лечения остео–артрита: симптоматические препараты медленного действия. Саратов, 2005. 9 с.
27. Остеоартрит: вопросы патогенеза, диагностики, лечебной тактики. http://www.mif-ua.com/education/symposium/osteoartroz-voprosyi-patogeneza-diagnostiki-lechebnoj-taktiki.
28. Narayanan V., Gandhi R. Understanding Collagen Supplements in Arthritis — Immunomodulation with Undenatured Collagen II Versus Cartilage Building with Hydrolysed Collagen II. Archives of Orthopedics and Rheumatology. 2019. Vol. 2.
29. Лучихина Л.В. Артроз. Ранняя диагностика и патогенетическая терапия. Москва: Медицинская энциклопедия, 2001. 139 с.
30. Яременко О.Б., Федьков Д.Л., Яременко К.М., Комкіна М.О., Мазанко К.В. Ефективність, переносимість та вплив на метаболізм хрящової тканини неденатурованого колагену ІІ типу UC-II™ (Меркана) у хворих на остеоартрит колінних суглобів. Біль. Суглоби. Хребет. 2021. Т. 11. № 3.
31. Khayyal M.T., El-Hazek R.M., El-Sabbagh W.A., Frank J., Behnamb D., Abdel-Tawaba M. Micellar solubilisation enhances the antiinflammatory activities of curcumin and boswellic acids in rats with adjuvant-induced arthritis. Nutrition. 2018. Vol. 54. P. 189-196.
32. Meinsa J., Behnamb D., Abdel-Tawaba M. Enhanced absorption of boswellic acids by a micellar solubilized delivery form of Boswellia extract. NFS Journal. 2018. № 11. P. 12-16.
33. Кабалык М.А. Витамин D в терапии остеоартрита: новые возможности и перспективы. РМЖ. Медицинское обозрение. 2019. № 11(II).
34. Xin W., Heilig J., Paulsson M., Zaucke F. Collagen II regulates chondroycte integrin expression profile and differentiation. Connect. Tissue Res. 2015. Vol. 56. № 4. Р. 307-314.
35. Charni-Ben Tabassi N., Desmarais S., Bay-Jensen A.C. et al. The type II collagen fragments Helix-II and CTX-II reveal different enzymatic pathways of human cartilage collagen degradation. Osteoarthritis Cartilage. 2008. Vol. 16. № 10. Р. 1183-1191.
36. Трентам Д.Е. Эффективность перорального приема коллагена типа II при ревматоидном артрите. Наука. 1993. № 261. С. 1727-30. PMID: 8378772.
37. Prabhoo R., Billa G. Undenatured collagen type II for the treatment of osteoarthritis: a review. Int. J. Res. Orthop. 2018. Vol. 4. № 5. Р. 684-689.
38. Pabst O., Mowat A.M. Oral tolerance to food protein. Mucosal. Immunol. 2012. Vol. 5. № 3. Р. 232-239.
39. Bagi C.M., Berryman E.R., Teo S., Lane N.E. Oral administration of undenatured native chicken type II collagen (UC-II) diminished deterioration of articular cartilage in a rat model of osteoarthritis (OA). Osteoarthritis Cartilage. 2017. Vol. 25. № 12. Р. 2080-2090.
40. Di Cesare Mannelli L., Micheli L., Zanardelli M., Ghelardini C. Low dose native type II collagen prevents pain in a rat osteoarthritis model. BMC Musculoskelet. Di–sord. 2013. Vol. 14. ID 228.
41. Tong Tong, Wei Zhao, Ying-Qi Wu, Yan Chang, Qing-Tong Wang, Ling-Ling Zhang, Wei Wei. Chicken type II collagen induced immune balance of main subtype of helper T cells in mesenteric lymph node lymphocytes in rats with collagen-induced arthritis. Inflamm Res. 2010. Vol. 59(5). Р. 369-77. doi: 10.1007/s00011-009-0109-4.
42. Di Cesare Mannelli L., Maresca M., Micheli L., Martin Puig D., Ghelardini C. Low dose chicken native Type II collagen is active in a rat model of osteoarthritis. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases. 2015 (Italy).
43. Honvo G., Lengelé L., Charles A., Reginster J.-Y., Bruyère O. Role of Collagen Derivatives in Osteoarthritis and Cartilage Repair: A Systematic Scoping Review with Evidence Mapping. Rheumatology and Therapy. 2020. Vol. 7. P. 703-740.
44. Lugo J.P., Saiyed Z.M., Lau F.C. et al. Undenatured type II collagen (UC-II®) for joint support: a randomized, double-blind, placebo-controlled study in healthy volunteers. J. Int. Soc. Sports Nutr. 2013. Vol. 10. № 1. Р. 48.
45. Azeem М.А., Patil R. The Study of undenatured type II collagen in the knee osteoarthritis. International Journal of Orthopaedics Traumatology & Surgical Sciences. 2019. Vol. 5. Р. 172-175.
46. Mehra А., Anand Р., Borate М., Paul Р., Kamble S., Mehta K.D., Qamra A., Shah A., Jain R. A non-interventio–nal, prospective, multicentric real life Indian study to assess safety and effectiveness of un-denatured type 2 collagen in management of osteoarthritis. International Journal of Research in Orthopaedics. 2019 March-April. Vol. 5. Iss. 2. P. 316.
47. Crowley D.C., Lau F.C., Sharma Р. et al. Safety and efficacy of undenatured type II collagen in the treatment of osteoarthritis of the knee: a clinical trial. Int. J. Med. Sci. 2009. Vol. 6. № 6. Р. 312-321.
48. Lugo J.P., Saiyed Z.M., Lane N.E. et al. Efficacy and tolerability of an undenatured type II collagen supplement in modulating knee osteoarthritis symptoms: a multicenter randomized, double-blind, placebo-controlled study. Nutr. J. 2016. Vol. 15. ID 14.
49. Dybka K., Walczak P. Collagen as a new diet suplement. Food Chemistry and Biotechnology. 2009. Vol. 73. № 1058.
50. Barnett M.L., Kremer J.M., St Clair E.W., Clegg D.O., Furst D., Weisman M., et al. Treatment of rheumatoid arthritis with oral type II collagen. Results of a multicenter, double-blind, placebo-controlled trial. Arthritis Rheum. 1998 Feb. Vol. 41(2). Р. 290-7. doi: 10.1002/1529-0131(199802)41:2<290::AID-ART13>3.0.CO;2-R. Erratum in: Arthritis Rheum. 1998 May. Vol. 41(5). Р. 938. PMID: 9485087.
51. Wei Wei, Ling-Ling Zhang, Jian-Hua Xu, Feng Xiao, Chun-De Bao, Li-Qing Ni, et al. A multicenter, double-blind, randomized, controlled phase III clinical trial of chicken type II collagen in rheumatoid arthritis.
52. Strasser E.M., Wessner B., Manhart N., Roth E. The relationship between the anti-inflammatory effects of curcumin and cellular glutathione content in myelomonocytic cells. Biochem. Pharmacol. 2005. Vol. 70. № 4. Р. 552-559.
53. Takada Y., Bhardwaj A., Potdar P., Aggarwal B. Nonstiroidal anti-inflammatory agents differ in their ability to suppress NF-kB activation, of expression of cyclooxigenase-2 and cyclin D1, and abrogation of tumor cell proli–feration. Oncogene. 2004. Vol. 23. Р. 9247-9258.
54. Boswellia serrata. Alternative Medicine Review. 2008. Vol. 13. № 2.
55. Umar S. et al. Boswellia serrata extract attenuates inflammatory mediators andoxidative stress in collagen induced arthritis. Phytomedicine. 014. Р. 10.
56. Karra A.G., Tziortziou M., Kylindri P., Georgatza D., Gorgogietas V.A., Makiou A., Krokida A., Tsialtas I., Kalousi F.D., Papadopoulos G.D., Papadopoulou K.K., Psarra A.-M.G. Boswellic acids and their derivatives as potent regulators of glucocorticoid receptor actions. Archives of Biochemistry and Biophysics. 2020. № 695.
57. Vishal А.А., Mishra А., Raychaudhuri S.P. A Double Blind, Randomized, Placebo Controlled Clinical Study Evaluates the Early Efficacy of Aflapin® in Subjects with Osteoarthritis of Knee. Int. J. Med. Sci. 2011. Vol. 8(7). Р. 615-622.
58. Yu G., Xiang W., Zhang T., Zeng L., Yang K., Li J. Effectiveness of Boswellia and Boswellia extract for osteoarthritis patients: a systematic review and meta-analysis. BMC Complementary Medicine and Therapies. 2020. Vol. 20. Р. 225.
59. Kimmatkar N., Thawani V., Hingorani L., et al. Efficacy and tolerability of Boswellia serrata extract in treatment of osteoarthritis of knee — a randomized double blind, placebo-controlled trial. Phytomedicine. 2003. Vol. 10. P. 3-7.
60. Etzel R. Special extract of Boswellia serrata (H15) in the treatment of rheumatoid arthritis. Phytomedicine. 1996. Vol. 3. P. 91-94.
61. Gupta S.G., Patchva S., Koh W., Aggarwal B.B. Discovery of Curcumin, a Component of the Golden Spice, and Its Miraculous Biological Activities. Clin. Exp. Pharmacol. Physiol. 2012. Vol. 39(3). Р. 283-299.
62. Madhu К., Chanda К., Saji M.J. Safety and efficacy of Curcuma longa extract in the treatment of painful knee osteoarthritis: a randomized placebo-controlled trial. Inflammopharmacology. 2013. Vol. 21(2). Р. 129-36.
63. Zheng M., Zhang Q., Joe Y., Lee B.H., Ryu G., Kwon K.B., Ryter S.W., Chung H.T. Curcumin induces apoptotic cell death of activated human CD4+ T cells via increa–sing endoplasmic reticulum stress and mitochondrial dysfunction. Int. Immunopharmacol. 2013. Vol. 15(3). Р. 517-23.
64. Hewlings S.J., Kalman D.S. Curcumin: A Review of Its’ Effects on Human Health. Foods. 2017. Vol. 6. Р. 92.
65. Liu J.P., Feng L., Zhu M.M., Wang R.S., Zhang M.H., Hu S.Y., Jia X.B., Wu J.J. The in vitro protective effects of curcumin and demethoxycurcumin in Curcuma longa extract on advanced glycation end products-induced mesangial cell apoptosis and oxidative stress. Planta Med. 2012. Vol. 78(16). Р. 1757-60.
66. Chandran B., Goel A. A Randomized, Pilot Study to Assess the Efficacy and Safety of Curcumin in Patients with Active Rheumatoid Arthritis. Phytother. Res. 2012.
67. Perkins K., Sahy W., Beckett R.D. Efficacy of Curcuma for Treatment of Osteoarthritis. J. Evid. Based Complementary Altern. Med. 2017. Vol. 22(1). Р. 156-165.
68. Kizhakkedath R. Clinical evaluation of a formulation containing Curcuma longa and Boswellia serrata extracts in the management of knee osteoarthritis. Mol. Med. Rep. 2013. Vol. 8(5). Р. 1542-8.
69. Shep D., Khanwelkar C., Gade P., Karad S. Safety and efficacy of curcumin versus diclofenac in knee osteoarthritis: a randomized open-label parallel-arm study. 2019. 20:214. https://doi.org/10.1186/s13063-019-3327-2.
70. Kuptniratsaikul V., Thanakhumtorn S., Chinswangwatanakul P., Wattanamongkonsil L., Thamlikitkul V. Efficacy and safety of Curcuma domestica extracts in patients with knee osteoarthritis. J. Altern. Complement Med. 2009. Vol. 15. Р. 891-897.
71. McFarlin B.K., Venable A.S., Henning A.L., Sampson J.B., Pennel K., Vingren J.L., Hill D.H. Reduced inflammatory and muscle damage biomarkers following oral supplementation with bioavailable curcumin. BBA Clin. 2016. Vol. 18. № 5. Р. 72-8.
72. Schiborr C., Toelstede S., Kocher A., Frank J. The oral bioavailability of curcumin from micronized powder and liquid micelles is significantly increased in healthy humans and differs between sexes. Molecular Nutrition & Food Research. 2014.
73. Huhtakangas J.A., Veijola J., Turunen S. et al. 1,25(OH) (2)D(3) and calcipotriol, its hypocalcemic analog, exert a long-lasting anti-inflammatory and anti-proliferative effect in synoviocytes cultured from patients with rheumatoid arthritis and osteoarthritis. J. Steroid Biochem. Mol. Biol. 2017. Vol. 173. Р. 13-22.
74. Rizka A., Setiati S., Harimurti K. et al. Effect of Alfacalcidol on Inflammatory markers and T Cell Subsets in Elderly with Frailty Syndrome: a Double Blind Rando–mized Controlled Trial. Acta Med. Indones. 2018. Vol. 50(3). Р. 215-221.
75. Schwartz Z., Schlader D.L., Ramirez V. et al. Effects of vitamin D metabolites on collagen production and cell proliferation of growth zone and resting zone cartilage cells in vitro. J. Bone Miner. Res. 1989. Vol. 4(2). Р. 199-207.
76. Hu Y., Liu Y., Lajeunesse D. et al. Identification of two populations of osteoarthritic osteoblasts according to the 1,25[OH]2 vitamin D3 potency to stimulate osteocalcin. Biomed. Mater. Eng. 2015. Vol. 25(1 Suppl.). Р. 103-110.
77. George J. Vitamin D Supplementation and Progression of Knee Osteoarthritis. JAMA. 2016. Vol. 316(3). Vol. 347-348.
78. Sanghi D., Mishra A., Sharma A.C., Singh A., Natu S.M., Agarwal S., Srivastava R.N. Does vitamin D improve osteoarthritis of the knee: a randomized controlled pilot trial. Clin. Orthop. Relat. Res. 2013. Vol. 471(11). Р. 3556-62.
79. Wu Z., Malihi Z., Stewart A.W., Lawes C.M., Scragg R. Effect of Vitamin D Supplementation on Pain: A Systematic Review and Meta-analysis. Pain Physician. 2016. Vol. 19(7). Vol. 415-27.
80. Gao X.R., Chen Y.S., Deng W. The effect of vitamin D supplementation on knee osteoarthritis: A meta-analysis of randomized controlled trials. Int. J. Surg. 2017. Vol. 46. Р. 14-20.
81. Heidari B., Javadian Y., Babaei M., Ghahari B.Y. Restorative Effect of Vitamin D Deficiency on Knee Pain and Quadriceps Muscle Strength in Knee Osteoarthritis. Acta Medica Iranicа. 2015. Vol. 53(8). Р. 466-470.