Журнал «Боль. Суставы. Позвоночник» Том 12, №2, 2022
Вернуться к номеру
Остеоартрит та кишкова мікробіота: патогенетичне значення осі суглоб — кишечник — мікробіом
Авторы: Головач І.Ю. (1), Рекалов Д.Г. (2)
(1) — Клінічна лікарня «Феофанія» Державного управління справами, м. Київ, Україна
(2) — Запорізький державний медичний університет МОЗ України, м. Запоріжжя, Україна
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
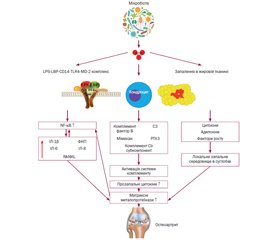
Актуальність. Остеоартрит (ОА) являє собою захворювання, що призводить до суглобової дегенерації, супроводжується постійним болем, запаленням та функціональною недостатністю суглобів. Хоча багато факторів сприяють розвитку ОА, мікробіом кишечника нещодавно виявився важливим патогенним фактором в ініціації та прогресуванні ОА. Мета дослідження: провести аналіз сучасних літературних даних щодо патогенетичного значення мікробіоти кишечника при ОА. Матеріали та методи. Проаналізовано доступні в науковій літературі дані клінічних досліджень та наукових оглядів, оцінені сучасні метааналізи щодо впливу мікробіоти кишечника на розвиток та прогресування ОА. Результати. Мікробіота кишечника відповідає за низку метаболічних, імунологічних, структурних і неврологічних функцій, потенційно може зумовлювати гетерогенність фенотипів ОА та формування індивідуальних особливостей перебігу хвороби. Численні дослідження підтримують гіпотезу існування кишково-суглобової осі та взаємодії між кишковою мікробіотою та ОА-релевантними факторами ризику. Запропонована концепція починається з порушення та дисбактеріозу кишечника, порушення гомеостазу мікробіоти, безперервної зміни мікробного складу та геномної пластичності для оптимальної адаптації бактерій до середовища хазяїна, що супроводжується як адаптивними, так і вродженими імунними реакціями внаслідок транслокації бактерій та бактеріальних продуктів у кровообіг до суглоба. Цей каскад зрештою призводить до запалення в суглобі та сприяє розвитку й прогресуванню ОА. Інтерпретація потенційних механізмів патогенезу ОА є необхідною для розробки нових заходів профілактики та терапевтичних втручань, що впливатимуть на перебіг захворювання. Крім того, кишкова мікробіота також є потенційним біомаркером, пов’язаним із запаленням та дисбіозом кишечника, що дозволяє передбачити прогресування ОА та контролювати ефективність терапевтичних втручань. Висновки. У цьому огляді підсумовано дані досліджень, що підтверджують гіпотезу про існування осі суглоб — кишечник — мікробіота і взаємодію між мікробіотою та факторами ризику ОА.
Introduction. Osteoarthritis (ОА) is a disease leading to joint degeneration, accompanied by constant pain, inflammation, and functional failure of the joints. Although many factors contribute to the development of ОА, the gut microbiome has recently emerged as an important pathogenic factor in ОА initiation and progression. The purpose of the study was to analyze modern literature data regarding the link between the gut microbiome and ОА. Materials and methods. The available data of clinical studies and scientific reviews were analyzed, and modern meta-analyses on the influence of gut microbiota on the development and progression of ОА were evaluated. Results. Gut microbiota is responsible for a number of metabolic, immunological, and structural and neurological functions, potentially elucidating the heterogeneity of OA phenotypes and formation of individual features of the course of the disease. Numerous studies support the hypothesis of the existence of a gut – joint axis and the interaction between gut microbiota and OA-relevant risk factors. The proposed concept begins with intestinal disruption and dysbacteriosis, disruption of microbiota homeostasis, continuous changes in microbial composition and genomic plasticity for optimal adaptation of bacteria to the host environment, accompanied by both adaptive and innate immune responses due to translocation of bacteria and bacterial products into the bloodstream to the joint. This cascade ultimately leads to inflammation in the joint and contributes to the development and progression of OA. Interpretion of the potential mechanisms of OA pathogenesis is essential for the development of new preventive and disease-modifying therapeutic interventions. In addition, gut microbiota is also a potential biomarker related to inflammation and gut dysbiosis to predict the progression of ОА and monitor the effectiveness of therapeutic interventions. Conclusions. In this review, we summarized research data that are supporting the hypothesis of a “joint – gut – microbiota axis” and the interaction between gut microbiota and the OA-relevant factors, including age, gender, metabolism, obesity.
остеоартрит; кишкова мікробіота; фактори ризику; дисбіоз кишечника; запалення; пробіотики; огляд
osteoarthritis; gut microbiome; risk factors; intestinal dysbiosis; inflammation; probiotics; review
Вступ
Висновки
- Glyn-Jones S., Palmer A.J., Agricola R. et al. Osteoarthritis. Lancet. 2015. 386(9991). 376-387. doi: 10.1016/S0140-6736(14)60802-3.
- Martel-Pelletier J., Barr A.J., Cicuttini F.M. et al. Osteoarthritis. Nat. Rev. Dis. Primers. 2016. 2. 16072. doi: 10.1038/nrdp.2016.72. PMID: 27734845.
- Berenbaum F. Deep phenotyping of osteoarthritis: a step forward. Ann. Rheum. Dis. 2019. 78(1). 3-5. doi: 10.1136/annrheumdis-2018-213864.
- Berthelot J.M., Sellam J., Maugars Y., Berenbaum F. Cartilage-gut-microbiome axis: a new paradigm for novel therapeutic opportunities in osteoarthritis. RMD Open. 2019. 5(2). e001037. doi: 10.1136/rmdopen-2019-001037.
- Губська О.Ю., Кузьмінець А.А., Гуцул В.М., Лавренчук І.О. Кишковий мікробіом й остеоартрит. Гастроентерологія. 2019. 53(2). 132-137. doi: 10.22141/2308-2097.53.2.2019.168988.
- Fändriks L. Roles of the gut in the metabolic syndrome: an overview. J. Intern. Med. 2017. 281(4). 319-336. doi:10.1111/ joim.12584.
- Mancabelli L., Milani C., Lugli G.A. et al. Meta-analysis of the human gut microbiome from urbanized and pre-agricultural populations. Environ Microbiol. 2017. 19(4). 1379-1390. doi: 10.1111/1462-2920.13692.
- Szychlinska M.A., Di Rosa M., Castorina A. et al. A correlation between intestinal microbiota dysbiosis and osteoarthritis. Heliyon. 2019. 5. e01134.
- Chisari E., Wouthuyzen-Bakker M., Friedrich A.W., Parvizi J. The relation between the gut microbiome and osteoarthritis: A systematic review of literature. PLoS ONE. 2021. 16(12). e0261353. doi: 10.1371/journal. pone.0261353.
- Головач И.Ю. Метаболический фенотип остеоартрита: двойная роль ожирения. Травма. 2017. 18(5). 87-94. doi: 10.22141/1608-1706.5.18.2017.114124.
- Berg G., Rybakova D., Fischer D. et al. Microbiome definition re-visited: old concepts and new challenges. Microbiome. 2020. 8(1). 103. doi: 10.1186/s40168-020-00875-0.
- Sommer F., Bäckhed F. The gut microbiota — masters of host development and physiology. Nat. Rev. Microbiol. 2013. 11(4). 227-238. doi: 10.1038/nrmicro2974.
- Sekirov I., Russell S.L., Antunes L.C., Finlay B.B. Gut microbiota in health and disease. Physiol. Rev. 2010. 90(3). 859-904. doi: 10.1152/physrev.00045.2009.
- Eckburg P.B., Bik E.M., Bernstein C.N. et al. Diversity of the human intestinal microbial flora. Science. 2005. 308(5728). 1635-1638. doi: 10.1126/science.1110591.
- Arumugam M., Raes J., Pelletier E. et al. Enterotypes of the human gut microbiome. Nature. 2011. 473. 174-180. doi: 10.1038/nature09944.
- Koren O., Knights D., Gonzalez A. et al. A guide to enterotypes across the human body: meta-analysis of microbial community structures in human microbiome datasets. PLoS Comput. Biol. 2013. 9(1). e1002863. doi: 10.1371/journal.pcbi.1002863.
- Qin J., Li R., Raes J. et al. A human gut microbial gene catalogue established by metagenomic sequencing. Nature. 2010. 464. 59-65. doi: 10.1038/nature08821.
- Knights D., Ward T.L., McKinlay C.E. et al. Rethinking «enterotypes». Cell Host. Microbe. 2014. 16(4). 433-437. doi: 10.1016/j.chom.2014.09.013.
- Ruff W.E., Kriegel M.A. Autoimmune host-microbiota interactions at barrier sites and beyond. Trends Mol. Med. 2015. 21(4). 233-244. doi: 10.1016/j.molmed.2015.02.006.
- Hao X., Shang X., Liu J., Chi R., Zhang J., Xu T. The gut microbiota in osteoarthritis: where do we stand and what can we do? Arthritis Res. Ther. 2021. 23(1). 42. doi: 10.1186/s13075-021-02427-9.
- Biver E., Berenbaum F., Valdes A.M. et al. Gut microbiota and osteoarthritis management: An expert consensus of the European society for clinical and economic aspects of osteoporosis, osteoarthritis and musculoskeletal diseases (ESCEO). Ageing Res. Rev. 2019. 55. 100946. doi: 10.1016/j.arr.2019.100946.
- Huang Z.Y., Stabler T., Pei F.X., Kraus V.B. Both systemic and local lipopolysaccharide (LPS) burden are associated with knee OA severity and inflammation. Osteoarthritis Cartilage. 2016. 24(10). 1769-1775. doi: 10.1016/j.joca.2016.05.008.
- Huang Z., Kraus V.B. Does lipopolysaccharide-mediated inflammation have a role in OA? Nat. Rev. Rheumatol. 2016. 12(2). 123-129. doi: 10.1038/nrrheum.2015.158.
- Dunn C.M., Velasco C., Rivas A. et al. Identification of Cartilage Microbial DNA Signatures and Associations With Knee and Hip Osteoarthritis. Arthritis Rheumatol. 2020. 72(7). 1111-1122. doi: 10.1002/art.41210.
- Collins K.H., Paul H.A., Reimer R.A., Seerattan R.A., Hart D.A., Herzog W. Relationship between inflammation, the gut microbiota, and metabolic osteoarthritis development: studies in a rat model. Osteoarthritis Cartilage. 2015. 23(11). 1989-98. doi: 10.1016/j.joca.2015.03.014.
- Ulici V., Kelley K.L., Azcarate-Peril M.A. et al. Osteoarthritis induced by destabilization of the medial meniscus is reduced in germ-free mice. Osteoarthritis Cartilage. 2018. 26(8). 1098-1109. doi: 10.1016/j.joca.2018.05.016.
- Boer C.G., Radjabzadeh D., Medina-Gomez C. et al. Intestinal microbiome composition and its relation to joint pain and inflammation. Nat. Commun. 2019. 10(1). 4881. doi: 10.1038/s41467-019-12873-4.
- Oliveria S.A., Felson D.T., Reed J.I., Cirillo P.A., Walker A.M. Incidence of symptomatic hand, hip, and knee osteoarthritis among patients in a health maintenance organization. Arthritis Rheum. 1995. 38(8). 1134-41. doi: 10.1002/art.1780380817.
- Loeser R.F., Collins J.A., Diekman B.O. Ageing and the pathogenesis of osteoarthritis. Nat. Rev. Rheumatol. 2016. 12(7). 12-20. doi: 10.1038/nrrheum.2016.65.
- Bischoff S.C. Microbiota and aging. Curr. Opin. Clin. Nutr. Metab. Care. 2016. 19(1). 26-30. doi: 10.1097/MCO.0000000000000242.
- O’Toole P.W., Jeffery I.B. Gut microbiota and aging. Science. 2015. 350(6265). 1214-5. doi: 10.1126/science.aac8469.
- Biagi E., Nylund L., Candela M. et al. Through ageing, and beyond: gut microbiota and inflammatory status in seniors and centenarians. PLoS One. 2010. 5(5). e10667. doi: 10.1371/journal.pone.0010667.
- Srikanth V.K., Fryer J.L., Zhai G., Winzenberg T.M., Hosmer D., Jones G. A meta-analysis of sex differences prevalence, incidence and severity of osteoarthritis. Osteoarthritis Cartilage. 2005. 13(9). 769-81. doi: 10.1016/j.joca.2005.04.014.
- Contartese D., Tschon M., De Mattei M., Fini M. Sex specific determinants in osteoarthritis: a systematic review of preclinical studies. Int. J. Mol. Sci. 2020. 21(10). 3696. doi: 10.3390/ijms21103696.
- Li Y., Luo W., Deng Z., Lei G. Diet-Intestinal Microbiota Axis in Osteoarthritis: A Possible Role. Mediators Inflamm. 2016. 2016. 3495173. doi: 10.1155/2016/3495173.
- Org E., Mehrabian M., Parks B.W. et al. Sex differences and hormonal effects on gut microbiota composition in mice. Gut Microbes. 2016. 7(4). 313-322. doi: 10.1080/19490976.2016.1203502.
- Haro C., Rangel-Zúñiga O.A., Alcalá-Díaz J.F. et al. Intestinal Microbiota Is Influenced by Gender and Body Mass Index. PLoS One. 2016. 11(5). e0154090. doi: 10.1371/journal.pone.0154090.
- Li J.Y., Chassaing B., Tyagi A.M. et al. Sex steroid deficiency-associated bone loss is microbiota dependent and prevented by probiotics. J. Clin. Invest. 2016. 126(6). 2049-2063. doi: 10.1172/JCI86062.
- Mills S., Stanton C., Lane J.A., Smith G.J., Ross R.P. Precision Nutrition and the Microbiome, Part I: Current State of the Science. Nutrients. 2019. 11(4). 923. doi: 10.3390/nu11040923.
- Kaliannan K., Wang B., Li X.Y., Kim K.J., Kang J.X. A host-microbiome interaction mediates the opposing effects of omega-6 and omega-3 fatty acids on metabolic endotoxemia. Sci. Rep. 2015. 5. 11276. doi: 10.1038/srep11276.
- Assa A., Vong L., Pinnell L.J., Avitzur N., Johnson-Henry K.C., Sherman P.M. Vitamin D deficiency promotes epithelial barrier dysfunction and intestinal inflammation. J. Infect. Dis. 2014. 210(8). 1296-1305. doi: 10.1093/infdis/jiu235.
- Ooi J.H., Li Y., Rogers C.J., Cantorna M.T. Vitamin D regulates the gut microbiome and protects mice from dextran sodium sulfate-induced colitis. J. Nutr. 2013. 143(10). 1679-86. doi: 10.3945/jn.113.180794.
- Ghaly S., Kaakoush N.O., Lloyd F. et al. High Dose Vitamin D supplementation alters faecal microbiome and predisposes mice to more severe colitis. Sci. Rep. 2018. 8(1). 11511. doi: 10.1038/s41598-018-29759-y.
- Ren W., Duan J., Yin J. et al. Correction to: Dietary L-glutamine supplementation modulates microbial community and activates innate immunity in the mouse intestine. Amino Acids. 2021. 53(2). 319. doi: 10.1007/s00726-020-02916-2.
- Schott E.M., Farnsworth C.W., Grier A. et al. Targeting the gut microbiome to treat the osteoarthritis of obesity. JCI Insight. 2018. 3(8). e95997. doi: 10.1172/jci.insight.95997.
- Guss J.D., Ziemian S.N., Luna M. et al. The effects of metabolic syndrome, obesity, and the gut microbiome on load-induced osteoarthritis. Osteoarthritis Cartilage. 2019. 27(1). 129-139. doi: 10.1016/j.joca.2018.07.020.
- Rios J.L., Bomhof M.R., Reimer R.A., Hart D.A., Collins K.H., Herzog W. Protective effect of prebiotic and exercise intervention on knee health in a rat model of diet-induced obesity. Sci. Rep. 2019. 9(1). 3893. doi: 10.1038/s41598-019-40601-x.
- Henrotin Y., Patrier S., Pralus A., Roche M., Nivoliez A. Protective Actions of Oral Administration of Bifidobacterium longum CBi0703 in Spontaneous Osteoarthritis in Dunkin Hartley Guinea Pig Model. Cartilage. 2021. 13 (2 suppl.). 1204S-1213S. doi: 10.1177/1947603519841674.
- de Oliveira G.L.V., Leite A.Z., Higuchi B.S., Gonzaga M.I., Mariano V.S. Intestinal dysbiosis and probiotic applications in autoimmune diseases. Immunology. 2017. 152(1). 1-12. doi: 10.1111/imm.12765.
- Lei M., Guo C., Wang D., Zhang C., Hua L. The effect of probiotic Lactobacillus casei Shirota on knee osteoarthritis: a randomised double-blind, placebo-controlled clinical trial. Benef. Microbes. 2017. 8(5). 697-703. doi: 10.3920/BM2016.0207.
- Sim B.Y., Choi H.J., Kim M.G. et al. Effects of ID-CBT5101 in Preventing and Alleviating Osteoarthritis Symptoms in a Monosodium Iodoacetate-Induced Rat Model. J. Microbiol. Biotechnol. 2018. 28(7). 1199-1208. doi: 10.4014/jmb.1803.03032.
- Kwon J.Y., Lee S.H., Jhun J. et al. The Combination of Probiotic Complex, Rosavin, and Zinc Improves Pain and Cartilage Destruction in an Osteoarthritis Rat Model. J. Med. Food. 2018. 21(4). 364-371. doi: 10.1089/jmf.2017.4034.
- Сафронова Л.А., Скороход І.О. Потенціал бактерій роду Bacillus як пробіотиків. Здоров’я України. 2021. № 13–14. С. 14-15.
- Ramires L.C., Santos G.S., Ramires R.P. et al. The Association between Gut Microbiota and Osteoarthritis: Does the Disease Begin in the Gut? Int. J. Mol. Sci. 2022. 23(3). 1494. doi: 10.3390/ijms23031494.
- Wei Z., Li F., Pi G. Association Between Gut Microbiota and Osteoarthritis: A Review of Evidence for Potential Mechanisms and Therapeutics. Front. Cell Infect. Microbiol. 2022. 12. 812596. doi: 10.3389/fcimb.2022.812596.
- Haglund L., Bernier S.M., Onnerfjord P., Recklies A.D. Proteomic Analysis of the LPS-Induced Stress Response in Rat Chondrocytes Reveals Induction of Innate Immune Response Components in Articular Cartilage. Matrix Biol. 2008. 27(2). 107-118. doi: 10.1016/j.matbio.2007.09.009.
- Bleau C., Karelis A.D., St-Pierre D.H., Lamontagne L. Crosstalk Between Intestinal Microbiota, Adipose Tissue and Skeletal Muscle as an Early Event in Systemic Low-Grade Inflammation and the Development of Obesity and Diabetes. Diabetes Metab. Res. Rev. 2015. 31(6). 545-561. doi: 10.1002/dmrr.2617.

/53.jpg)
/56.jpg)